2. 新疆医科大学 基础医学院微生物学教研室,乌鲁木齐 830011;
3. 新疆医科大学 公共卫生学院劳动卫生与环境卫生学教研室,乌鲁木齐 830011
2. College of Basic Medical Science, Xinjiang Medical University, Urumqi 830011;
3. Department of Labor Hygiene and Environmental Hygiene, College of Public Health, Xinjiang Medical University, Urumqi 830011
恰玛古为十字花科(Cruciferae)芸苔属芸苔种的两年生草本植物芜菁(Brassica rapa L.)的块根,是维吾尔重要的药用植物之一,维吾尔名查木古尔,别名射里节木、射里海米,全国各地均有栽培,主产于新疆南部地区。中国医学百科全书《维吾尔医医学分册》记载,本品性湿热,味微苦辛甘。功能生湿生热、补肺止咳、润肠软便、营养身体、增强视力、利尿开胃、补肾壮阳、填补精液等,是一种新疆维吾尔等少数民族喜爱并且有较长食用历史的传统药食同源植物,主治干寒性或黑胆质性疾病,如干性肺虚咳嗽、肠燥便秘、体虚视弱、小便不利、食欲不振,寒性关节疼痛、肾虚阳痿、精液稀少等[1]。
现代药理研究表明,恰玛古具有增强免疫力、抗辐射和抗疲劳等活性,硫代葡萄糖苷、类黄酮和多糖成分是其主要的活性物质[2-5]。然而,目前对恰玛古的研究多集中于活性物质和功能开发,对其内生微生物资源的研究工作尚未见报道。而对应内生真菌的研究开发不仅对于解决植物资源问题意义重大,并且是新型天然产物获得的重要资源宝库。块根是恰玛古的药用部位,也是植物的营养器官,对于恰玛古块根内生真菌多样性进行研究,是探索内生真菌与恰玛古功能性成分关系的前提和基础,可为进一步开发和利用维药恰玛古资源提供参考。本研究从形态学鉴定和分子生物学鉴定入手,探讨恰玛古块根中内生真菌的多样性,旨为维药恰玛古的进一步开发利用及新的药用资源开发提供基础的理论依据。
1 材料与方法 1.1 材料 1.1.1 恰玛古块根的采集恰玛古(Brassica rapa L.)块根样品,于2015年9月采集自中国新疆省乌鲁木齐市米东区古牧地镇团结村十一小队,地理位置为北纬87.69°,东经44.02°。样品于采集后4℃保存,48 h内进行内生真菌分离处理。
1.1.2 培养基及试剂PDA固体成品培养基,购自北京陆桥公司;真菌基因组DNA提取试剂盒及PCR相关试剂,购自TIANGEN公司;PCR引物由北京诺赛生物公司合成。
1.2 方法 1.2.1 内生真菌的分离、纯化取恰玛古材料无病症的块状根用自来水冲洗干净,晾干,依次用70%乙醇30 s,无菌水冲洗3次,次氯酸钠溶液(2.5%有效Cl-)3 min,无菌水冲洗4次,在无菌条件下晾干[6];取表面灭菌后的样品5 g,置于加有少量灭菌的石英砂和碳酸钙的无菌研钵中充分研磨,再依次稀释成10-1和10-2两个浓度梯度,各取0.1 mL涂布于含有0.002%氯霉素的PDA固体培养基平板上,每个梯度3个重复,共5个植株。每日定时观察,将新生出的菌丝挑取尖端部分转接至PDA培养基上,纯化培养直至获得纯菌株。最后再转接到PDA平板培养基,25℃培养箱中倒置暗培养1-2周,供观察、鉴定和保藏用[2]。同时取最后一次淋洗水0.1 mL涂于含0.002%的氯霉素的PDA固体培养基平板上,25℃培养7 d,检测表面灭菌效果,以确保表面消毒彻底,保证分离到的菌株确实是内生真菌。
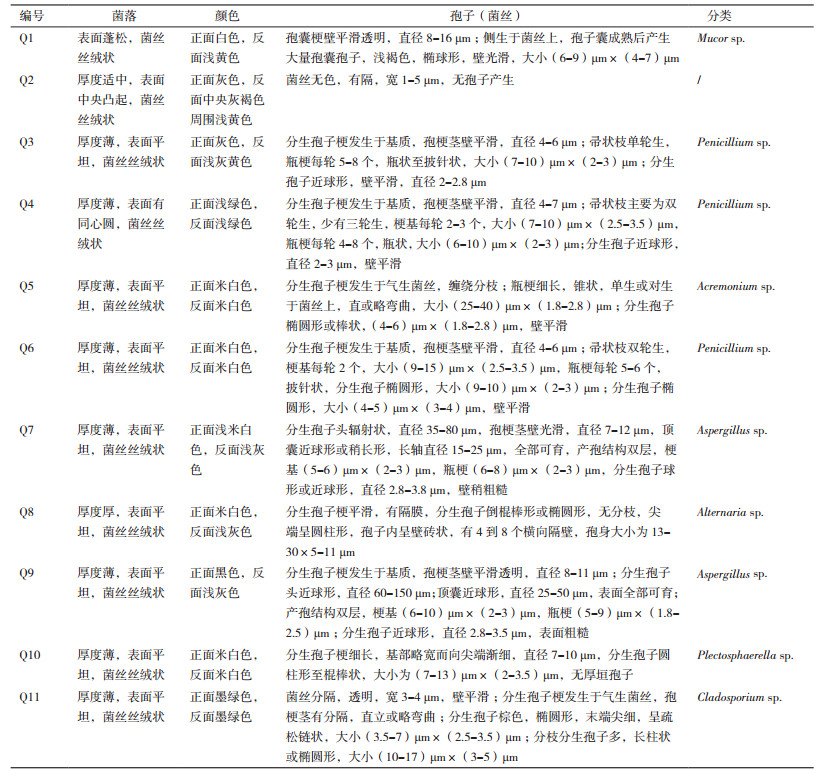
1.2.2 形态学鉴定在PDA平板培养基上25℃暗培养长至平皿3/4时进行观察。观察菌落大小、颜色、菌落纹饰、菌丝质地、边缘;孢子形态及大小的观察采用粘胶法[7, 8]。分类检索参照Barnett等[9]方法。
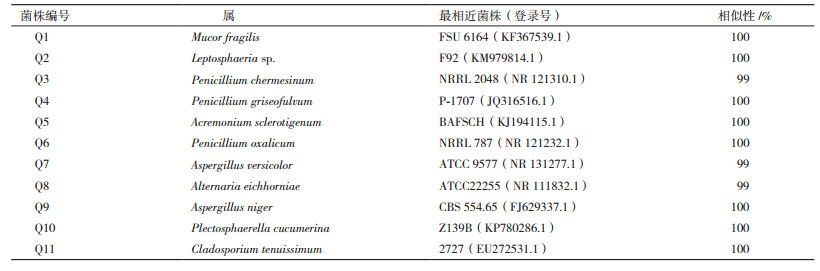
1.2.3 ITS系统发育分析采用传统CTAB抽提法提取内生真菌基因组DNA,以通用引物ITS1、ITS4进行PCR扩增。得到的基因组DNA片段用琼脂糖凝胶电泳检测浓度和纯度后进行测序,所得序列进行BLAST比对。将每个菌株的ITS序列分别在GenBank数据库中搜索同源序列,挑选与靶序列最相近的参考菌种序列,与测定序列一起用Clustal X(1.83)软件[10]进行序列对齐。利用MEGA5.1[11]的p-distance模型计算进化距离,用Neighbor-Joining法构建系统发育树,并计算bootstrap值。
2 结果 2.1 内生真菌的分离与纯化将恰玛古块根表面消毒后粉碎,进行组织内生真菌的分离培养,在PDA平板上陆续长出大量菌落,菌落形态存在明显差异,通过分离纯化共得到内生真菌29株。
2.2 形态学鉴定结果分离得到的29株内生真菌合并相同菌落形态和显微形态后,共获得11株内生真菌,其中10株可产生孢子,显微形态特征见图 1,形态学描述见表 1。

|
| 图 1 恰玛古块根内生真菌代表菌株产孢显微结构特征图 |
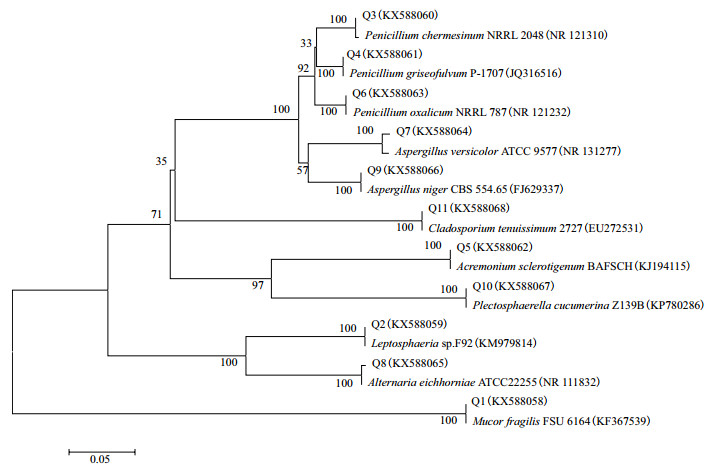
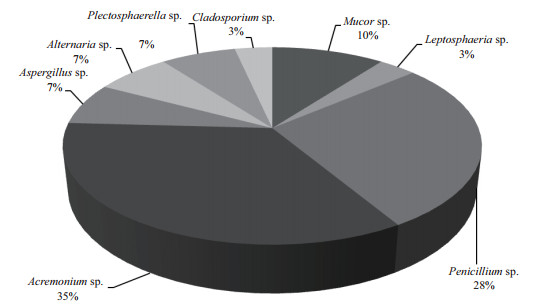
将上述11株内生真菌的ITS序列利用BLAST比对,并与GenBank的相关参考序列进行系统发育分析,构建系统发育树(图 2)(内生真菌ITS序列在NCBI核酸数据库的登录号为KX588058-588068)。相关序列GenBank登录号,见表 2。从系统发育树可见,11株内生真菌分属于8个属的11个种,分别为毛霉属(Mucor sp.)、小球腔菌属(Leptosphaeria sp.)、青霉属(Penicillium sp.)、支顶孢属(Acremonium sp.)、曲霉属(Aspergillus sp.)、链格孢属(Alternaria sp.)、Plectosphaerella sp.、枝孢属(Cladosporium sp.)。其中支顶孢属和青霉菌属为优势属,分别占总菌株数的34.48%和27.59%(图 3)。
|
| 图 2 基于ITS rDNA序列构建的恰玛古块根内生真菌系统发育树 |
|
| 图 3 恰玛古块根中可培养内生真菌所占的比例 |
植物内生真菌是指寄生在健康植物各种组织和器官内部或细胞间隙中度过全部或近乎全部生活周期而不使寄主表现任何症状的一类真菌[12]。内生真菌与宿主植物是互惠共生的关系,一方面宿主为内生真菌提供其赖以生存的养分和合适的生态环境,另一方面真菌会刺激植物自身产生或将植物所含的一部分成分代谢转换成植物生长发育过程所必需的养分,或抵抗外界环境侵害的活性物质,以提高宿主植物的生态适应性[13, 14]。除了通过刺激宿主植物产生应激物质外,还有研究表明内生真菌自身可以产生抗生素或其它次生代谢物以增强宿主植物的防御能力来杀死或抑制病原菌。
新疆恰玛古(芜菁)作为维药的重要资源,其内生真菌组成与结构是其道地性的重要影响因素之一,而其内生真菌作为一种重要的可再生自然资源长期以来被人们所忽视。本研究分离培养得到的29株内生真菌分属于5个纲7个科8个属11个种,此结果表明恰玛古块根的内生真菌数量和种类均很丰富,支顶孢属和青霉菌属为优势菌属。
有研究表明,从棉花中分离得到小球腔菌属和支顶孢属内生真菌对棉花黄萎病致病菌大丽轮枝菌有明显的抑制作用,其中小球腔菌属内生真菌在PDA平板上生长缓慢,但其次级代谢产物对致病菌抑制作用很强,镜检见其可导致致病菌菌丝结节、畸形、膨大,抑制率高达88.1%;支顶孢属内生真菌对致病菌的抑制表现为包围型,其菌落呈弧形生长,可导致致病菌菌丝缠绕成团,变粗、混乱、无序生长[15]。此外,另有从印度洋深海底泥中分离得到一株支顶孢属真菌,对胶孢炭疽、绿色木霉、立枯丝核菌、核盘菌和长柄链格孢5种常见病原菌均有较好的抑制作用,经研究表明其中蛋白为主要的抑菌活性成分。到目前为止,已从青霉属和曲霉属中分离出9种不同的抗真菌肽。这些抗真菌肽对一系列动物和植物致病真菌均有明显的抗性作用,并且在极端pH、高温条件下能够保持很好的稳定性,对蛋白酶的降解作用不敏感[16, 17]。
本研究结合传统形态学分类和分子生物学方法对恰玛古可培养内生真菌进行了初步研究,这些内生真菌可能参与植物的生长与代谢过程,它们与植物的生长及活性成分的关系还有待于进一步研究。本实验所研究的恰玛古内生真菌的群落多样性对恰玛古的深度开发和利用具有重要意义。
4 结论利用组织块培养法从健康恰玛古块根中分离得到29株内生真菌,通过形态学结合分子鉴定方法对内生真菌群落进行分类地位确定。结果表明,其分属于8个属的11个种,其中支顶孢属(Acremonium sp.)和青霉属(Penicillium sp.)为优势属,分别占总菌株数的34.48%和27.59%。
| [1] | 《中医学》编辑委员会.中国医学百科全书《维吾尔医医学分册》[M]. 《中医学》编辑委员出版, 1997: 94-95. |
| [2] | 安熙强, 马媛, 张涛, 等. 维药恰玛古粉和蜜膏对辐射损伤防护的对比. 科技导报, 2010, 28(10): 28–31. |
| [3] | 蔡啸镝, 刘跃峰. 恰玛古多糖的纯化及对运动小鼠抗疲劳活性研究. 食品工业, 2015, 36(8): 59–62. |
| [4] | 孙艳, 安熙强, 马媛, 等. 恰玛古蜜膏对小鼠免疫功能的影响. 中国医药导报, 2010, 7(6): 20–22. |
| [5] | 张涛, 安熙强, 黄莉, 等. 维药恰玛古中硫代葡萄糖苷的提取工艺研究. 中国药房, 2015, 25(26): 3548–3551. |
| [6] | 范黎, 郭顺星, 曹文芩, 等. 墨兰共生真菌一新种的分离、培养、鉴定及其生物活性. 真菌学报, 1996, 15(4): 251–255. |
| [7] | Wei JC. Handbook of Fungi Identification (真菌鉴定手册)[M]. Shanghai: Shanghai Science and Technology Press, 1979. |
| [8] | Ariso Paul CJ, Minsky CW, Blackwell M. Introductory Mycology (菌物学概论)[M]. Beijing: China Agriculture Press, 2002. |
| [9] | Barnett HL, Hunter BB. Illustrated Genera of the Imperfect Fungi (半知菌属图解)[M]. Translated by Shen CY1 3rd ed. Beijing: Science Press, 1977. |
| [10] | Thompson JD, Gibson TJ, Plewniak F, et al. The CLUSTAL_X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools. Nucleic Acids Res, 1997, 25 : 4876–4882. DOI:10.1093/nar/25.24.4876 |
| [11] | Tamura K, Dudley J, Nei M, Kumar S. MEGA4: molecular evolutionary genetics analysis (MEGA) software version 4. 0. Mol Biol Evol, 2007, 24 : 1596–1599. DOI:10.1093/molbev/msm092 |
| [12] | Yang RY, Feng PY, Li J. Research advances on the activity of endophyte pesticides. Agrochemicals, 2006, 45 : 440–443. |
| [13] | Rodriguez R, Redman R. More than 400 million years of evolution and some plants still can't make it on their own: plant stress tolerance via fungal symbiosis. Journal of Experimental Botany, 2008, 59 (5): 1109–1114. DOI:10.1093/jxb/erm342 |
| [14] | Marquez LM, Redman RS, Rodriguez RJ, et al. A virus in a fungus in a plant: three-way symbiosis required for thermal tolerance. Science, 2007, 315 (5811): 513–515. DOI:10.1126/science.1136237 |
| [15] | 王玲飞.棉花内生真菌多样性分析及对黄萎病生防潜力评估[D].北京:中国农业科学院, 2014. |
| [16] | 陈丽维, 敖敬群, 陈新华. 一株抗植物致病真菌的深海霉菌的鉴定和活性成分理化性质分析. 应用海洋学学报, 2013, 32(3): 390–395. |
| [17] | Kovacs L, Viragh M, Tako M, et al. Isolation and characterization of Neosartorya fischeri antifungal protein (NFAP). Peptides, 2011, 32 (8): 1724–1731. DOI:10.1016/j.peptides.2011.06.022 |