2. 中国热带农业科学院海口实验站,海口 570102;
3. 中国热带农业科学院热带作物生物技术研究所,海口 571101;
4. 华中农业大学,武汉 430070
2. Haikou Experimental, Chinese Academy of Tropical Agricultural Sciences, Haikou 570102;
3. Institute of Tropical Bioscience and Biotechnology, Chinese Academy of Tropical Agricultural Sciences, Haikou 571101;
4. Huazhong Agricultural University, Wuhan 430070
在不同的胁迫环境中,海藻糖是许多生物体具有重要作用的二糖。其具有生物抗逆性,无毒性,不被糖苷酶水解,在非生物胁迫条件下保护蛋白质、生物膜等生物大分子物质或细胞膜。海藻糖可以直接清除活性氧,在植物热胁迫及恢复过程中对保护光合作用机制起重要作用[1]。而其生物合成通过高度保守的海藻糖合成酶途径完成,由海藻糖-6-磷酸合成酶(TPS)和T6P磷酸酯酶(TPP)两种酶催化完成[2, 3]。20世纪90年代,最先在厥类植物中被发现,打破了植物体中不存在海藻糖的传言,开创了植物海藻糖研究的新纪元[4],使不同植物中的海藻糖合成酶基因相继被克隆、进行功能分析[5]。在许多开花植物中海藻糖和它的前体海藻糖-6-磷酸的含量非常低,分别低于10 µmol/g鲜重和10 nmol/g鲜重,是由于TPS/TPP基因在过表达或突变时植物代谢和发育也随之发生改变[6, 7]。美国学者发明了一项利用海藻糖-6-磷酸合成酶基因调节植物生长的专利,通过下调表达海藻糖-6-磷酸合成酶基因以提高植物生物量[8]。棉花所有TPS基因家族成员分为2个亚家族(Class Ⅰ和Class Ⅱ),这2个亚家族基因遗传结构不同,但在胁迫条件下均能被诱导表达,响应环境不同胁迫[9]。水稻基因组11条OsTPS基因中只有OsTPS1具有TPS活性,在低温、高盐、干旱胁迫下,转OsTPS1基因水稻植株抗逆性增强,转基因株系海藻糖和脯氨酸含量高于野生型,同时OsTPS1基因过表达使WSI18、RAB16C、HSP70、ELIP等相关胁迫基因上调表达[10, 11]。
关于非生物胁迫条件下海藻糖增强植物抗逆性的研究报道已屡见不鲜[12, 13]。但目前国内外有关香蕉海藻糖基因在非生物胁迫下的生物学功能研究却少有报道,现仅有1篇文献报道香蕉海藻糖合成酶基因在生物胁迫下的功能研究[14]。香蕉是热带地区人们的主要粮食作物和经济收入来源。但土地干旱,农药、肥料的不恰当使用,使土地盐碱化日趋严重,导致香蕉产量遭受不同程度的影响。为丰富香蕉抗逆基因资源,本实验以香蕉苗为材料,对香蕉海藻糖-6-磷酸合成酶基因(MaTPS5)进行初步的生物信息学分析,借助qRT-PCR分析MaTPS5在不同胁迫下的表达量,以期为进一步探讨MaTPS5是否参与香蕉抗逆机制提供理论依据。
1 材料与方法 1.1 材料香蕉苗源自中国热带农业科学院热带生物技术研究所澄迈香蕉种植园。取正常条件下生长的五叶一心香蕉幼苗(Musa acuminata L. AAA group cv. Brazilian)的根、球茎、假茎、叶片,以及该品种成年香蕉树的花和果实,用清水清洗不同香蕉组织器官后立即用液氮速冻,于-70℃保存备用。
1.2 方法 1.2.1 蛋白质同源序列比对及系统发生分析从香蕉根系转录组中通过随机克隆、测序,以获得香蕉海藻糖合成酶基因5,将全长DNA序列在NCBI ORF Finder中查找开放阅读框,利用ProtParam(http://web.expasy.org/protparam/)在线分析其理化性质,PSORT Prediction软件预测亚细胞定位情况,SignalP 4.1 Server、TMpred软件分析蛋白信号肽和跨膜结构,NCBI Conserved Domain软件推导MaTPS5氨基酸序列保守结构域。
在NCBI数据库BLASTx中查找同源序列,利用DNAMAN软件进行同源序列比对,通过MEGA5.0软件分析MaTPS5蛋白与其他植物TPS蛋白序列的进化关系,构建分子进化树。
1.2.2 MaTPS5在不同组织中特异性表达分析采用改良的CTAB方法(Wan and Wilkins,1994)提取香蕉根、茎、叶、花、果实5种器官的总RNA。利用M-MLV反转录酶(TaKaRa公司)合成第一条链cDNA链,具体操作过程详见试剂盒说明书。
取正常条件下生长的五叶一心香蕉幼苗(Musa acuminata L. AAA group cv. Brazilian)的根、球茎、假茎、叶片以及该品种成年香蕉树的花和果实的cDNA为模板,采用半定量方法对其进行组织特异表达分析。以MaActin1:Pf:5'-CGAGGCTCAATCA-AAGA-3'和MaActin2:Pr:5'-ACCAGCAAGGTCCA-AAC-3'为内参引物。MaTPS5引物为P1:5'-GGGG-AAGGACGAGGATA-3'和P2:5'-ATCAAGCACCGA-TGACC-3'。通过荧光PCR仪设定反应程序为:95℃预变性30 s;95℃ 7 s,56℃ 15 s,72℃ 20 s,40个循环后做熔解曲线(95-55℃,0.1℃/s),反应体系为25 μL。在Tonan凝胶成像系统仪上查看并获取cDNA扩增条带的电泳图片,分析不同香蕉组织器官中MaTPS5表达量浓度。
1.2.3 MaTPS5在不同非生物胁迫下表达特性分析 1.2.3.1 渗透胁迫处理取40株五叶一心,生长健壮的香蕉幼苗,分为2组,每组3个处理,每个处理5株,以0 h处理为对照(CK)。利用土壤水分测试仪测定每盆幼苗培养基质水分,并保持80%的水分含量。将香蕉幼苗连带基质分别浸泡于200 mmol/L NaCl和200 mmol/L PEG6000溶液中,浸没过根部,胁迫处理时间分别为6、12和24 h。用无菌水洗净根部,取样,液氮速冻,放置-80℃保存,提取RNA[15]。
1.2.3.2 低温胁迫处理取20株五叶一心,生长健壮并一致的香蕉幼苗,分为4个处理,每个处理5株,其中以0 h处理为对照(CK)。将香蕉幼苗连带基质放置温度为8℃的恒温植物培养箱中,处理时间分别为6、12和24 h。迅速用常温自来水洗净根部,快速取样,液氮速冻,放置-80℃保存,提取RNA[15]。
1.2.3.3 外源激素诱导处理选取60株五叶一心,生长健壮的香蕉幼苗,分为2组,每组20株,将幼苗连带培养基质分别浸泡于浓度均为100 μmol/L ACC、ABA水溶液中,浸没过幼苗根部。处理0(CK)、6、12和24 h后,用无菌水洗净根部基质,取样,液氮速冻,放置-80℃保存,提取RNA[15]。
1.2.3.4 枯萎病4号生理小种浸染香蕉苗根系选取20株五叶一心,生长健壮的香蕉幼苗,分为4个处理,每个处理20株。在正常管理条件下,将枯萎病Foc TR4号小种真菌体浇灌幼苗培养基质,致使菌丝体侵害幼苗根部,处理0(CK)、2、4和6 d之后洗净根部基质,取样,液氮速冻,放置-80℃保存,提取RNA[16]。
2 结果 2.1 MaTPS5全长cDNA序列的生物信息学分析将获得的海藻糖合成酶基因,命名为MaTPS5,通过扩增获得MaTPS5 cDNA序列全长为3 081 bp。NCBI ORF Finder分析指出:MaTPS5全长cDNA包含247 bp 5'端非编码区、175 bp 3'端非编码区和2 559 bp开放阅读框;在同一编码框内同时含有起始密码子为ATG,终止密码子TAA,表明此序列为全长序列,其ORF框编码852个氨基酸。
通过ProtParam分析其理化性质,推测MaTPS5蛋白的分子式C4264H6685N1205O1253S33,相对分子量为95 936.2,等电点pI6.52,为不稳定蛋白,不稳定参数51.68;其理论半衰期为30 h,平均疏水指数-0.258。该蛋白中相对含量较多的氨基酸是10.1% Leu、8.7% Val、7.5% Ala、7.4% Ser、7.2% Arg;总的带负电荷的残基(Asp + Glu)为103,总的带正电荷的残基(Arg+Lys)为96。通过Protscale分析预测该蛋白脂溶指数为87.17,为疏水性蛋白,说明此蛋白具有高级结构域。
WoLF PSORT软件分析表明,该蛋白位于线粒体可能性为16.4%,叶绿体可能性为15.1%,位于细胞核可能性为16.1%,其中位于叶绿体中该蛋白的相似序列较多。SignalP 4.1 Server软件分析发现,MaTPS5蛋白不存在信号肽。推测MaTPS5蛋白亚细胞定位于细胞质中的可能性最大。
TMpred软件分析MaTPS5蛋白跨膜结构表明,该蛋白存在2个跨膜区域,由胞内到胞外的单向跨膜区域位于第23-24位氨基酸,胞内外双向跨膜区域位于第399-420位氨基酸,属于跨膜蛋白。说明MaTPS5蛋白参与对植物生长发育起重要作用的分子机制的调控。
NCBI Conserved Domain软件分析MaTPS5氨基酸序列保守结构域表明,该蛋白包含GT1-TPS、Trehalase-PPase(TPP)结构域,分别属于Glycosyl transferase-GTB类超级家族和HAD-like超级家族,此外还有一个PLN03063(UDP-forming)多结构域(图 1)。说明MaTPS5基因序列高度保守。

|
| 图 1 MaTPS5氨基酸序列的保守结构域分析 |
与已在NCBI数据库中登录的其他高等植物TPS氨基酸同源序列比较,结果(图 2)表明MaTPS5编码的氨基酸序列与其他高等植物TPS氨基酸序列存在较高的同源性,一致性为77.31%。

|
| 图 2 MaTPS5编码的氨基酸序列与其他植物TPS蛋白序列的同源性分析 |
进化关系分析表明,香蕉MaTPS5氨基酸序列与野蕉TPS(ABF70084.1)氨基酸序列聚在同一侧枝上,说明二者亲缘关系很近,同源性84.54%。另外与聚类同一主分枝内另一侧枝的印度水稻(AEB53177.1)和小麦(ACI16353.1)的进化关系也较近,同源性分别为72.28%和82.29%(图 3)。
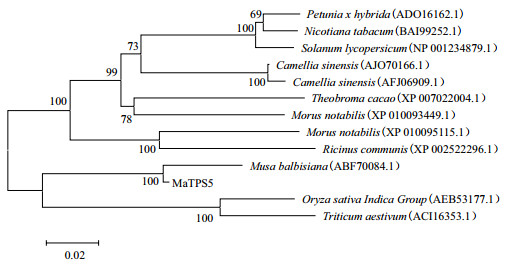
|
| 图 3 不同植物中TPS氨基酸序列的进化树分析 |
图 4显示,MaTPS5基因在根、球茎、假茎、叶、花、果实各器官中均有表达,其中在球茎、叶和花中表达量较大,在根中表达量最低。表明MaTPS5表达具有组织差异性。
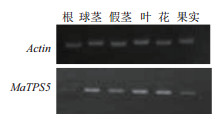
|
| 图 4 MaTPS5在香蕉不同器官中的表达分析 |
实验采用非生物胁迫(100 μmol/L ABA和100 μmol/L ACC、8℃、200 mmol/L PEG6000、200 mmol/L NaCl)和生物胁迫(Foc TR4)处理。提取上述5种经非生物胁迫处理的香蕉根系总RNA。如图 5所示,qRT-PCR分析表明高盐胁迫使MaTPS5的表达量增加,在24 h时达到极显著,为CK的10倍;外源ACC处理后,MaTPS5表达量增加,在24 h达到极显著,为CK的8倍;外源激素ABA处理植株后,MaTPS5表达量增加,但不显著。而在其他2种胁迫条件下,MaTPS5表达不响应。图 6结果显示,生物胁迫Foc TR4(香蕉巴拿马病菌4号生理小种浸染)处理后,MaTPS5在根系中的表达量显著增加,为CK的3倍。

|
| 图 5 MaTP5在不同非生物胁迫下的表达量分析 |

|
| 图 6 MaTPS5基因在Foc RT4病原菌侵染后的表达变化 |
TPS和TPP蛋白构成高等植物一大蛋白家族之一,水稻11个都含有TPS和TPP结构域的TPS基因,功能检测证明酵母tps1、tps2菌株突变体内只有OsTPS1编码TPS活性酶,OsTPS蛋白无TPP活性,通过酵母双杂分析表明TPS结构域可能在互作反应中起关键作用,结果显示OsTPS家族成员可能形成海藻糖-6-磷酸合酶复合物,并具有调节T6P水平的潜力从而调控植物发育;在拟南芥和水稻基因组有11个TPS,水稻中有9个TPP,拟南芥中至少10个TPP[8, 10, 17];仅有少部分的TPS/TPP蛋白具有活性,水稻OsTPS1、OsTPP1、OsTPP2蛋白分别具有TPS和TPP活性[10, 18]。蒋伟等[19]经克隆玉米ZmTPS家族研究分析发现,ZmTPS基因具有TPS和TPP两个结构域,N端为TPS结构域,C端为TPP结构域;并通过酵母突变体互补实验证明ZmTPS家族基因中ZmTPS3具有TPS催化活性和具有TPP催化活性,参与调控海藻糖合成。实验中,MaTPS5编码的氨基酸与其他植物TPS氨基酸的序列存在较高的同源性,一致性为77.8%(图 3),其中与野蕉TPS(ABF70084.1)氨基酸序列聚为一类,说明二者亲缘关系很近,同源性为84.54%;MaTPS5编码852个氨基酸,保守结构域分析表明其含有TPS和TPP结构域,具有TPS/TPP蛋白活性,作用于底物UDP-葡萄糖和6-磷酸-葡萄糖,进而参与调控海藻糖的生物合成。目前高等植物TPS/TPP蛋白功能的研究报道甚少,还有待于进一步探讨。
3.2 MaTPS5在不同器官中表达分析研究认为植物中不能积累海藻糖与存在海藻糖酶活性过高有关。Muller等[5]发现在拟南芥不同组织器官中海藻糖酶含量不同,在花药中含量最高,其次叶、茎和根部。丁菲等[20]研究表明,CsTPS在茶树不同器官中表达量依次为花 > 根 > 茎 > 芽 > 叶 > 种子,并指出器官差异表达可能是由不同组织和器官发育分化情况、空间位置、代谢活动、功能及环境条件等造成。实验中,MaTPS5在香蕉植株的根、球茎、假茎、叶、花、果实各器官中均有表达,其中在球茎、叶和花中表达量较大。
3.3 MaTPS5在不同胁迫处理下的特异性表达分析水稻数据库统计调查发现,水稻基因组内大量的TPS/TPP基因家族与拟南芥基因家族相似,尤其是基因家族结构,表达分析表明OsTPP1在盐、渗透和ABA胁迫处理后瞬时上调表达,转基因过表达株系表明OsTPP1引起非生物胁迫响应基因。OsTPS1过表达提高水稻幼苗对低温、高盐和干燥胁迫的耐受性;在转基因株系中OsTPS1过表达使海藻糖和辅氨酸含量较野生型的高,同时也引起某些胁迫相关基因上调表达,如WSI18、RAB16C、HSP70和ELIP等,结果表明了OsTPS1可能通过提高海藻糖和脯氨酸含量来增强植物对非生物胁迫的耐受性,并诱导其他胁迫相关基因上调表达[11]。转具有双官能团的酵母TPS基因番茄植株实验表明,转基因植株叶片内海藻糖浓度的增加提高了植株的耐旱和耐盐性,光合速率也较野生植株强[21]。
植物在生长发育过程中可能遭到不同程度非生物和生物胁迫的危害,植物形成一套复杂的防御系统,在防御过程中植物激素起到重要作用。有研究表明,ACC处理可以显著增加野生型拟南芥C01-0幼苗在高盐环境下的抗盐能力和成活率[22]。乙烯信号途径中的重要组分参与了植物的盐胁迫反应,因此高盐胁迫会诱导乙烯合成[23, 24]。实验qRT-PCR结果(图 5)表明,高盐胁迫下MaTPS5表达量增加,在24 h时表现极显著,ACC处理下MaTPS5表达量提高,推断MaTPS5基因表达可能与乙烯信号传导途径有关联。ACC是乙烯合成前体,在ACC氧化酶的催化下产生乙烯,乙烯与受体结合,激活下游元件,完成乙烯信号传导途径。乙烯信号传导途径参与激发植物防御应答,因此,MaTPS5在乙烯参与植物抗逆应答反应中扮演重要作用。植物在受到病原胁迫之后,能诱导乙烯合成,进一步激活乙烯信号途径,参与植物防御应答反应。用烟草花叶病毒(TMV)接种烟草时,可以诱导ACS和ACO基因的表达,产生大量的乙烯,诱导生成的乙烯可以进一步激活乙烯信号途径,诱导大量病程相关蛋白(Pathogenesis related protein,PR)基因的表达,提高植物的抗病性[24]。实验室已建立接种枯萎病病原菌Foc TR4后香蕉根系转录组和香蕉基因的转录变化的研究方法[16]。运用上述方法,枯萎病病原菌Foc TR4侵染香蕉幼苗后,根系中MaTPS5表达量显著提高;且ABA处理下,根系中MaTPS5基因表达不显著,说明MaTPS5不依赖ABA途径而是通过乙烯信号途径参与植株生物胁迫的抗逆反应。在全球变暖,土壤盐碱化和香蕉巴拿马病的危害下,研究MaTPS5生物学功能及其海藻糖合成酶途径对提高和改良香蕉抗逆新品种具有重要意义。
4 结论通过生物信息学分析和基因表达手段,研究MaTPS5基因序列和蛋白结构的特点及其表达特性得出MaTPS5基因编码的蛋白具有TPS/TPP结构域,定位于细胞质中可能性最大。MaTPS5基因表达具有组织特异性,可能依赖乙烯信号传导途径激活相关的蛋白酶活性,诱导其表达,并生物合成相应的海藻糖,参与植物抗逆反应,进而提高植物抗逆性。
| [1] | 罗音.外源海藻糖提高小麦热性的生理机制研究[D].泰安:山东农业大学, 2007 |
| [2] | 王多佳, 苍晶, 牟永潮, 等. 植物抗寒基因研究进展. 东北农业大学学报, 2009, 40(10): 134–138. |
| [3] | Henry C, Bledsoe SW, et al. The trehalose pathway in maize: conservation and gene regulation in response to the diurnal cycle and extended darkness. J Exp Bot, 2014, 20 : 5959–5973. |
| [4] | Muller J, Boller T, Wiemken A. Trehalose and trehalase in Plants: recent developments. Plant Science, 1995, 112 (1): 1–9. DOI:10.1016/0168-9452(95)04218-J |
| [5] | 刘姣, 姜大刚. 作物海藻糖合成相关基因的研究进展. 基因组学与应用生物学, 2014, 3(2): 432–437. |
| [6] | Eastmond PJ, et al. Trehalose-6-phosphate synthase1, which catalyses the first step in trehalose synthesis, is essential for Arabidopsis embryo maturation. Plant J, 2002, 2 : 225–235. |
| [7] | Ponnu J, Wahl V, Schmid M. Trehalose-6-phosphate: connecting plant metabolism and development. Frontiers in Plant Science, 2011, 2 (12): 70–81. |
| [8] | Leyman B, Ramon M, et al. Use of trehalose-6-phosphate synthase to modulate plant growth: United States, 8357835[P]. 2013. |
| [9] | Mu M, et al. Genome-wide Identification and analysis of the stress-resistance function of the TPS (Trehalose-6-Phosphate Synthase) gene family in cotton. BMC Genetics, 2016, 1 : 1–11. |
| [10] | Zang B, Li H, Li W, et al. Analysis of trehalose-6-phosphate synthase (TPS) gene family suggests the formation of TPS complexes in rice. Plant Mol Biol, 2011, 6 : 507–522. |
| [11] | Li HW, Zang S, Deng XW, et al. Over-expression of the trehalose-6-phosphate synthase gene OsTPS1 enhances abiotic stress tolerance in rice. Planta, 2011, 234 (5): 1007–1018. DOI:10.1007/s00425-011-1458-0 |
| [12] | 刘占磊, 等. 海藻糖的应用及其合酶基因TPS在植物转基因中的研究进展. 中国农学通报, 2009, 25(6): 54–58. |
| [13] | 杨瑾.海藻糖对番茄耐盐性作用效应的研究[D].大庆:黑龙江八一农垦大学, 2010. |
| [14] | Yang LY, et al. Cloning and induced expression analysis of trehalose synthase gene TPS1of banana Fusarium oxysporum f. sp.. Chinese Agricultural Science Bulletin, 2012, 28 (7): 171–175. |
| [15] | Wang Z, Xu BY, Jia CH, et al. Molecular cloning and expression of five glutathione S-transferase (GST) genes from Banana (Musa acuminata L. AAA group, cv. Cavendish). Plant Cell Reports, 2013, 32 (9): 1373–1380. DOI:10.1007/s00299-013-1449-7 |
| [16] | Wang Z, et al. De Novo characterization of the banana root transcriptome and analysis of gene expression under Fusarium oxysporum f. sp. Cubense tropical race 4 infection. BMC Genomics, 2012, 2 : 1–9. |
| [17] | Ramon M, Rolland F. Plant development: introducing trehalose metabolism. Plant Science, 2007, 12 (5): 185–188. DOI:10.1016/j.tplants.2007.03.007 |
| [18] | Shima S, Matsui H, Tahara S, et al. Biochemical characterization of rice trehalose-6-phosphate phosphatases supports distinctive func-tions of these plant enzymes. Febs J, 2007, 5 : 1192–1201. |
| [19] | 蒋伟.玉米海藻糖-6-磷酸合成酶基因家族的功能验证和差异表达分析[D].雅安:四川农业大学, 2010. |
| [20] | 丁菲, 庞磊, 李叶云, 等. 茶树海藻糖-6-磷酸合成酶基因(CsTPS)的克隆及表达分析. 农业生物技术学报, 2012, 20(11): 1253–1261. |
| [21] | Lyu JI, et al. Over-expression of a trehalose-6-phosphate synthas /phosphatase fusion gene enhances tolerance and photosynthesis during drought and salt stress without growth aberrations in tomato. Plant Cell Tissue Organ Culture, 2012, 2 : 257–262. |
| [22] | Wang NN, Shih MC, Li N. The GUS reporter-aided analysis of the promoter activities of Arabidopsis ACC synthase genes AtACS4, AtACS5, and AtACS7 induced by hormones and stresses. Journal of Experimental Botany, 2005, 56 (413): 909–920. DOI:10.1093/jxb/eri083 |
| [23] | Kim KJ, Park CJ, Ham BK, et al. Induction of a cytosolic pyruvate kinase 1 gene during the resistance response to Tobacco mosaic vi-rus in Capsicum annuum. Plant Cell Rep, 2006, 4 : 359–364. |
| [24] | 于延文, 黄荣峰. 乙烯与植物抗逆性. 中国农业科技导报, 2013, 15(2): 70–75. |




