珠子参又名竹节三七、血参、七叶子,为五加科人参属植物珠子参(P. japonicus var. major)的干燥根茎[1],分布于云南、四川、陕西、湖北等省的高海拔地区,在我国西部地区少数民族中运用十分广泛,是一味非常珍贵的传统中药[2]。珠子参含有三萜类、多糖、挥发油等成分,其中三萜类成分三萜皂苷是珠子参中研究最多,最主要的有效成分[3]。三萜皂苷是一类由三萜苷元与糖或糖醛酸组合而成的植物次生代谢产物,在改善缺血性损伤,提高免疫力,抗炎,抗肿瘤等方面效果明显[4]。此外,三萜皂苷兼具多种生物学活性,如充当植物抗菌素、活性抗氧剂和调节植物生长等[5, 6]。三萜类化合物突出的药理作用和生理活性备受研究人员关注。
在植物体内三萜类化合物的生物合成是多种生物酶参与调控的复杂过程,大体可分为前体物的合成、萜类骨架的构建和环上官能团的修饰[7]。其中,氧化鲨烯环化酶(oxido squalene cyclase,OCS)基因家族催化2,3-氧化鲨烯形成不同类型的三萜碳环,是整个合成过程中的关键步骤[8]。β-香树素合成酶(beta-amyrin synthase,βAS)是OCS家族成员,能催化2,3-氧化鲨烯环化合成β-香树脂,后者通过一系列生化反应最终生成齐墩果烷型皂苷。在三萜皂苷合成下游途径中,βAS是指向分流达玛烷型皂苷和齐墩果烷型皂苷的关键限速酶,也是维持植物体内三萜化合物多样性的因素之一[9]。目前已从人参[10]、甘草[11]、拟南芥[12]等植物中成功克隆得到编码βAS的cDNA序列,但尚未见关于珠子参βAS基因克隆及其生物信息学分析的报道。
本课题组借助第二代测序技术得到珠子参转录组数据[13],从中筛选出βAS基因核酸拼接片段,采用反转录PCR获得βAS基因全长cDNA序列,对其序列进行生物信息学分析,并通过实时荧光定量PCR分析pjβAS基因在珠子参花、叶、茎、根状茎4个组织中的表达情况,旨为阐明该基因在珠子参皂苷生物合成途径中的分子作用机制和表达调控提供参考。
1 材料与方法 1.1 材料实验植物6年生珠子参样本采自湖北恩施华中药用植物园,在相同生长环境下取新鲜珠子参植株,经无菌水洗净后分离花、叶、茎、根状茎组织,由液氮快速冷冻后置于-80℃保存。
植物总RNA快速提取试剂盒、琼脂糖凝胶DNA回收纯化试剂盒购自北京艾德莱(Aidlab)生物科技有限公司;PrimeScriptTM RT Reagent Kit with gDNA Eraser反转录试剂盒、SYBR® Premix Ex TaqTM实时荧光定量试剂盒、TaKaRa LA Taq®试剂盒、PMD18-T Vector、DL5000 DNA Marker、E. coil DH5α感受态细胞、MiniBEST Bacterial Genomic DNA Extraction Kit Ver.2.0质粒抽提试剂盒购自大连宝生物(TaKaRa)工程有限公司;IPTG、X-Gal购自美国普洛麦格(Promega)公司;MG96G PCR仪购自杭州朗基(LongGene)科学仪器有限公司;LG 2020凝胶成像分析系统购自上海美吉(Majorbio)生物医药科技有限公司;荧光定量PCR仪为美国应用生物系统(Applied Biosystems)公司生产的ABI 7500实时荧光定量系统。
1.2 方法 1.2.1 总RNA提取与反转录分别取珠子参花、叶、茎、根状茎组织样本0.1 g于液氮中充分研磨,利用北京艾德莱植物总RNA快速提取试剂盒提取RNA,采用超微量紫外分光光度计检测RNA的浓度和纯度,1%琼脂糖凝聚胶电泳检测RNA完整性。取珠子参花、叶、茎、根状茎组织总RNA各1 μg,按照TaKaRa公司PrimeScriptTM RT Reagent Kit with gDNA Eraser试剂盒说明书进行反转录反应,分别合成cDNA第一链,于-20℃保存。
1.2.2 pjβAS基因的克隆通过珠子参转录组测序数据,得到βAS基因核酸拼接序列,利用NoePrimer2.03和Primer6.0引物设计软件设计特异性扩增引物βAS-F:5'-GAGCTCAATTTTTGTTTGAAGATGTGGAG-3'和βAS-R:5'-GCGTCTGAACATTTACTACAGTGCATGC-3',以珠子参根状茎cDNA为模板,运用TaKaRa LA Taq®试剂盒进行珠子参βAS基因全长序列PCR扩增,预期扩增片段长度为2 655 bp。PCR反应体系(50 µL):TaKaRa Ex Taq(5 U/µL)0.25 µL,2×Ex Taq Buffer 5 µL,dNTP Mixture 4 µL,cDNA 5 µL,βAS-F和βAS-R(10 µmoL/L)各2 µL,ddH2O 31.75 µL。PCR反应条件:98℃预变性5 min;98℃变性1 min,68℃退火25 s,72℃延伸1 min,进行30个循环;72℃延伸10 min。1.5%琼脂糖凝聚胶电泳对扩增产物进行检测,对PCR扩增所得特异目的片段进行回收纯化。将回收所得DNA片段与pMD18-T载体连接后,转化DH5α感受态细胞,在加有氨苄抗生素的LB平板上进一步培养,经蓝白斑筛选、阳性克隆菌落扩大培养、质粒抽提后送往上海桑尼生物科技有限公司测序。
1.2.3 pjβAS基因的生物信息学分析依据pjβAS基因测序结果,利用DNAstar中EditSeq软件获取基因序列的开放阅读框(Open reading frame,ORF)和其所编码氨基酸序列;使用在线工具BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi),将获得的核苷酸和氨基酸序列与NCBI中已登录的其它物种进行序列比对和同源性分析,并利用MEGA6.0软件构建系统进化树;借助ExPASy网站中在线工具Protparam(http://www.expasy.ch/tools/protaparam.html)进行蛋白质基本理化性质预测;蛋白质二级结构预测采用WOLF SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html);运用在线工具TMHMM 2.0(http://www.cbs.dtu.dk/service/TMHMM-2.0/)预测蛋白质跨膜区结构域;蛋白质亚细胞定位分析运用在线程序WOLF PSORT(http://wolfpsort.org/);蛋白质磷酸化位点预测使用NetPhos 2.0 Server(http://www.cbs.dtu.dk/services/NetPhos/);蛋白质序列信号位点分析使用Signal P 4.0 Server(http://www.cbs.dtu.dk/service/SignalP/);采用在线工具SWISS-MODEL(http://swissmodel.expasy.org/)进行蛋白质三维结构建模。
1.2.4 pjβAS基因在珠子参不同器官中的表达分析运用实时荧光定量PCR对珠子参花、叶、茎、根状茎中pjβAS基因的表达量进行检测。依据pjβAS基因测序结果,运用Oligo7引物设计软件设计定量分析引物pjβAS-F:5'-AAGATGTGGAGGCTAA-3'和pjβAS-R:5'-CAGAAATGGAGACGAG-3';分别以珠子参花、叶、茎、根状茎的cDNA为模板;采用SYBR Green I法,利用TaKaRa公司SYBR® Premix Ex TaqTM荧光定量试剂盒,在应用生物系统(Applied Biosystems)公司ABI 7500荧光定量PCR仪上进行扩增反应。反应体系(20 µL):SYBR Premix Ex TaqTM Ⅱ 10 µL,ROX Reference Dye Ⅱ 0.6 µL,pjβAS-F和pjβAS-R(10 umoL/L)各0.3 μL,60 ng/μL的cDNA模板2 μL,RNase Free H2O 6.8 μL。每个反应进行3次技术重复,并设置一例阴性对照。反应条件:96℃预变性3min;96℃变性20 s,60℃退火35 s,72℃延伸50 s,进行40个循环。本次实时荧光定量PCR反应选用β-actin(肌动蛋白)基因作为内参基因,内参引物为β-actin-F:5'-GGCATCACACTTTCTACAACG-3'和β-actin-R:5'-GGCAGGAACATTAAAGGTTTC-3'[14],以2-ΔΔct法计算pjβAS基因的相对表达量[15]。
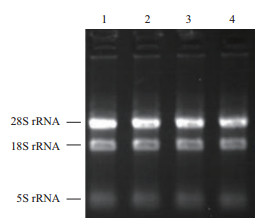
2 结果 2.1 总RNA提取结果的检测通过1%琼脂糖凝聚胶电泳对珠子参花、叶、茎、根状茎总RNA进行检测,结果(图 1)显示,3条特征条带完整清晰,其中28S rRNA条带与18S rRNA条带亮度比例约为2:1,且无拖带现象发生,表明总RNA未发生降解完整性良好。由超微量紫外分光光度计检测结果表明,各组织器官总RNA的A260/A280值介于1.8-1.9之间、A260/A230值介于2.0-2.1之间,表明总RNA纯度高,无多酚类有机物和蛋白质等杂质污染,满足后续分子实验要求。
|
| 图 1 珠子参不同组织器官总RNA电泳结果 1:珠子参花总RNA;2:珠子参叶总RNA;3:珠子参茎总RNA;4:珠子参根状茎总RNA |
以珠子参根状茎cDNA为模板,βAS-F和βAS-R为引物,进行普通PCR扩增。扩增产物经1.5%琼脂糖凝聚胶电泳检测,结果(图 2)显示,获得一条长度约为2 700 bp的明亮条带,与预期扩增片段大小基本一致。初步判定为珠子参pjβAS基因全长片段,由测序分析进一步鉴定。

|
| 图 2 pjβAS基因全长序列PCR扩增结果 M:DNA marker(DL5000);1:pjβAS基因PCR产物 |
测序结果经引物序列的剔除和片段拼接,获得了1个大小为2 655 bp的cDNA序列片段。经EditSeq软件分析,该序列包含一段2 286 bp的完整开放阅读框,编码761个氨基酸组成的蛋白,起始密码子为ATG,终止密码子为TGA,5'-UTR与3'-UTR的长度分别为98 bp和271 bp。Protparam推测pjβAS蛋白的分子式为C3980H5980N1042O1121S48,相对分子质量为87.90 kD,理论等电点(pI)为5.84,带正电氨基酸残基(Arg+Lys)为74,带负电氨基酸残基(Asp+Glu)为91。该蛋白平均亲水性系数为-0.360,不稳地系数为49.38,脂肪系数为75.14。pjβAS蛋白包含20种基本氨基酸,其中含量最高的是Glu(7.0%),含量最低的是Cys(2.4%)。
将测序得到的核苷酸序列在NCBI中进行BLAST比对,结果显示,该序列与竹节参Panax japonicus C. A. Mey(KP658156.1)、西养参Panax quinquefolius(JX262290.1)、柴胡Bupleurum chinense DC(EU400220.2)、辽东楤木Aralia elata(Miq.)Seem(HM219225.1)和刺揪Kalopanax septemlobus(Thunb.)Koidz(KT150523.1)全长序列相似度分别为99%、99%、86%、83%和83%,说明克隆获得的序列可能为珠子参pjβAS基因。对推衍的珠子参pjβAS氨基酸序列进行同源性分析,结果(图 3)显示,该序列与竹节参Panax japonicus C. A. Mey(AKN23431.1)、西洋参Panax quinquefolius(AGG09939.1)、柴胡Bupleurum chinense DC(ABY-90140.2)、辽东楤木Aralia elata(Miq.)Seem(ADK-12003.1)和刺揪Kalopanax septemlobus(Thunb.)Ko-idz(ALO23119.1)氨基酸序列的一致性分别为100%、99%、89%、87%和85%,比对结果经筛选得到3段OSC基因家族特征保守氨基酸序列DCTAE、QW(QXXXXXW)和MWCRCY。由此推测,本研究成功获得了一个新的珠子参/氧化鲨烯环化酶基因家族成员的全长cDNA序列,命名为pjβAS,将序列提交至GenBank数据库,获得的登录号为KX254566。

|
| 图 3 珠子参pjβAS基因编码蛋白的多序列比对 A:保守序列DCTAE;B:保守序列MWCRCY;C:保守序列QW(QXXXXXW) |
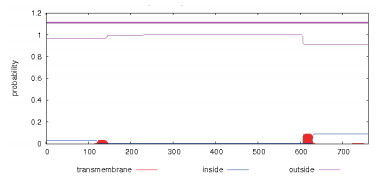
使用WOLF PSORT程序预测pjβAS基因编码蛋白的亚细胞定位情况,结果如下:叶绿体的定位系数为5.0(chlo5.0);内质网的定位系数为3.0(E.R3.0);线粒体的定位系数为2.0(mito2.0);细胞核的定位系数为1.5(uncl1.5);细胞骨架的定位系数为1.5(cysk_uncl1.5);质体的定位系数为1.0(plas1.0)。Signal P4.0在线软件预测该蛋白无信号肽,属非分泌蛋白。在线工具TMHMM2.0预测该蛋白几乎不含跨膜区,为非跨膜蛋白(图 4)。
|
| 图 4 pjβAS基因编码蛋白跨膜区域分析 |
运用NetPhos程序对pjβAS基因编码蛋白的磷酸化位点进行预测,结果(图 5)显示,该蛋白含有14处潜在的丝氨酸磷酸化位点,8处潜在的苏氨酸磷酸化位点,16处潜在的酪氨酸磷酸化位点。

|
| 图 5 pjβAS基因编码蛋白的磷酸化位点预测 |
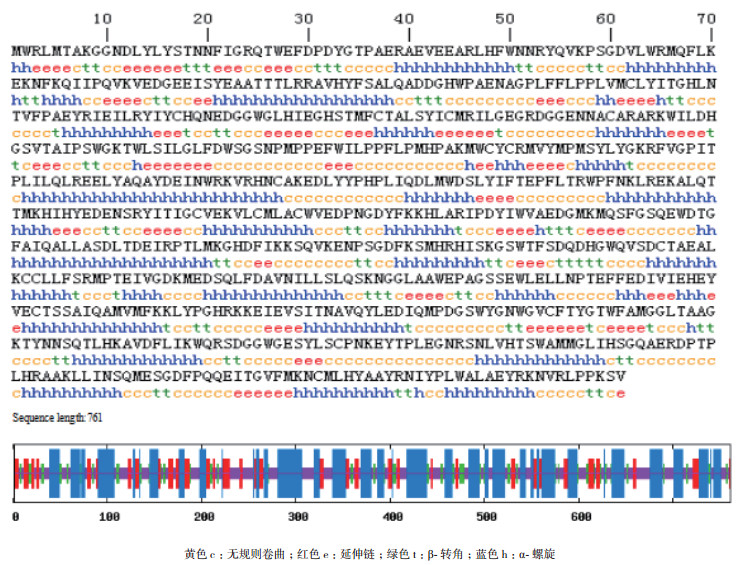
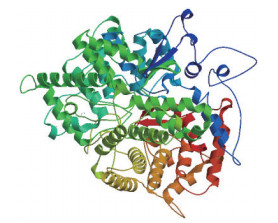
利用SOPMA在线软件对pjβAS基因编码蛋白的二级结构进行预测,结果(图 6)显示,该蛋白由39.82%α-螺旋,16.56%延伸链,10.38%β-转角和33.24%无规则卷曲构成,表明α-螺旋和无规则卷曲是主要的二级结构元件。使用SWISS-MODEL工具,运用同源建模法对pjβAS基因编码蛋白进行三级结构建模(图 7)。
|
| 图 6 pjβAS基因编码蛋白的二级结构预测 黄色c:无规则卷曲;红色e:延伸链;绿色t:β-转角;蓝色h:α-螺旋 |
|
| 图 7 pjβAS基因编码蛋白的三级结构预测 |
为了解pjβAS蛋白在自然界中大致的进化关系,从NCBI数据库中筛选出与pjβAS基因编码蛋白同源性较高的16种植物的βAS蛋白序列,分别为竹节参Panax japonicus C. A. Mey(AKN23431.1);西洋参Panax quinquefolius(AGG09939.1);柴胡Bupleurum chinense DC(ABY90140.2);辽东楤木Aralia elata(Miq.)Seem(ADK12003.1);刺揪Kalopanax septemlobus(Thunb.)Koidz(ALO23119.1);番茄Lycopersicon esculentum Mill(NP_001234604.1);麻花艽Gentiana straminea Maxim(AHX97777.1);黄花蒿Artemisia annua Linn(ACA13386.1);绿玉树Euphorbia tirucalli L.(BAE43642.1);百脉根Lotus corniculatus L.(BAE53429.1);可可Theobroma cacao(XP_007023608.1);大豆Glycine max(Linn.)Merr(AHI17180.1);南非醉茄Ashwagandha(AGA17940.1);乌拉尔甘草Glycyrrhiza uralensis Fisch(ADE88148.1);蒺藜苜蓿Medicago truncatula(XP_003604121.1);紫菀Aster tataricus L. f.(AAX147161);由ClustalW序列比对后,通过MEGA6.0软件采用NJ法,构建进化树,结果(图 8)显示,pjβAS基因与同属植物竹节参、西洋参和伞型科植物柴胡的βAS基因亲缘性最近,划归于同一分支,与菊科植物黄花蒿和紫菀在进化水平上遗传距离较近,而与豆科植物大豆、乌拉尔甘草、百脉根和蒺藜苜蓿遗传距离较远。
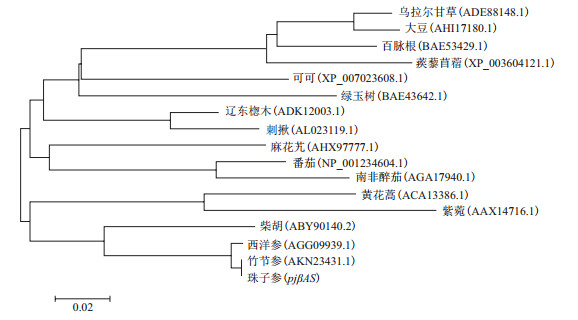
|
| 图 8 17种植物βAS基因的系统进化树 |
以珠子参花、叶、茎、根状茎cDNA为模板,pjβAS-F和pjβAS-R为引物,β-actin为内参基因进行实时荧光定量PCR反应,检测不同组织中pjβAS基因转录层面的相对表达量。结果(图 9)显示,pjβAS基因在叶中表达量最高,在根状茎中的表达量最低。珠子参的主要药用部位为根状茎,而pjβAS基因的组织差异表达,说明珠子参中皂苷类成分的代谢、合成与积累可能存在指向性和组织间的转运。

|
| 图 9 珠子参不同组织中pjβAS基因的相对表达量 |
珠子参作为人参属植物中的重要药材,在我国拥有悠久的药用传统。随着其化学成分和药理活性研究的深入,已成功从珠子参中分离出了28个皂苷单体,囊括了齐墩果烷型三萜皂苷和达玛烷型三萜皂苷两大类,其中竹节参皂苷Ⅳa作为珠子参的主要药用活性成分被2010版《中国药典》收录[16, 17]。近期,珠子参总皂苷在抑制大鼠心肌细胞凋亡和拮抗氧化应激损伤等方面的应用[18],已成为临床研究的热点。然而,珠子参中皂苷类成分含量较低,对活性单体皂苷的分离,传统的化学提纯法提取成本高且收益率低。加之珠子参为多年生草本植株,收获周期长,对土壤、气候和海拔高度等生长条件要求较高,使得珠子参在医药领域和日常生活中的推广应用受到限制。因此,利用合成生物学的研究思路,借助分子生物学和生物信息学的分析方法,探索珠子参中皂苷类成分的生物合成途径,实现合成途径中关键调控基因的定位、克隆和高效表达[19],将成为三萜皂苷大规模外源合成的可行办法。目前,对药用植物βAS基因的研究已取得了一定的进展。吴琼等[20],首次在西洋参中克隆得到βAS基因全长序列,并进行了序列特征分析和聚类分析。焉雅涛等[21],分析了不同种属间氧化鲨烯环化酶(OSC)基因家族的特征构型、表达调控和进化关系。王康宁等[22],在人参15个组织器官中对βAS基因表达量和皂苷含量进行了相关性分析,证实人参总皂苷和单体皂苷Rb1与βAS基因的表达呈显著正相关。本课题组在早期研究中通过Illumina高通量测序平台,获得了15.6 Gb的珠子参转录组数据,并从中筛选出了包括βAS基因在内的大量参与三萜皂苷生物合成的候选基因[13]。
在药用植物中,OSC家族处于三萜皂苷合成途径的中游位置,负责催化皂苷前体物的合成,βAS是OSC家族中目前唯一发现的调控齐墩果烷型皂苷合成的限速酶。本研究首次从珠子参中克隆得到βAS基因全长cDNA序列,编码761个氨基酸,整个多肽链中存在38处磷酸化位点,包括14处丝氨酸磷酸化位点,8处苏氨酸磷酸化位点和16处络氨酸磷酸化位点。蛋白质磷酸化是生物体内一种调节蛋白质活性与功能的普遍机制,氨基酸残基经磷酸化作用致使蛋白质分子带有电荷,进而使其分子结构和功能发生改变[23]。Haralampidis等[8]研究发现,βAS基因中邻近络氨酸Tyr261的氨基酸易产生突变,致使四环三萜类与五环三萜类产物发生互换。pjβAS基因与竹节参βAS基因氨基酸序列一致性为100%,而核苷酸序列相似度为99%,磷酸化作用可能是导致亲缘性较近的不同个体间基因功能发生改变的原因。在与其它OSC氨基酸序列的比较分析中,发现pjβAS基因含有OSC家族3个特征保守基序DCTAE、QW(QXXXXXW)和MWCRCY。序列DCTAE被视为环氧己烷亲电活化的质子供体,作用于底物结合[24-26];QW(QXXXXXW)为一段带负电荷的芳香族序列,在2,3-氧化鲨烯的环化过程中作用于正电荷中间体,达到稳固蛋白质结构的作用[27];在OSC基因家族中,MWCRCY序列于βAS中较为保守,其序列中的色氨酸(W)经研究发现参与调控三萜化合物碳骨架的生物合成[28]。
亚细胞定位分析表明,pjβAS蛋白在叶绿体和内质网中定位系数较高,且该蛋白无信号肽,不含跨膜区。推测pjβAS蛋白主要在附着于内质网的核糖体上合成,后由相应的信号肽定向输送到细胞内的靶位点发挥其生物学作用。实时荧光定量PCR检测表明,pjβAS基因在珠子参叶、茎、花、根状茎中表达量依次降低,表达量的变化与皂苷含量的分布相违背,珠子参根状茎中皂苷含量最高,茎和叶次之,花中含量最低[29]。由此推测珠子参中皂苷类成分主要在叶和茎中合成,通过物质转移通道运输到根状茎中储存,这种分布状态也符合草本植物在胁迫环境下自身防卫机制的客观要求。
4 结论本研究克隆得到的珠子参pjβAS基因全长2 655 bp,包含一个2 286 bp的完整开放阅读框,编码761个氨基酸。生物信息学分析显示,pjβAS编码蛋白分子量为87.90 kD,理论等电点(pI)5.84,不含跨膜区,为非分泌蛋白,含有38处磷酸化位点,主要于叶绿体和内质网中发挥生理作用。二级结构主要由α-螺旋和无规则卷曲构成,具有DCTAE、QW(QXXXXXW)和MWCRCY3个保守基序。pjβAS蛋白与竹节参(AKN23431.1)一致性达100%,和西洋参(AGG09939.1)、柴胡(ABY90140.2)的亲缘关系较近,划为同一支。pjβAS基因在珠子参不同组织中均有表达,在叶中表达量最高,根状茎中表达量最低。
| [1] | 中国药典[M].一部. 2015: 254. |
| [2] | 赵仁, 赵毅, 李东明, 等. 珠子参研究进展. 中国现代中药, 2008, 10(7): 3–6. |
| [3] | 李利霞, 赵厚涛, 朱虹, 等. 珍稀濒危植物珠子参研究进展. 陕西农业科学, 2015, 61(2): 59–61. |
| [4] | 王辉, 郭天康, 胡鹏斌. 珠子参临床药理研究进展. 甘肃医药, 2015, 34(2): 99–101. |
| [5] | 辛欣, 余宙, 范青生, 等. 藜蒿三萜分离纯化及其体外抗氧化、抗菌活性研究. 天然产物研究与开发, 2009, 21(2): 312–318. |
| [6] | 孙延芳, 梁宗锁, 刘政, 等. 酸枣果三萜皂苷抑菌和抗氧化活性的研究. 食品工业科技, 2012, 33(6): 139–142. |
| [7] | 许晓双, 张福生, 秦雪梅. 三萜皂苷生物合成途径及关键酶的研究进展. 世界科学技术-中医药现代化, 2014, 16(11): 2440–2448. |
| [8] | Haralampidis K, Trojanowska M, Osbourn AE. Biosynthesis of triterpenoid saponins in plants. Adv BioChem Eng Biotechnol, 2002, 75 (75): 31–49. |
| [9] | Basyuni M, Oku H, Tsujimoto E, et al. Triterpene synthases from the Okinawan mangrove tribe, Rhizoporaceae. FEBS Journal, 2007, 274 (19): 5028–5042. DOI:10.1111/j.1742-4658.2007.06025.x |
| [10] | 赵寿经, 候春喜, 梁彦龙, 等. 人参皂苷合成相关βAS基因的克隆及其反义植物表达载体的建立. 中国生物工程杂志, 2008, 28(4): 74–77. |
| [11] | Hayashi H, Huang P, Kirakosyan A, et al. Cloning and characterization of a cDNA encoding β-amyrin synthase involved in glycyrrhizin and soyasaponin biosynthese in licorice. Biol Pharm Bull, 2001, 24 (8): 912–916. DOI:10.1248/bpb.24.912 |
| [12] | Shibuya M, Katsube Y, Otsuka M, et al. Identification of a product specific β-amyrin synthase from Arabidopsis thaliana. Plant Physiol Biochem, 2009, 47 (1): 26–30. DOI:10.1016/j.plaphy.2008.09.007 |
| [13] | 张绍鹏, 金健, 胡炳雄, 等. 珍稀药用植物珠子参的转录组测序及分析. 中国中药杂志, 2015, 40(11): 2084–2089. |
| [14] | 候双利, 韩梅, 刘翠晶, 等. 人参β-actin基因实时荧光定量PCR方法的建立. 中草药, 2014, 45(17): 2530–2533. |
| [15] | 魏结书, 杨锦芬. 应用荧光定量比较Ct值法测定基因相对表达量. 中国科技论文在线精品论文, 2013, 6(5): 390–395. |
| [16] | 时晓磊, 王加付, 姚华, 等. 珠子参化学成分分析. 高等学校化学学报, 2013, 34(2): 381–385. |
| [17] | 宋小妹, 李林, 杨光明, 等. 不同产地珠子参中竹节参皂苷Ⅳa含量测定. 中国中药杂志, 2010, 35(7): 885–887. |
| [18] | 金家红, 贺海波, 石孟琼, 等. 珠子参总皂苷对小鼠局灶性脑缺血的保护作用. 第三军医大学学报, 2011, 33(24): 2631–2633. |
| [19] | 陈士林, 朱孝轩, 李春芳, 等. 中药基因组学与合成生物学. 药学学报, 2012, 47(8): 1070–1078. |
| [20] | 吴琼, 孙超, 陈士林. 西洋参β-香树脂合成酶基因的克隆和生物信息学分析. 中草药, 2013, 44(11): 1476–1480. |
| [21] | 焉雅涛, 王义, 王康宁, 等. 氧化鲨烯环化酶(OSC)基因家族研究进展. 人参研究, 2015, 27(2): 49–53. |
| [22] | 王康宁, 张美萍, 李闯, 等. 人参15个组织器官中皂苷量与6中人参皂苷生物合成基因表达的相关性研究. 中国中药杂志, 2015, 40(16): 3168–3173. |
| [23] | 梁前进, 王鹏程, 白燕荣. 蛋白质磷酸化修饰研究进展. 科技导报, 2012, 30(31): 73–79. |
| [24] | ChangCH, ChenYC, Tseng SW, et al. The cysteine 703 to isoleucine or histidine mutation of the oxidosqualene-lanosterol cyclase from Saccharomyces cerevisiae generates an iridal-type triterpenoid. Biochimie, 2012, 94 (11): 2376–2381. DOI:10.1016/j.biochi.2012.06.014 |
| [25] | 陈颖, 孙海燕, 曹银萍. 三萜皂苷生物合成途径研究进展. 中国野生植物资源, 2012, 31(6): 15–17. |
| [26] | Kushino T, Shibuya M, Ebizuka Y. Chimeric triterpene synthase. a possible model for multifunetional triterpene synthase. Am Chem Soc, 1999, 121 (6): 1208–1216. DOI:10.1021/ja983012h |
| [27] | Poralla K, Hewelt A, Prestwich GD, et al. A specific amino acid repeat in squalene and oxidosqualene cyclase. Trends Biochem Sci, 1994, 19 (4): 157–158. DOI:10.1016/0968-0004(94)90276-3 |
| [28] | Kushiro T, Shibuya M, Masuda K, et al. Mutational studied on triterpene synthases: engineering lupeol synthase into β-amyrin synthase. Am Chem Soc, 2000, 122 (29): 6816–6824. DOI:10.1021/ja0010709 |
| [29] | 宋砚农. 大叶珠子参不同药用部位皂苷类成分的研究. 成都中医学院学报, 1986, 3(3): 41–43. |




