2. 贵州医科大学附属医院肿瘤生物治疗中心,贵阳550004
2. Cancer Molecular Diagnostics & Immunotherapy Center, the Affiliated Hospital of Guizhou Medical University, Guiyang 550004
几丁质是由β-1,4糖苷键连接N-乙酰-D-氨基葡萄糖构成的直链多糖高聚物,广泛存在于自然界中[1]。在昆虫体内,它存在于外骨骼、围食膜中,发挥骨架支撑等重要生理功能。几丁质的水解主要由几丁质降解酶来完成,几丁质酶是几丁质降解酶家族的关键酶,参与了昆虫蜕皮、围食膜降解等多种重要生命活动[2-4]。此外,几丁质酶也具有抑制病原微生物生长等作用。鉴于几丁质酶的重要性,以几丁质为靶标,通过阻断几丁质酶的表达途径,从而可阻止昆虫的蜕皮、羽化及围食膜再生,达到防治有害昆虫目的[5]。由于几丁质及其聚合物在脊椎动物等高等动物中不存在,因此通过扰乱几丁质酶的正常调控进而破坏几丁质的新陈代谢来防治害虫,对脊椎动物和人类是相对安全并且有效的生物防治策略。
自1993年Kramer[6]从烟草夜蛾中克隆出第一条完整的昆虫几丁质酶基因cDNA序列后,现已从双翅目(dipterans)[7]、鳞翅目(lepidopterans)[8, 9]、鞘翅目(coleopterans)[10]、半翅目(hemipteransf)[11]和膜翅目(hymenopterans)等昆虫中鉴定到多个不同类型的几丁质酶基因,有多个学者证实了几丁质酶对小菜蛾、埃及伊蚊等有杀虫增效作用[12, 13]。
家蝇是一种常见的卫生昆虫,几乎分布在世界的每一个地方,携带多种病原体和寄生虫,可传播伤寒、霍乱、痢疾等多种传染病。一直以来,人们主要依靠化学手段来防治家蝇,但长期、大量地使用化学杀虫剂,不仅对环境造成严重污染,同时使家蝇的抗药性不断增加,导致防治日益困难[14]。因此,寻求一种即可靠又安全的防治有害昆虫的方法具有重要的意义。目前,国内外对家蝇的研究主要集中在先天性免疫活性因子的筛选及功能研究方面[15, 16],但对其在生长发育及免疫防御中具有重要意义的几丁质降解酶家族却鲜有报道。
本课题组前期对筛选到的家蝇几丁质酶Ⅰ(MDCI)进行了克隆表达分析[17],本研究对家蝇几丁质酶MDCⅡ基因进行克隆,构建重组表达质粒,采用实时荧光定量PCR的技术,分析MDCⅡ的时空表达模式,初步探讨该基因在家蝇生长发育及免疫防御过程中可能发挥的作用,旨在为有害昆虫的生物防治设计合理的控制措施提供一定的实验依据。
1 材料与方法 1.1 材料 1.1.1 实验材料家蝇(贵州医科大学寄生虫学教研室实验室传代繁殖),饲养条件:温度28±1℃,相对湿度50%-60%,光照黑暗各12 h交替。
1.1.2 主要试剂和仪器RNAiso Reagent(Total RNA提取试剂);PrimeScript RT reagent Kit with gDNA Eraser,SYBR Premix Ex TaqTM Ⅱ,焦碳酸二乙酯(DEPC),DNA标志物DL2000,DNA凝胶回收试剂盒质粒、DNA快速提取试剂盒(均购自大连TaKaRa公司);其他试剂均为国产分析纯。PCR扩增仪(德国Eppendorf公司);紫外分光光度计(美国GE公司);显微解剖镜(尼康)。
引物合成与DNA测序:引物由TAKARA公司合成;重组质粒DNA测序工作由上海生工生物技术有限公司完成。
1.2 方法 1.2.1 家蝇几丁质酶基因MDCⅡ的识别及序列测定对测定得到的家蝇3龄幼虫EST序列进行BLAXT分析,从中筛选获得编码家蝇几丁质酶基因的文库质粒(编号为005-H08),命名为MDCⅡ。
1.2.2 MDCⅡ基因的生物信息学分析利用NCBI网站的BLAST工具进行数据库基因序列的相似性及同源性查找和比对,使用MEGA5.1软件采用邻接法构建系统进化树;瑞士生物信息学研究所的蛋白分析专家系统(ExPASy)分析MDCⅡ基因编码蛋白的理化特性。
1.2.3 MDCⅡ基因的cDNA克隆用DNAClub和Primer5.0设计引物。上游引物为:5' -CAGTACCGATCATCGATATCAATACC-3' ,下游引物为:5' -TTAGTGCAACAAACGATATTTAATG-3' 。以MDCⅡ基因的cDNA文库质粒为模板,PCR循环参数为:94℃预变性5 min;94℃变性60 s;54℃退火60 s;72℃延伸60 s,35个循环;72℃总延伸10 min。PCR后产物行1.0%琼脂糖凝胶电泳鉴定。将目的基因与pEASY-E1载体25℃连接20 min,冰浴5 min,连接产物转入Trans1-T1克隆感受态细胞中。挑选单菌落混于10 μL LB培养液中,用相同的引物、体系、循环参数分别使用目的基因的上下游引物、目的基因上游引物和T7下游引物、T7上游引物和目的基因下游引物及T7上下游引物进行PCR鉴定;将PCR鉴定阳性的菌液测序。
1.2.4 家蝇MDCⅡ在不同发育时期、不同组织的表达分析提取家蝇不同发育时期(卵、各龄期幼虫、蛹及雌雄成虫),以及3龄幼虫不同组织(体壁、气管、唾液腺、脂肪体、马氏管及中肠)的总RNA,每个样本设3个技术重复,并进行逆转录后,以获得总cDNA,根据扩增得到的MDCⅡ基因的cDNA序列在其保守序列区设计特异引物,上游引物序列为5' -ATGCAAATTTCATCAGTTTTCATCC-3' ;下游引物序列为5' -GGATGAAAACTGATGAAATTTGCAT-3' 。内参根据家蝇GAPDH序列设计,上游引物为5' -CATCATCTCCGCTCCATC-3' ;下游引物为5' -AAGCCATACCAGTGAGTTTACC-3' ,进行qRT-PCR检测。反应条件为:95℃预变性30 s;95℃变性5 s,60℃退火1 min,40个循环。
1.2.5 家蝇MDCⅡ在不同微生物诱导后的表达分析取大小均一的3龄家蝇幼虫,用显微注射法分别将大肠埃希菌(Escherichia coli)和金黄色葡萄球(Staphylococcus aureus),白色念珠菌(Candida albicans),注入体内。在细菌刺激后3、6、12、18、24、36和48 h取样,各实验点分别设置3组平行,每个实验对象设有6个生物重复。分别提取总RNA,按上述反应条件进行qRT-PCR检测。采用比较CT值法对目标基因进行相对定量分析,采用SPSS17.0进行统计学分析。
2 结果 2.1 MDCⅡ基因序列分析MDCⅡ基因序列包含一个1 374 bp的完整开放阅读框(ORF),编码一个由457氨基酸组成的蛋白,理论分子量约为51.6 kD,等电点约为9.13,含有6个半胱氨酸,在溶液中性质稳定。MDCⅡ同舌蝇的几丁质酶成虫盘生长因子(Idgf4)具有53%的相似性,与果蝇的CG520蛋白的相似度为61%。BLAST对其保守结构域分析显示,MDCⅡ包含几丁质酶的保守结构域,属于糖苷水解酶18家族(图 1)。

|
| 图 1 BLAST中MDCⅡ保守结构域分析 |
二级结构分析显示,MDCⅡ蛋白有N-糖基化位点1个,N-肉豆蔻酰化位点7个,有6个潜在的蛋白激酶C磷酸化位点,1个甲壳酶18家族的活性位点。MDCⅡ功能结构域为第31位氨基酸到第434位氨基酸间的序列,无几丁质酶结合域,含有12个α螺旋和β折叠。
MDCⅡ的进化分析中,所选序列分别来自果蝇、埃及伊蚊、按蚊和致倦库蚊等,结果(图 2)显示家蝇MDCⅡ与果蝇成虫盘生长因子的遗传距离较近。
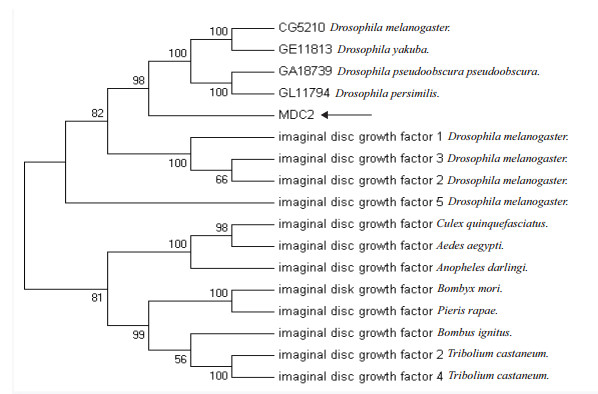
|
| 图 2 MDCⅡ进化树分析 |
以MDCⅡ基因的cDNA文库质粒为模板,用特异性引物进行PCR扩增,获得与预期目的基因大小一致的条带(图 3)。经测序比对,结果显示与目的基因cDNA序列一致。

|
| 图 3 MDCⅡ基因重组质粒的PCR鉴定图 M:DL 2000;1:MDCⅡ目的条带;2:MDCⅡ目的条带(去信号肽);3:MDCⅡ-F和T7R(重组质粒);4:T7F和MDCⅡ-R(重组质粒);5:T7F和T7R(重组质粒) |
在家蝇的各个发育时期,MDCⅡ基因均有不同程度的表达。以卵期作为参照,MDCⅡ基因在2龄幼虫中的表达量最高,其表达量由高到低依次为:2龄﹥3龄幼虫﹥1龄幼虫﹥雄虫﹥蛹﹥雌虫﹥卵(图 4)。

|
| 图 4 MDCⅡ基因在家蝇生活史不同发育阶段的表达差异 与卵期相比,*P < 0.05 |
在家蝇3龄幼虫的各主要组织中,以体壁作为参照,MDCⅡ基因在唾液腺和脂肪体中的表达量较高,其表达量由高到低依次为:唾液腺﹥脂肪体﹥马氏管﹥中肠﹥气管﹥体壁(图 5)。
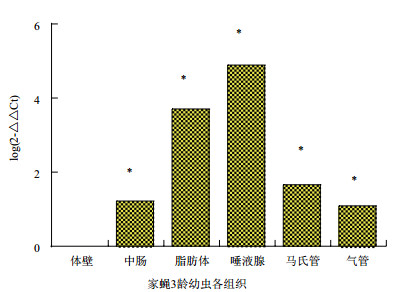
|
| 图 5 MDCⅡ基因在家蝇3龄幼虫各组织部位的表达差异 与体壁相比,*P < 0.05 |
3龄幼虫经白色念珠菌诱导后,MDCⅡ基因在诱导3 h后出现了明显的表达上调,6 h出现下调,但与基础免疫状态相比仍处于较稳定的高水平状态,到达24 h后,表达开始下调,直至36 h以后,接近基础免疫状态(图 6)。经金黄色葡萄球菌和大肠埃希菌诱导后,MDCⅡ基因在诱导后的各个时间点亦出现明显的上调,其在诱导后3 h上调最为明显(图 7、图 8)。

|
| 图 6 MDCⅡ经白色念珠菌诱导后家蝇3龄幼虫中的表达差异 |
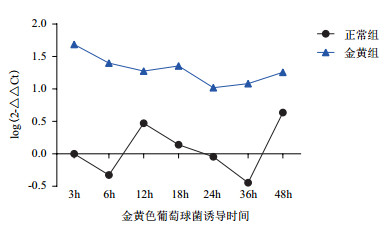
|
| 图 7 MDCⅡ经金黄色葡萄球菌诱导后家蝇3龄幼虫中的表达差异 |
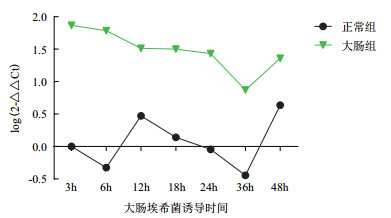
|
| 图 8 MDCⅡ经大肠埃希菌诱导后家蝇3龄幼虫中的表达 |
几丁质酶是几丁质降解酶家族的关键酶。Arakane等[18]根据各种昆虫几丁质酶的氨基酸序列的同源性和系统发育分析,将几丁质酶和几丁质酶类似蛋白分为Ⅰ-Ⅷ型,随后通过RNAi技术和RT-PCR对这些基因的功能和表达特异性进行了研究[19],证明了不同类型的几丁质酶及其类似蛋白在昆虫的不同生长发育阶段和不同组织中的作用具有很大的差异性。昆虫体内通常有多种几丁质酶共同存在,发挥不同的功能[20]。
本研究从家蝇3龄幼虫cDNA文库中筛选出MDCⅡ基因,构建了原核重组质粒,并初步探讨了该基因在家蝇发育和免疫防御过程中的可能作用。在克隆过程中所选用的是pESAY-E1表达载体,带有T7启动子和Lac,组氨酸标签,因其在与目的片段相连处有突出的胸腺嘧啶(T)与PCR产物中自带的腺嘌呤(A)相连,故可省略传统表达载体构建过程中载体及PCR纯化产物双酶切的步骤。但采用的连接方式可能会导致目的片段与载体启动子阅读方向反向连接情况出现,因此,在进行PCR鉴定时需要用目的片段前的T7启动子上游引物和目的基因的下游引物、目的基因的上游引物和目的基因后的T7启动子下游引物,以及T7启动子的上下游引物同时进行PCR鉴定。
通过实时荧光定量PCR技术,对目的基因时空表达模式进行研究,探寻该基因在家蝇发育及免疫防御过程中的潜在功能。结果发现,MDCⅡ基因在家蝇各发育时期都有不同程度的表达,其中在家蝇幼虫2龄期和3龄期中的表达量最高,而到达蛹期表达量下降,提示MDCⅡ参与了家蝇的生长发育。MDCⅡ在3龄幼虫组织中都有较为稳定的表达,其中在唾液腺和脂肪体的表达量较高。
进化分析显示,MDCⅡ与果蝇成虫盘生长因子(IDGFs)的同源性较高。IDGFs归属于几丁质酶V型,现有的研究表明其在昆虫的生长发育过程中起到不可或缺的作用。果蝇IDGFs在脂肪体中高表达,本研究结果亦显示MDCⅡ在脂肪体中表达量较高,提示家蝇和果蝇的IDGFs在组织表达特性上有相似之处。有研究显示,除了参与细胞的增值和分化外,IDGFs还具有免疫功能,有学者在对冈比亚按蚊IDGFs进行研究时发现,这类蛋白在金黄色葡萄球菌和大肠埃希菌诱导后出现明显上调,其原因主要因为这类蛋白可能作用于细菌细胞壁的肽聚糖结构,使细菌的细胞壁结构发生改变,激活相应的免疫应答,抵制细菌[21]。舌蝇的成虫盘生长因子可以抵制含几丁质的微生物(如真菌)的侵染,但具体作用机制尚未研究清楚[22]。家蝇MDCⅡ基因在白色念珠菌、金黄色葡萄球菌和大肠埃希菌诱导后均出现明显的表达上调,推测家蝇MDCⅡ基因也参与了家蝇对病原微生物的免疫防御过程,在机体的抗菌过程中亦发挥一定的作用。
4 结论本研究成功构建pEASY-E1-MDCⅡ重组表达质粒,通过生物信息学分析,构建系统进化树,发现MDCⅡ基因属于成虫盘生长因子,采用实时荧光定量PCR方法,初步研究了MDCⅡ基因参与了家蝇的生长发育,在免疫防御过程中也发挥了一定作用。
| [1] | Andersen SO, Hojrup P, Roepstorff P. Insect cuticular proteins. Insect Biochemistry and Molecular Biology, 1995, 25 (2): 153–176. DOI:10.1016/0965-1748(94)00052-J |
| [2] | Merzendorfer H, Zimoch L. Chitin metabolism in insects: structure, function and regulation of chitin synthases and chitinases. Journal of Experimental Biology, 2004, 206 (Pt 24): 4393–412. |
| [3] | 李瑶, 范晓军. 昆虫几丁质酶及其在害虫防治中的应用. 应用昆虫学报, 2011, 48(5): 1489–1494. |
| [4] | Wu Q, Liu T, Yang Q. Cloning, expression and biocharacterization of OfCht5, the chitinase from the insect Ostrinia furnacalis. Insect Science, 2013, 20 (2): 147–57. DOI:10.1111/j.1744-7917.2012.01512.x |
| [5] | Khajuria C, Buschman LL, Chen MS. A gut-specific Chitinase gene essential for regulation of chitin content of peritrophic matrix and growth of Ostrinia nubilalis larve. Insect Biochemistry and Molecular Biology, 2010, 40 (8): 621–629. DOI:10.1016/j.ibmb.2010.06.003 |
| [6] | Kramer KJ, Corpuz L, Choi HK, et al. Sequence of a cDNA and expression of the gene encoding epidermal and gut chitinases of Manduca sexta. Insect Biochemistry & Molecular Biology, 1993, 23 (6): 691–701. |
| [7] | Yang WJ, Xu KK, Zhang RY, et al. Transcriptional regulation of a chitinase gene by 20-hydroxyecdysone and starvation in the oriental fruit fly, Bactrocera dorsalis. International Journal of Molecular Sciences, 2013, 14 (10): 20048–20063. DOI:10.3390/ijms141020048 |
| [8] | Kokuho T, Yasukochi Y, Watanabe S, et al. Molecular cloning and expression profile analysis of a novel beta-D-N-acetylhexosaminidase of domestic silkworm (Bombyx mori). Genes to Cells, 2010, 15 (5): 525–536. |
| [9] | Nomura T, Ikeda M, Ishiyama S, et al. Cloning and characterization of a beta-N-acetylglucosaminidase (BmFDL) from silkworm Bombyx mori. Journal of Bioscience and Bioengineering, 2010, 110 (4): 386–391. DOI:10.1016/j.jbiosc.2010.04.008 |
| [10] | Zhu QS, Arakane Y, Beeman RW, et al. Functional specialization among insect chitinase family genes revealed by RNA interference. Proc Natl Acad Sci, 2008, 105 (18): 6650–6655. DOI:10.1073/pnas.0800739105 |
| [11] | Nakabachi A, Shigenobu S, Miyagishima S. Chitinase-like proteins encoded in the genome of the pea aphid, Acyrihosiphon pisum. Insect Molecular Biology, 2010, 19 (Suppl 2): 175–185. |
| [12] | Sampsora MN, Gaoobay GW. Involvement of chitinases of Bacillus thuringiensis during pathogenesis in insects. Microbiology, 1998, 144 (8): 2189–2194. DOI:10.1099/00221287-144-8-2189 |
| [13] | Arora N, Ahmad T, Rajagopal R, et al. A constitutively expressed 36 kD exochitinase from Bacillus thuringiensis HD-1. Biochemical and Biophysical Research Communications, 2003, 307 (3): 620–625. DOI:10.1016/S0006-291X(03)01228-2 |
| [14] | 莫晓畅. 5种化合物对家蝇的引诱效果研究. 中国媒介生物学及控制杂志, 2013, 24(4): 330–335. |
| [15] | Kita T, Ozoe F, Ozoe Y. Expression pattern and function of alternative splice variants of glutamate-gated chloride channel in the housefly Musca domestica. Insect Biochemistry & Molecular Biology, 2014, 45 (1): 1–10. |
| [16] | Joyner C, Mills MK, Nayduch D. Pseudomonas aeruginosa in Musca domestica L.: temporospatial examination of bacteria population dynamics and house fly antimicrobial responses.. PLoS One, 2013, 8 (11): e79224–e79224. DOI:10.1371/journal.pone.0079224 |
| [17] | 国果, 吴建伟, 吴沁怡. 家蝇几丁质酶基因的序列分析、克隆和诱导表达. 中国人兽共患病学报, 2012, 28(6): 570–573. |
| [18] | Arakane Y, Muthukrishnan S. Insect chitinase and chitinase-like proteins. Cellular & Molecular Life Sciences Cmls, 2010, 67 (2): 201–216. |
| [19] | Zhang J, Zhang X, Arakane Y, et al. Comparative genomic analysis of chitinase and chitinase-like genes in the African malaria mosquito (Anopheles gambiae). PLoS One, 2011, 6 (5): e19899–e19899. DOI:10.1371/journal.pone.0019899 |
| [20] | Van Eijk M, van Roomen CP, Renkema GH, et a1. Characterization of human phagocytederived chitotriosidase, a component of innate immunity. Int Immunol, 2005, 17 (11): 1505–1512. DOI:10.1093/intimm/dxh328 |
| [21] | Shi L, Paskewitz SM. Identification and molecular characterization of two immune-sesponsive chitinase-like proteins from Anopheles gambiae. Insect Mol Biol, 2004, 13 (4): 387–398. DOI:10.1111/imb.2004.13.issue-4 |
| [22] | Yan J, Cheng Q, Narashimhan S, et al. Cloning and functional expression of a fat body-specific chitinase cDNA from the tsetse fly, Glossina morsitans morsitans. Insect Biochem Mol Biol, 2002, 32 (9): 979–989. DOI:10.1016/S0965-1748(02)00034-6 |




