玉米是重要的粮饲兼用作物,我国玉米年均种植面积超约3.3×107 hm2,产量超2×108 t,是世界第二大玉米生产国。玉米籽粒在授粉后开始发育,叶片中光合作用产生的淀粉、蛋白质和有机物质储存在籽粒里的生物学过程,称为灌浆期。在这一阶段,源、库关系调控植株光合作用产生的碳水化合物从营养器官向籽粒转移,叶片光合产物的90%运往籽粒,通过一系列蛋白间的相互作用进而调控一系列酶催化,将蔗糖转化为淀粉。因此,灌浆对于决定玉米籽粒发育的成败和产量至关重要[1-2]。
玉米籽粒灌浆速率的研究一直是玉米育种领域的重要科学问题,延长籽粒灌浆持续时间和加快灌浆速率有利于籽粒中干物质的积累,从而提高籽粒产量[3-6]。提高灌浆速率既可以使玉米利用生长期的有效积温和水肥营养获得经济的籽粒产量[7],也可以使籽粒含水量迅速降低避免秋季霜冻带来的危害。研究发现植物的糖通过转运体和输出载体从母体组织持续的运出和运入过程中,任何一个环节发生变化都会影响蔗糖的转运和利用[8-10]; 并且糖和淀粉代谢酶的活跃程度及相关基因的表达水平的调节直接影响籽粒库器官的活力,进而影响籽粒灌浆速率[11-14]。
研究参与和调控籽粒灌浆期生化过程的关键基因和调控因子,解析调控籽粒灌浆速率的分子机制,一方面有助于我们了解这一生物学过程的重要信息; 另一方面可以为农业生产中培育适应机械化收获的快速灌浆和快速脱水的玉米品种提供理论指导和技术支撑。
本实验室根据B73玉米基因组信息和生物信息学分析预测了在玉米灌浆期籽粒中特异表达的转录因子GRAS家族基因,ZmSCL1是其中之一。该基因在玉米籽粒中,尤其是胚乳中高表达,进化树分析表明其和DELLA亚家族的成员的序列同源性最高[15]。鉴于蛋白质是基因功能的体现者和执行者,其表达的时空特异性,及与上下游互作因子的关联性是决定其在生命过程中发挥作用的基础。为深入研究了解ZmSCL1在灌浆过程中的功能,本研究在分析其基因序列和转录水平信息的基础上,采用SMART cDNA合成技术,通过同源重组方法构建了玉米籽粒灌浆期的酵母双杂交cDNA文库,并利用ZmSCL1作为诱饵进行文库筛选,以期获得在玉米籽粒灌浆期与ZmSCL1互作的蛋白,为阐明ZmSCL1及其互作相关因子调控籽粒灌浆的分子机制奠定基础。
1 材料与方法 1.1 材料玉米自交系B73由本实验室保存,B73种植在中国农业科学院廊坊基地,取材授粉后12 d、20 d的籽粒材料; pGADT7和pGBKT7空载质粒由本实验室保存; RNA提取试剂RNAiso Plus购自TaKaRa公司; Make Your Own “Mate & PlateTM” Library System User Manual购自Clontech公司; DH5α感受态细胞购自北京全式金生物技术有限公司; 酵母菌株AH109,载体pGADT7-Rec购自Clontech公司; YPD Agar Medium购自生工生物; Yeast Nitrogen Base W/O Amino Acids购自BD公司; SD/-Leu、SD/-Leu/-Trp和SD/-Ade/-His/-Leu/-Trp购自Clontech公司; BactoTMAgar购自BD公司; 琼脂糖购自Amresco公司; 引物合成及测序由生工生物工程(上海)股份有限公司完成。
1.2 方法 1.2.1 总RNA的提取用液氮研磨不同授粉时间12 DAP(Days after pollination)和20 DAP的籽粒,采用RNAiso Plus(TaKaRa公司)提取籽粒总RNA,每1 mL RNAiso Plus试剂提取30 mg样品; 最终将RNA溶解到30 μL无RNase的水中。用1%的琼脂糖凝胶电泳检测提取的RNA质量。
1.2.2 诱饵载体的构建将12 DAP和20 DAP的总RNA分别逆转录成cDNA,依据MaizeGDB数据库中ZmSCL1基因的序列信息设计引物ZmSCL1-BDF/R(ZmSCL1-BDF:5' -CATATGATGGATGCTCACACCACTCACATTG-3' ;ZmSCL1-BDR:5' -GGATCCCTACTCCATGGGTCCATTACGGTTTTC-3' )进行PCR扩增,这样基因的两端分别带有BamH I和Xba I两个限制性内切酶位点,将PCR产物切胶回收,使用BamH I和Xba I双酶切,回收酶切产物,与经相同方式酶切的pGBKT7空载的酶切回收产物进行连接反应,转化大肠杆菌感受态细胞(DH5α),经酶切鉴定和测序分析,获得pGBKT7-ZmSCL1构建。
1.2.3 AH109菌株感受态细胞的制备用YPDA培养基活化和培养酵母AH109菌株,使用美国伯乐公司的分光光度计测定菌液浓度OD600。在YPDA培养基中摇菌,至OD600达到0.15-0.3,700 ×g离心5 min,弃上清,加入新鲜的100 mL YPDA培养基重悬菌液并继续培养,至OD600达到0.4-0.5,700×g离心收集菌体,并用灭菌水重悬菌体,离心收集,用1.1×TE/LiAc溶液重悬菌体,再次离心收集菌体,最后,制备好的感受态细胞重悬在1.1×TE/LiAc溶液中。
1.2.4 诱饵融合蛋白的自激活活性鉴定按照Clontech YeastmakerTM Yeast Transformation System 2说明书中的转化方法,参照赵慧等[16]的转录自激活检测方法,将构建好的诱饵载体质粒pGBKT7-ZmSCL1 0.2 μg和空载质粒pGADT7 0.1 μg共转化酵母感受态细胞,同时将空载对照pGADT7+pGBKT7、阳性对照pGADT7+pGBKT7-53均按以上质量比进行共转化。最后将转化菌体吸取150 μL涂布SD/-Leu/-Trp和SD/-Ade/-His/-Leu/-Trp平板,30℃温箱中倒置培养3-5 d观察结果。
1.2.5 双链cDNA的合成以0.1-2.0 μg总RNA为模版,以CDS Ⅲ(Oligo-dT)为引物反转录合成第一链cDNA; 以第一链cDNA为模版,使用Long distance PCR(LD PCR)扩增合成ds cDNA(扩增程序为95℃ 30 s; 95℃ 10 s,68℃ 6 min,20个循环; 68℃ 5 min); 在1.2%的琼脂糖凝胶上对PCR产物进行分析(参照Make Your Own “Mate & PlateTM” Library System User Manual使用说明书)。
1.2.6 酵母双杂交cDNA文库的构建和筛选使用制备好的酵母感受态细胞,参照崔红军等[17]的文库构建方法和杨莎等[18]的酵母共转化筛选方法,在600 μL感受态细胞中加入20 μL ds cDNA(5 μg),6 μL pGADT7-Rec(3 μg)质粒载体,5 μL pGBKT7-ZmSCL1(5 μg),20 μL Herring Tests Carrier DNA,轻柔混匀。加入2.5 mL PEG/LiAc溶液,轻柔混匀。30℃孵育45 min且每15 min混匀一次,然后加入160 μL DMSO(用DMSO增强细胞通透性),42℃孵育20 min,且中间每10 min混匀一次,即采用热激法将诱饵、质粒载体和ds cDNA导入感受态细胞中,然后700×g离心5 min收集菌体,弃上清,加入3 mL YPD Plus(试剂盒提供)30℃摇床培养90 min,再离心收集菌体,最后用6 mL 0.9% NaCl溶液重悬菌体。转化后的酵母细胞液,吸取10 μL,按比例1:100,1:1 000稀释,分别涂SD/-Leu平板各两个,500 μL/板; 吸取100 μL,按比例1:10,1:100,1:1 000稀释,分别涂SD/-Leu/-Trp平板各两个,500 μL/板; 将剩下的细胞液涂SD/-Ade/-His/-Leu/-Trp,500 μL/板。30℃倒置培养3-5 d。详见Make Your Own “Mate & PlateTM” Library System User Manual使用说明书V Ⅲ-A。
1.2.7 文库滴度、重组率和多态性分析待上述涂SD/-Leu平板(按比例1:100,1:1 000稀释)上长出单克隆后,统计平板上的菌落计数,参照杨君等[19]的文库滴度计算方法,计算文库滴度(文库滴度(CFU/mL)=每板平均克隆数/涂布体积×稀释倍数)。挑SD/-Ade/-His/-Leu/-Trp平板上的单克隆摇菌培养,2-3 d,使用天根酵母质粒提取试剂盒提取酵母质粒DNA,使用pGADT7-Rec载体引物(pGADT7-F:5' -TAATACGACTCACTATAGGGC-3' 和pGADT7-R:5' -AGATGGTGCACGATGCACAG-3' )进行菌落PCR,根据扩增结果计算文库重组率(%)=阳性克隆数/检测菌落数×100%,并分析文库多态性。详见Make Your Own “Mate & PlateTM” Library System User Manual使用说明书。
1.2.8 ZmSCL1互作因子的筛选和生物信息学分析参照酵母建库试剂盒,构建ZmSCL1诱饵载体,并在上述的cDNA文库中筛选ZmSCL1的互作因子。所筛选的克隆进行测序,除去载体序列,测序长度大于400 bp的DNA片段通过Blast2GO和玉米转录本进行同源比对,获得基因的全长,对这些基因所编码的蛋白质进行功能注释和富集分析。Blast2GO的参数按照软件说明设置。
2 结果 2.1 玉米中ZmSCL1的表达特性基因的时空表达特异性与其参与的功能直接相关。根据B73玉米基因组信息和生物信息学分析预测了在玉米灌浆期籽粒中特异表达的转录因子GRAS家族基因,最终获得了在胚乳中特异性表达的ZmSCL1。ZmSCL1从授粉后12-24 d持续高表达(图 1)。这说明ZmSCL1可能参与玉米籽粒,尤其是胚乳的发育调控。

|
| 图 1 B73中ZmSCL1的表达谱 横坐标为不同组织器官的不同发育时期:R:播种后7 d主根; L1:营养生长期第一片真叶; L2:营养生长期第18片真叶; St:茎; Ta:未成熟雄花; Si:花丝; DAP:授粉后天数; Se:全籽粒; En:胚乳; Em:胚; Pe:果皮。纵坐标为FPKM(Fragments Per Kilobase of exon model per Million mapped fragments,每千个碱基的转录每百万映射读取的fragments).数据来源于MaizeGDB的RNAseq |
以玉米籽粒灌浆期ZmSCL1表达量较高的12 DAP和20 DAP籽粒为材料,使用Takara公司的RNAiso Plus试剂,提取籽粒总RNA,使用1%琼脂糖凝胶检测提取的总RNA质量,如图 2所示,28S和18S rRNA条带清晰,表明RNA完整性较好; 经Nano drop测定分析,A260/A280在1.9-2.1之间,浓度约为1-2 μg/μL,这表明RNA无DNA、蛋白质和小分子物质的污染,浓度较高,可用于下一步实验。

|
| 图 2 玉米籽粒总RNA电泳检测 20 DAP:授粉后20 d的籽粒; 12 DAP:授粉后12 d的籽粒 |
将实验组pGADT7+pGBKT7-ZmSCL1共转化酵母感受态细胞,同时设置空载对照组pGADT7+pGB-KT7、阳性对照组pGADT7+pGBKT7-53。结果(图 3)显示,实验组在SD/-Leu/-Trp平板上有菌落生长,但在SD/-Ade/-His/-Leu/-Trp平板上没有菌落生长,与空载对照相同。这说明该诱饵基因的融合蛋白没有自激活活性,可以进行下一步酵母双杂交互作蛋白的筛选。
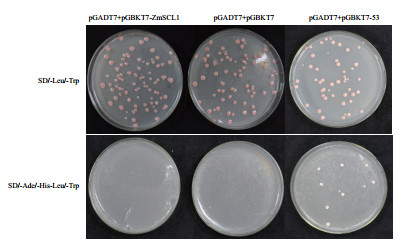
|
| 图 3 诱饵融合蛋白的转录激活活性鉴定 SD/-Leu/-Trp:亮氨酸-色氨酸缺陷培养基; SD/-Ade/-His/-Leu/-Trp:腺嘌呤-组氨酸-亮氨酸-色氨酸缺陷培养基 |
以2 μL RNA为模板,反转录合成第一链cDNA,然后经20次LD-PCR合成双链cDNA(ds cDNA),合成的ds cDNA经1.2%琼脂糖凝胶电泳检测,如图 4所示,12 DAP和20 DAP的ds cDNA呈弥散状,大小集中分布在600-1 500 bp范围内。

|
| 图 4 ds cDNA电泳检测cDNA片段大小范围 M:1 kb DNA Marker; 20 DAP:授粉后20 d的籽粒; 12 DAP:授粉后12 d的籽粒 |
依据SMART同源重组原理,将12 DAP和20 DAP的ds cDNA使用Nano drop进行定量,然后等量混合。将混合好的ds cDNA、pGADT7-Rec载体和诱饵pGBKT7-ZmSCL1质粒共转化酵母AH109感受态细胞,涂布SD/-Leu、SD/-Leu/-Trp和SD/-Ade/-His/-Leu/-Trp平板进行筛选,3-5 d后长出单克隆。统计SD/-Leu上稀释100倍和1 000倍后长出的单克隆数目(图 5),求平均值后计算文库滴度,文库滴度=每板平均克隆数/涂布体积×稀释倍数=1.10×105 CFU/mL,文库库容量为1.32×106。SD/-Ade/-His/-Leu/-Trp平板上共计232个单克隆,摇菌提质粒后进行PCR检测,部分结果如图 6所示,显示插入片段的大小集中在400-1 500 bp之间,阳性菌落数为190个,重组率为81.90%。

|
| 图 5 文库滴度测定 A:酵母转化液经稀释100倍后涂布SD/-Leu(500 μL/板),菌落数目用于文库滴度计算; B:文库转化液经稀释1 000倍后涂布SD/-Leu(500 μL/板),菌落数目用于文库滴度计算 |

|
| 图 6 PCR检测文库插入片段琼脂糖胶检测 M:100 bp DNA Ladder Marker; 1-27:插入片段的PCR产物。每个PCR产物两个泳道,仅3、18和19为单个泳道 |
将插入的cDNA进行测序,除去载体序列,测序长度大于400 bp为有效克隆。将有效测序结果的序列用Blast2GO进行同源比对,最终获得164个基因的全长(表 1)。GO功能富集分析对这些互作蛋白进行了初步分类(图 7):生物过程(Biological Process)注释显示,参与细胞生理过程和代谢过程分别有79和73个肽段,即候选蛋白注释信息主要富集于参与细胞生理过程和代谢过程; 分子功能(Molecular Function)注释显示,结合、催化和营养储备的分别有61、57和56个肽段,即候选蛋白注释信息主要富集于结合、催化和营养储备相关功能。因此,本结果显示ZmSCL1可能参与结合、催化和营养储备相关生命活动。

|
| 图 7 候选互作蛋白的GO分析 BP:biology process,生物过程; MF:molecular function,分子功能; CC:cellular component,细胞组分。黑色箭头指示候选蛋白主要富集子集 |
cDNA文库的完整性和代表性是评价cDNA文库质量的重要指标。总RNA样本的完整性和高纯度是构建高质量cDNA文库的前提,并直接决定cDNA文库的好坏。本实验中的12 DAP和20 DAP样本总RNA条带清晰,未发生降解,并且没有多聚糖、蛋白质和其他小分子物质的污染,因而具备了构建高质量籽粒cDNA文库的前提条件。
本研究利用SMART(Switching Mechanism at 5’ End of the RNA Transcript)技术合成ds cDNA,不需要对样本总RNA中mRNA进行分离纯化,避免了纯化过程中产生的mRNA降解; 合成的cDNA片段集中在600-1 500 bp之间,具有较好的多态性,适合进行下一步酵母双杂交筛选互作蛋白; 利用了同源重组的方法,把外源ds cDNA定向重组到pGADT7-Rec载体上,有效的避免了繁琐的酶切连接等步骤,也解决了低效率的连接和克隆的嵌合问题,从而保证了cDNA文库整合外源ds cDNA时的方向性和完整性[20]。
本研究采用将ds cDNA和诱饵质粒同时转化酵母感受态细胞的方法[18],直接获得了籽粒灌浆期与ZmSCL1互作的候选蛋白,当实验不需要进行多次筛选文库时,该方法不产生冻存的文库,可作为一个非常快速的互作蛋白筛选过程。
本研究以玉米籽粒灌浆期12 DAP和20 DAP的籽粒为材料构建cDNA文库,使用玉米胚乳特异高表达基因ZmSCL1作为诱饵基因,进行互作蛋白筛选,初步筛选到了一些在籽粒灌浆期可能与ZmSCL1互作的候选蛋白,GO功能富集分析显示候选蛋白注释信息主要富集于结合、催化和营养储备相关功能,而淀粉的合成和营养积累是玉米籽粒灌浆期胚乳的主要生命活动[21]。值得注意的是,酵母双杂交的结果显示,候选蛋白中也筛选到了蔗糖合酶1(Sucrose synthase 1,SUS1)和UDP-葡萄糖基转移酶(UDP-glycosyltransferase 76E12,UGT76E12)。因此,ZmSCL1可能参与结合、催化和营养储备相关的生命活动。接下来的互作验证以及ZmSCL1功能验证的开展将为解析玉米籽粒灌浆期的蛋白互作网络和阐明玉米灌浆期的分子机制奠定必备的研究基础。
4 结论本研究使用玉米胚乳特异高表达基因ZmSCL1作为诱饵,在构建的酵母双杂交cDNA文库中初步筛选到了玉米籽粒灌浆期可能与ZmSCL1互作的蛋白。文库滴度为1.10×105 CFU/mL,文库库容量为1.32×106,插入片段大小集中在400-1 500 bp之间,重组率为81.9%。GO分类结果显示ZmSCL1可能参与结合、催化和营养储备相关生物过程的调控。
| [1] |
李绍长, 盛茜, 陆嘉惠, 等. 玉米籽粒灌浆生长分析[J]. 石河子大学学报:自科科学版, 1999, 3(s1): 243-246. |
| [2] |
贾波, 谢庆春, 倪向群. 玉米籽粒灌浆特性研究进展[J]. 江西农业学报, 2015, 27(12): 15-18. DOI:10.3969/j.issn.1001-8581.2015.12.004 |
| [3] |
陈国平. 玉米的干物质生产与分配[J]. 玉米科学, 1994, 2(1): 48-53. |
| [4] |
陈国平, 王荣焕, 赵久然. 玉米高产田的产量结构模式及关键因素分析[J]. 玉米科学, 2009, 17(4): 89-93. |
| [5] |
刘宗华, 张战辉. 玉米籽粒灌浆速率研究进展[J]. 东北农业大学学报, 2010, 41(11): 148-153. DOI:10.3969/j.issn.1005-9369.2010.11.028 |
| [6] |
KatsantonisN, 夏明忠. 玉米灌浆持续时间和速率的遗传及其与籽粒产量的关系[J]. 园艺与种苗, 1986, 96(2): 115-121. |
| [7] |
闫淑琴. 玉米籽粒灌浆速度研究进展[J]. 园艺与种苗, 2006, 26(4): 285-287. |
| [8] |
Bihmidine S, Iii CTH, Johns CE, et al. Regulation of assimilate import into sink organs:update on molecular drivers of sink strength[J]. Frontiers in plant science, 2013, 4(177): 1-15. |
| [9] |
Eom JS, Chen LQ, Sosso D, et al. SWEETs, transporters for intracellular and intercellular sugar translocation[J]. Current Opinion in Plant Biology, 2015, 25(4): 53-62. |
| [10] |
王欣生. 水稻蔗糖转运载体(OsSUT)及蔗糖与己糖信号分子对颖果胚乳发育作用分子机理研究[D]. 北京: 北京师范大学, 2005. http://www.doc88.com/p-8146090206347.html
|
| [11] |
Tang T, Xie H, Wang Y, et al. The effect of sucrose and abscisic acid interaction on sucrose synthase and its relationship to grain filling of rice(Oryza sativa L.)[J]. Journal of Experimental Botany, 2009, 60(9): 2641-2652. DOI:10.1093/jxb/erp114 |
| [12] |
Jeon JS, Ryoo N, Hahn TR, et al. Starch biosynthesis in cereal endosperm[J]. Plant Physiol Biochem, 2010, 6(3): 215-222. |
| [13] |
任晓东. 玉米蔗糖代谢关键基因灌浆期动态表达及其调控的初步研究[D]. 雅安: 四川农业大学, 2014.
|
| [14] |
王志琴, 叶玉秀, 杨建昌, 等. 水稻灌浆期籽粒中蔗糖合成酶活性的变化与调节[J]. 作物学报, 2004, 30(7): 634-643. |
| [15] |
Itoh H, Shimada A, Ueguchitanaka M, et al. Overexpression of a GRAS protein lacking the DELLA domain confers altered gibberellin responses in rice[J]. Plant Journal for Cell & Molecular Biology, 2005, 44(4): 669-679. |
| [16] |
赵慧, 王遂, 姜静, 等. 酵母双杂交筛选与小黑杨PsnWRKY70相互作用的蛋白质[J]. 北京林业大学学报, 2016, 38(2): 44-51. |
| [17] |
崔红军, 张军杰, 黄玉碧. 玉米根部酵母双杂交cDNA文库的构建及评价[J]. 分子植物育种, 2008, 6(1): 161-164. |
| [18] |
杨莎, 李燕, 郭峰, 等. 利用酵母双杂交系统筛选AhCaM相互作用蛋白[J]. 作物学报, 2015, 41(7): 1056-1063. |
| [19] |
杨君, 张艳, 王伟巧, 等. 黄萎病菌诱导海岛棉酵母双杂交cDNA文库构建及评价[J]. 生物技术通报, 2014, 29(12): 105-110. |
| [20] |
肖冬来, 邓慧颖, 谢荔岩, 等. 灰飞虱酵母双杂交cDNA文库的构建及分析[J]. 植物保护, 2011, 37(1): 19-23. |
| [21] |
顾勇. 玉米灌浆期胚乳发育分子调控分析[D]. 雅安: 四川农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10626-1016050667.htm
|





