2. 主要粮食作物产业化湖北省协同创新中心(长江大学),荆州 434025
2. Hubei Collaborative Innovation Center for Grain Industry, Yangtze University, Jingzhou 434025
水稻是世界上最主要的粮食作物。为确保全球日益增长的人口的粮食安全,控制各种虫害对水稻的危害尤为必要[1],而褐飞虱是对水稻生产破坏性最强的虫害。1969年第一次报道Mudgo是褐飞虱的宿主抗性水稻品种[2]。大多数研究表明抗性水稻品种抑制了褐飞虱的体重,大面积的水稻生产区域中褐飞虱的数量多代维持在一个较低的水平[3, 4],抗性品种的产量也明显比易感品种高[5]。因此,控制褐飞虱最经济和对环境最友好的策略是种植具有遗传抗性的水稻品种[6]。
自20世纪70年代起,各国相继开展了水稻褐飞虱抗性基因的发掘工作。截至2017年4月,经国际注册确认和报道的水稻抗褐飞虱基因共31个,已被定位的达26个,已经克隆的有3个:Bph14、Bph9和Bph3[7-9]。Bph14基因来源于水稻材料B5[10-11],是第一个被克隆的水稻抗虫基因。它在不同遗传背景下表现出稳定的抗性,对发展抗性水稻品种很有意义。
早期研究发现,乙烯几乎参与调控了植物生长发育的全部过程,同时,乙烯在植物响应逆境胁迫的过程中也具有重要的作用,植物遭受胁迫时产生乙烯,在植物对逆境胁迫的感受和适应中通过启动和调节某些与逆境适应相关的生理生化过程来诱导抗逆性的形成。如植物在干旱、高盐、低温和病害等逆境胁迫中都有乙烯的不同程度的参与,且具有各自的胁迫应答机制。ACO、ACS、P5CS等基因在植物体内的作用都与乙烯合成途径和抗性有关。ACO(1-氨基环丙烷-1-羧酸氧化酶)是乙烯生物合成途径中的最后一个酶,催化ACC(1-氨基环丙烷-1-羧酸)向乙烯转化。ACS则是ACC合成酶,是乙烯合成途径中的关键酶和限速酶。水稻基因组中有6个ACO基因和6个ACS基因,这些基因都能影响乙烯的合成,也进一步影响植物的抗逆性。P5CS(二氢吡咯-5-羧酸合成酶)是植物体内合成脯氨酸的关键酶,受干旱、高温和ABA诱导。已在豇豆、烟草、拟南芥、柑橘、马铃薯等多种作物中转化P5CS基因,可导致植物体内脯氨酸增加,从而使其耐盐性[12-13]和抗旱性[14-15]增强。
过氧化氢酶(CAT)是植物体内主要的抗氧化酶之一,能通过清除细胞内积累的H2O2来增强植株的耐盐性[16]。水稻数据库(http://rice.plantbiology.msu.edu/)中显示水稻基因组中有3个过氧化氢酶基因:CatA基因、CatB基因和CatC基因。
LEA3、LIP9和RABl6A都是依赖于ABA信号通路中的标记基因。这3个基因都能被ABA诱导表达且在它们的启动区都有ABA应答元件(ABRE)[17]。RAB16A是水稻脱落酸应答基因。有研究表明,当脱落酸浓度由1 µmol/L增加到12 µmol/L时,水稻根中Os RAB16A的表达量也随之增加[18, 19]。晚期胚胎富集蛋白(LEA)是一类亲水性蛋白,在高盐、干旱、低温等非生物胁迫的刺激下产生,能维持细胞膜完整性及细胞内酶的活性,降低细胞受损程度[20, 21]。LEA3基因能增强植物对高盐、干旱的耐受性。Duan等[20]提出OsLEA3-1或OsLEA3-2的过表达水稻对增强耐旱能力有促进作用。
高等植物醇脱氢酶ADH基因家族中,家族成员在防御生物和非生物胁迫中起作用,并且还是很多激素作用途径中的参与者[22-24]。ADH基因表达产物醇脱氢酶在淹水、干旱、盐、冷害胁迫以及对机械损伤及信号分子的响应中都具有非常积极的作用[25]。
ABA在调控植物生长发育中具有十分重要的作用,其更多的是通过与其他植物激素的相互作用,特别是植物激素乙烯。同时,在植物中,ABA作为一种抗逆激素已经得到广泛认可,它能够在多种逆境胁迫反应中发挥调控作用,降低包括干旱、高盐等逆境胁迫对植物的损伤,这些方面的研究已有大量文献报道[26-29]。
本研究通过农杆菌介导的方法将Bph14基因转入主栽水稻品种,在研究确定外源Bph14基因能够稳定遗传的前提下,分析转基因水稻中乙烯合成相关基因和非生物胁迫相关基因的表达情况以及转基因水稻对外源ABA的敏感性和对盐的耐受性,得到Bph14基因在转基因水稻中的生理影响的初步结果,以期全面理解Bph14基因对褐飞虱的抗性机制。
1 材料与方法 1.1 材料转基因受体材料m5274为湖北省农业科学院粮食作物研究所自有籼稻品种,代号为F; 水稻品种B5由武汉大学何光存实验室提供。转化用农杆菌为EHA105,目的基因Bph14代号为5,转基因后代编号记为F5。转化载体见图 1。
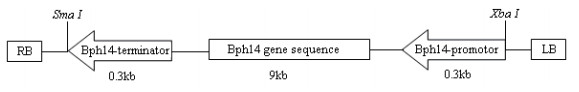
|
| 图 1 转化载体T-DNA区图谱 |
用CTAB法提取转基因后代植株叶片DNA,进行PCR检测目的基因的整合情况。PCR程序为:95℃预变性5min; 95℃变性30s,58℃退火30s,72℃延伸40s,32个循环; 72℃延伸10min,4℃保存。1.5%琼脂糖凝胶电泳检测扩增产物。PCR检测Bph14基因的引物为:5' -ATAGACCAGAAGCTATTCGGACTCC-3' ;5' -AAGTCGACGGAGAGATAAACAACG-3' 。
1.2.2 Q-PCR检测基因表达水稻幼苗总RNA用TRIzol法抽提,然后用DNase去除残留的基因组DNA,cDNA第一链用2 µg总RNA作模版,通过M-MLV反转录酶合成。使用Bio-Rad IQ5系统进行Real-time PCR扩增,用SYBR监测生成双链DNA的量,用Actin作为反应的内参。所用引物见表 1。
水稻种子25℃条件下16 h光8 h暗萌芽至第4天,根长约0.3 cm时,将幼苗平分为两组,分别转移至不含ABA和ABA浓度为5 µmol/L的1/10 MS培养液中培养3 d,观察根和幼苗的生长状况。
1.2.4 盐胁迫试验水稻种子分为两组,一组用清水,另一组用浓度为250 mmol/L的NaCl水溶液浸种2 d,在30℃培养箱中16 h光/8 h暗发芽。然后将用清水发芽的一组转入1/10 MS培养液中,另一组转入含有250 mmol/L NaCl的1/10 MS培养液中继续培养3 d,观察根和幼苗的生长状况。
2 结果 2.1 目的基因的整合与表达提取转化得到的再生植株T1代叶片DNA,通过PCR检测目的基因Bph14整合情况,绝大多数植株都能检测到566 bp大小的条带,少数植株在后代分离过程中丢失了目的基因(图 2)。
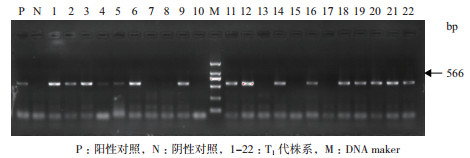
|
| 图 2 部分转基因植株T1代Bph14基因PCR检测 P:阳性对照,N:阴性对照,1-22:T1代株系,M:DNA maker |
通过Q-PCR检测目的基因Bph14的表达情况,除野生型对照外,其余含有目的基因的转基因植株都能检测到Bph14的表达,扩增片段长度为284 bp(图 3)。
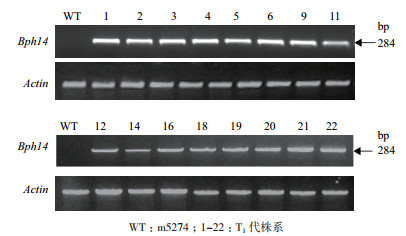
|
| 图 3 Bph14转基因T1植株的RT-PCR分析 WT:m5274;1-22:T1代株系 |
通过对广泛存在于植物中的乙烯合成和非生物胁迫应答功能相关基因的表达进行检测,转基因植株中,OsACO2、OsACS2、OsACS6等与乙烯合成相关的基因表达发生了不同程度的变化,检测其它一些与逆境胁迫相关的基因,也出现了不同植株中不同基因表达量不同的情况。所有这些被检测的基因中,转基因后代植株大都出现了表达量的变化,有的变化不是很明显,有的则出现成倍增长或降低的情况(图 4)。这些结果的出现表明,Bph14基因可能参与调控乙烯合成以及非生物胁迫应答的功能基因的表达。
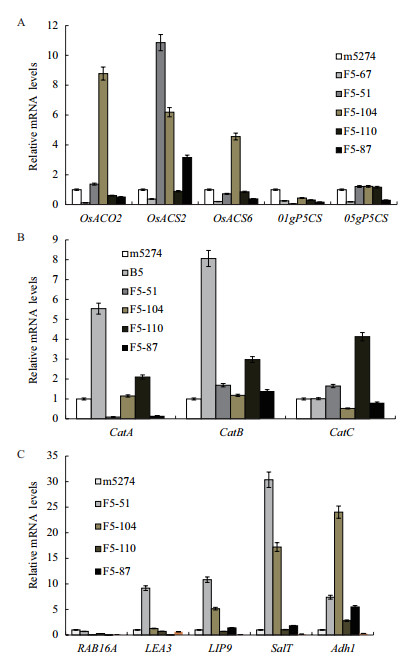
|
| 图 4 乙烯合成及非生物胁迫应答功能基因的表达 A:乙烯合成相关基因表达情况; B、C:非生物胁迫相关基因表达情况(F5-51、F5-104、F5-110、F5-110为转Bph14基因株系后代,m5274为转基因受体材料,B5为Bph14基因供体品种) |
从处理组和未处理组的实验结果(图 5)对比可以看出,转Bph14基因水稻芽和根的生长明显受到ABA的抑制,芽的长度显著变小,根的数量减少,长度也明显变小,而未转基因的受体材料处理与否影响较小。说明Bph14基因的导入提高了水稻对外源ABA的敏感性。
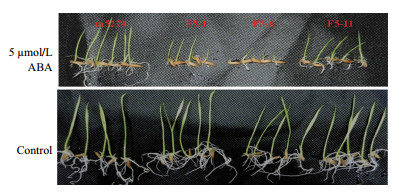
|
| 图 5 Bph14提高水稻对ABA的敏感性 m5274为转基因受体材料,F5-1,F5-6,F5-11为转Bph14基因株系后代 |
经过250 mmol/L NaCl处理的转基因幼苗长度较对照材料(受体)长,有的甚至显著增长,而未经处理的一组受体材料和转基因材料幼苗生长长度没有明显差异(图 6)。这说明Bph14基因的导入提高了水稻对盐胁迫的耐受性。

|
| 图 6 Bph14提高水稻对盐胁迫的耐受性 m5274为转基因受体材料,F5-1,F5-6,F5-11,F5-28为转Bph14基因株系后代 |
Bph14基因是水稻中克隆的第一个抗褐飞虱基因,该基因的克隆意义重大。水稻转基因的研究文献报道较多,但目前鲜有抗虫基因Bph14对植物乙烯合成和抗逆性影响方面的报道。杜波等[7]的研究表明褐飞虱取食转Bph14基因水稻后激活了植物防御昆虫取食的水杨酸信号,相关基因表达量上调,但该研究没有研究取食前转基因植株与受体植株相比在生理上的一些变化。本研究则考虑初步探索水稻在引入外源抗性基因后的一些生理变化,以期再经过深入研究后能解析出水稻抗虫性与其他非生物胁迫抗性之间的关系。本研究针对外源基因稳定表达的转基因后代株系进行乙烯合成相关基因和部分非生物胁迫相关基因的表达研究,并对转Bph14基因水稻在生理上的一些反应作了初步探索,发现转基因后代株系中,乙烯合成相关基因和非生物胁迫相关基因的表达都发生了明显的变化,且通过外源ABA敏感试验和盐胁迫试验也能看出,由于Bph14基因的导入,水稻增强了对外源ABA的敏感性以及对盐的耐受性。这些实验结果表明,来源于水稻B5的Bph14基因在水稻中可能参与调控乙烯合成以及非生物胁迫应答的功能基因的表达。对于植物而言,乙烯合成和ABA对植物的影响以及干旱、耐盐性等生理活动有一个庞大的网络联系,各个因素之间都不是独立存在的,而是相互影响,相互制约。转Bph14基因水稻在生理上的这些变化由Bph14基因引起,但具体机制还有待于进一步研究,这些机制可能有助于全面理解Bph14基因对褐飞虱的抗性机理。
4 结论本研究将Bph14基因转入水稻栽培品种m7274中,携带有外源基因的转基因株系中目的基因都能表达。通过荧光定量PCR检测表明,与乙烯合成相关的基因OsACO2,OsACS2,OsACS6,O1gP5CS和O5gP5CS等的表达量均较转基因受体m5274发生了变化,与干旱、耐盐等非生物胁迫相关的基因CatA、CatB、CatC、RAB16A、LEA3、LIP9、SalT、AdhI等也均不同于在受体m5274中的表达。分别用5 µmol/L ABA和250 mmol/L NaCl处理转基因水稻株系和相应受体材料发现,Bph14基因的导入提高了水稻对ABA的敏感性和对盐胁迫的耐受性,说明Bph14基因在水稻中可能参与调控乙烯合成以及非生物胁迫应答的功能基因的表达。
| [1] |
Normile D. Reinventing rice to feed the world[J]. Science, 2008, 321(7): 330-333. |
| [2] |
Pathak MD, Cheng CH, Fortuno ME. Resistance to Nephotettix impicticeps and Nilaparvata lugens in varieties of rice[J]. Nature, 1969, 223(5205): 502-504. DOI:10.1038/223502a0 |
| [3] |
Jung JK, Im DJ. Feeding inhibition of the brown planthopper, Nilaparvata lugens(Homoptera:Delphacidae)on a resistant rice variety[J]. J Asia-Pacific Entomol, 2005, 8(3): 301-308. DOI:10.1016/S1226-8615(08)60250-2 |
| [4] |
Cohen MB, Alam SN, Medina EB, Bernal CC. Brown planthopper, Nilaparvata lugens, resistance in rice cultivar IR64:Mechanism and role in successful N lugens management in Centrl Luzon, Philippines[J]. Entomol Exp Appl, 1997, 85(3): 221-229. DOI:10.1046/j.1570-7458.1997.00252.x |
| [5] |
Cuong NL, Ben PT, Phuong LT, Chau LM, Cohen MB. Effect of host plant resistance and insecticide on brown planthopper Nilaparvata lugens(Stål)and predator population development in the Mekong Delta, Vietnam[J]. Crop Prot, 1997, 16(8): 707-715. DOI:10.1016/S0261-2194(97)00068-9 |
| [6] |
Khush GS. Green revolution:The way forward[J]. Nat Rev Genet, 2001, 2(10): 815-822. DOI:10.1038/35093585 |
| [7] |
Du B, Zhang W, Liu B, et al. Identification and characterization of Bph14, a gene conferring resistance to brown planthopper in rice[J]. Proc Natl Acad Sci USA, 2009(106): 22163-22168. |
| [8] |
Zhao Y, Huang J, Wang ZZ, et al. Allelic diversity in an NLR gene BPH9 enables rice to combat planthopper variation[J]. Proc Natl Acad Sci USA, 2016, 113(45): 12850-12855. DOI:10.1073/pnas.1614862113 |
| [9] |
Liu Y, Wu H, Chen H, et al. A gene cluster encoding lectin receptor kinases confers broad-spectrum and durable insect resistance in rice[J]. Nat Biotechnol, 2015, 33(3): 301-305. |
| [10] |
Wang B, Huang Z, Shu LH, et al. Mapping of two new brown planthopper resistance genes from wild rice[J]. Chinese Science Bulletin, 2001, 46(13): 1092-1095. DOI:10.1007/BF02900685 |
| [11] |
Huang Z, He GC, Shu LH, et al. Identification and mapping of two brown planthopper resistance genes in rice[J]. Theor Appl Genet, 2001, 102: 929-934. DOI:10.1007/s001220000455 |
| [12] |
苏金, 朱汝财. 渗透胁迫调节的转基因表达对植物抗旱耐盐性的影响[J]. 植物学通报, 2001, 18(2): 129-136. |
| [13] |
Hmida-Sayari A, Cargouri-Bouzid R, Bidani A, et al. Overexpres-sion of Δ1-pyrroline-5-carboxylate synthetase increases proline producyion and confers salt tolerance in transgenic potato plants[J]. Plant Science, 2005, 169(4): 746-752. DOI:10.1016/j.plantsci.2005.05.025 |
| [14] |
De Ronder JA. Photosynthetic response of transgenic soybean, containing an Arabidopsis P5CR gene, during heat and drought stress[J]. Journal of Plant Physiology, 2004, 161(11): 1211-1224. DOI:10.1016/j.jplph.2004.01.014 |
| [15] |
Hbc M, Marur CJ, Bespalhok FJC, et al. Osmotic adjustment in transgenic citrus root-stock Carrzo citrange(Citrus sinensis Osb. ×Poncirus trifoliate L. Raf)overproducting proline[J]. Plant Science, 2005, 167(6): 1375-1381. |
| [16] |
Nayyar H, Gupta D. Differential sensitivity of C3 and C4 plants to water deficit stress:Association with oxidative stress and antioxidants[J]. Environmental and Experimental Botany, 2006, 58: 106-113. DOI:10.1016/j.envexpbot.2005.06.021 |
| [17] |
Fukao T, Yeung E, Bailey-Serres J. The submergence tolerance regulator SUB 1 A mediates crosstalk between submergence and drought tolerance in rice[J]. Plant Cell, 2011, 23(1): 412-427. DOI:10.1105/tpc.110.080325 |
| [18] |
Ganguly M, Datta K, Roychoudhury A, et al. Overexpression of Rab16A gene in indica rice variety for generating enhanced salt tolerance[J]. Plant Signaling & Behavior, 2012, 7(4): 502-509. |
| [19] |
Hong CY, Chao YY, Yang MY, et al. NaCl-induced expression of glutathione reductase in roots of rice(Oryza sativa L.)seedlings is mediated through hydrogen peroxide but not abscisic acid[J]. Plant and Soil, 2009, 320(1-2): 103-115. DOI:10.1007/s11104-008-9874-z |
| [20] |
Duan JL, Cai W. OsLEA3-2, an abiotic stress induced gene of rice plays a key role in salt and drought tolerance[J]. PLoS One, 2012, 7(9): e45117. DOI:10.1371/journal.pone.0045117 |
| [21] |
Checker VG, Chhibbar AK, Khurana P. Stress-in-ducible expression of barley HvⅢ gene in transgenic mulberry displays enhanced tolerance against drought, salinity and cold stress[J]. Transgenic Res, 2012, 21(5): 939-957. DOI:10.1007/s11248-011-9577-8 |
| [22] |
Zeevaart JAD, Creelman RA. Metabolism and physiology of abscisic acid[J]. Annu Rev Plant Physiol Mol Biol, 1988, 39(4): 439-473. |
| [23] |
Peña-Cortès H, Willmitzer L, Sánchez-Serrano JJ. Abscisic acid mediates the wound induction but not developmental-specific expression of the proteinase inhibitor Ⅱ gene family[J]. Plant Cell, 1991, 3(9): 963-972. DOI:10.1105/tpc.3.9.963 |
| [24] |
Strommer J, Garabagi F. ADH and PDC:Key roles for enzymes of alcoholic fermentation[M]//Gerats T, Strommer J(eds). Petunia:Evolutionary, Developmental and Physiological Genetics. New York:Springer-Verlag New York Inc., 2009, 71-84.
|
| [25] |
刘威, 陈昊, 靳亚忠, 等. 高等植物醇脱氢酶及其基因家族研究进展[J]. 植物生理学报, 2014, 50(10): 1479-1493. |
| [26] |
Popko J, Hänsch R, Mendel RR, et al. The role of abscisic acid and auxin in the response of poplar to abiotic stress[J]. Plant Biology, 2010, 12(2): 242-258. DOI:10.1111/j.1438-8677.2009.00305.x |
| [27] |
Ganguly M, Datta K, Roychoudhury A, et al. Overexpression of Rab16A gene in indica rice variety for generating enhanced salt tolerance[J]. Plant Signal Behav, 2012, 7(4): 502-509. DOI:10.4161/psb.19646 |
| [28] |
Lenka SK, Katiyar A, Chinnusamy V, et al. Comparative analysis of drought-responsive transcriptome in Indica rice genotypes with contrasting drought tolerance[J]. Plant Biotechnol J, 2011, 9(3): 315-327. DOI:10.1111/pbi.2011.9.issue-3 |
| [29] |
Kim H, Lee K, Hwang H, et al. Overexpression of PYL5 in rice enhances drought tolerance, inhibits growth, and modulates gene expression[J]. J Exp Bot, 2014, 65(2): 453-464. DOI:10.1093/jxb/ert397 |





