2. 昆明市环境监测中心,昆明 650100;
3. 中国科学院过程工程研究所,北京 100190
2. Kunming Environmental Monitoring Center, Kunming 650100;
3. State Key Laboratory of Biochemical Engineering, Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190
阿尔茨海默病(Alzheimer’s disease,AD),是一种持续性恶化的神经退行性疾病。近年来,AD的发病率及患病人数持续增长,已成为继心脏病、癌症、中风后的第四大致病性疾病。AD的病理变化主要表现为由Aβ在神经元细胞外形成的老年斑和由异常磷酸化tau蛋白在神经元细胞内形成的神经纤维缠结[1]。Aβ是由其前体蛋白APP经β-和γ-分泌酶酶切产生的多肽片段[2],过量的Aβ累积后会发生聚集,形成寡聚体、原纤维和纤维等。其中,APP和Aβ单体在神经元和突触发育中起着重要作用[3],而Aβ寡聚体具有神经毒性,是AD发病的起始诱因。
抗Aβ免疫治疗是清除Aβ的有效途径,在AD治疗中具有广阔的应用前景。然而,自身免疫的风险、显著的副作用以及不确定的治疗效果限制了Aβ免疫治疗的发展[4]。第一代疫苗AN1792利用全长的Aβ42多肽作为免疫原直接进行免疫治疗,在动物实验中表现出了良好的治疗效果,但是在临床Ⅱ期试验中由于引发严重的脑膜炎等副作用而被迫中止。随后的研究表明,全长Aβ含有的T细胞表位引发的T细胞活化及浸润是其副作用发生的主要原因[5]。为了避免T细胞自身免疫反应,第二代Aβ疫苗ACC-001、CAD106等利用Aβ42的B细胞表位区作为抗原表位,同时搭载病毒载体蛋白提高了免疫效率,但是Ⅰ期或者Ⅱ期的临床试验发现其治疗效果仍不显著[6-7]。同时,使用抗Aβ单克隆抗体的被动免疫治疗在AD临床试验中效果也不理想,例如bapineuzumab[8],solanezumab[9]。这些单抗或者疫苗免疫产生的抗体可同时结合Aβ单体、寡聚体和纤维以及APP蛋白。这或许降低了有限的抗体靶向寡聚体的能力,再者,靶向具有正常生理功能的Aβ和APP可导致副作用发生。
2016年的一项Ⅰ期临床试验表明,一种特异性靶向Aβ寡聚体的单克隆抗体aducanumab,能显著降低AD患者脑内的Aβ水平,改善患者临床认知能力[10]。除此之外,一项Ⅲ期临床实验表明,人静脉用免疫球蛋白(IVIG)可改善携带APOE-ε4基因的轻度到中度AD患者的认知损伤[11]。我们认为IVIG中抗Aβ寡聚体的抗体组分是起到这一治疗作用的关键[12]。这些研究表明,特异性针对Aβ寡聚体的免疫治疗对AD具有更好的治疗作用。
本研究选择Aβ42寡聚体作为阿尔茨海默病的免疫治疗靶标,利用本实验室从IVIG中纯化获得的抗Aβ42寡聚体特异性抗体组分(IVIG-AOB)筛选获得Aβ42寡聚体模拟表位,并克隆至HBc中制备VLP疫苗,然后免疫BalB/c小鼠,用ELISA方法检测小鼠血清中抗体水平,进一步验证这种新型疫苗Aβ42寡聚体模拟表位疫苗的免疫原性,期望获得一株较高免疫原性的疫苗。
1 材料与方法 1.1 材料 1.1.1 实验试剂随机多肽噬菌体库(NEB公司,美国); BL21感受态细胞(TakaRa公司,日本); IVIG-AOB(实验室制备); 层析柱、亲和层析填料、疏水介质丁基及羟基磷灰石介质(GE公司,美国); 注射用铝佐剂、化学发光试剂盒(ECL)(Thermo公司,美国); Amyloid beta 42(Aβ42)(American Pept-ide,美国); 二甲基亚砜(DMSO)、六氟异丙醇(HFIP)、十二烷基磺酸钠(SDS)、硫磺素T(ThT)、过硫酸铵(AP)、N,N,N,N,-四甲基乙二胺(TEMED)、甲叉双丙烯酰胺、丙烯酰胺、Tris、甘氨酸(glycin)、Tween-20(Sigma公司,美国); 200目碳支持膜、醋酸双氧铀(北京中镜科仪); 硝酸纤维素膜(NC膜)(Milipore公司,美国); HBc单克隆抗体(Invitrogen公司,美国); 抗His单克隆抗体、HRP-羊抗鼠(北京中杉生物工程有限公司); 96孔酶标板(广州JET公司); 可溶型单组分TMB显色底物(北京天根生化科技有限公司); 酸性显影粉、通用定影粉(天津世纪奥博公司); 其他试剂为国产分析纯。
1.1.2 实验动物雌性Balb/c小鼠,4-6周龄,由北京华阜康生物科技股份有限公司提供。
1.2 方法 1.2.1 Aβ42寡聚体模拟表位多肽的筛选本试验采用固相结合法,将IVIG-AOB包被于聚乙烯平皿中,加入环形7肽噬菌体库,洗脱掉未结合或者结合不牢的噬菌体后收集特异性结合的噬菌体。在淘选过程中,使用逐步降低靶分子浓度(100 μg/mL,10 μg/mL,1 μg/mL)、提高去污剂Tween-20的浓度(0.1%、0.3%和0.5%)和增加洗涤次数(12次、15次和20次)的方法,以提高筛选效率。按这种方法进行了4轮的筛选,最终获得了特异性富集的噬菌体。
1.2.2 噬菌体阳性克隆的筛选使用96孔ELISA板,每孔加入1 μg/100 µL Aβ寡聚体(PBS稀释),同时需包被空白孔(PBS)以排除挑选的噬菌体与ELISA板结合,4℃包被过夜。包被结束后,用0.3% PBST洗脱3遍,除去残液并拍干后,每孔加满封阻液,37℃封闭2 h。封闭结束后,0.3% PBST洗脱两遍,除去残液并拍干。然后加入合适稀释度的扩增噬菌体贮液,室温震荡1 h,弃掉贮液并拍干,0.3% PBST洗脱10遍,然后用0.3% PBST以1:1 000的比例稀释HRP标记的抗-M13抗体,每孔加入100 μL稀释后的抗体,室温震荡作用1 h。用0.3% PBST洗板10次。每孔加100 μL TMB底物溶液,室温作用10 min,1 mol/L H2SO4每孔100 μL终止反应。用读板仪记录450 nm处的吸光值。
1.2.3 ELISA检测模拟表位多肽与IVIG-AOB结合活性根据噬菌体ELISA检测结果及测序结果,合成了具有重复序列的6条环形7肽,在多肽合成时加入含有6个组氨酸的His标签(CxxxxxxxCHHHHHH),以检测其与IVIG-AOB的结合情况。环形多肽ELISA检测时,包被样品为IVIG-AOB,每孔1 µg/100 µL,一抗为带His标签的多肽,二抗小鼠抗His标签的单抗,其余按1.2.2的方法。
1.2.4 HBc与模拟表位多肽重组蛋白的表达纯化首先将表位多肽插入HBc149的免疫显性区域(Major immunodominant region,MIR),重组的HBc表位嵌合基因克隆至pBR327质粒中。然后将质粒转化至BL21感受态细胞中,挑取单克隆后在含有氨苄抗生素的LB培养基中培养过夜,按照1:50接种至M9培养基,37℃诱导培养24 h。培养结束后,于8 500 r/min离心5 min,收集菌体,加入2 mL重悬buffer(50 mmol/L Tris,5 mmol/L EDTA,150 mmol/L NaCl),加入蛋白酶抑制剂PMSF,混匀,超声破碎菌体,12 000 r/min离心10 min,分别取上清和沉淀; 利用SDS-PAGE鉴定蛋白表达。最后将菌体裂解上清进行硫酸铵沉淀(80%)粗纯后,利用疏水层析和羟基磷灰石进行两步纯化,收集洗脱液。
1.2.5 表位疫苗免疫取4-6周龄的雌性BalB/c小鼠18只,分6组,每组3只,皮下免疫3次,每次间隔两周。接种剂量为每只小鼠100 μg HBc重组蛋白VLP抗原混合Imject® Alum佐剂。抗原与佐剂的比例为3:1(V/V)。
1.2.6 ELISA检测小鼠血清中抗体水平在第3次免疫后第10天,利用眼眶取血收集血清。在96孔板中分别包被用PBS稀释的表位多肽和Aβ42寡聚体(均为0.5 μg/100 μL),血清利用封闭液按照1:100稀释,二抗为HRP标记的山羊抗小鼠IgG,其他步骤同1.2.2。
1.2.7 统计学分析所有实验数据均为平均值±标准误差。采用T-TEST分析各组样品间的显著性差异。P < 0.05被认为具有统计学差异。*表示P < 0.05,**表示P < 0.01,***表示P < 0.001。
2 结果 2.1 噬菌体多肽库的筛选经过4轮的筛选,噬菌体的产出量由4.5×106 CFU/mL提高到1.0×109 CFU/mL,投入产出比从2.3×10-5提高到5×10-3,提高了200多倍。淘选条件及噬菌体富集变化,见表 1。
ELISA检测4轮淘选后获得的单克隆噬菌体,经OD450的比值分析,IVIG-AOB/对照(阿达木单抗)大于1.7被认为阳性克隆。一般以样品组比上对照组大于2被认为阳性,为了获得更多的克隆数,在此以大于1.7作为选择参数。从288个克隆中挑出118株阳性克隆,并对其进行测序。结果表明,118株阳性克隆中共有6条序列具有两次及两次以上的重复,分别命名为C1-C6。
2.3 验证多肽与IVIG的结合情况ELISA检测以上合成的6条多肽C1-C6,结果(图 1)表明,多肽C1与IVIG-AOB结合与对照组没有差异,说明C1可能与抗体的恒定区结合; 而C2-C6与IVIG-AOB的结合明显高于与对照抗体的结合,说明C2-C6这5条多肽是潜在的Aβ寡聚体模拟表位。
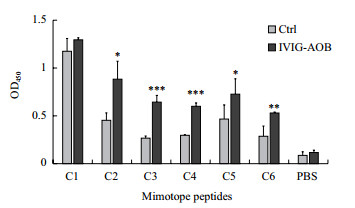
|
| 图 1 ELISA检测合成的环形7肽与IVIG-AOB的结合 |
SDS-PAGE和Western Blot检测表明HBc表位重组蛋白能够成功表达,Western Blot检测抗体是抗HBc抗体,目标条带在14-17 kD之间(图 2),条带大小与预期相符。
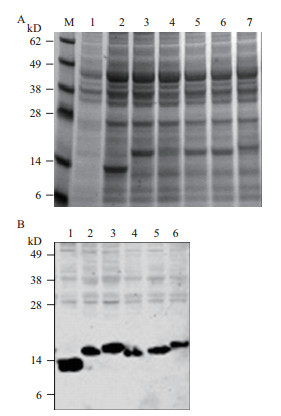
|
| 图 2 SDS-PAGE(A)和Western-blot(B)检测HBc及HBc重组蛋白表达情况 A:M:Marker,1-7分别为,空载、HBc、HBc-C2、HBc-C3、HBc-C4、HBc-C5、HBc-C6;B:1-6分别为HBc、HBc-C2、HBc-C3、HBc-C4、HBc-C5、HBc-C6 |
透射电子显微镜(Transmission Electron Micros-cope,TEM)检测结果(图 3)表明,HBc表位重组蛋白组装成正常的VLP颗粒。
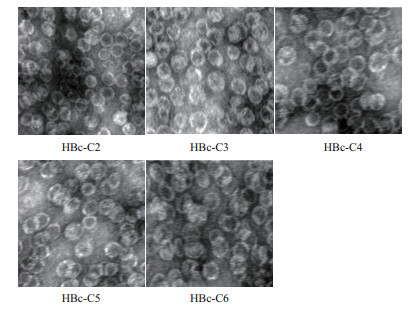
|
| 图 3 透射电镜检测纯化后HBc-VLP重组蛋白 |
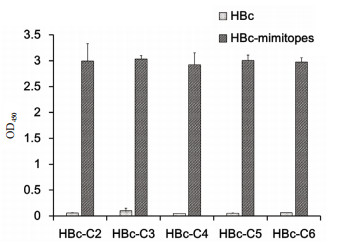
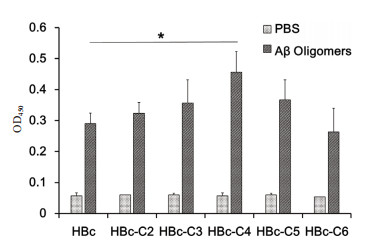
包被表位多肽的ELISA检测结果(图 4)表明,5种HBc表位疫苗免疫3次后都可诱发针对各自表位的抗体,表明HBc载体是一种有效的半抗原载体。包被Aβ42寡聚体的ELISA检测结果表明,由于HBc-VLP是一种分子量大于3 000 kD,结构复杂的大蛋白,能够免疫产生多种抗体; Aβ42寡聚体则是不同分子量Aβ的混合物,包含多种不同的构象表位,因此HBc-VLP免疫产生的抗体可能会和Aβ42寡聚体发生一些交叉反应,导致HBc产生的抗Aβ42寡聚体抗体水平偏高。然而HBc-C4诱导产生抗Aβ42寡聚体抗体明显高于HBc对照组,其余则与HBc对照组无显著差异(图 5),表明C4多肽较好的模拟了Aβ42寡聚体表位。
|
| 图 4 ELISA检测小鼠血清中抗表位多肽IgG的水平 |
|
| 图 5 ELISA检测小鼠血清中抗Aβ42寡聚体IgG的水平 |
阿尔茨海默症(AD)是一种持续性恶化的神经退变性疾病,常发生于65岁以上的老人,是最常见的一种老年痴呆疾病[13-15]。随着世界人口老龄化的加剧,AD已成为最大的公共健康问题[16]。针对Aβ的免疫治疗一直被认为是治疗AD的突破口。目前,Aβ疫苗和抗体先后经历过30多次临床试验,但尚无一种疫苗或抗体能够在Ⅲ期临床试验中表现出良好的改善认知作用[15]。系统分析表明,目前临床所使用的疫苗或者抗体都是针对Aβ单体的N端、中间或者C端,而Aβ单体具有正常的生理功能。因此利用免疫反应中和Aβ单体可能会引起潜在的副作用。同时,对AD发病机制的研究表明,由Aβ单体聚集形成寡聚体是AD发病的核心诱发因素,由此引发一系列毒性级联反应[17]。因此,特异性靶向Aβ寡聚体的免疫制剂可能具有较好的治疗效果,并能减少副作用产生。2016年,一例利用抗Aβ寡聚体的单克隆抗体Aducanumab治疗AD的临床实验表明,Aducanumab能够明显改善AD患者的认知损伤和病理学损伤[10]。
本研究利用从IVIG中纯化获得的特异性结合Aβ42寡聚体的组分IVIG-AOB为靶抗体,通过随机多肽库淘选获得了一系列与之结合的表位多肽; 以HBc为载体构建出多个表位载体疫苗,并进行免疫检测从而成功筛选出一株可免疫产生Aβ寡聚体抗体模拟表位疫苗HBc-C4。IVIG-AOB作为一种Aβ寡聚体抗体,相较于目前商业化的Aβ寡聚体抗体A11和OC(均为兔源抗体),其来源于正常人体,安全性更高并特异性结合Aβ42寡聚体。筛选获得表位多肽C4与Aβ42一级序列无任何同源性,且C4为环形的多肽,因此我们认为模拟表位C4免疫产生的抗体不应该与Aβ42单体结合,从而有效避免了自身免疫反应问题。
HBc-C4是一种完全模拟Aβ42寡聚体的表位疫苗,与目前已报道的Aβ聚集体疫苗-Affitope AD02,SDPM1,3A,pBri等相比具有明显的优势。AD02表位与Aβ单体有50%同源性,其产生的抗体虽不和Aβ单体及APP结合,但主要识别Aβ纤维而非寡聚体[18]。SDPM1是一种可结合Aβ40聚集体的环形20肽,其免疫产生的抗体可结合Aβ聚集体而不能特异性针对寡聚体[19]。3A是由8种氨基酸(T、Y、S、H、I、V、F和L)随机合成的20肽,3A本身并不能作为Aβ寡聚体表位,而是其聚集物可免疫产生抗Aβ前纤维状寡聚体的抗体[20]。与3A相似,ABri多肽聚集后形成的聚合物-pABri免疫小鼠能诱发针对Aβ寡聚体的抗体反应[21]。AD02、SDPM1、3A及ABri等Aβ聚集体疫苗都能够明显改善AD转基因小鼠的记忆和病理损伤。因此,我们认为HBc-C4具有治疗AD转基因小鼠的潜力。除此之外,病毒样颗粒(VLP)是一种呈递外源表位理想的载体[12],目前已有多种VLP疫苗应用于临床研究,包括乙肝病毒表面抗原(Hepatitis B virus surface antigen,HBs)疫苗和人乳头瘤病毒(Human papillomavirus,HPV)疫苗[13]等。乙肝病毒核心抗原(Hepatitis B core antigen,HBc)作为抗原制备出的疫苗已得到十分广泛的临床应用,其安全性已经得到确认。因而,以HBc-VLP作为载体制备的表位疫苗在未来临床试验中安全性优越。
4 结论本研究成功验证了应用新型Aβ42寡聚体模拟表位制备AD疫苗的可行性。通过噬菌体筛选技术,成功获得了一类Aβ42寡聚体模拟表位多肽,并将其克隆至HBc载体中,构建HBc-VLP表位疫苗,通过免疫后筛选获得一株可产生抗Aβ42寡聚体抗体的模拟表位疫苗株HBc-C4。
| [1] |
Querfurth HW, Laferla FM. Mechanisms of disease Alzheimer's disease[J]. New Engl J Med, 2010, 362(4): 329-344. DOI:10.1056/NEJMra0909142 |
| [2] |
Haass C, Selkoe DJ. Soluble protein oligomers in neurodegeneration:lessons from the Alzheimer's amyloid beta-peptide[J]. Nat Rev Mol Cell Bio, 2007, 8(2): 101-112. DOI:10.1038/nrm2101 |
| [3] |
Muller UC, Zheng H. Physiological functions of APP family proteins[J]. Cold Spring Harbor Perspectives in Medicine, 2012, 2(2): a006288. |
| [4] |
Schneeberger A, Mandler M, Mattner F, et al. AFFITOME(R)technology in neurodegenerative diseases the doubling advantage[J]. Hum Vaccines, 2010, 6(11): 948-952. DOI:10.4161/hv.6.11.13217 |
| [5] |
Senior K. Dosing in phase Ⅱ trial of Alzheimer's vaccine suspended[J]. Lancet Neurol, 2002, 1(1): 3. DOI:10.1016/S1474-4422(02)00023-6 |
| [6] |
Pasquier F, Sadowsky C, Holstein A, et al. Two Phase 2 multiple ascending-dose studies of vanutide cridificar(ACC-001)and QS-21 adjuvant in mild-to-moderate Alzheimer's disease[J]. J Alzheimers Dis, 2016, 51(4): 1131-1143. DOI:10.3233/JAD-150376 |
| [7] |
Farlow MR, Andreasen N, Riviere ME, et al. Long-term treatment with active A β immunotherapy with CAD106 in mild Alzheimer's disease[J]. Alzheimers Res Ther, 2015, 7(1): 23. DOI:10.1186/s13195-015-0108-3 |
| [8] |
Vandenberghe R, Rinne JO, Boada M, et al. Bapineuzumab for mild to moderate Alzheimer's disease in two global, randomized, phase 3 trials[J]. Alzheimers Res Ther, 2016, 8(1): 18. DOI:10.1186/s13195-016-0189-7 |
| [9] |
Doody RS, Thomas RG, Farlow M, et al. Phase 3 Trials of solanezumab for mild-to-moderate Alzheimer's disease[J]. New Engl J Med, 2014, 370(4): 311-321. DOI:10.1056/NEJMoa1312889 |
| [10] |
Sevigny J, Chiao P, Bussiere T, et al. The antibody aducanumab reduces A β plaques in Alzheimer's disease[J]. Nature, 2016, 537(7618): 50-56. DOI:10.1038/nature19323 |
| [11] |
Relkin N. Clinical Trials of intravenous immunoglobulin for Alzheimer's disease[J]. J Clin Immunol, 2014, 34(1): S74-S79. |
| [12] |
Ye S, Zeng R, Jiang P, et al. Concentrations of antibodies against beta-amyloid 40/42 monomer and oligomers in Chinese intravenous immunoglobulins[J]. Journal of Pharmaceutical and Biomedical Analysis, 2017, 138(2): 277-282. |
| [13] |
Boller F, Forbes MM. History of dementia and dementia in history:an overview[J]. J Neurol Sci, 1998, 158(2): 125-133. DOI:10.1016/S0022-510X(98)00128-2 |
| [14] |
Bleuler E. Dementia praecox or the group of schizophrenias[J]. Vertex, 2010, 21(93): 394-400. |
| [15] |
Alzheimer's A. 2016 Alzheimer's disease facts and figures[J]. Alzheimers Dement, 2016, 12(4): 459-509. DOI:10.1016/j.jalz.2016.03.001 |
| [16] |
Prince M, Comas-Herrera A, Knapp M, et al. World Alzheimer report 2016:improving healthcare for people living with dementia:coverage, quality and costs now and in the future[C]. London:Alzheimer's Disease International, 2016.
|
| [17] |
Nimmrich V, Ebert U. Is Alzheimer's disease a result of presynaptic failure? Synaptic dysfunctions induced by oligomeric beta-amyloid[J]. Rev Neuroscience, 2009, 20(1): 1-12. DOI:10.1515/REVNEURO.2009.20.1.1 |
| [18] |
Mandler M, Santic R, Gruber P, et al. Tailoring the antibody respo-nse to aggregated a beta using novel Alzheimer-vaccines[J]. PLoS One, 2015, 10(1): e0115237. DOI:10.1371/journal.pone.0115237 |
| [19] |
Kang C K, Jayasinha V, Martin P T. Identification of peptides that specifically bind A β(1-40)amyloid in vitro and amyloid plaques in Alzheimer's disease brain using phage display[J]. Neurobiol Dis, 2003, 14(1): 146-156. DOI:10.1016/S0969-9961(03)00105-0 |
| [20] |
Rasool S, Albay R, Martinez-Coria H, et al. Vaccination with a non-human random sequence amyloid oligomer mimic results in improved cognitive function and reduced plaque deposition and micro hemorrhage in Tg2576 mice[J]. Mol Neurodegener, 2012, 7: 37. DOI:10.1186/1750-1326-7-37 |
| [21] |
Goni F, Prelli F, Ji Y, et al. Immunomodulation Targeting abnormal protein conformation reduces pathology in a mouse model of Alzheimer's disease[J]. PLoS One, 2010, 5(10): e13391. DOI:10.1371/journal.pone.0013391 |





