2. 长沙医学院 基础医学院 应用生物学教研室,长沙 410219
2. Department of Applied Biology, School of Basic Medical Science, Changsha Medical University, Changsha 410219
金黄色葡萄球菌(Staphylococcus aureus)分布极广,主要存在于各类熟肉制品、乳及乳制品、蛋及蛋制品[1],可引起局部化脓感染,也可引起肺炎甚至败血症、脓毒症等全身感染的致病菌[2]。金黄色葡萄球菌合成分泌的毒素和侵袭性酶类可引起食物中毒,如肠毒素、溶血毒素、毒性休克综合征毒素(Toxic shock syndrom toxin-1,TSST-1)和脱氧核糖核酸酶等[3]。其中S.aureus分泌的TSST-1能够引起毒性休克综合征(Toxic shock syndrome,TSS),并且可能使患者并发心内膜炎与肌肉转移性脓肿等疾病[4-5]。从患者体内分离出的金黄色葡萄球菌中,高达70%的菌株都携带毒性休克综合征毒素基因(tst)。TSST-1作为金黄色葡萄球菌重要的标志性污染物之一,对其基因tst进行检测不仅可以用于微生物实验室致病菌株的筛选,也可用来研究金黄色葡萄球菌对机体的感染致病机制。
目前,可通过免疫学[6]、聚合酶链反应[7]、及反向被动乳胶凝集[8]等方法检测含tst基因金黄色葡萄球菌,但是这些方法存在操作繁琐、设备昂贵、灵敏度不高,特异性不强等缺点[9-12]。因此,建立一种更为稳定、操作简单、成本低廉、灵敏度和特异性高的方法来实现对产TSST-1金黄色葡萄球菌的快速检测显得尤为重要。随着材料科学的快速发展,纳米材料被广泛应用于各个领域[13],其中碳纳米管具有生物低毒性,生物分子亲和性等特点,在化学、材料学、生命科学及生物医药等领域都具有广泛的应用前景[14-15]。本研究利用单壁碳纳米管(Single -walled carbon nanotubes,SWCNTs)联合荧光标记探针(FAM-P)作为复合检测体系对含有tst基因的金黄色葡萄球菌进行检测,以验证该体系的灵敏度和特异性。
1 材料与方法 1.1 材料称取0.1g SWCNTs溶于100 mL超纯水,低温条件下超声波震荡3 h使其均匀分散,制备成1 mg/mL SWCNTs储备液,室温保存。
菌种为金黄色葡萄球菌(S.aureus)、大肠杆菌K88(E.coli K88)、肠炎沙门氏菌(S.enteritidis)、志贺氏菌(S.castellani)均由中国医学科学院医学生物学研究所中心实验室提供。
LS55型荧光分光光度计(购自RerkinElmer公司)、PL203型电子天平(购自于METTLER TOLEDO公司)、单壁碳纳米管(购自于南京先锋材料科技有限公司)。PBS溶液(购自于SIGMA公司,pH7.4)高压灭菌后4℃保存备用。荧光探针、靶标序列,靶标的2个和12个碱基错配序列[16](表 1)均由上海生工生物科技有限公司合成。
由于荧光共振能量转移受荧光供体和受体的比例影响很大,因此探讨体系中FAM-P /SWCNs的最佳比例[8]:设定体系中FAM-P终浓度恒定为50 nmol/L,设置SWCNT终浓度分别0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09和1.0 mg/mL。设置激发波长为480 nmol/L,发射波长516 nmol/L,测定复合溶液荧光值(F)和原始荧光值(F0)。
1.2.2 靶标和错配DNA序列的检测试验激发波长设置为480 nmol/L,发射波长设置为516 nmol/L; 反应体系中FAM-P终浓度恒定为50 nmol/Lol / L,加入最适宜浓度的SWCNT,制备成FAM-P/SWCNTs复合工作液; 设置体系反应中靶标序列DNA浓度梯度10、20、30、40、50、60、80和100 nmol/L,另外两种错配DNA序列只测定100 nmol/L的浓度,并设置空白对照以此来验证实验体系的特异性程度,37℃恒温孵育45 min。测定复合溶液荧光值(F)和原始荧光值(F0)。
1.2.3 S.aureus基因组中靶标序列的检测试验使用涂布平板法在普通培养基上,37℃需氧条件下培养S.aureus 24 h后,制备成不同浓度的菌液:102、103、104、105、106和107 CFU/mL。95℃水浴15 min后置于冰上10 min得到菌体的单链DNA(ssDNA),将获得的ssDNA加入最优FAM-P /SWCNTs复合液中,孵育45 min后测定荧光值(F)。
1.2.4 FAM-P/SWCNTs定量测定反应体系准确度验证取102、104和106三种浓度的S.aureus样品,按上述方法获得ssDNA并测定荧光值(F)后,对照样品标准曲线,以验证该反应体系定量测定的准确度。
1.2.5 菌种特异性检测为进一步证明FAM-P / SWCNTs复合检测体系的特异性,故而选取大肠杆菌K88、肠炎沙门氏菌、志贺氏菌3种菌进行检测。以上3种菌分别制备成浓度为5×106 CFU/mL的菌液,相同方法获得ssDNA进行检测。
2 结果 2.1 FAM-P/SWCNTs复合反应体系原理本体系以SWCNTs为平台,联合荧光标记的S.aureus毒力岛基因tst的互补链作为探针,基于SWCNT与DNA分子非共价偶联后可淬灭荧光的特性,构建FAM-P /SWCNTs复合检测体系(图 1)。当体系中不存在靶标序DNA时,FAM-P结合在SWCNT表面,此时探针上的FAM荧光基团被淬灭。在靶标DNA存在的情况下,FAM-P与靶序列互补配对形成双链从SWCNT表面解离下来而恢复荧光。检测体系中的靶标序列的含量与荧光强度呈正相关,因此可以通过检测体系中的荧光值实现对携带tst基因金黄色葡萄球菌的定量检测。

|
| 图 1 FAM-P/SWCNTs复合反应体系原理 |
FAM-P/SWCNTs之间的比例是检测体系的一个非常关键的因素,本实验通过8个不同比例的考察结果得到图 2。SWCNT浓度与荧光值的增加量呈负相关,当SWCNT浓度达到0.06 mg/mL以上时荧光相对值F/ F0-1并无明显变化并趋近与1.0。
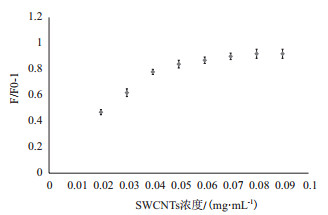
|
| 图 2 FAM-P/SWCNTs比例优化 |
8个不同浓度的靶标序列测定结果显示:体系中的荧光值随着靶标序列浓度的增大而显著增大,以靶标DNA浓度为X轴,荧光值为Y轴,通过Origin8.0软件绘制标准曲线,得到线性回归方程:y = 2.414x + 11.90,R2= 0.994说明靶标基因浓度在0.05-1.0 nmol/L范围内,呈现良好的线性关系,显示出该体系的高灵敏度,见图 3。
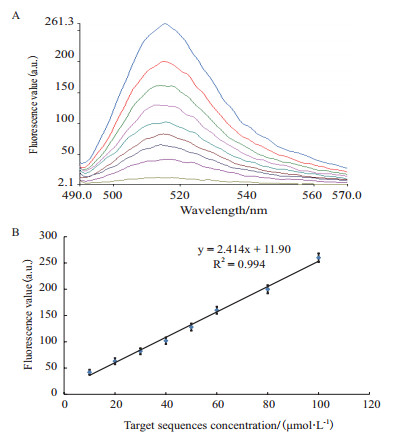
|
| 图 3 FAM-P/SWCNTs复合检测体系对不同浓度靶标序列的检测 |
在错配试验中,将未加入任何测定序列的试验作为空白对照,将同种浓度的靶标序列与2种错配序列分别用相同体积的FAM-P/SWCNTs复合检测体系中测定荧光值。结果(图 4)显示加入靶标序列后荧光值显著增加,而2种错配碱基序列的实验经过测定显示的荧光值与空白组并无差异,说明FAM-P/SWCNTs复合检测体系的特异性很强。

|
| 图 4 错配试验结果 |
金黄色葡萄球菌基因组DNA在单链状态下,tst基因可与探针特异性结合并使探针脱离SWCNTs,从而恢复荧光。结果(图 5)显示,随着菌体浓度的上升荧光值显著增大,在该浓度范围内呈良好的线性关系(R2= 0.999)。
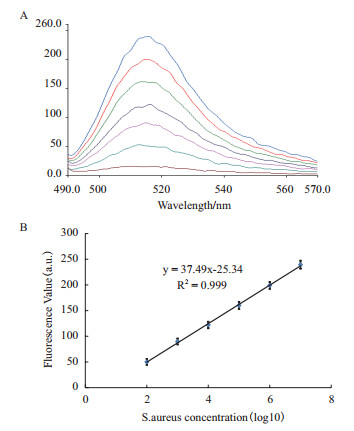
|
| 图 5 含tst基因序列的S.aureus检测结果 |
为验证该反应体系对于定量测定的准确度,故选取102、104和106三个浓度的S.aureus样品进行试验。结果(图 6)显示,102、104和106三种浓度的S.aureus样品荧光值测定后,对照上述标准曲线,能够得到相应浓度,说明FAM-P/SWCNTs复合检测体系对于含tst基因的S.aureus样品定量测定具有较高的准确度。
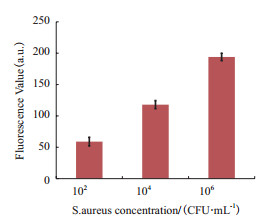
|
| 图 6 FAM-P/SWCNTs定量复合检测体系准确度检测 |
选取大肠杆菌K88、肠炎沙门氏菌、志贺氏菌3种菌检测该反应体系的特异性,结果(图 7)显示加入靶标菌的荧光值显著高于其它菌的荧光值,说明FAM-P/SWCNTs复合检测体系有很强的特异性。
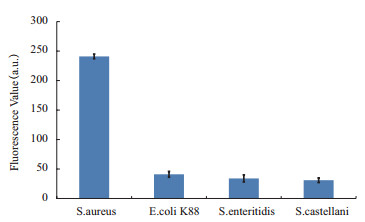
|
| 图 7 FAM-P/SWCNTs复合检测体系的特异性检测 |
金黄色葡萄球菌是一种分布性极广的食源性微生物污染源,存在于空气、水、灰尘及人和动物的排泄物中,可以分泌多种致病的毒素和酶[17]。因为其广泛的分布性,食品极易受到污染,导致腐败变质,产生对人体有害的物质,人类及其它动物感染金黄色葡萄球菌可导致坏死性肺炎、乳房炎、食物中毒及毒性休克综合征等。美国CDC报告指出,由金黄色葡萄球菌引起的感染占第二位,仅次于大肠杆菌。在美国由金黄色葡萄球菌引起的食物中毒,占整个细菌性食物中毒的33%,加拿大则更多,占到45%,中国金黄色葡萄球菌引起的食物中毒事件也时有发生。
在经济快速发展的今天,人类更加重视食品安全,大力推动对致病菌,如金黄色葡萄球菌检测方法的研究步伐。目前已有多种技术手段可对金黄色葡萄球菌进行快速检测。利用快速测试片法可依据微生物在测试片上的生长和显色程度来判断样品中微生物的存在情况,这种方法操作步骤较为简单,但在定量分析方面效果有所欠缺[18]; 酶联免疫吸附法(ELISA)是目前对金黄色葡萄球菌进行快速检测应用最为广泛的方法之一,将酶与特定的抗体耦联,抗体与样品中的靶标抗原发生特异性结合反应后通过显色反应,利用酶标仪对目标微生物进行定性或定量分析,ELISA检测方法灵敏度高,特异性强,但耗费的成本也较高[19]; 此外,快速发展的基因芯片技术也被用于微生物检测领域,通过检测杂交信号强弱可达到对目标微生物的定性和定量检测,但成本过高[20]。
随着现代生物技术的不断创新,不同学科之间相互借鉴,共同发展,将会产生更多的微生物快速检测技术手段[21-22]。本实验利用单壁碳纳米管联合荧光素标记探针构建出操作简便、成本低廉、灵敏度和特异性高的纳米生物传感器。根据荧光能量共振转移原理,荧光标记的探针与SWCNT非共价结合后两种分子间距离 < 10 nmol/L,此时即会发生能量共振转移效应使得荧光淬灭。当在靶标序列存在下,靶标序列通过竞争结合与探针序列碱基互补配对形成双链,探针可从SWCNT表面解离下来,FAM基团恢复荧光。随着靶标序列浓度升高,荧光值逐渐增强,可以通过检测该复合体系的荧光值对含tst基因的金黄色葡萄球菌实现定量检测。该体系对靶标序列浓度仅为0.05 μmol/L时仍能准确的检测出,说明其灵敏度较高; 在错配试验和对不同菌液样品的检测结果也说明该体系的特异性较强。
4 结论本实验利用单壁碳纳米管联合荧光标记探针构建出复合检测体系对含tst基因的金黄色葡萄球菌进行检测,结果显示该复合检测体系灵敏度高,在靶标序列浓度0.05-1.0 nmol/L和目标菌液浓度102-107 CFU/mL范围内均呈现良好的线性关系(R2= 0.994;R2= 0.999);在错配试验和对不同菌液样品的检测结果也说明了该体系的特异性很强。
| [1] |
Lu YX, Xiao TT, Song J, et al. Isolation, identification and contamination analysis of Staphylococcus aureus and coliforms in cold dishes and cooked meat products[J]. Chinese Journal of Health Laboratory Technology, 2015. |
| [2] |
Chen Y, Jin D, Lu SJ. Analysis of 12 cases of severe sepsis caused by methicillin-resistant Staphylococcus aureus infections in children[J]. Journal of Clinical Pediatrics, 2015, 121(1-4): 55-73. |
| [3] |
Fetsch A, Contzen M, Hartelt K, et al. Staphylococcus aureus food-poisoning outbreak associated with the consumption of ice-cream[J]. International Journal of Food Microbiology, 2014, 187: 1-6. DOI:10.1016/j.ijfoodmicro.2014.06.017 |
| [4] |
Zaghloul MZ. Staphylococcus aureus toxic shock syndrome[J]. Tropical Medicine & Surgery, 2015, 3: 2. |
| [5] |
Tinelli M, Monaco M, Maffezzini E, et al. Staphylococcus aureus toxic shock syndrome toxin-1 endocarditis with muscular metastatic abscesses[J]. New Microbiologica Official Journal of the Italian Society for Medical Virology, 2014, 37(37): 113-118. |
| [6] |
Bergdoll MS. Analytical methods for Staphylococcus aureus[J]. IntJ Food Microbiol, 1990, 10: 91-100. DOI:10.1016/0168-1605(90)90058-D |
| [7] |
Da CML, Calsolari RA, Júnior JP. Detection of enterotoxin and toxic shock syndrome toxin 1 genes in Staphylococcus, with emphasis on coagulase-negative staphylococci[J]. Microbiology & Immunology, 2007, 51(4): 381-390. |
| [8] |
Igarashi H, Fujikawa H, Shingaki M, et al. Latex agglutination test for staphylococcal toxic shock syndrome toxin 1[J]. Journal of Clinical Microbiology, 1986, 23(3): 509-512. |
| [9] |
Mills JT, Dodel AW, Kass EH. Regulation of staphylococcal toxic shock syndrome toxin-1 and total exoprotein production by magnesium ion[J]. Infection & Immunity, 1986, 53(3): 663-670. |
| [10] |
Lee AC, Robbins RN, Reiser RF, et al. Isolation of specific and common antibodies to staphylococcal enterotoxins B, C1, and C2[J]. Infection & Immunity, 1980, 27(2): 431-434. |
| [11] |
Wieneke AA. Comparison of four kits for the detection of staphylococcal enterotoxin in foods from outbreaks of food poisoning[J]. International Journal of Food Microbiology, 1991, 14(3-4): 305-312. DOI:10.1016/0168-1605(91)90122-6 |
| [12] |
Jarraud S, Peyrat MA, Lim A, et al. egc, a highly prevalent operon of enterotoxin gene, forms a putative nursery of superantigens in Staphylococcus aureus[J]. Journal of Immunology, 2001, 166(1): 669-667. DOI:10.4049/jimmunol.166.1.669 |
| [13] |
贺气志, 宁毅, 陈珂珂, 等. 基于核酸功能化的氧化石墨烯技术快速检测含SSeC基因鼠伤寒沙门氏菌的研究[J]. 中华微生物学和免疫学杂志, 2016, 36(6): 453-457. |
| [14] |
Soleyman R, Hirbod S, Adeli M. Advances in the biomedical application of polymer-functionalized carbon nanotubes[J]. Biomater Sci, 2015, 3(5): 695-711. DOI:10.1039/C4BM00421C |
| [15] |
Battigelli A, Ménardmoyon C, Da RT, et al. Endowing carbon nanotubes with biological and biomedical properties by chemical modifications[J]. Advanced Drug Delivery Reviews, 2013, 65(15): 1899-1920. DOI:10.1016/j.addr.2013.07.006 |
| [16] |
Deurenberg RH, Nieuwenhuis RF, Driessen C, et al. The prevalence of the Staphylococcus aureus tst gene among community-and hospital-acquired strains and isolates from Wegener's Granulomatosis patients[J]. Fems Microbiology Letters, 2005, 245(1): 185-189. DOI:10.1016/j.femsle.2005.03.002 |
| [17] |
Bronner S, Monteil H, Prévost G. Regulation of virulence determinants in Staphylococcus aureus:complexity and applications[J]. Fems Microbiology Reviews, 2004, 28(2): 183-200. DOI:10.1016/j.femsre.2003.09.003 |
| [18] |
Silva BO, Caraviello DZ, Rodrigues AC, et al. Evaluation of Petrifilm for the isolation of Staphylococcus aureus from milk samples[J]. Journal of Dairy Science, 2005, 88(8): 3000-3008. DOI:10.3168/jds.S0022-0302(05)72980-5 |
| [19] |
Nguyen HM, Rocha MA, Chintalacharuvu KR, et al. Detection and quantification of Panton-Valentine leukocidin in Staphylococcus aureus cultures by ELISA and Western blotting:diethylpyrocarbonate inhibits binding of protein A to IgG[J]. Journal of Immunological Methods, 2010, 356(1-2): 1-5. DOI:10.1016/j.jim.2010.03.005 |
| [20] |
Abeyrathne CD, Huynh DH, Mcintire TW, et al. Lab on a chip sensor for rapid detection and antibiotic resistance determination of Staphylococcus aureus[J]. Analyst, 2016, 141(6): 1922-1929. DOI:10.1039/C5AN02301G |
| [21] |
Ashok AD, Maxime D, Jocelyn R, et al. Single-pair fluorescence resonance energy transfer on freely diffusing molecules:Observa-tion of Forster distance dependence and subpopulations[J]. Proc Natl Acad Sci USA, 1999, 96(7): 3670-3675. DOI:10.1073/pnas.96.7.3670 |
| [22] |
Dyadyusha L, Yin H, Jaiswal S, et al. Quenching of CdSe quantum dot emission, a new approach for biosensing[J]. Chemical Communications, 2005, 25(25): 3201-3203. |





