2. 寿光富康制药研发部,潍坊 262700
2. Shouguang Fukang Pharmaceutical Co. Ltd., R & D., Weifang 262700
间苯三酚及其衍生物在自然界中分布广泛,在多种植物和微生物中都有分布[1]。间苯三酚是一种重要的医药中间体和有机合成中间体,具有良好的抗病毒[2]、抗肿瘤[3]、抗菌、消炎[4]、止血及收缩子宫[5]等药理活性,市场前景极为广阔。其在国内外的需求量逐年上升,而传统的化学合成法生产技术落后,环境污染严重,产品质量跟不上医药产业的发展。
Weller和Achkar等[6-7]发现在荧光假单胞菌(Pseudomonas fluorescens)中phlACBD操纵子可以合成2,4-二乙酰基间苯三酚(2,4-DA PG),而phlD是其中的关键基因,phlD与Ⅲ型聚酮合酶(PKSⅢ)之一查尔酮合酶(Chalcone synthase,CHS)结构和功能的相似性很高[8]。间苯三酚本身可作为黄酮及类黄酮合成的中间体,其合成和代谢途径与CHS催化合成黄酮及类黄酮类物质的途径相似[9]。在大肠埃希菌胞内的碳循环途径中存在少量丙二酰辅酶A,phlD可利用3分子的丙二酰辅酶A合成1分子的间苯三酚[7],单独克隆phlD基因可合成间苯三酚[10-12]。在phlD的异源表达方面前人已经做了较多研究。例如,Achkar等[7]在phlD的异源表达研究中将间苯三酚的产量提高到780 mg/L; Rao等[13]在phlD异源表达的稳定性方面所做的研究使phlD蛋白在37℃下的半衰期比野生型提高了24倍。然而,由于目前单位产量低,生产成本高,间苯三酚的生物合成法没有在工业生产中被推广应用。
导致生物合成法产量低的关键问题是:(1)间苯三酚是多种抗生素的前体[14],具有较强的抑菌能力,且其水溶液呈酸性,在培养基中积累后严重抑制工程菌的生长; (2)phlD合成间苯三酚的直接前体丙二酰辅酶A在大肠埃希菌胞内含量较低,且胞内存在多条消耗丙二酰辅酶A的竞争性代谢通路[15]。大肠埃希菌多重抗药基因正向调节因子(marA)能参与调控60多个基因的转录,能提高大肠埃希菌的主动外排泵系统(AcrAB-TolC)的外排能力,提高大肠埃希菌对抗生素的抵抗能力[16-17]。乙酰辅酶A羧化酶(ACCase,EC 6.4.1.2)可以催化乙酰辅酶A羧化生成丙二酰辅酶A[18]。所以在大肠埃希菌细胞中超表达marA和ACCase能够较好的解决上文提到的这两个问题。
虽然对phlD基因的研究论文较多,但是与marA及ACCase关联研究并且对培养基的碳源及离子环境进行综合探索的研究未见报道。本研究克隆并超表达基因marA和ACCase,以提高细胞对间苯三酚的抵抗能力和胞内丙二酰辅酶A的含量[13]; 探究甘油、葡萄糖、丙酮酸钠等不同碳源以及Mg2+和Ca2+对间苯三酚产量的影响,旨在使生物合成法制备间苯三酚的成本进一步降低。
1 材料与方法 1.1 材料 1.1.1 菌种和质粒本研究所用菌株和质粒均为本研究构建和实验室购买自全式金生物技术有限公司和Novagen公司,详见表 1。
高保真DNA聚合酶KOD-plus购自TOYOBO(东洋纺),Taq DNA聚合酶、质粒小提试剂盒、DNA纯化试剂盒、DNA胶回收试剂盒及细菌总DNA提取试剂盒均购自全式金生物技术有限公司,限制性内切酶及T4连接酶购自Thermo Scientific公司,PCR引物(表 2)由生工生物(上海)有限公司合成。间苯三酚色谱级标准品购自Sigma-Aldrich公司。
LB培养基(g/L):蛋白胨10.0,氯化钠10.0,酵母粉5.0,用1N氢氧化钠调整pH为7.4;制备固体培养基时添加2%的琼脂。TB培养基(g/L):蛋白胨10.0,酵母粉5.0,氯化钠1.0,磷酸二氢钾17 mmol/L,磷酸氢二钾72 mmol/L,用1N氢氧化钠调整pH为7.4。M9改良培养基(g/L):磷酸氢二钠3.0、磷酸二氢钾1.5、氯化铵0.5,蛋白胨10.0。
1.2 方法 1.2.1 培养方法种子培养:挑取生长良好的单一菌落,接种于25 mL LB液体培养基中,37℃、220 r/min,震荡培养24 h。摇瓶发酵培养:将2%种子培养液接种于100 mL TB培养基中,37℃、220 r/min,震荡培养至光密度值optical density,OD值0.6-0.8,加入诱导剂异丙基硫代半乳糖苷(IPTG)至0.1 mmol/L,24℃、160 r/min培养48 h,定时取样,检测间苯三酚的积累量。
M9培养基发酵:将2%种子培养液接种于100 mL M9培养基中,37℃、220 r/min,震荡培至OD值0.6-0.8,加IPTG至0.1 mmol/L,32℃、160 r/min培养24 h,HPLC检测间苯三酚的积累量。
1.2.2 基因的扩增与质粒的构建从GenBank数据库获得荧光假单胞菌(P. fluorescens F113)来源的phlD基因序列(GenBank ID:11830552)。phlD经大肠埃希菌密码子偏好性修改后,合成其全基因序列。将phlD及pET28a分别用Nde I和BamH I双酶切,连接得到重组质粒pET28a-phlD(图 1-A),测序确认。

|
| 图 1 原核表达phlD、marA和ACCase的重组质粒图谱 |
以E. coli DH5α全基因组DNA为模板,扩增marA(GenBank ID:947613)、accA(GenBank ID:944895)、accBC(GenBank ID:947758,GenBank ID:947761)和accD(GenBank ID:946796)。将marA插入pACYCDuet-1得到重组质粒pA-marA(Nco I和BamH I,图 1-B)。以pA-marA质粒为PCR模板,克隆连接有T7启动子的marA,并插入pET28a-phlD质粒,得到pET28a-phlDmarA重组质粒(Sal I和Xho I,图 1-C)。将accA和accD分别插入pACYCDuet-1质粒,得到重组质粒pA-accA(Nco I和BamH I)和pA-accD(Nco I和BamH I); 以pA-accD为模板克隆T7accD片段,并插入pA-accA得到重组质粒pA-accAD(Sal I和Hind Ⅲ); 最后将accBC插入pA-accAD质粒的得到重组质粒pA-accADBC(Nde I和Xho I,图 1-D)。用T7引物与基因特异引物组合法进行重组子的PCR筛选,并测序确认。
1.2.3 分析方法HPLC法定量检测发酵液中间苯三酚的含量具体条件参见《欧洲药典》8.7版,流动相A为1.36 g/L的磷酸二氢钾溶液,用磷酸调pH至3.0;流动相B为乙腈,梯度洗脱; 色谱柱为C18反相柱Thermo SCIENTIFIC syncronis Dim(mm)250*4.6,粒径5 μm。流速为1.0 mL/min柱温30℃,进样量20 μL,检测器为紫外检测器,检测波长265 nm。间苯三酚标准品保留时间约为8.9 min,标准曲线为:C=0.296 5S+32.1(C代表间苯三酚浓度,单位:mg/L; S代表峰面积)相关系数R2=0.999。
H-NMR分析确认发酵液中间苯三酚结构,核磁共振谱采用DMX20型核共振仪(Bruker公司)测定。
2 结果 2.1 phlD、marA、accA、accD和accBC基因的克隆及pET28a-phlDmarA和pA-accADBC表达质粒载体的构建PCR克隆获得phlD、marA、accA、accD和accBC基因的CDS区序列,结果见图 2,经测序分析,其大小分别为1 050 bp、384 bp、960 bp、915 bp和1 830 bp,与GenBank所登记序列大小一致。

|
| 图 2 phlD的全合成以及marA、accA、accD和accBC克隆琼脂糖凝胶电泳 M:DNA marker; 1:phlD; 2:marA; 3:accA; 4:accD; 5:accBC |
重组质粒pET28a-phlD、pET28a-phlDmarA、pA-accAD和pA-accADBC的质粒酶切图谱见图 3,经BGI测序,确认重组质粒包含完整插入基因序列且无突变。
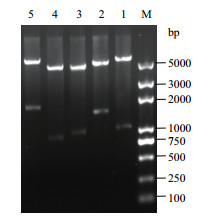
|
| 图 3 重组质粒pET28a-phlD、pET28a-phlDmarA、pA-accAD和pA-accADBC的酶切鉴定图谱 M:DNA marker; 1:pET28a-phlD(BamH I/Nde I); 2:pET28a-phlDmarA(Xho I/Nde I); 3:pA-accAD(Sal I/Hind Ⅲ); 4:pA-accAD(Nco I/Xho I); 5:pA-accADBC(Nde I/Xho I) |
将重组表达质粒pET28a-phlD转入BL21(DE3)细胞,诱导表达,进行SDS-PAGE蛋白分析,成功检测到phlD蛋白(图 4-A)。取40 h发酵液经乙酸乙酯萃取后进行TLC及HPLC分析,在TLC分析中样品斑与阳性对照一致; 在HPLC分析中样品出峰时间(8.9 min)及光谱峰与标准品均一致。使用葡萄糖-TB培养基发酵,经HPLC标准曲线定量,间苯三酚产量达到520 mg/L(使用LB培养基产量仅为350 mg/L,TB培养基改善了发酵液的pH环境)。发酵液经乙酸乙酯萃取浓缩后用DMSO溶解进行1H NMR检测,确认了间苯三酚的存在,如图 5。间苯三酚标准品1H NMR(400 MHz,DMSO):δ8.95(s,3H),5.65(s,3H); 间苯三酚样品1H NMR(400 MHz,DMSO):δ8.95(s,3H),5.66(s,3H)。

|
| 图 4 SDS-PAGE蛋白分析 (A)M:DNA marker; 1:含pET28a-phlD的BL21(DE3)细胞经IPTG诱导12h的粗提液; 2:阴性对照.(B)M:DNA marker; 1, 4:阴性对照; 2, 3:同时含有pET28a-phlDmarA和pA-accADBC的BL21(DE3)细胞经IPTG诱导12 h和40 h后的粗提液; M:蛋白marker(kD) |
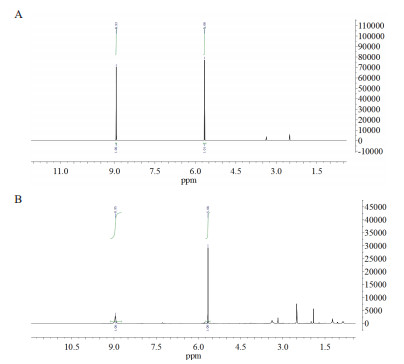
|
| 图 5 1H-NMR鉴定 A:间苯三酚标准品; B:发酵样品,1H NMR(400 MHz,DMSO) |
将pET28a-phlDmarA和pA-accADBC两个质粒转化BL21(DE3)细胞,超表达蛋白(箭头标注)的分子量依次与AccC、PhlD、AccA、AccD(与AccA亚基分子量相近合并为一条带)、AccB和MarA的理论大小一致,见图 4-B。
使用2.5%葡萄糖碳源TB培养基分别进行摇瓶发酵对比实验(图 6,n=3),IPTG诱导后8、16、24、32、40和48 h取样,HPLC检测间苯三酚积累量(图 6)。数据显示间苯三酚积累峰值在40 h左右出现,之后浓度逐渐降低。同时超表达phlD和marA的最高产量(1 060 mg/L)是仅超表达phlD最高产量(450 mg/L)的2.35倍,经T检验分析具有极显著差异(P < 0.01);同时超表达phlD、marA和ACCase的最高产量(2 120 mg/L)是仅超表达phlD最高产量的4.71倍,经T检验分析具有极显著差异(P < 0.01);是同时超表达phlD和marA的最高产量的2倍,经t检验分析具有极显著差异(P < 0.01)。在前24 h间苯三酚呈线性累积,24 h之后生产效率逐渐下降。超表达marA及marA&ACCase明显提高了间苯三酚的积累速度和积累峰值,尤其是marA&ACCase的超表达使前24 h的积累速度大幅提高,说明marA可以有效提高细菌对间苯三酚的抵抗能力以及ACCase的表达使胞内丙二酰辅酶A的供应量有一定水平的增加。
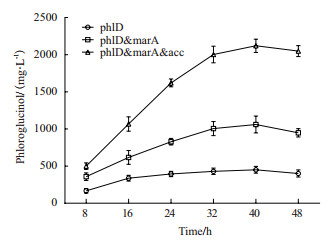
|
| 图 6 marA及ACCase对间苯三酚积累速度的影响 (每组3个重复) |
培养基1、2和3分别为每升M9改良培养基中添加25 g葡萄糖、甘油或丙酮酸钠。培养基1、2和3中分别加入2 mmol/L Mg2+和0.1 mmol/L Ca2+成为钙镁培养基。分别使用以上培养基进行发酵实验,HPLC检测间苯三酚积累量,如图 7。使用葡萄糖碳源的工程菌产量达到490 mg/L,是使用甘油碳源产量(275 mg/L)的1.8倍,经t检验分析具有极显著差异(P < 0.01);是使用丙酮酸钠碳源产量(205 mg/L)的2.4倍,经t检验分析具有极显著差异(P < 0.01)。钙镁离子对间苯三酚的积累没有影响。
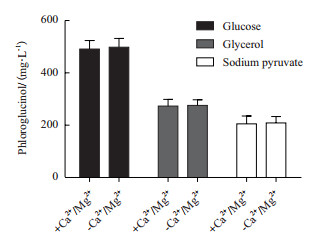
|
| 图 7 葡萄糖、甘油和丙酮酸钠不同碳源及Ca2+/Mg2+对间苯三酚产量的影响 |
影响间苯三酚产量的主要原因在前言中已提及:间苯三酚的抑菌性及phlD直接底物的缺乏。在BL21(DE3)细胞中超表达marA基因和ACCase,部分解决了前言中提及的这两个问题,使间苯三酚的产量得到大幅提升,最高产量达到约2 120 mg/L,是同类研究中摇瓶发酵的最高产量。发酵后期间苯三酚浓度的降低与间苯三酚本身结构不稳定有关[19]。进一步降低发酵温度,可提高间苯三酚的稳定性,从而提高间苯三酚的积累峰值。但是温度的降低也会提高生产成本,拉长发酵周期,平衡考虑或不可取。
MarA的超表达虽然缓解了间苯三酚对工程菌的抑制作用,但是间苯三酚的积累却进一步降低了发酵液的pH值,形成了新的矛盾。我们通过使用改良TB培养基来缓解了pH的矛盾,使间苯三酚产量进一步提升,且积累速度大幅提升。ACCase的超表达虽然提高了胞内丙二酰辅酶A的浓度,使间苯三酚产量有了较大的提升,但是大量的蛋白超表达以及间苯三酚生物合成对胞内碳资源的争夺,抑制了工程菌的生长,使工程菌的最终OD值降低,制约了间苯三酚的生物合成,降低了培养基的利用率,增加了成本。
细胞中乙酰辅酶A主要来源于丙酮酸氧化脱羧[20],在培养基中添加丙酮酸盐以期提高胞内乙酰辅酶A的含量,进而增加ACCsae酶的底物浓度,达到提高丙二酰辅酶A浓度的目的。但是,通过与葡萄糖、甘油对比实验发现效果不理想。可能是因为细胞膜上缺少相关转运蛋白,而带负电的丙酮酸根很难直接穿过细胞膜被细胞直接吸收。虽然葡萄糖要经过复杂的糖酵解途径在胞内才能生成丙酮酸,但是大肠埃希菌细胞膜上具有成熟的吸收葡萄糖的磷酸酶转移系统[21],有极高的吸收效率。所以最终还是葡萄糖对间苯三酚的积累更加有利。
4 结论本研究通过在BL21(DE3)菌株中异源表达来自荧光假单胞菌的phlD基因,成功构建间苯三酚的胞内生物合成途径; 同时超表达了来自E.coli DH5α菌株的marA和ACCase基因,提高了工程菌对间苯三酚的抵抗能力,提高了胞内合成间苯三酚的直接底物丙二酰辅酶A的含量。
不同碳源及培养基中离子环境对间苯三酚产量的影响:葡萄糖为最佳发酵碳源,且钙镁离子对间苯三酚的产量没有影响。本研究使间苯三酚的产量得到大幅的提升,达到2 120 mg/L的水平,为目前摇瓶发酵的最高产量。
| [1] |
周小菲, 高增平. 间苯三酚类成分的植物来源及结构分类[J]. 北京中医药大学学报, 2012, 35(6): 399-405. |
| [2] |
Artan M, Li Y, Karadeniz F, et al. Anti-HIV-1 activity of phloroglucinol derivative, 6, 6'-bieckol, from Ecklonia cava[J]. Bioorganic & Medicinal Chemistry, 2008, 16(17): 7921-7926. |
| [3] |
Kim RK, Uddin N, Hyun JW, et al. Novel anticancer activity of phloroglucinol against breast cancer stem-like cells[J]. Toxicol Appl Pharmacol, 2015, 286(3): 143-150. DOI:10.1016/j.taap.2015.03.026 |
| [4] |
Weng JR, Tsao LT, Wang JP, et al. Anti-inflammatory phloroglucin-ols and terpenoids from Garcinia subelliptica[J]. Journal of Natu-ral Products, 2004, 67(11): 1796-1799. DOI:10.1021/np049811x |
| [5] |
Dellabella M, Milanese G, Muzzonigro G. Randomized trial of the efficacy of tamsulosin, nifedipine and phloroglucinol in medical exp-ulsive therapy for distal ureteral calculi[J]. J Urol, 2005, 174(1): 167-172. DOI:10.1097/01.ju.0000161600.54732.86 |
| [6] |
Weller DM, Landa BB, Mavrodi OV, et al. Role of 2, 4-diacetylphlo-roglucinol-producing fluorescent Pseudomonas spp. in the defense of plant roots[J]. Plant Biol(Stuttg), 2007, 9(1): 4-20. |
| [7] |
Achkar J, Xian M, Zhao H, et al. Biosynthesis of phloroglucinol[J]. Journal of the American Chemical Society, 2005, 127(15): 5332-5333. DOI:10.1021/ja042340g |
| [8] |
Bender C, Rangaswamy V, Loper J. Polyketide production by plant-associated Pseudomonads[J]. Annual Review of Phytopathology, 1999, 37: 175-196. DOI:10.1146/annurev.phyto.37.1.175 |
| [9] |
李凤霞. 查尔酮异构酶基因过表达对新疆雪莲类黄酮生物合成的调控[D]. 北京: 中国科学院植物研究所, 2006. http://d.wanfangdata.com.cn/Thesis/Y1627993
|
| [10] |
Bangera MG, Thomashow LS. Identification and characterization of a gene cluster for synthesis of the polyketide antibiotic 2, 4-diacetylphloroglucinol from Pseudomonas fluorescens Q2-87[J]. J Bacteriol, 1999, 181(10): 3155-3163. |
| [11] |
Paulsen IT, Press CM, Ravel J, et al. Complete genome sequence of the plant commensal Pseudomonas fluorescens Pf-5[J]. Nature Biotechnology, 2005, 23(7): 873-878. DOI:10.1038/nbt1110 |
| [12] |
高海军, 肖丹, 杨永政, 等. 荧光假单胞菌phlD基因的克隆、表达及功能[J]. 北京理工大学学报, 2009, 29(5): 465-470. |
| [13] |
Rao G, Lee JK, Zhao H. Directed evolution of phloroglucinol synthase PhlD with increased stability for phloroglucinol production[J]. Applied Microbiology and Biotechnology, 2013, 97(13): 5861-5867. DOI:10.1007/s00253-013-4713-4 |
| [14] |
Yang F, Cao Y. Biosynthesis of phloroglucinol compounds in microorganisms[J]. Applied Microbiology and Biotechnology, 2012, 93(2): 487-495. DOI:10.1007/s00253-011-3712-6 |
| [15] |
Zha W, Rubin-Pitel SB, Shao Z, et al. Improving cellular malonyl-CoA level in Escherichia coli via metabolic engineering[J]. Metabolic Engineering, 2009, 11(3): 192-198. DOI:10.1016/j.ymben.2009.01.005 |
| [16] |
Touze T, Eswaran J, Bokma E, et al. Interactions underlying assembly of the Escherichia coli AcrAB-TolC multidrug efflux system[J]. Mol Microbiol, 2004, 53(2): 697-706. DOI:10.1111/mmi.2004.53.issue-2 |
| [17] |
Pradel E, Page`s J. The AcrAB-TolC efflux pump contributes to multidrug resistance in the nosocomial pathogen Enterobacter aerogenes[J]. Antimicrobial Agents and Chemotherapy, 2002, 36(8): 2640-2643. |
| [18] |
Cronan J, Waldrop G. Multi-subunit acetyl-CoA carboxylases[J]. Progress in Lipid Research, 2002, 41: 407-435. DOI:10.1016/S0163-7827(02)00007-3 |
| [19] |
Stein HN, Tendeloo HJC. The oxidation of phloroglucinol as a model for humification processes[J]. Plant and Soil, 1959, 11(2): 131-138. DOI:10.1007/BF01435102 |
| [20] |
沈冬钱. 代谢工程大肠杆菌积累丙酮酸的研究[D]. 杭州: 浙江大学, 2014. http://d.wanfangdata.com.cn/Thesis/Y2507781
|
| [21] |
张旭. 葡萄糖专一性磷酸转移酶系统单基因缺失对大肠杆菌生理特性的影响[D]. 济南: 山东大学, 2014. http://d.wanfangdata.com.cn/Thesis/Y2594526
|






