Raf激酶(Rapidly accelerated fibrosarcoma)是逆转录病毒致癌基因v-Raf的同源蛋白,它调控细胞的生长、分化、转化和凋亡等诸多生命过程,Raf-MEK-ERK通路是细胞信号传导的一条主干通路,这条通路的调控失常是细胞癌变的主要原因之一[1-2]。
Raf激酶家族有3个成员A-Raf、B-Raf和C-Raf(Raf-1),它们均可被上游信号分子Ras激酶激活(Ras突变和异常活化与20%的人类癌症相关[3]),从细胞质转位到细胞膜,并通过磷酸化靶蛋白MEK来进一步激活ERK。但3个成员生物学功能却各有所不同[4-5]。与B-Raf和C-Raf相比,A-Raf的激酶活性最低,仅为C-Raf的20%[6]。而且,A-Raf突变在癌症中的发现相对较少,目前仅在肺癌细胞中发现了A-Raf-S214C突变体[7]。
A-Raf-S214C突变体是A-Raf的第214位氨基酸丝氨酸突变为半胱氨酸。通过基因组学筛查在肺癌细胞中发现该突变体,并且它能转化支气管表皮细胞,使其发生癌变[7]。在朗格汉氏增生症中也发现该突变[8]。A-Raf(S214C)突变体对MAPK的激活能力几乎与B-Raf(V600E)相同[8]。
本研究通过点突变法构建了A-Raf-S214C位点突变真核表达质粒,并在Flp-In T-Rex HEK293细胞进行稳转,构建该突变体的稳定表达细胞系,检测其在Flp-In T-Rex HEK293细胞中的表达水平,以及其对MAPK信号通路的作用。
1 材料与方法 1.1 材料 1.1.1 细胞、菌株和质粒A-Raf cDNA、Flp-In细胞、pcDNA5/FRET/TO载体由本实验室保存,感受态大肠杆菌DH5α购自TaKaRa公司。引物合成和测序工作由生工生物工程(上海)有限公司完成。
1.1.2 主要试剂盒与抗体TOYOBO点突变试剂盒购自东洋纺(上海)生物科技有限公司(该试剂盒含有KOD-Plus-、DpnI、T4 Polynucleotide Kinase、Ligation high等);胶回收试剂盒、质粒提取试剂盒等购自Tiangen公司;DMEM培养基、Blasticidin、Zeocin、Hygromycin、转染试剂Lipo-fectamine2000均购自Invitrogen corporation;胎牛血清和Opti-MEM培养基购自北京Solarbio有限公司;Anti-VSV、Anti-GAPDH、Anti-ERK、Anti-p-ERK购自Santa Cruz Biotechnology;辣根过氧化物标记鼠、羊、兔IgG抗体购自Kirkegaarg & laboratories公司。
1.2 方法 1.2.1 pcDNA5/FRT/TO-VSV-A-Raf质粒的构建首先根据载体特点及VSV标签序列设计上下游引物(表 1)。然后用PCR的方法将VSV标签序列及限制性酶切位点引入A-Raf的cDNA,并用BamH I和Xho I酶对pcDNA5/FRET/TO载体和含有VSV标签和酶切位点的A-Raf cDNA进行双酶切,利用连接酶将扩增的VSV-A-Raf基因连接到pcDNA5/FRET/TO载体,从而得到pcDNA5/FRT/TO-VSV-A-Raf质粒(以下简称A-Raf质粒)。将质粒送生工生物工程(上海)有限公司测序。
以A-Raf质粒为模板,设计点突变引物(表 1),并送生工生物工程(上海)有限公司合成。
1.2.3 pcDNA5/FRT/TO-VSV-A-Raf-S214C突变体(以下简称A-Raf-S214C)的构建与鉴定用TOYOBO点突变试剂盒构建突变体质粒。第一步,以A-Raf质粒为模板,用反向设计的两条引物对质粒进行完整的PCR。第二步,用Dpn I对模板质粒进行消化,37℃反应1 h。第三步,PCR产物自身环化:将Dpn I处理后PCR产物、灭菌蒸馏水、Ligation high、T4 Polynucleotide Kinase以2:7:5:1的体积比进行混合,混合物在16℃条件下反应1 h,实现PCR产物的自身环化。第四步,转化质粒:将自身环化后产物转化至DH5α感受态细胞中,涂布于含有氨苄青霉素的LB固体培养基平板,37℃恒温培养12 h后,挑取单克隆菌落进行PCR鉴定,筛选阳性克隆,用质粒提取试剂盒抽提质粒,用Xho I和BamH I酶进行双酶切,并测序验证定点突变是否成功。
1.2.4 细胞培养及转染Flp-In T-Rex HEK293细胞培养于含有10%胎牛血清、100 U/mL的青霉素、100 μg/mL的链霉素、3 μg/mL Blasticidin、100 μg/mL的Zeocin的DMEM维持培养基中,培养条件为37℃,5%CO2和80%湿度。待细胞生长至密度为70%-80%时(T25培养瓶培养),将构建成功的pcDNA5/FRT/TO-VSV-A-Raf-S214C质粒(以下简称A-Raf-S214C质粒)和pOG44质粒按1:9的比例共转染该细胞。具体步骤:将质粒DNA(0.3 μg)与pOG44(2.7 μg)混合物溶入500 μL Opti-MEM培养基中,并将6 μL脂质体Lipo-fectamine2000也溶入500 μLOpti-MEM培养基中,将二者混合均匀,静置15-20 min。在静置期间,将T25培养瓶中的培养基吸出,用1 mL 1×PBS洗涤3次,并加入2.5 mL Opti-MEM培养基,并放回培养箱继续培养。待静置结束后,轻轻将质粒与转染试剂混合物均匀混合,加入T25培养瓶中,混匀后放回37℃培养箱中继续培养。6 h后,将Opti-MEM培养基更换为正常维持培养基5 mL,继续培养。第2天,将转染了质粒的Flp-In T-Rex HEK293细胞传代至T125培养瓶中继续培养。第3天,将T125培养瓶中的维持培养基更换成含200 μg/mL Hygromycin的筛选培养基继续培养。之后每3-5 d更换一次筛选培养基,直至有单克隆细胞出现。然后将单克隆细胞用胰酶消化,转移至T25培养瓶,并更换为维持培养基继续扩大培养,用于后续试验。
1.2.5 免疫印记分析将A-Raf野生型和A-Raf-S214C稳定表达细胞系铺6孔板,用浓度为0、1、5、10、100和1 000 ng/mL六个浓度梯度的Doxycycline(Dox)诱导VSV-A-Raf和VSV-A-Raf-S214C的表达,诱导24 h后裂解细胞,收集蛋白样品,并进行BCA定量,进行SDS-PAGE电泳、PVDF膜转膜、牛奶封闭、孵育一抗、1×TBST洗膜、孵育二抗、1×TBST洗膜、显影,用凝胶成像系统软件对结果进行分析。根据VSV的表达水平,可确定诱导剂的最佳浓度。再次将A-Raf野生型和A-Raf-S214C稳定细胞系铺6孔板,用之前检测得到的Dox最佳诱导浓度分别诱导细胞0、12、18和24 h后收集细胞,进行Western blot检测,方法同前,可确定Dox最佳诱导时间。
1.2.6 A-Raf-S214C突变体活性检测将A-Raf野生型和A-Raf-S214C突变体稳定表达细胞系分别铺6孔板,每种细胞分成3组。待细胞生长至密度为70%-80%时,用最佳Dox诱导浓度分别诱导A-Raf野生型和A-Raf-S214C突变体稳定表达细胞。诱导12 h后,第1组细胞不做任何处理,将第2组和第3组细胞更换为无血清培养基,并继续用Dox诱导。再过12 h后,将第2组细胞用200 μL胎牛血清刺激5 min(加入血清后,培养基中血清终浓度为10%),其余两组不作处理。然后进行细胞收样,用Western blot检测ERK的磷酸化水平,Western blot方法同前。
1.2.7 统计学分析本实验数据处理应用SPASS21.0统计软件,采用t检验进行统计分析,显著性差异水平定位P < 0.05。
2 结果 2.1 pcDNA5/FRT/TO-VSV-A-Raf质粒的鉴定将构建的A-Raf质粒用琼脂糖凝胶电泳分析,结果(图 1)显示,pcDNA5/FRT/TO-VSV-A-Raf质粒在相应位置具有清晰的条带,大小正确。质粒测序结果与NCBI数据库中基因序列完全一致,说明构建的A-Raf质粒符合实验要求。
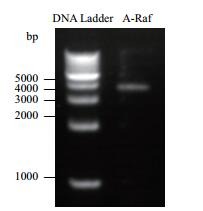
|
| 图 1 琼脂糖凝胶电泳测定pcDNA5-FRT-TO-A-Raf质粒的大小 |
通过反向PCR法对A-Raf进行点突变PCR产物经Dpn I酶切及产物自身环化后,将环化产物转染至DH5α感受态细胞中,挑取单克隆菌落进行菌液PCR鉴定,其中12个代表性单克隆菌落的菌落PCR电泳结果如图 2-A所示。通过菌液PCR筛选阳性克隆,用质粒提取试剂盒抽提质粒,将其中前8个菌落的质粒分别进行Xho I和BamH I双酶切鉴定它们是否含有相应大小的插入片段,酶切的电泳结果如图 2-B所示。经序列比对,发现A-Raf序列第641位碱基C突变为G,即编码214位氨基酸的丝氨酸(TCC)突变为半胱氨酸(TGC),即可确定点突变成功。测序结果如图 3所示。
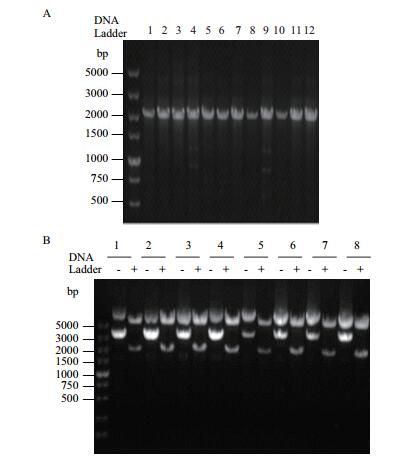
|
| 图 2 琼脂糖凝胶验证A-Raf-S214C菌落PCR产物(A)及pcDNA5-FRT-TO-A-Raf-S214C质粒的双酶切验证(B) (A)1-12:12个代表性单克隆菌落的菌落PCR;(B)1-8:对其中8个单克隆菌落质粒分别进行双酶切的结果;-:未进行双酶切,作为阴性对照;+:对质粒进行XhoI和BamHI双酶切 |

|
| 图 3 A-Raf-S214C突变体测序 |
用浓度为0、1、5、10、100和1 000 ng/mL Doxycycline分别处理稳定表达A-Raf及其突变体A-Raf-S214C的两个细胞系,处理24 h后,用抗VSV标签蛋白抗体检测A-Raf及其突变体A-Raf-S214C的表达情况,免疫印记结果(图 4-A)显示,100 ng/mL Dox是A-Raf及其突变体A-Raf-S214C的最佳诱导浓度。用该最佳浓度,再次分别诱导两个细胞系0、12、18和24 h,结果(图 4-B)显示诱导24 h后,A-Raf和A-Raf-S214C的表达量可达最大。本实验说明,用100 ng/mL Dox处理细胞24 h是诱导A-Raf和A-Raf-S214C表达的最佳条件。
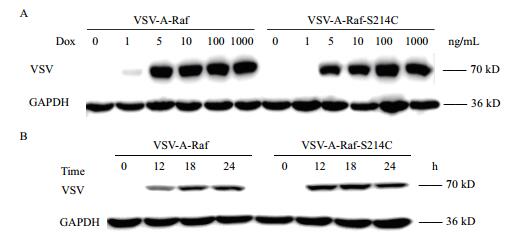
|
| 图 4 不同多西环素浓度(A);及在100 ng/mL多西环素诱导的条件下,不同诱导时间(B)对VSV-A-Raf野生型和VSV-A-Raf-S214C突变体表达的影响 |
将A-Raf野生型和A-Raf-S214C稳定表达细胞系分别分为正常培养诱导组、饥饿组和饥饿后加血清刺激组进行实验,之后用Western blot检测ERK的磷酸化水平,发现饥饿组中的A-Raf-S214C突变体细胞的ERK磷酸化水平明显高于A-Raf野生型细胞(图 5-A)。重复3次该实验,并进行统计学分析,饥饿处理组A-Raf野生型和A-Raf-S214C突变体的ERK磷酸化水平,差异显著(**P < 0.01),结果如图 5-B所示。该结果初步证明A-Raf-S214C突变体是A-Raf的激活突变体,与A-Raf相比,A-Raf-S214C对MAPK信号通路下游信号分子ERK的磷酸化能力更强。
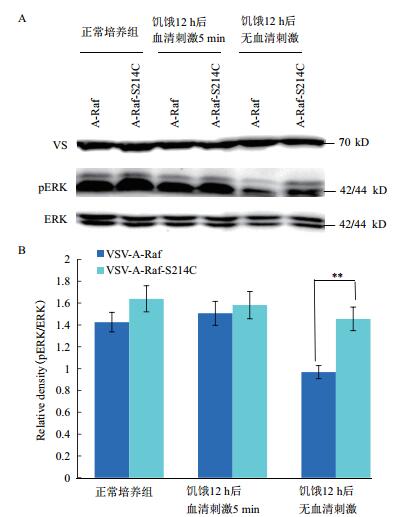
|
| 图 5 免疫印迹检测VSV-A-Raf野生型细胞和VSV-A-Raf-S214C突变体细胞的ERK磷酸化水平 A:在正常培养、饥饿12 h后血清处理5 min和饥饿12 h后无血清刺激条件下,A-Raf和A-Raf-S214C对ERK磷酸化的影响;B:对Western结果的灰度扫描以及统计学分析(**P < 0.01) |
Ras-Raf-MEK-ERK通路是细胞信号传导的一条主干通路,它调控着细胞的生长、分化、转化和凋亡等诸多生命过程[9]。在这条通路中,Raf激酶作为关键组分之一发挥着重要作用[6]。
Raf激酶是逆转录病毒致癌基因v-Raf的同源蛋白,Raf激酶家族有3个成员A-Raf、B-Raf和C-Raf(Raf-1),3个成员结构相似(由调节区和激酶活性区两部分组成),大小接近(A-Raf:606个氨基酸;B-Raf:806个氨基酸;C-Raf:648个氨基酸),都可以被Raf激酶的结合蛋白Ras激活,之后从细胞质转位到细胞膜,并通过磷酸化靶蛋白MEK进一步激活ERK。但3个成员生物学功能和调控机制却各不相同[10]。其中对B-Raf和C-Raf的研究最为深入,它们是Ras-Raf-MEK-ERK信号通路上的主要致癌蛋白也是激活MEK的主要蛋白[10]。研究表明Ras-Raf-MEK-MAPK信号通路中的组分过表达或发生激活突变,与超过30%的人类肿瘤相关[11]。其中Raf激酶的突变是导致细胞癌变的主要原因之一,如B-Raf突变与57%的神经系统癌变、39%的皮肤癌和38%胸腺癌相关[12];C-Raf突变与超过90%的小细胞肺癌相关[13]。因此,调控Raf激酶也就成为了治疗癌症的最主要手段之一[13-14]。
与B-Raf和C-Raf相比,A-Raf具有较低的激酶活性,其最大活性仅为C-Raf的20%[15],而且当前在肿瘤中发现A-Raf发生基因突变的报道较少。因此,人们对A-Raf激酶的关注较少,作为Raf激酶家族中重要一员,对其生物学功能仍不是非常清楚。这同时也给我们一种启示,为什么在进化过程中会形成一个较差的MEK激酶A-Raf,而与之同源的B-Raf和C-Raf会具有非常强的激酶活性?因此,这些问题驱使我们对A-Raf及其激活突变体进行研究。本研究发现,与野生型A-Raf相比,其突变体A-Raf-S214C可明显增强下游信号分子ERK的磷酸化程度,该突变体是A-Raf激酶的构建性激活突变体,可引起MAPK信号通路下游信号分子ERK异常活化。而异常活化的ERK可通过转录因子调控细胞周期进展、细胞分化、蛋白质合成、代谢、细胞存活[16]、细胞迁移和入侵等使正常细胞获得许多肿瘤细胞的特征[17]。也有报道称,A-Raf激酶在细胞凋亡[18]、肿瘤形成[19]、拮抗Raf激酶抑制剂[20]等过程中扮演重要角色。因此,进一步了解A-Raf-S214C突变体的具体激活机制有助于帮助我们了解A-Raf的致癌机制,为人们寻找治疗癌症的方法提供了新的思路。
4 结论利用点突变的方法,成功构建了A-Raf-S214C突变体质粒。并且成功构建了在Flp-In T-Rex HEK293细胞中稳定表达的A-Raf野生型和A-Raf-S214C突变体细胞系。在不同浓度的多西环素诱导下,A-Raf野生型细胞与A-Raf-S214C突变体细胞的表达量有所不同,二者均在100 ng/mL的多西环素诱导24 h的条件下,表达水平达最大值。与野生型相比,A-Raf-S214C突变体可明显增强MAPK信号通路中下游信号分子ERK的磷酸化水平,即A-Raf-S214C突变体是A-Raf激酶的激活突变体。
| [1] |
Kolch W. Coordinating ERK/MAPK signalling through scaffolds and inhibitors[J]. Nat Rev Mol Cell Biol, 2005, 6(11): 827-837. |
| [2] |
Matallanas D, Birtwistle M, Romano D, et al. Raf family kinases: old dogs have learned new tricks[J]. Genes Cancer, 2011, 2(3): 232-260. DOI:10.1177/1947601911407323 |
| [3] |
Montagut C, Settleman J. Targeting the Raf-MEK-ERK pathway in cancer therapy[J]. Cancer Lett, 2009, 283(2): 125-134. DOI:10.1016/j.canlet.2009.01.022 |
| [4] |
Leicht DT, Balan V, Kaplun A, et al. Raf kinases: function, regulation and role in human cancer[J]. Biochim Biophys Acta, 2007, 1773(8): 1196-1212. DOI:10.1016/j.bbamcr.2007.05.001 |
| [5] |
Osborne JK, Zaganjor E, Cobb MH. Signal control through Raf: in sickness and in health[J]. Cell Res, 2012, 22(1): 14-22. DOI:10.1038/cr.2011.193 |
| [6] |
An S, Yang Y, Ward R, et al. A-Raf: A new star of the family of raf kinases[J]. Crit Rev Biochem Mol Biol, 2015, 50(6): 520-530. DOI:10.3109/10409238.2015.1102858 |
| [7] |
Imielinski M, Gredulich H, Kaplan B. Oncogenic and sorafenib-sensitive A-Raf mutations in lung adenocarcinoma[J]. J Clin Invest, 2014, 124(4): 1582-1586. DOI:10.1172/JCI72763 |
| [8] |
Nelson DS, Quispel W, Badalian-Very G, et al. Somatic activating A-Raf mutations in Langerhans cell histiocytosis[J]. Blood, 2014, 123(20): 3152-3155. DOI:10.1182/blood-2013-06-511139 |
| [9] |
Olson JM, Hallahan AR. P38MAPK kinase: a convergence pointin cancer therapy[J]. Trends Mol Med, 2004, 10(3): 125-129. DOI:10.1016/j.molmed.2004.01.007 |
| [10] |
Osbome JK, Zaganjor E, Cobb HM. Signal control through Raf: in sickness and in health[J]. Cell Res, 2012, 22(1): 14-22. DOI:10.1038/cr.2011.193 |
| [11] |
Fernandez-Medarde A, Santos E. Ras in cancer and developmental diseases[J]. Genes Cancer, 2011, 2(3): 344-358. DOI:10.1177/1947601911411084 |
| [12] |
Santarpia L, Lippman SM, El-Naggar AK. Targeting the MAPK-RAS-RAF signaling pathway in cancer therapy[J]. Expert Opin Ther Targets, 2012, 16(1): 103-119. DOI:10.1517/14728222.2011.645805 |
| [13] |
Beeram M, Patnaik A, Rowinsky EK. Raf: a strategic target for therapeutic development against cancer[J]. J Clin Oncol, 2005, 23(27): 6771-6779. DOI:10.1200/JCO.2005.08.036 |
| [14] |
Kim DH, Sim T. Novel small molecule Raf kinase inhibitors for targeted cancer therapeutics[J]. Arch Pharm Res, 2012, 35(4): 605-615. DOI:10.1007/s12272-012-0403-5 |
| [15] |
Martin-Liberal J, Larkin J. New RAF kinase inhibitors in cancer therapy[J]. Expert Opin Pharmacother, 2014, 15(9): 1235-1245. DOI:10.1517/14656566.2014.911286 |
| [16] |
邹平, 何涛, 陈颢, 等. 细胞衰老过程中JNK、p38和Akt的活性变化[J]. 中国生物化学与分子生物学报, 2006, 22(7): 571-574. |
| [17] |
Scheid MP, Schubert KM, Duronio V. Regulation of bad phosphorylation and association with Bcl-x(L)by the MAPK/ERK kinase[J]. J Biol Chem, 1999, 274(43): 31108-31113. DOI:10.1074/jbc.274.43.31108 |
| [18] |
Rauch J, Moran-Jones K, Albrecht V, et al. c-Myc regulates RNA splicing of the A-Raf kinase and its activation of the ERK pathway[J]. Cancer Res, 2011, 71(13): 4664-4674. DOI:10.1158/0008-5472.CAN-10-4447 |
| [19] |
Imielinski M, Greulich H, Kaplan B, et al. Oncogenic and sorafenib-sensitive ARAF mutations in lung adenocarcinoma[J]. J Clin Invest, 2014, 124(4): 1582-1586. DOI:10.1172/JCI72763 |
| [20] |
Mooz J, Oberoi-Khanuja TK, Harms GS, et al. Dimerization of the kinase ARAF promotes MAPK pathway activation and cell migration[J]. Sci Signal, 2014, 7(337): ra73. DOI:10.1126/scisignal.2005484 |





