肝癌(Hepatocellular carcinoma,HCC)是常见的恶性肿瘤之一,在世界范围内占肿瘤发生的第六位,死亡率占第二位[1]。我国是肝癌的高发国,每年新发肝癌约46.6万例,占全世界新发病例的一半以上[2]。迄今尚未能完全明了HCC的发病机理,即使是根治性切除,5年内仍有60%-70%的病人出现转移复发,而局部治疗的转移复发率更高[3-4]。磷脂酰肌醇蛋白聚糖3(Glypican-3,GPC3)是一种硫酸乙酰肝素糖蛋白(Heparan sulfate proteoglycan,HSPG),它通过糖基磷脂酰肌醇(Glycosyl Phosphatidyl Inositol,GPI)锚定在细胞膜表面[5]。研究发现,GPC3在肝癌中特异性高表达,细胞膜上GPC3核心蛋白与Wnt结合,促进Wnts与其特异的Frizzled受体结合,进而促进细胞的恶性转化和肿瘤的持续增殖[6-8]。GPC3的肝素多聚糖链(HS)与肿瘤分泌的生长因子结合,抑制了生长因子的活性,从而抑制了肿瘤的生长[9-10];缺少GPI锚定点的可溶性GPC3(GPC3△GPI,soluble Glypican-3,sGPC3)可阻断Wnts信号从而抑制Wnt依赖性肿瘤的生长[11]。GPC3与肝癌的发生、发展关系密切,但GPC3在高转移性肝癌中的作用仍需要进一步深入的研究[12-13]。本实验将sGPC3和GPC3基因分别转入高转移性肝癌细胞HCCLM3中表达重组蛋白,观察其对细胞生物学行为的影响,探讨GPC3与高转移性肝细胞癌发生、发展的关系,旨在为开发一种治疗高转移性肝癌的新型药物奠定基础。
1 材料与方法 1.1 材料pMD20-GPC3质粒和pcDNA3.0-GFP真核表达载体由本实验室构建;大肠杆菌E. coli DH5α本实验室保存;HCCLM3人肝癌细胞购自中国典型培养物保藏中心(武汉)。总RNA提取试剂盒、无内毒素质粒大提试剂盒、DNA纯化回收试剂盒和质粒小量提取试剂盒购自Tiangen公司;胎牛血清、DMEM高糖培养基购自Gibco公司,限制性内切酶Xba I和EcoR I、T4 DNA Ligase、Taq DNA Polymerase、DNA Marker、第一链合成试剂盒购自Takara公司;蛋白质Marker购自Fermentas公司;anti-β-actin、anti-GPC3抗体购自Santa Cruz公司;LipofectamineTM3000购自Invitrogen公司。
1.2 方法 1.2.1 PCR扩增sGPC3和GPC3基因根据Gen-Bank上GPC3序列(NM_004484.3)和真核表达载体pcDNA3.0-GFP上多克隆位点设计3条特异性引物:P1:5'-CCGGAATTCATGGGGGGTTCTCATCACCACCATCACCATGCCGGGACCGTGCGCAC-3';P2:5'-TGCTCTAGATTACTCGAGTGAACGTTCCCGAGGTTGT-3';P3:5'-TGCTCTAGATTAGTGCACCAGGAAGAAGAAGCACACCACCGAGAT-3'。(注:P1引物中的“GAATTC”为EcoR I酶切位点,;P2、P3引物中的“TCTAGA”为Xba I酶切位点)。
以测序正确的pMD20-GPC3质粒为模版,引物P1、P2扩增含大小1 680 bp无锚定结构的可溶性sGPC3基因序列;引物P1、P3扩增含大小1 740 bp的有锚定结构的全长GPC3基因序列。在sGPC3和GPC3序列两端分别引入限制性内切酶EcoR I和Xba I位点。引物由上海英潍捷基公司合成。
1.2.2 构建pcDNA3.0-GFP-sGPC3和pcDNA3.0-GFP-GPC3重组表达载体限制性内切酶EcoR I和Xba I双酶切PCR扩增的sGPC3、GPC3基因产物,经琼脂糖凝胶电泳分离和DNA纯化回收获得的目的基因sGPC3、GPC3,分别连接到经相应内切酶酶切的真核表达载体pcDNA3.0-GFP上,构建重组表达载体pcDNA3.0-GFP-sGPC3、pcDNA3.0-GFP-GPC3,并转化到DH5α感受态中,经抗生素筛选、酶切鉴定后送去测序。
1.2.3 细胞转染及RT-PCR和Western blot鉴定将对数生长期的HCCLM3细胞以5×105/孔接种于6孔板培养,待细胞长至饱和度70%-80%,Lipofecta-mineTM3000介导pcDNA3.0-GFP-sGPC3和pcDNA3.0-GFP-GPC3转染HCCLM3细胞(具体步骤参阅产品说明书),设pcDNA3.0-GFP空载体对照。转染后72 h收集细胞,Trizol法提取总RNA,并逆转录合成cDNA,定量后以其为模板进行PCR扩增,琼脂糖凝胶电泳检测。转染后96 h收集细胞,提取细胞总蛋白,BCA法测定样品的蛋白质含量,SDS-PAGE,转膜,用Anti-GPC3抗体检测GPC3的表达情况,β-actin作内参。以未转染的野生型细胞株为对照。IPP6.0统计目的条带的IOD值。
1.2.4 CCK-8法检测GPC3对HCCLM3增殖的影响以转染pcDNA3.0-GFP-sGPC3、pcDNA3.0-GFP-GPC3和pcDNA3.0-GFP后48 h的HCCLM3细胞为实验组,野生型HCCLM3细胞为空白对照组。取各组细胞接种于96孔板,5×103 cell/孔,每组6个复孔,在细胞贴壁后0、24和36 h,分别加入CCK-8测定波长450 nm的吸光度值(A450)。绘制各组细胞生长曲线并计算抑制率。
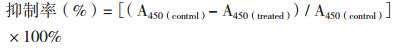
分组同1.2.4。取吹打成单个的各组细胞,作梯度倍数稀释,每组细胞分别以每孔100个细胞均匀接种于12孔板中。置37℃、5% CO2及饱和湿度的细胞培养箱中培养,当出现肉眼可见的克隆时,终止培养。用PBS小心浸洗2次,4%多聚甲醛固定15 min,GIMSA染色液染20 min。计数大于10个细胞的克隆数,计算克隆形成率。

分组同1.2.4。细胞划痕:取各组细胞接种于24孔板中,1×105 cell/孔,待贴壁铺满后,用枪头垂直划痕,不能倾斜。用PBS洗去除划下的细胞,加入无血清培养基,37℃ 5% CO2培养。在0、24、48和72 h拍照观察细胞迁移的情况。Transwell实验:取各组细胞,在Transwell上室内分别加入200 μL无血清培养液配制成5×105个/mL的细胞悬液,下室加600 μL含10% FBS培养液,培养48 h。取出小室弃除上室液体,4%多聚甲醛固定5 min,用棉签擦尽上室未穿膜的细胞,DAPI染色,200倍光境下拍照,IPP6.0统计迁移细胞数。
1.2.7 流式细胞术检测GPC3对HCCLM3周期、凋亡的影响分组同1.2.4。PI单染检测细胞周期:收集各组细胞(>l×106)于70%乙醇中-20℃固定24 h以上,收集固定后的细胞,加入RNA酶(终浓度100 μg/mL),37℃水浴30 min,加入PI(终浓度50 μg/mL)染色,室温下避光15 min,流式细胞仪检测,用ModFit软件分析细胞周期分布。Annexin-V-FITC/PI双染检测细胞凋亡:不含EDTA的胰酶消化并收集各组细胞于流式管中,2 mL冷PBS洗涤后重悬于100 μL Binding Buffer,细胞密度约(0.25-1×107)cell/mL,分别加入5 μL Annexin V-FITC和5 μL PI混匀,避光室温反应15 min,加入400 μL Binding Buffer,流式细胞仪检测,FlowJo分析细胞凋亡比例。
1.2.8 统计学分析采用SPSS 16. 0统计学软件,计量资料用x±s表示,两组均数比较采用t检验,多组均数比较采用单因素方差分析。
2 结果 2.1 PCR扩增sGPC3、GPC3基因以测序正确的pMD20-GPC3质粒为模板,分别以P1、P2和P1、P3为引物,PCR扩增含有EcoR I和Xba I限制性内切酶位点大小约为1 740 bp的全长GPC3基因序列和大小约为1 680 bp的可溶性sGPC3基因序列。琼脂糖凝胶电泳结果如图 1所示,在1.6-1.8 kb之间,有清晰的特异性目的条带,大小与理论值相符。
|
| 图 1 PCR扩增sGPC3、GPC3基因电泳图 M:200bp DNA Ladder;1-4:P1、P2为引物扩增的sGPC3基因片段;5-8:P1、P3为引物扩增的GPC3基因片段 |
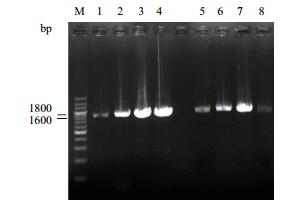
EcoR I和Xba I双酶切鉴定,得到2个片段(图 2),在1.6-1.8 kb之间的sGPC3或GPC3基因,在4.0-7.0 kb之间的pCDNA3.0-GFP载体片段,酶切结果与预期相符。测序结果与GenBank比较分析,目的基因无突变,pCDNA3.0-GFP-sGPC3和pCDNA3.0-GFP-GPC3重组表达载体构建成功。
|
| 图 2 重组表达载体酶切鉴定图 M1:200 bp DNA Ladder;M2:DL10000 DNA Marker;1-3:pCDNA3.0-GFP-sGPC3质粒、EcoR I单酶切、EcoR I和Xba I双酶切;4-6:pCDNA3.0-GFP-GPC3质粒、EcoR I单酶切、EcoR I和Xba I双酶切 |
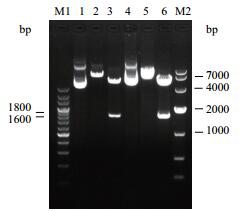
提取的总RNA用核酸蛋白检测仪和琼脂糖凝胶电泳检测,OD260/OD280≈1.95,有清晰的3条带(图 3-A),说明RNA纯度较高,完整性良好,可用于后续的RT-PCR。利用GPC3特异性引物RT-PCR,以GAPDH基因为内参,结果(图 3-B)显示,与转染空载细胞和野生型细胞相比,转染含sGPC3和GPC3重组质粒后的HCCLM3细胞,GPC3 mRNA含量显著增加(P < 0.05)。
|
| 图 3 细胞总RNA(A)和RT-PCR(B)电泳图 1:转染pcDNA3.0-GFP-sGPC3 HCCLM3细胞;2:转染pcDNA3.0-GFP-GPC3 HCCLM3细胞;3:转染pcDNA3.0-GFP HCCLM3细胞;4:野生型HCCLM3细胞 |
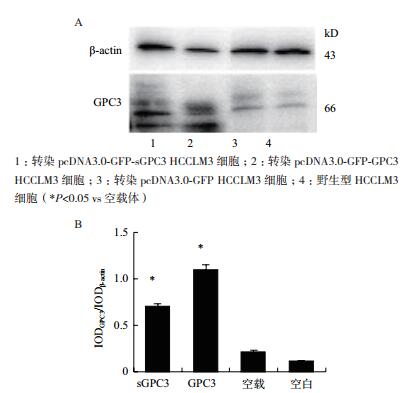
Western blot结果(图 4)显示,在约66 kD处有一个特异性条带。与转染空载细胞和野生型HCCLM3细胞相比,转染pcDNA3.0-GFP-sGPC3和pcDNA3.0-GFP-GPC3的HCCLM3细胞,GPC3/β-act-in蛋白条带IOD比值显著提高,说明sGPC3和GP-C3已在细胞中成功过表达。
|
| 图 4 Western Blot结果图(A)和Western blot条带IOD比值统计图(B) |
CCK-8法检测结果(图 5)显示,在24和36 h,过表达sGPC3和GPC3与转染空载细胞和野生型HCCLM3细胞相比,细胞增殖均明显受到抑制,其中过表达sGPC3对HCCLM3细胞的增殖抑制率较过表达GPC3的显著增高,具有统计学意义[(44.53±1.46% vs 25.58±1.87%)、(33.84±1.14)vs(20.52±1.87)%,均P < 0.05]。

|
| 图 5 CCK8法检测各组细胞的增殖情况(n=3,x±s,*P < 0.05 vs空载体) |
克隆形成实验结果(图 6)显示,过表达sGPC3和GPC3与转染空载体细胞和野生型HCCLM3细胞相比,细胞克隆形成率均明显降低[(20±3)%、(24±4)% vs(31±5.5)%、(34±6.5)%,P < 0.05]。结果表明,GPC3不仅抑制HCCLM3细胞的增殖,而且也影响其克隆形成能力,同时sGPC3更好地抑制细胞克隆形成。

|
| 图 6 各组细胞的单克隆形成情况 A:细胞克隆形成GIMSA染色结果;B:细胞克隆形成能力的统计(n=3,x±s,*P < 0.05 vs空载体) |
由细胞划痕法建立细胞迁移模型结果(图 7-A)可知,在划痕后48和96 h,转染sGPC3细胞比转染空载体和空白细胞愈合速度慢;而转染GPC3细胞比转染空载体的愈合速度慢。可初步推断,过表达sGPC3和GPC3可抑制HCCLM3高转移性肝癌细胞的迁移。为了更准确的评价过表达sGPC3和GPC3对HCCLM3细胞迁移的影响,进行Transwell实验,结果表明:与转染空载体细胞相比,转染sGPC3和GPC3细胞迁移到下腔的数量明显减少(图 7-B),转染sGPC3和GPC3迁移细胞数与转染空载体细胞相比,迁移率分别降低了36.04±2.30%和26.06±1.29%(图 7-C)。结果表明过表达sGPC3和GPC3能够抑制HCCLM3的迁移(P < 0.05)。

|
| 图 7 各组细胞迁移情况的比较 A:细胞划痕检测各组细胞的迁移情况;B:Transwell检测各组细胞的迁移情况;C:B结果中迁移细胞数的统计分析(n=3,x±s,*P < 0.05 vs空载体) |
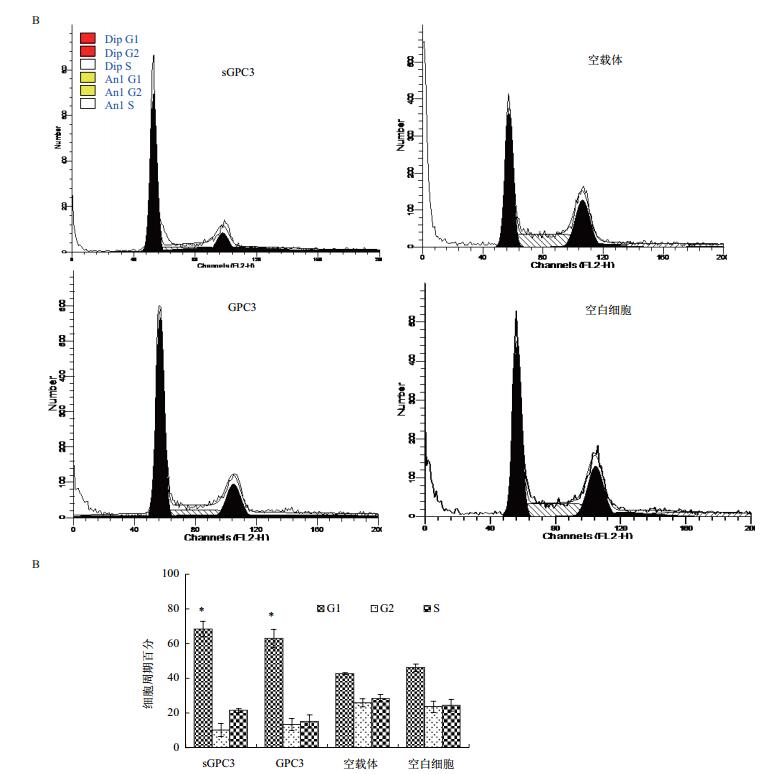
流式细胞术检测细胞周期结果(图 8-A)显示:转染空载体细胞和野生型HCCLM3细胞的G1期细胞所占比例分别为(42.53±0.43)%和(45.97±2.20)%,转染sGPC3和GPC3的细胞G1期所占比例分别为(68.22±4.36)%和(62.75±5.35)%,转染sGPC3和GPC3的肝癌细胞G1期细胞数均明显高于转染空载体和野生型HCCLM3细胞(P < 0.05),说明过表达sGPC3和GPC3都发生了G1期阻滞。
|
| 图 8 流式细胞仪检测各组细胞的周期分布 A:各组细胞的周期分布;B:各组细胞的各期分布统计(n=3,x±s,*P < 0.05 vs空载体) |
流式细胞术检测细胞凋亡结果(图 9)显示:转染空载体细胞和野生型HCCLM3细胞的凋亡率分别为(12.67±1.37)%和(11.98±1.66)%,转染sGPC3和GPC3的细胞凋亡率分别为(24.66±2.35)%和(17.99±1.82)%,转染sGPC3和GPC3均可促进HCCLM3高转移性肝癌细胞的细胞凋亡,其中转染sGPC3组的细胞凋亡率与转染GPC3比较,差异均有统计学意义(P < 0.05)。说明过表达sGPC3能更好的促进HCCLM3的凋亡。

|
| 图 9 流式细胞仪检测各组细胞的凋亡 A:各组细胞的凋亡情况;B:各组细胞的凋亡比例统计(n=3,x±s,*P < 0.05 vs空载体) |
磷脂酰肌醇蛋白聚糖3(Glypican-3,GPC3)基因包括1 740 bp的开放阅读框,编码具有580个氨基酸、大小为66 kD的蛋白。该蛋白核心由40 kD长的N端和30 kD大小的C端两部分组成,在C端有两个乙酰肝素多聚糖链(HS)。该蛋白在C端通过糖基磷脂酰肌醇(GPI)结合在细胞表面,在被转运至内质网之后,GPC3 N端(SS:1-24位氨基酸)和C端的的引导肽(S560)被切除,后者被磷脂酰肌醇替代,成为蛋白在细胞膜表面的锚定点。GPC3在肝癌组织中特异性高表达,与肝癌的发生、发展关系密切。上调GPC3的表达可阻断FGF2介导的信号通路,抑制肝癌细胞的增殖;另外,GPC3下调了纤连蛋白和I型胶原的表达,从而抑制肝癌细胞迁移和侵袭[14-15]。反义RNA阻断HepG2和Hep3B肝癌细胞内源性GPC3的表达,减少G1期细胞阻滞,促进肝癌细胞的生长[16]。表达缺乏GPI锚定位的GPC3(GPC3△GPI,sGPC3)可阻断Wnts信号,而抑制Wnt依赖性肝癌细胞的生长,促进细胞凋亡[11]。本研究以测序正确的pMD20-GPC3质粒为模版,PCR法获得大小1 680 bp无锚定结构的可溶性sGPC3(GPC3△GPI,M1-H559)基因序列和大小1 740 bp的有锚定结构的全长GPC3基因序列,并克隆到真核表达载体pcDNA3.0-GFP中,成功构建pCDNA3.0-GFP-sGPC3和pCDNA3.0-GFP-GPC3重组表达载体,经脂质体介导转染高转移性肝癌细胞HCCLM3后,过表达sGPC3/GPC3抑制HCCLM3肝癌细胞的增殖能力和克隆形成能力,迁移率显著下降,周期阻滞于G1期,细胞凋亡率增加。本研究结果与上述文献报道的一致。
另有研究表明,没有糖胺聚糖的GPC3核心蛋白能与Wnts结合形成复合物,或与Frizzled结合激活经典Wnt信号途径促进肝癌组织生长[6, 17]。GPC3蛋白通过N末端脯氨酸丰富区和IGF2和IGFIR结合,减少了IGFLR和下游信号分子ERK的磷酸化,刺激肝癌生长[7-8];另外,GPC3被siRNA干扰后或被GPC3 micorRNA和GPC3抗体靶向抑制后,不能激活经典Wnt信号途径,肝癌细胞的繁殖受到抑制[18-22]。本研究比较了过表达可溶性GPC3和能够锚定于细胞膜上的全长GPC3对HCCLM3肝癌细胞生物学行为的影响,结果发现,过表达可溶性GPC3对HCCLM3肝癌细胞的增殖能力和克隆形成能力的抑制作用明显强于全长GPC3;对HCCLM3肝癌细胞迁移、周期和凋亡的影响也具有显著性差异。上述研究提示GPC3在肝癌生物学行为作用中的复杂性,推测GPC3在肝细胞癌中的作用可能是多因素、多途径和多机制的,这可能与不同肿瘤细胞病理类型、表达GPC的水平有关。
4 结论本研究成功构建pCDNA3.0-GFP-sGPC3和pCDNA3.0-GFP-GPC3真核表达载体,并转染入高转移性肝癌细胞HCCLM3中,过表达sGPC3/GPC3均明显抑制细胞的增殖、克隆形成及迁移能力;同时sGPC3对细胞的抑制作用明显强于GPC3。
| [1] |
Iliescu L, Mindrut E, Grasu M, et al. Management of hepatocellular carcinoma -experience of a single center[J]. Chirurgia, 2014, 109(2): 204-207. |
| [2] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [3] |
Zheng J, Kuk D, Gonen M, et al. Actual 10-year survivors after resection of hepatocellular carcinoma[J]. Ann Surg Oncol, 2017, 24(5): 1358-1366. DOI:10.1245/s10434-016-5713-2 |
| [4] |
Andreou A, Vauthey JN, Cherqui D, et al. Improved long-term survival after major resection for hepatocellular carcinoma: a multicenter analysis based on a new definition of major hepatectomy[J]. J Gastrointest Surg, 2013, 17(1): 66-77. DOI:10.1007/s11605-012-2005-4 |
| [5] |
Li M, Choo B, Wong ZM, et al. Expression of OCI-5/glypican 3 during intestinal morphogenesis: regulation by cell shape in intestinal epithelial cells[J]. Exp Cell Res, 1997, 235: 3-12. DOI:10.1006/excr.1997.3629 |
| [6] |
Capurro MI, Xiang YY, Lobe C, Filmus J. Glypican-3 promotes the growth of hepatocellular carcinoma by stimulating canonical Wnt signaling[J]. Cancer Res, 2005, 65: 6245-6254. DOI:10.1158/0008-5472.CAN-04-4244 |
| [7] |
Cheng W, Tseng CJ, Lin TT, et al. Glypican-3-mediated oncogenesis involves the Insulin-like growth factor-signaling pathway[J]. Carcinogenesis, 2008, 29: 1319-1326. DOI:10.1093/carcin/bgn091 |
| [8] |
Filmus J, Capurro M. The role of glypican-3 in the regulation of body size and cancer[J]. Cell Cycle, 2008, 7: 2787-2790. DOI:10.4161/cc.7.18.6672 |
| [9] |
Sung YK, Hwang SY, Farooq M, et al. Growth promotion of HepG2 hepatoma cells by antisense-mediated knockdown of glypican-3 is independent of insulin-like growth factor 2 signaling[J]. Exp Mol Med, 2003, 35: 257-262. DOI:10.1038/emm.2003.34 |
| [10] |
Sakurai M, Shibata K, Umezu T, et al. Growth-suppressing function of glypican-3(GPC3)via insulin like growth factor Ⅱ(IGF-Ⅱ)signaling pathway in ovarian clear cell carcinoma cells[J]. Gynecol Oncol, 2010, 119: 332-336. DOI:10.1016/j.ygyno.2010.07.013 |
| [11] |
Sandra IZ, Mariana IC, Wen S, Jorge F. Soluble glypican 3 inhibits the growth of hepatocellular carcinoma in vitro and in vivo[J]. Int J Cancer, 2010, 126: 1291-1301. |
| [12] |
Zhou F, Shang W, Yu X, Tian J. Glypican-3: A promising biomarker for hepatocellular carcinoma diagnosis and treatment[J]. Med Res Rev, 2017. DOI:10.1002/med.21455 |
| [13] |
Haruyama Y, Kataoka H. Glypican-3 is a prognostic factor and an immunotherapeutic target in hepatocellular carcinoma[J]. World J Gastroenterol, 2016, 22(1): 275-283. DOI:10.3748/wjg.v22.i1.275 |
| [14] |
Kwack MH, Choi BY, Sung YK. Cellular changes resulting from forced expression of Glypican-3 in hepatocellular Carcinoma cells[J]. Mol Cells, 2006, 21(2): 224-228. |
| [15] |
Lai JP, Sandhu DS, Yu CR, et al. Sulfatase 2 up-regulates glypican 3, promotes fibroblast growth factor signaling, and decreases surv-ival in hepatocellular carcinoma[J]. Hepatology, 2008, 47(4): 1211-1222. DOI:10.1002/hep.22202 |
| [16] |
Farooq M, Hwang SY, Park MK, et al. Blocking endogenous glypican-3 expression releases Hep 3B cells from G1 arrest[J]. Mol Cells, 2003, 15: 356-360. |
| [17] |
Capurro M, Martin T, Shi W, Filmus J. Glypican-3 binds to Frizzled and plays a direct role in the stimulation of canonical Wnt signaling[J]. J Cell Sci, 2014, 127(7): 1565-1575. DOI:10.1242/jcs.140871 |
| [18] |
Sun CK, So SK. Suppression of glypican 3 inhibits growth of hepatocellular carcinoma cells through up-regulation of TGF-β2[J]. Neoplasia, 2011, 13(8): 735-747. DOI:10.1593/neo.11664 |
| [19] |
Cartier F, Indersie E, Lesjean S, et al. New tumor suppressor microRNAs target glypican-3 in human liver cancer[J]. Oncotarget, 2017, 8(25): 41211-41226. |
| [20] |
Gao W, Kim H, Feng M, et al. Inactivation of Wnt signaling by a human antibody that recognizes the heparan sulfate chains of glypican-3 for liver cancer therapy[J]. Hepatology, 2014, 60(2): 576-587. DOI:10.1002/hep.v60.2 |
| [21] |
Ikeda M, Ohkawa S, Okusaka T, et al. Japanese phase Ⅰ study of GC33, a humanized antibody against glypican-3 for advanced hepatocellular carcinoma[J]. Cancer Sci, 2014, 105(4): 455-462. DOI:10.1111/cas.2014.105.issue-4 |
| [22] |
阮健. RNA干扰GPC3基因对肝癌huh-7细胞的生物学行为的影响[D]. 广州: 南方医科大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-90023-2010240035.htm
|




