胃癌是严重威胁人类生命安全的十大恶性肿瘤之一,发病率与死亡率一直居高不下,并且呈现稳步增长趋势。世界癌症研究报告数据显示,2017年在美国胃癌的新增病例为28 000例,死亡病例为10 960例,分别占据十大肿瘤发病率第二、死亡率第一的位置[1]。中国面临的形势更严峻,据2015年统计预测新增胃癌病例约733 300例,新增死亡人数为610 200例[2]。然而,目前针对胃癌主要还是以手术切除为主,并给予放化疗辅助治疗。但是临床预后较差、发现晚,极大地降低了胃癌患者生存概率,其主要原因是缺乏胃癌早期诊断标志物,以及对胃癌发病机理缺乏充分的认识[3]。大量研究数据表明,癌症的发生发展是一个多因素参与的复杂过程,基因突变、缺失、表达失调导致细胞生长、迁移特性异常或紊乱是癌症发生发展的常见机制。同样,胃癌中关键分子及关键信号途径仍有待挖掘[4-5]。
研究表明,Wnt信号通路过度激活以及关键调节蛋白的改变与肿瘤的发生发展密切相关[6-8]。Wnt配体家族有19个成员,其中Wnt10A基因被报道促进肾细胞癌发生,发挥癌基因功能[9-10]。同时有研究表明,在胃癌细胞系和原发性胃癌组织中Wnt10A基因表达也增强[11]。而且TNFα和幽门螺杆菌感染均诱导Wnt10A基因表达上调。幽门螺杆菌是胃炎的元凶,并且会导致胃癌的形成[11],但Wnt10A基因在胃癌中的功能及分子机制尚无报道。
本研究通过基因干扰技术下调胃癌细胞AGS细胞中Wnt10A表达,检测AGS细胞增殖、迁移的改变,并以免疫印迹技术探索Wnt10A在胃癌发生、发展中参与调控的信号机制。
1 材料与方法 1.1 材料40例冰冻胃癌样本组织及对应癌旁组织来源于河北医科大学第一医院病理科。胃癌细胞系AGS、MGC-803、SGC-7901及对照细胞系GES购自中科院上海细胞库,细胞培养于DMEM培养基(含10%FBS)。
1.2 方法 1.2.1 siRNA合成与转染以在线软件设计并合成2条靶向Wnt10A基因编码区的siRNA片段(siWnt10A-1与siWnt10A-2),如表 1所示。参考Invitrogen公司Lipofectamine2000使用手册以脂质体转染法将siRNA片段与细胞共培养6 h,然后更换新鲜培养基继续培养细胞。
分组:siRNA对照组(NC组)、Wnt10A-siRNA-1组、抑制剂对照组(DMSO组)、LGK-974组、联用组(Wnt10A-siRNA-1/LGK-974组);其中LGK-974实验剂量为0.6 nmol/L。
准备96孔板,按照2 000个细胞/孔接种胃癌细胞,3个复孔/组,按照1.2.1方法转染siRNA片段,继续培养至120 h,每24 h取一组细胞弃上清并加入20 µL MTT试剂(5 mg/mL),继续孵育4 h,弃上清并加入200 µL DMSO试剂,振荡30 s,以酶标仪检测490 nm波长读值。计算细胞增殖率。
1.2.3 划痕实验准备6孔板,按照200 000个细胞/孔接种胃癌细胞,3个复孔/组,按照1.2.1方法转染siRNA片段,24 h后观察细胞融合度达到90%,以10 µL移液枪头制造1个划痕并以含2%FBS的DMEM培养基继续培养48 h。显微镜下观察细胞迁移情况,并分别在24 h、72 h两个时间点测量划痕距离(S24h、S72h),计算细胞迁移率,计算公式为migration rate=(S24h-S72h)/S24h。
1.2.4 Transwell实验取BD公司transwell小室(上室,孔径8 µm),按照20 000个细胞/孔接种siRNA处理过的胃癌细胞,3个复孔/组,将上室置于24孔板(下室)中,下室中加入500 µL含20%FBS的DMEM培养基。48 h后,取出上室,刮去上室内侧细胞,上室外侧细胞以0.1%结晶紫染色并以甲醇固定。显微镜下观察穿膜细胞数量并计数,评估细胞侵袭能力。
1.2.5 实时荧光定量PCR(qRT-PCR)参考Invitr-ogen公司的TRIZOL产品手册提取胃癌组织及细胞系中总RNA并以Promega公司的核酸酶处理RNA。以1 µg RNA为模板逆转录合成cDNA,取2 µL cDNA为模板,以SYBR Green方法进行qRT-PCR。以GAPDH为内参,按照2-△Ct方法计算目的基因相对含量。△Ct=Ct(目的基因)-Ct(GAPDH)。
1.2.6 免疫印迹实验以商业蛋白提取试剂盒提取细胞中总蛋白并以BCA方法定量。取15 µg总蛋白以10% SDS-PAGE电泳分离并以湿转染将目的蛋白转移至PVDF膜上,以第一抗体包括Wnt10A抗体(ab62051,Abcam)、DKK1(ab109416,Abcam)、TCF(ab69999,Abcam)、β-catenin(ab32572,Abcam)、cyclin D1(ab134175,Abcam)、GAPDH(ab9484,Abcam)孵育PVDF膜,4℃过夜,然后以相应第二抗体孵育PVDF膜,以ECL kit曝光检测目的基因表达量。
1.2.7 数据分析所有实验均至少重复3次,并表示为平均值±标准差(x±s)。Student’t检验用于评价各实验组之间是否具有显著差异。*P < 0.05表示具有显著差异。
2 结果 2.1 Wnt10A基因在胃癌细胞中高表达借助荧光定量PCR技术(qPCR)及免疫印迹技术(WB)分析发现,在多株胃癌细胞系中,Wnt10A基因表达明显强于正常胃上皮细胞GES-1。如图 1-A所示,在3株胃癌细胞系AGS、MGC-803、SGC-7901中Wnt10A基因的mRNA表达显著高于对照细胞GES-1,其中以AGS细胞中Wnt10A表达最强。而且在蛋白表达水平,Wnt10A基因在3株胃癌细胞系中表达也明显高于GES-1细胞中(图 1-B)。同时,以qPCR技术也发现在40例胃癌组织中Wnt10A基因表达也明显高于癌旁正常组织,平均表达水平增强约3倍(图 1-C)。因此,Wnt10A基因在胃癌发生、进展中可能有重要意义。
|
| 图 1 Wnt10A基因表达模式 A,B:在胃癌细胞系中Wnt10A基因在RNA水平与蛋白水平表达高于正常细胞系GES-1;C:Wnt10A基因在胃癌组织中表达量显著高于正常对照组织。*P < 0.05表明组间有显著差异,下同 |
如表 1,设计、合成2个siRNA片段即siWnt-10A-1余siWnt10A-2。然后,通过lipo2000将这2个siRNA片段分别导入AGS细胞中。共培养48 h后,通过qPCR与WB方法分析发现AGS细胞中Wnt10A基因在AGS细胞中被显著降低。如图 2所示,Wnt10A基因在mRNA与蛋白水平分别降低达60%与54%。因此,表明成功敲减胃癌细胞AGS中Wnt10A基因的表达。

|
| 图 2 Wnt10A基因被成功敲减 A:在RNA水平Wnt10A基因被成功下调;B:在蛋白水平Wnt10A基因被成功敲减 |
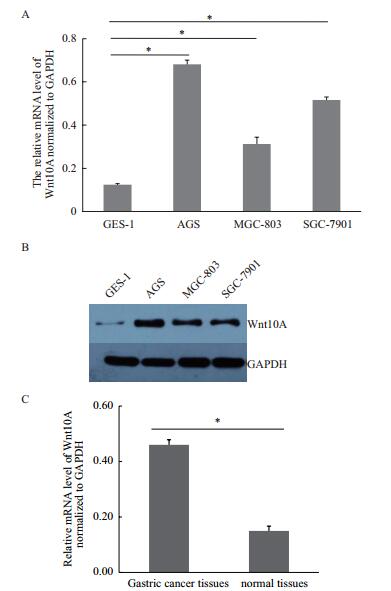
当降低Wnt10A基因表达后,发现AGS细胞增殖能力明显减弱。如图 3所示,转染siRNA片段后120 h,AGS细胞增殖率降低40%以上。这些数据表明Wnt10A基因对胃癌细胞生长有促进作用。
|
| 图 3 Wnt10A基因敲减阻滞AGS细胞生长 |
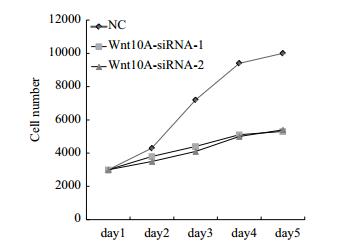
以划痕实验分析发现敲减Wnt10A基因表达后,AGS细胞的迁移率降低达40%(图 4-A与4-C)。同时在transwell实验中,AGS细胞侵袭能力也显著减弱,幅度达到70%以上(图 4-B与4-D)。因此,Wnt10A有利于胃癌细胞迁移及侵袭。
|
| 图 4 Wnt10A基因敲减抑制AGS细胞迁移及侵袭 A,C:划痕实验表明下调Wnt10A基因后细胞迁移能力下降;B,D:Transwell实验显示下调Wnt10A基因后48 h细胞侵袭能力减弱 |
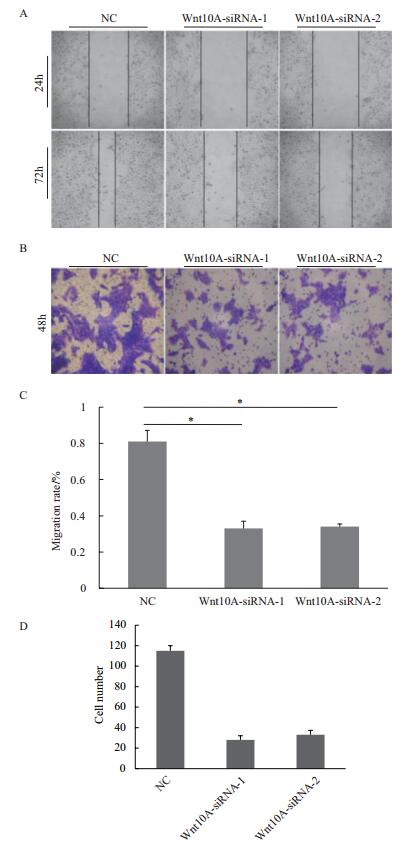
如图 5-A,敲减Wnt10A基因后,经典Wnt信号通路中的关键分子如β-catenin、Cyclin D1、TCF以及Myc基因表达量下调,而DKK1与GSK3β表达增强。该数据与以Wnt信号抑制剂LGK-974处理AGS细胞得到的结果一致,并且LGK-974与Wnt10A敲减之间无协调效应或叠加效应。如图 5-B,联用组LGK-974/ siWnt10A-1与单独组siWnt10A-1的AGS细胞增殖无显著差异(P < 0.05)。据此推断,在胃癌细胞中Wnt10A基因模拟调控Wnt/β-catenin/Myc信号活性。
|
| 图 5 Wnt10A基因调控Wnt/β-catenin信号 A:免疫印迹分析Wnt10A基因敲减后,Wnt/β-catenin信号途径关键分子表达变化(1:Wnt10A-siRNA-1;2:Wnt10A-siRNA-2);B:Wnt10A敲减与Wnt信号抑制剂LGK-974对细胞生长无协同效应(1:Wnt10A-siRNA-1;2:DMSO;3:LGK-974;4:Wnt10A-siRNA-1/GK-974) |
Wnt10A基因是Wnt信号配体家族成员之一,而大量研究数据表明Wnt信号通路对促进肿瘤细胞生长起重要的作用。因此推测Wnt10A基因在肿瘤进程中可能也发挥一定作用。借助qPCR技术,我们检测在胃癌组织样本中Wnt10A基因表达量显著高于癌旁正常组织。进一步发现在常见胃癌细胞系中Wnt10A基因在RNA及蛋白水平也显著高于正常胃上皮细胞。这些数据进一步支持我们的推测,即Wnt10A在胃癌发生、发展中有临床意义。已有研究报道表明Wnt10A在食道癌、淋巴瘤、结直肠癌组织中也呈高水平表达[9, 12-13]。同时有报道证实Wnt10A基因在肾癌的发生、进展过程中发挥促癌基因的作用[10]。肿瘤具有两大显著特征即无限制生长与侵袭能力强[14]。在本研究中,我们发现Wnt10A基因下调后,胃癌细胞的增殖能力、侵袭及迁移能力均大幅度下降。这表明Wnt10A基因的高表达促进胃癌细胞增殖、迁移及侵袭行为。因此,体外功能实验与组织表达模式提示Wnt10A在胃癌中也发挥促癌基因的功能。
Wnt信号家族已发现19个成员,大量研究表明Wnt分子表达增强或功能异常在各种肿瘤中均发挥重要作用。在Wnt/β-catenin信号途径中,Wnt分子结合相应受体激活Dishevelled蛋白,抑制GSK3β导致β-catenin分子集聚及核内移,进而结合TCF/LEF因子,促进下游靶基因表达。促进细胞生长、增殖[15]。
在本研究中,我们发现Wnt10A基因下调后,经典Wnt信号通路中的关键分子包括β-catenin、Cyclin D、TCF与LEF分子表达显著降低。而Wnt10A-受体结合率降低导致Dishevelled蛋白活性减弱,从而解除对GSK3β的抑制作用,增强GSK3β表达。因为GSK3β分子可促进β-catenin的磷酸化水平升高,进一步降解β-catenin,从而抑制Wnt信号激活。同时DKK1基因表达量也显著增强。DKK1可结合受体LRP5/6,促进膜受体内吞作用,减少膜上受体占有率。而LRP5/6受体对Wnt配体结合对应Frizzled受体并激活下游信号通路发挥关键作用[17]。因此DKK1表达增强必将阻断Wnt信号激活。
当我们以Wnt信号的小分子抑制剂LGK-974处理AGS细胞发现LGK-974单独作用、si-Wnt10A单独作用、LGK-974与si-Wnt10A联合作用均可以显著抑制AGS细胞生长,但是联合作用组与单独处理组无显著差异,表明si-Wnt10A与LGK-974之间无显著叠加效应或协同效应。LGK-974是经典Wnt/β-catenin信号通路阻断剂,可特异性结合Wnt下游porcn蛋白,抑制Wnt信号。这些数据表明在胃癌细胞中Wnt10A基因通过模拟调控经典Wnt/β-catenin信号通路促进胃癌细胞生长与迁移。Myc基因是一个原癌基因,大量研究表明Myc基因在肿瘤组织及肿瘤细胞中表达量明显增强,肿瘤细胞增殖能力也显著提高[16-17]。而且Myc基因参与肿瘤细胞代谢,有利于细胞生长[17]。在本研究中,我们发现敲减Wnt10A基因后,Myc基因表达量显著降低。而体外细胞功能实验已经证明Wnt10A基因下调后,胃癌细胞增殖能力明显降低。所以,在分子水平和细胞水平均证明Myc基因对Wnt10A基因的功能非常关键。基于以上数据分析,我们提出在胃癌细胞中,Wnt10A基因通过模拟调控Wnt/β-catenin/Myc信号途径发挥促进癌细胞生长及迁移的作用。
4 结论Wnt10A基因在胃癌细胞系及组织中均呈高水平表达,并且Wnt10A通过模拟激活Wnt/β-catenin/Myc信号通路促进胃癌细胞增殖与迁移,发挥促癌基因的功能。
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67: 7-30. DOI:10.3322/caac.21387 |
| [2] |
Chen WQ, Zheng RS, Zhang SW, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66: 115-132. DOI:10.3322/caac.21338 |
| [3] |
Cervantes A, Roda D, Tarazona N, et al. Current questions for the treatment of advanced gastric cancer[J]. Cancer Treat Rev, 2013, 39(1): 60-67. DOI:10.1016/j.ctrv.2012.09.007 |
| [4] |
王思萌, 高柳村, 帖君, 等. Cetuximab抑制胃癌SGC7901/ADR细胞的增殖并增加其化疗敏感性[J]. 现代生物医学进展, 2013, 13(12): 2253-2256. |
| [5] |
Kühl SJ, Kühl M. On the role of Wnt/β-catenin signaling in stem cells[J]. Biochim Biophys Acta, 2013, 1830(2): 2297-2306. DOI:10.1016/j.bbagen.2012.08.010 |
| [6] |
Katoh M. WNT/PCP signaling pathway and human cancer(review)[J]. Oncol Rep, 2005, 14(6): 1583-1588. |
| [7] |
Clevers H, Nusse R. Wnt/β-catenin signaling and disease[J]. Cell, 2012, 149(6): 1192-1205. DOI:10.1016/j.cell.2012.05.012 |
| [8] |
Klaus A, Birchmeier W. Wnt signalling and its impact on development and cancer[J]. Nat Rev Cancer, 2008, 8(5): 387-398. DOI:10.1038/nrc2389 |
| [9] |
Long A, Giroux V, Whelan KA, et al. WNT10A promotes an invasive and self-renewing phenotype in esophageal squamous cell carcinoma[J]. Carcinogenesis, 2015, 36(5): 598-606. DOI:10.1093/carcin/bgv025 |
| [10] |
Hsu RJ, Ho JY, Cha TL, et al. WNT10A plays an oncogenic Role in Renal Cell Carcinoma by activation WNT/β-catenin pathway[J]. PLoS One, 2001, 7(10): e47649. |
| [11] |
Kirikoshi H, Sekihara H, Katoh M. Up-regulation of Wntl0A by tumor necrosis factor alpha and Helicobacter pylori in gastric cancer[J]. Int J Oncol, 2001, 19(3): 533-536. |
| [12] |
Kirikoshi H, Inoue S, Sekihara H, et al. Expression of WNT10A in human cancer[J]. Int J Oncol, 2001, 19: 997-1001. |
| [13] |
Kirikoshi H, Sekihara H, Katoh M. WNT10A and WNT6, clustered in human chromosome 2q35 region with head-to-tail manner, are strongly coexpressed in SW480 cells[J]. Biochem Bioph Res Co, 2001, 283: 798-805. DOI:10.1006/bbrc.2001.4855 |
| [14] |
Hanahan D, Weinberg RA. Hallmarks of Cancer: The next generation[J]. Cell, 2011, 144(5): 646-674. DOI:10.1016/j.cell.2011.02.013 |
| [15] |
Delannay D, Cortay V, Patti D, et al. Mimtic spindle asymmetry: a Wnt/PCP regulated mechanism generating asymmetrical division in cortical precursors[J]. Cell Rep, 2014, 6(2): 400-414. DOI:10.1016/j.celrep.2013.12.026 |
| [16] |
Hsieh AL, Dang CV. MYC, Metabolic Synthetic Lethality, and Cancer[J]. Recent Results Cancer Res, 2016, 207: 73-91. DOI:10.1007/978-3-319-42118-6 |
| [17] |
Tarrado-Castellarnau M, de Atauri P, Cascante M. Oncogenic regulation of tumor metabolic reprogramming[J]. Oncotarget, 2016, 7(38): 62726-62753. DOI:10.18632/oncotarget.v7i38 |




