钼因具有耐高温、不易膨胀和软化、导热性好等优点,广泛应用于钢铁、超合金和不锈钢生产中[1-2]。尽管我国钼矿储量大、类型多,但品位较低,选冶较困难,因而需要探索高效的选冶方法[1, 3]。此外,含钼废料、含钼废催化剂以及含钼污泥等也需要无害化处理。
生物浸出是利用微生物能够通过多种途径将固体物质中的有价金属转化为溶液中的离子来获取金属的一种提取技术。它与传统工艺相比,具有污染小、成本低、对资源利用率高等优点,是处理低品位矿、复杂矿及环境污染物的新方法。目前,生物浸出已在铜、金、铀等金属硫化矿中得到广泛应用,但钼矿生物浸出的工业应用尚未成功[4-9]。钼矿生物浸出率不高的关键问题之一是目前所用菌种对钼离子的金属抗性较差[1]。为了筛选对金属离子、特别是钼离子抗性较强的菌种,本研究测定了Mo6+、Cu2+和Zn2+对中等嗜热的喜温嗜酸硫杆菌(Acidithiobacillus caldus)和氧化亚铁微螺菌(Leptospirillum ferriphilum)混合菌活性的影响。
1 材料与方法 1.1 材料试剂:FeSO4·7H2O、升华硫、K2Cr2O7、Na2MoO4·2H2O、CuSO4·5H2O、ZnSO4·7H2O,均为分析纯;蒸馏水,自制。
仪器:FA2004型电子天平;THZ-98A恒温振荡箱;TG16-WS台式高速离心机;PHS-3E型酸度计;XSZ-4G型光学双筒显微镜;SW-CG-1A单人净化工作台;DHG-9240A型电热恒温鼓风干燥箱。
菌株:氧化亚铁微螺菌与喜温嗜酸硫杆菌均来自中南大学生物实验室。自制无铁9K液体培养基成分,见表 1。
取18只三角瓶,分为6组,每组分别加入90 mL含不同浓度金属离子的无铁9K培养基(每种浓度重复3次),调节培养基pH为2.0,再分别依次加入10 g FeSO4·7H2O、1 g S和10 mL菌种(菌液浓度约为3.0×107个/mL),恒温振荡培养,转速150 r/min,温度45℃。每隔24 h测定培养液pH值、Fe2+氧化率和细菌个数。实验重复2次,取平均值。
pH值测定采用PHS-3E型酸度计;Fe2+氧化速率测定采用重铬酸钾滴定法;细菌计数采用血球计数法。
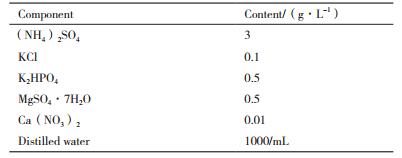
2 结果 2.1 金属离子浓度对细菌生长的影响 2.1.1 钼离子浓度对细菌生长的影响由图 1-A可知,当钼离子浓度为0.2 g/L和0.4 g/L时,细菌的生长与对照组几乎一致,细菌生长整体符合一般微生物生长规律,即调整期、对数期和稳定期,说明钼离子浓度在细菌可承受范围之内,对细菌影响不大。当钼离子浓度为0.5 g/L时,细菌的生长繁殖能力受到一定影响,当钼离子浓度为0.6 g/L时,细菌的生长繁殖能力受到明显影响,当钼离子浓度为0.8 g/L和1 g/L时,细菌几乎不生长,说明过高的钼离子浓度对细菌产生了很大的毒性,抑制了细菌的生长繁殖。该菌种对钼离子的耐受浓度为0.6 g/L。
|
| 图 1 金属离子(A:Mo,B:Cu,C:Zn)浓度对细菌生长的影响 |
由图 1-B可知,当铜离子浓度为10 g/L时,细菌个数的增长明显低于对照,说明此时的铜离子浓度已经对细菌产生了毒性,但毒性较小,细菌生长仍能保持较高水平;而铜离子浓度大于15 g/L时,细菌个数增长缓慢,但是直到铜离子浓度30 g/L时,仍然有少量细菌繁殖,说明此浓度下铜离子对细菌产生了很强的毒性,但是不能完全抑制细菌生长繁殖。氧化亚铁微螺菌和喜温嗜酸硫杆菌混合菌对铜离子的耐受浓度为10 g/L。
2.1.3 锌离子浓度对细菌生长的影响由图 1-C可知,在10 g/L、20 g/L锌离子的浓度下,细菌个数与对照几乎一致,30 g/L的锌离子浓度影响了细菌的生长,而在50 g/L的锌离子浓度下,细菌几乎不增长,说明50 g/L的锌离子浓度对细菌产生了严重毒性。氧化亚铁微螺菌和喜温嗜酸硫杆菌耐受的锌离子浓度为30 g/L。
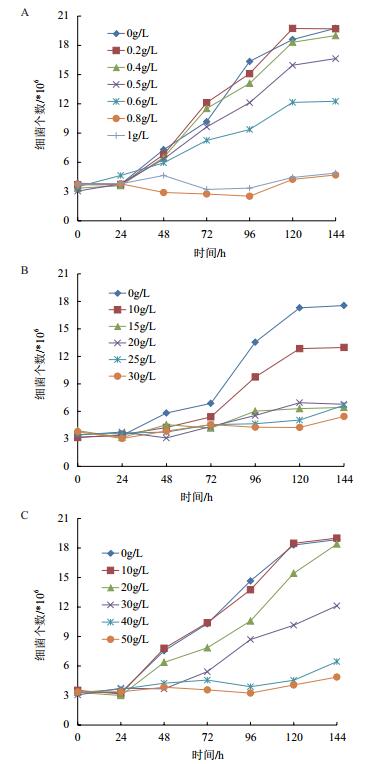
2.2 金属离子浓度对Fe2+氧化率的影响 2.2.1 细菌氧化Fe2+的能力为了解氧化亚铁微螺菌氧化Fe2+的能力,设置了有菌和无菌的对照试验,其他条件参数相同,试验结果如图 2所示。在96 h后,有菌组Fe2+的氧化率达100%,而无菌组Fe2+氧化率仅为20%左右。
|
| 图 2 有菌和无菌条件下Fe2+的氧化率 |
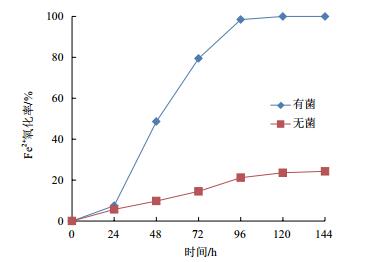
由图 3-A可知,钼离子浓度为0.2 g/L和0.4 g/L时,Fe2+氧化率与对照一致,能够达到100%;钼离子浓度为0.5 g/L时,Fe2+的氧化率能够达到80%,而钼离子浓度为0.6 g/L时,Fe2+的氧化率达到56%;大于0.8 g/L钼离子浓度下的细菌,Fe2+氧化率仅为20%左右,与无菌的自然氧化状态下的Fe2+氧化率相似,说明当钼离子浓度为0.2 g/L和0.4 g/L时,细菌的活性没有受到影响。当钼离子浓度为0.6 g/L时,钼离子对细菌产生了毒性,但毒性较小,细菌通过调节自身的代谢,活性仍能保持一定的水平,当钼离子浓度大于0.8 g/L时,对细菌有强烈的抑制作用,细菌活性几乎丧失,因此,氧化亚铁微螺菌耐受钼离子浓度为0.6 g/L。

|
| 图 3 金属离子(A:Mo;B:Cu;C:Zn)浓度对Fe2+氧化率的影响 |
由图 3-B可知,经过1个周期的培养,当铜离子浓度为10 g/L时,Fe2+的氧化率为63%,而在15 g/L、20 g/L、25 g/L和30 g/L的铜离子浓度下,Fe2+的氧化率仅在20%左右,说明大于15 g/L的铜离子浓度抑制了氧化亚铁微螺菌的活性,使细菌几乎失去了氧化Fe2+的能力。氧化亚铁微螺菌耐受的铜离子浓度为10 g/L。
2.2.4 锌离子浓度对Fe2+氧化率的影响由图 3-C可知,在10 g/L和20 g/L的锌离子浓度下,Fe2+氧化率能够达到100%;30 g/L的锌离子浓度对Fe2+氧化率有一定的影响,而40 g/L和50 g/L的锌离子浓度对细菌活性产生了强烈的抑制作用,Fe2+的氧化率小于30%。受试菌能够耐受的锌离子浓度为30 g/L。
2.3 金属离子浓度对培养液pH值的影响喜温嗜酸硫杆菌能够将S氧化为H2SO4,使培养液pH值下降,所以测定培养液pH值的变化,可以得知金属离子浓度对喜温嗜酸硫杆菌活性的影响。
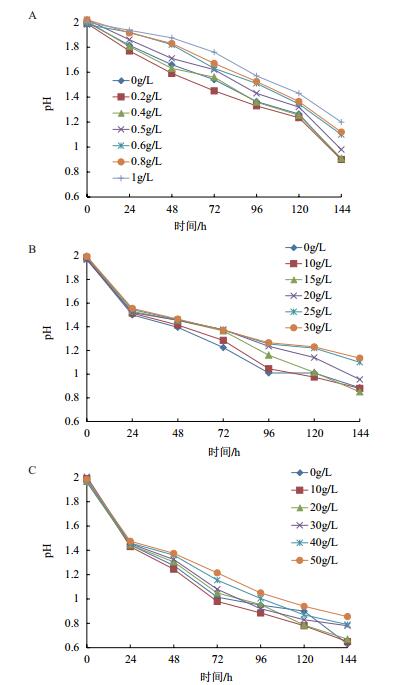
2.3.1 钼离子浓度对培养液pH值的影响由图 4-A可知,经过6 d的培养,0.2 g/L和0.4 g/L的钼离子浓度对细菌几乎没有影响,与对照相似,培养液pH值降到了pH1.0以下;0.6 g/L的钼离子浓度条件下,培养液pH值降到了pH1.1,说明受试菌的活性还很高;值得注意的是,在1.0 g/L的钼离子浓度条件下,培养液pH值仍然降到了pH1.2。
|
| 图 4 金属离子(A:Mo;B:Cu;C:Zn)浓度对培养液pH值的影响 |
由图 4-B可知,在10 g/L和15 g/L的铜离子浓度下,培养114 h后培养液pH值与对照相似,说明10 g/L和15 g/L的铜离子浓度没有影响喜温嗜酸硫杆菌的活性;在20 g/L的铜离子浓度下,培养液pH值仍然低于pH1.0;25 g/L和30 g/L铜离子浓度下,培养液pH值明显高于对照,但是也下降到pH1.2以下。
2.3.3 锌离子浓度对培养液pH值的影响由图 4-C可知,即使在50 g/L的锌离子浓度下,培养液pH值也降低到了pH1.0以下。
3 讨论金属离子能够使蛋白质(如酶)变性,破坏正常的生理活动,导致生命有机体中毒甚至死亡。采用生物技术处理金属矿物或回收固体废物中的重金属时,随着生物浸出的进行,浸出液中的金属离子浓度会不断升高,微生物的生存压力越来越大,导致微生物活性下降,甚至失活。所以,筛选金属离子耐受能力强的菌种是提高生物浸出效率的关键环节。本研究中钼离子浓度范围选取0-1 g/L,铜离子浓度范围选取0-30 g/L,锌离子浓度范围选取0-50 g/L[1, 7, 10-13]。本研究所用菌种对钼离子的耐受浓度为0.6 g/L。吉兆宁等[10]用嗜中温细菌浸出以辉钼矿为主的低品位原生硫化矿发现:当钼离子浓度为0.15 g/L时,细菌就几乎不生长。与前人的研究相比,本研究选用的中等嗜热菌的耐钼能力更强,同时对铜、锌也有很高的耐受性[7-8, 10]。
生物浸矿的机理在于细菌能够将浸出体系中的Fe2+氧化为Fe3+,将低价硫氧化为高价硫,Fe3+和H+具有强氧化作用,对硫化矿物进一步氧化,达到浸出目标金属的目的,所以细菌氧化Fe2+的能力和产酸能力能够反映其浸矿效率。本研究中受试菌种为氧化亚铁微螺菌和喜温嗜酸硫杆菌混合菌,其中氧化亚铁微螺菌能够将Fe2+氧化成Fe3+,喜温嗜酸硫杆菌能够将低价硫氧化为高价硫。在培养96 h后,有菌组Fe2+的氧化率达100%,而无菌组Fe2+氧化率仅为20%左右,说明氧化亚铁微螺菌有很强的Fe2+氧化能力。Pradhan等[11]研究发现,当钼离子浓度为0.04 g/L时,中温浸矿菌嗜酸氧化亚铁硫杆菌的Fe2+氧化活性几乎被完全抑制,其对钼离子的耐受浓度小于0.03 g/L。Zamani等[12]从伊朗Sarchesh-meh矿酸性矿坑水分离到的嗜酸氧化亚铁硫杆菌能耐受0.25 g/L的钼离子浓度。Olson等[13]的研究结果表明,在0.097 g/L钼离子浓度条件下,嗜中温菌失去了氧化Fe2+的能力。与上述研究相比,本研究选用的中等嗜热的氧化亚铁微螺菌在正常铁离子浓度范围内对金属钼的耐受浓度为0.6 g/L,耐受能力更强。此外,在1.0 g/L的钼离子浓度条件下,培养液pH值仍然降到了pH 1.2;在30 g/L铜离子浓度下,培养液pH值下降到pH1.2以下;在50 g/L的锌离子浓度下,培养液pH值降低到了pH 1.0以下。上述结果说明,即使在高浓度金属离子作用下,喜温嗜酸硫杆菌也没有完全失去氧化S的能力。参考图 3的结果,说明高浓度的金属离子对氧化亚铁微螺菌活性有强烈的抑制作用,但是对喜温嗜酸硫杆菌活性的影响有限,喜温嗜酸硫杆菌比氧化亚铁微螺菌能耐受更高的金属离子浓度。
4 结论通过金属离子耐受试验,确定Mo6+、Cu2+和Zn2+对中等嗜热混合菌(喜温嗜酸硫杆菌和氧化亚铁微螺菌)的耐受浓度分别为 < 0.6 g/L、< 10 g/L和 < 30 g/L。喜温嗜酸硫杆菌对金属离子的耐受能力高于氧化亚铁微螺菌。本研究所用混合菌对钼离子的耐受力达到0.6 g/L,说明该菌种有很强的钼抗性,适于含钼硫化矿、含钼废料及含钼污泥等的生物浸出。
| [1] |
黄明清, 王贻明, 杨保华, 等. 辉钼矿生物浸出研究进展[J]. 中国钼业, 2011, 35(4): 14-17. |
| [2] |
贾红秀, 高丽梅, 姜威. 钼市场30年回顾与展望[J]. 中国钼业, 2006, 30(1): 42-47. |
| [3] |
吕发奎. 辉钼矿与难选钼矿的柱式高效分选工艺研究[D]. 徐州: 中国矿业大学, 2010: 22. http://cdmd.cnki.com.cn/Article/CDMD-10290-2010280093.htm
|
| [4] |
杨显万, 沈庆峰, 郭玉霞. 微生物湿法冶金[M]. 北京: 冶金工业出版社, 2003, 123-125.
|
| [5] |
Dew DW, Buuren CV, Mcewan K, et al. Bioleaching of base metal sulphide concentrates: A comparison of mesophile and thermophile bacterial cultures[J]. Process Metallurgy, 1999, 9(99): 229-238. |
| [6] |
Klaus B. Bioleaching: Metal solubilization by microorganisms[J]. FEMS Microbiology Reviews, 1997, 20: 591-604. DOI:10.1111/j.1574-6976.1997.tb00340.x |
| [7] |
石绍渊, 方兆衍. 氧化亚铁硫杆菌与中度嗜热铁氧化菌浸出铁闪锌矿的比较[J]. 过程工程学报, 2005, 5(4): 384-388. |
| [8] |
谢海云, 陆建生, 蓝卓越, 等. 中等嗜热菌浸出高砷铜精矿研究[J]. 昆明理工大学学报:理工版, 2010, 01: 24-28. |
| [9] |
王有团, 李广悦, 刘玉龙, 等. JX嗜酸异养菌与氧化亚铁硫杆菌联合浸铀的研究[J]. 有色金属(冶炼部分), 2010(2): 42-45. |
| [10] |
吉兆宁, 余斌, 刘坚, 等. 金堆城低品位钼矿石可浸性研究[J]. 有色金属(矿山部分), 2002, 54(5): 15-18, 26. |
| [11] |
Pradhan D, Ahn JG, Kim DJ, et al. Effect of Ni2+, V4+ and Mo6+ concentration on iron oxidation by Acidithiobacillus ferrooxidans[J]. Korean Journal of Chemical Engineering, 2009, 26(3): 736-741. DOI:10.1007/s11814-009-0123-9 |
| [12] |
Zamani MAA, Hiroyoshi N, Tsunekawa M, et al. Bioleaching of sarcheshmeh molybdenum concentrate for extraction of rhenium[J]. Hydrometallurgy, 2005, 80: 23-31. DOI:10.1016/j.hydromet.2005.06.016 |
| [13] |
Olson GJ, Clark TR. Bioleaching of molybdenite[J]. Hydrometallurgy, 2008, 93: 10-15. DOI:10.1016/j.hydromet.2008.02.013 |