2. 上海海洋大学食品学院 上海水产品加工及贮藏工程技术研究中心,上海 201306;
3. 上海邦成生物工程有限公司,上海 201506
2. College of Food Science and Technology, Shanghai Ocean University, Shanghai Engineering Research Center of Aquatic-Product Processing & Preservation, Shanghai 201306;
3. Shanghai Bangcheng Biotechnology Co. Ltd., Shanghai 201506
近年来食品安全事件频发,其中由微生物引起的食品腐败和食源性疾病占很大一部分比例,化学防腐剂的添加可有效抑制食品中的腐败微生物,但防腐剂的滥用又造成了新的食品安全问题,因此寻找安全无毒副作用的天然食品防腐剂显得尤为重要。乳酸菌细菌素是由乳酸菌通过核糖体合成机制,在代谢过程产生的一类具有抑菌活性的前体多肽或多肽,通常乳酸菌对其自身所产细菌素具有免疫性[1-2]。因细菌素对人体无危害,可被胃肠道内蛋白酶降解消化,具有作为食品生物防腐剂的潜在应用价值[3-4]。乳酸菌细菌素可分为4大类:第一类被称为羊毛硫细菌素,是一类小分子的修饰肽;第二类是小分子热稳定肽,其代表为乳酸链球菌产生的乳酸链球菌素Nisin,已在包括我国在内的许多国家获得许可并在食品工业中推广应用[5];第三类是被称为溶菌素的大分子热不稳定蛋白;第四类是复合型的大分子复合物。其中第二类细菌素又可分为3个亚类,其中的IIa类是类片球菌细菌素,主要由戊糖片球菌、乳酸片球菌、小片球菌产生。这类细菌素相比于Nisin在pH6.0时就有90%以上的活性丧失的特点,其性质更稳定[6],抑菌谱较广,对单增李斯特菌的抑制作用尤为明显[7-8],在食品防腐保鲜领域中具有更广泛的应用前景。
类片球菌素中的片球菌素PA-1是目前继Nisin之后第二个被用于商业开发的细菌素[9],其相关基因是大小为9.4 kb的质粒pSRQ11,由4个基因簇构成一个操纵子,分别为pedA,pedB,pedC,pedD基因,pedA基因为结构基因,编码62个氨基酸的PA-1前体,其成熟且有活性的片球菌素是由第19-62个氨基酸组成的44个氨基酸残基和2个二硫键组成。其余3个基因分别为免疫基因、分泌基因、加工基因,它们不涉及片球菌素的产生[10]。天然菌株片球菌素的表达量低,不易纯化,难以实现产业化,化学合成法虽然能够生产足够量的细菌素,但成本高、活性不稳定[11]。采用基因工程技术将片球菌素基因克隆到细菌等宿主内进行异源高效表达是近年来细菌素领域的研究热点。如Moon等[12]在E.coli内成功表达了无活性的His-tag-仓鼠二氢叶酸还原酶-乳酸片球菌素PA-1,纯化后的融合蛋白经酶切后恢复抑菌活性;刘珊娜[11]和陈信全等[13]分别在E. coli BL21(DE3)和E. coli Rosetta(DE3)内实现了片球菌素PA-1的异源融合表达;韩烨等[14]也成功实现了乳酸片球菌素pedA基因在E.coli体内的表达。以真菌为宿主异源表达细菌素近来也有报道,van Reenen等[15]利用酿酒酵母表达Plantaricin 423,其工程菌表现出了抑菌活性;Beaulieu等[16]在毕赤酵母中也实现了无生物活性的片球菌素的高效表达。
本实验室前期从内蒙古干酪中筛选出一株戊糖片球菌C-2-1菌株,经证实该菌株能产生片球菌素[6]。本研究以此戊糖片球菌C-2-1菌株的总DNA为模板,设计引物扩增片球菌素PA-1成熟肽的结构基因pedA,构建pET28a-pedA重组质粒,在E.coli细胞内表达重组片球菌素PA-1,利用李斯特氏菌抑菌活性检验纯化后获得的重组片球菌素PA-1,运用生物信息学工具分析了重组蛋白的理化特性和结构信息,以期为片球菌素PA-1的体外高效表达和后期在食品中的应用奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌株与质粒戊糖片球菌C-2-1(Pediococcus pentosaceus C-2-1)由本实验室自行分离获得,表达载体pET-28a(+)、大肠杆菌Top10、BL21(DE3)、指示菌单增李斯特菌(L. monocytogenes ATCC19114)均由本实验室保藏。
1.1.2 试剂与培养基DNA聚合酶、T4 DNA连接酶购自北京全式金生物技术有限公司;限制性内切酶、质粒提取试剂盒、琼脂糖胶回收试剂盒、Ni-NTA Agarose、卡那霉素、Tris、异丙基-β-D-硫代半乳糖甘(IPTG)、X-Gal、琼脂糖、溶菌酶等均购自上海生工生物工程有限公司;DNA marker、蛋白marker购自中科瑞泰生物科技有限公司;胰蛋白胨、酵母粉购自OXOID公司,氯化钠、甘油、吐温-80等购自国药。LB液体培养基(g/L):胰蛋白胨10.0、酵母粉5.0、氯化钠10.0,121℃灭菌15 min,用于大肠杆菌的培养;MRS培养基(g/L):葡萄糖20.0,蛋白胨10.0,酵母粉10.0,牛肉膏5.0,磷酸氢二钾2.0,柠檬酸铵2.0,无水乙酸钠5.0,七水硫酸镁0.58,水合硫酸锰0.25,吐温-80 1.0,pH 6.2-6.6,121℃灭菌15 min,用于戊糖片球菌C-2-1的培养;TSB-YE液体培养基(g/L):胰蛋白胨17.0,大豆蛋白胨3.0,酵母粉6.0,氯化钠5.0,磷酸氢二钾2.5,葡萄糖2.5,调pH 7.3±0.1,121℃灭菌15 min。TSB-YE固体培养基(g/L):配方同上,加入琼脂粉1.0%。用于指示菌单增李斯特菌的培养。
1.2 方法 1.2.1 引物设计及基因扩增根据GenBank中上传的可产片球菌素细菌的基因进行对比,找到编码片球菌素PA-1的pedA结构基因的全序列(GenBank登录号:AY083244.3),设计正向引物pedA-F:5'-CATGCCATGGAAAAAATTGAAAAATTAACTGAAAAAGAA-3'(划线部分为Nco I酶切位点,前面为保护碱基和启动子)。反向引物pedA-R:5'-CCCAAGCTTCTAGTGATGATGGTGATGATGGCATTTATGATTACCTTGATGTCCA-3'(划线部分为Hind Ⅲ酶切位点,前面为保护碱基,后面加有His标签),由生工生物工程(上海)有限公司合成。以戊糖片球菌C-2-1总DNA为模板,设计引物进行PCR扩增。PCR反应条件为:95℃预变性10 min;95℃变性30 S,55℃退火30 S,72℃延伸45 S,循环30次;72℃后延伸10 min。PCR产物以1.5%的琼脂糖凝胶电泳进行检测,切下凝胶上目的条带后,用DNA回收试剂盒回收纯化。
1.2.2 重组质粒pET28a-pedA的构建将回收的PCR产物和pET-28a(+)质粒用限制性内切酶Nco I和Hind Ⅲ双酶切,回收酶切产物,利用T4 DNA连接酶将双酶切后的pedA基因和pET-28a(+)质粒进行连接,连接产物转化至Top10大肠杆菌感受态细胞,在含有卡那霉素抗性的LB平板中筛选阳性转化子。挑出单克隆接种LB液体培养基培养,提取质粒,将质粒用Nco I和Hind Ⅲ双酶切鉴定,鉴定正确后送至上海生工公司进行DNA测序。
1.2.3 重组球菌素PA-1的诱导表达将测序正确的重组质粒pET28a-pedA转化到大肠杆菌BL21(DE3)中,挑取单菌落于含卡那霉素(终浓度50 μg/mL)的LB培养基中,37℃、200 r/min摇床培养至对数生长期(OD600nm=0.6),加入终浓度1 mmol/L IPTG,30℃振荡培养5 h,4℃离心收集细胞并洗涤后,加入细胞裂解液(终浓度为50 mg/mL)和溶菌酶(终浓度为1 mg/mL)。冰浴超声裂解细胞,高速离心后分别取上清和沉淀进行Tricine-SDS-PAGE电泳分析,检测重组蛋白的表达形式,收集上清和沉淀保存备用。
1.2.4 重组球菌素PA-1蛋白的纯化取1 000 μL的Ni-NTA His-Bind树脂混合液加入空纯化柱中,用蒸馏水重悬珠子,待水从纯化柱下方流出后,用Binding buffer(NaH2PO4 50 mmol/L,NaCl 500 mmol/L,咪唑10 mmol/L,最终调pH为8.0)重悬,重复2次,备用;将离心得到的细胞破碎上清加入含有琼脂糖珠子的纯化柱中,4℃在旋转仪上与珠子孵育2 h后,将上清从纯化柱下方流出;用Wash buffer(NaH2PO4 50mmol/L,NaCl 500 mmol/L,咪唑20 mmol/L,最终调pH为8.0)洗涤树脂,重复3次;漂洗完毕后用Elution buffer(NaH2PO4 50 mmol/L,NaCl 500 mmol/L,咪唑250 mmol/L,最终调pH为8.0)洗脱蛋白,每200 μL洗脱1次,重复2次,分别取5 μL洗脱液进行Tricine-SDS-PAGE胶分析。
1.2.5 戊糖片球菌素PA-1的活性检测以单核细胞增生李斯特氏菌为指示菌,采用琼脂扩散法检测表达片球菌素的活性。取50 μL第二次洗脱液样品经0.22 μm滤膜过滤除菌,注入接种有新鲜过夜单核细胞增生李斯特菌菌液(37℃条件下培养16 h)的TSB固体平板上的琼脂孔(约3 mm)中,对照组琼脂孔加入洗脱重组蛋白时使用的相同洗脱液。在超净工作台上静止1 h后,置于37℃培养箱培养12 h,观察抑菌圈。
1.2.6 片球菌素PA-1的生物信息学分析氨基酸序列利用NCBI网站提供的BLAST工具进行预测(https://www.ncbi.nlm.nih.gov/orffinder/),BioEdit工具进行氨基酸序列对比,用ProtParam蛋白在线分析工具和https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.p?page=/NPSA/npsa_seccons.html网站二级结构预测工具等对两种蛋白的理化性质和二级结构组成等生物信息学信息进行分析。
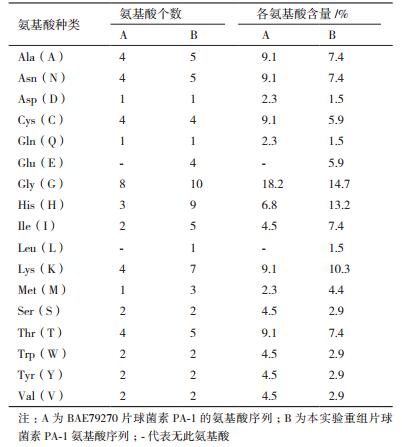
2 结果 2.1 pedA基因的扩增以戊糖片球菌C-2-1菌株的总DNA为模板,pedA-F和pedA-R为正反向引物,进行pedA基因PCR扩增,产物经1.5%琼脂糖凝胶电泳检测,如图 1所示,在220 bp左右有明显条带,与预期片段大小相符,目的基因扩增成功。

|
| 图 1 pedA基因的PCR扩增 M:DNA Marker;1:pedA基因 |
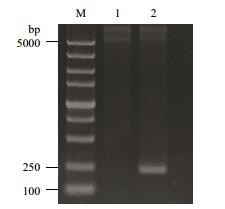
将双酶切后的pedA基因和pET-28a(+)质粒进行T4连接酶连接,产物转化至感受态细胞,筛选阳性转化子接种到LB液体培养基培养,提取质粒。如图 2所示,将重组质粒pET28a-pedA用Nco I和Hind Ⅲ双酶切后,获得一条220 bp左右的条带,此条带大小与预期值相符。将双酶切鉴定正确的质粒进行基因测序,测序结果表明连入pET28a质粒中的pedA基因与GenBank中的pedA基因碱基序列(GenBank登录号:AY083244.3)完全一致,说明重组质粒pET28a-pedA构建成功。
|
| 图 2 阳性重组子双酶切鉴定 M:DNA Marker;1:重组质粒pET28a-pedA;2:经双酶切处理后的重组质粒pET28a-pedA |
将重组质粒pET28a-pedA转化到大肠杆菌BL21(DE3)感受态细胞中,在含有卡那霉素的LB培养基中振荡培养,加入IPTG后降低培养温度诱导表达,震荡培养5 h后,4℃离心收集细胞并洗涤,加入裂解液和溶菌酶。冰浴超声裂解细胞,离心后取上清和沉淀进行电泳分析,检测重组蛋白表达形式,实验结果如图 3所示,诱导后的上清和沉淀中在7.8 kD附近有一条明显的条带,与理论值相符。而未转化重组质粒pET28a-pedA的大肠杆菌BL21(DE3)野生菌株在7.8 kD附近无明显条带。表明重组球菌素PA-1蛋白在大肠杆菌BL21(DE3)中诱导表达成功,且以可溶性蛋白形式存在。

|
| 图 3 重组片球菌素PA-1蛋白的Tricine-SDS-PAGE电泳检测 M:超低分子量蛋白marker;1:大肠杆菌BL21(DE3)总蛋白;2:转化空载体pET-28a(+)的BL21(DE3)总蛋白;3:转化pET28a-pedA的BL21(DE3)总蛋白;4:转化pET28a-pedA的BL21(DE3)表达产物破碎上清;5:转化pET28a-pedA的BL21(DE3)表达产物破碎沉淀 |
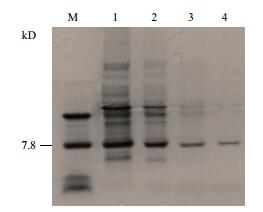
将收集的超声裂解上清液与Ni-NTA琼脂糖镍柱孵育,带有His标签的重组球菌素PA-1蛋白会与镍柱特异性结合,经过3次漂洗和2次洗脱后,成功获得纯化的重组球菌素PA-1蛋白(图 4)。收集对应洗脱液保存,进行活性检测。
|
| 图 4 重组片球菌素PA-1蛋白的纯化 M:超低分子量蛋白marker;1-3:分别为第1、2、3次漂洗;4:第2次洗脱 |
以单核细胞增生李斯特氏菌为指示菌,利用琼脂扩散法鉴定表达重组片球菌素PA-1的活性。结果如图 5所示,纯化后的重组片球菌素PA-1抑菌圈明显,而仅含洗脱液的空白对照没有抑菌圈,证明戊糖片球菌素pedA结构基因在大肠杆菌体内成功表达出了有活性的PA-1细菌素。

|
| 图 5 重组片球菌素的抑菌活性验证 1:空白对照2:纯化后的重组片球菌素PA-1 |
鉴于本实验得到的重组蛋白为胞内可溶性表达,而已报道的仅表达成熟且有活性的由44个氨基酸组成(GenBank登录号为BAE79270)的PA-1细菌素前体蛋白,大部分为包涵体不可溶表达。运用生物信息学工具分析预测本实验得到的重组片球菌素PA-1氨基酸序列和BAE79270 PA-1细菌素两种蛋白的理化性质、结构特征等内容,推测本实验重组蛋白在大肠杆菌体内可溶性表达的可能原因。
2.6.1 片球菌素PA-1的理化性质分析本实验成功表达的重组片球菌素PA-1氨基酸序列为:MKKIEKLTEKEMANIIGGKYYGNGVTCGKHSCSVDWGKATTCIINNGAMAWATGGHQGNHKCHHHHHH,由68个氨基酸(其中含划线部分6个组氨酸组成的His标签)组成。登录号为BAE79270的PA-1细菌素由44个氨基酸组成,其氨基酸序列为:KYYGNGVTCGKHSCSVDWGKATTCIINNGAMAWATGGHQGNHKC。BioEdit分析发现两者之差别在于本研究多了氨基酸序列MKKIEKLTEKEMANIIGG,其他序列相同。
用ProtParam蛋白在线分析工具分析BAE79270的PA-1细菌素氨基酸序列,结果表明,其分子式为C196H297N61O60S5,分子量为4 628.19,理论pI(等电点)值为8.85,同时含有1个负电荷氨基酸(Asp + Glu)和4个正电荷氨基酸(Arg + Lys),脂肪系数为40.00,总平均亲水值(GRAVY)为-0.716,不稳定性系数为-0.48。用相同方法分析本实验成功表达的重组片球菌素PA-1氨基酸序列,结果表明,其分子式为C319H489N101O94S7,分子量为7 467.43,理论pI值为8.42,含有5个负电荷氨基酸(Asp + Glu)和7个正电荷氨基酸(Arg + Lys),脂肪系数为50.29,总平均亲水值为-0.716,不稳定性系数为23.65,属于稳定型细菌素。两种蛋白的氨基酸组成见表 1。
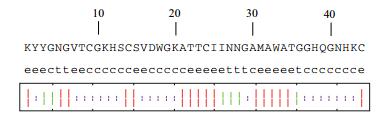
利用二级结构预测工具对片球菌素PA-1进行二级结构预测。各参数设置为:视窗宽度为17,相似度阈值为8,状态数目为4。经分析:登录号为BAE79270的PA-1细菌素的二级结构(图 6)中,无α螺旋结构;延伸链占40.91%,有18个氨基酸残基参与;β转角占13.64%,有6个氨基酸残基参与;无规则卷曲占45.45%,共有20个氨基酸残基参与。
|
| 图 6 BAE79270片球菌素PA-1的二级结构预测 大写字母为氨基酸简写;h,t,e,c分别代表α螺旋、β转角、延伸链和无规则卷曲;长竖线代表α螺旋;中竖线代表延伸链;次中竖线代表β转角;短竖线代表无规则卷曲(下同) |
本实验成功表达的重组片球菌素PA-1的二级结构(图 7)中,α螺旋占23.53%,有16个氨基酸残基参与;延伸链占20.97%,有13个氨基酸残基参与;β转角占12.90%,有8个氨基酸残基参与,无规则卷曲占40.32%,共有25个氨基酸残基参与。

|
| 图 7 本实验片球菌素PA-1的二级结构预测 |
对比预测结果后发现,本实验重组片球菌素PA-1的二级结构中含有23.53%的α螺旋结构,而由44个氨基酸组成的成熟且有活性的PA-1细菌素的二级结构中不含有α螺旋结构。
3 讨论采用基因工程技术来提高片球菌素的效价是可行的,但还存在一定问题。已报道的片球菌素PA-1在大肠杆菌中的表达形式多为细胞内不溶性表达,产物通常存在于包涵体中,包涵体溶解、变性、复性等过程复杂,导致表达效率降低[17]。刘珊娜等[11]在E. coli BL21(DE3)内实现了Trx-PA-1的融合表达,重组片球菌素以包涵体的形式存在,限制了PA-1进一步应用。此外,引入分子伴侣或运用融合表达的方法来实现PA-1的可溶性表达,也是学者常用的一种细菌素异源表达的方法,但获得的重组蛋白要经过肠激酶酶切去除标签蛋白后才能恢复活性。陈信全等[13]利用GST系统,通过在GST和PA-1蛋白间引入His标签实现了融合蛋白的可溶性表达,重组PA-1经过肠激酶去除标签蛋白后活性才得以恢复,制约了其在食品工业中的应用。本研究构建了pET28a-pedA重组质粒,转入大肠杆菌后经诱导表达、Ni-NTA柱纯化、Tricine-SDS-PAGE电泳分析后[18],获得了分子量在7.8 kD左右的可溶性重组蛋白,与ProtParam蛋白分析工具的分子量预测值相符。经单增李斯特菌抑菌检测显示,重组片球菌素具有明显的抑菌活性。本实验成功表达的可溶性重组片球菌素PA-1,未加入融合蛋白或分子伴侣,使重组片球菌素的提取和纯化更加简便,为片球菌素PA-1在食品防腐保鲜领域的应用奠定了很好的基础。
Marugg等[10]证实pedA基因编码PA-1片球菌素62个氨基酸的PA-1前体,第19-62个氨基酸为具有活性的片球菌素前体,前18个氨基酸为信号肽序列,与刘珊娜[11]包涵体表达的片球菌素PA-1相比,本实验成功表达的重组片球菌素PA-1含有此信号肽序列。研究表明分泌蛋白的N端都携带有引导其跨越细胞膜的信号肽,它对于分泌蛋白的分泌效率起主导作用[19],利用信号肽来引导外源蛋白定位分泌到细胞特定区间,提高可溶性,可避免因包涵体复性带来的困难[20]。因此,本实验获得的重组片球菌素PA-1含信号肽可能是导致其可溶性表达的原因。进一步比较两种PA-1的理化性质及二级结构后发现,未含信号肽的BAE79270的PA-1细菌素没有α螺旋结构,含有信号肽的片球菌素PA-1的α螺旋结构占23.53%,重组蛋白疏水性提高。据文献报道,信号肽分泌加工能力随疏水性增加而提高,前体蛋白可以不依赖分子伴侣或其他辅助因子仍能较好的分泌[21]。杨运桂等[22]证实信号肽疏水性能提高促进青霉素G酰化酶分泌。因此,本实验获得的重组PA-1蛋白含有的疏水核心信号肽可能促进了重组蛋白的分泌,从而获得了较稳定的重组蛋白,使提取和纯化更为简单。
4 结论本实验成功构建了片球菌素PA-1结构基因pedA的原核表达载体,纯化得到了可溶性表达并具有抑菌活性的重组片球菌素PA-1。运用生物信息学手段,进一步分析了重组片球菌素PA-1可溶性表达的原因可能为含有信号肽的PA-1的重组蛋白疏水性提高,促进了重组蛋白的分泌。
| [1] |
Deegan LH, Cotter PD, Hill C, et al. Bacteriocins: Biological tools for bio-preservation and shelf-life extension[J]. International Dairy Journal, 2006, 16(9): 1058-1071. DOI:10.1016/j.idairyj.2005.10.026 |
| [2] |
Kaur G, Singh TP, Malik RK. Antibacterial efficacy of Nisin, Pediocin 34 and Enterocin FH99 against Listeria monocytogenes and cross resistance of its bacteriocin resistant variants to common food preservatives[J]. Braz J Microbiol, 2013, 44(1): 63-71. DOI:10.1590/S1517-83822013005000025 |
| [3] |
于雷雷, 王超, 等. 戊糖乳杆菌素pentocin LPEM818的初步纯化及特性研究[J]. 食品与发酵工业, 2013(2): 17-23. |
| [4] |
吕燕妮. 广谱抗菌肽—片球菌素pediocin PA-1[J]. 食品科技, 2011(9): 41-44. |
| [5] |
Beaulieu L, Aomari H, et al. An improved and simplified method for the large-scale purification of pediocin PA-1 produced by Pediococcus acidilactici[J]. Biotechnol Appl Biochem, 2006, 43((Pt 2): 77-84. |
| [6] |
王艳婷, 汪立平, 唐潮, 等. 蒙古干酪中产细菌素戊糖片球菌的筛选及其细菌素理化特性研究[J]. 食品与发酵工业, 2015, 41(10): 14-19. |
| [7] |
Siegers K, Entian KD. Genes involved in immunity to the lantibiotic nisin produced by Lactococcus lactis 6F3[J]. Appl Environ Microbiol, 1995, 61(3): 1082-1089. |
| [8] |
Reviriego C, Fernández A, Horn N, et al. Production of pediocin PA-1, and coproduction of nisin A and pediocin PA-1, by wild Lactococcus lactis, strains of dairy origin[J]. International Dairy Journal, 2005, 15(1): 45-49. DOI:10.1016/j.idairyj.2004.05.003 |
| [9] |
刘晨, 齐凡, 陈颖怡, 等. 片球菌素在食品防腐保鲜中的应用研究进展[J]. 保鲜与加工, 2012, 12(4): 1-6. |
| [10] |
Marugg JD, Gonzalez CF, Kunka BS, et al. Cloning, expression, and nucleotide sequence of genes involved in production of pediocin PA-1, and bacteriocin from Pediococcus acidilactici PAC1.0[J]. Appl Environ Microbiol, 1992, 58(8): 2360-2367. |
| [11] |
刘珊娜. 乳酸片球菌素pedA基因的克隆与表达[D]. 天津: 天津大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10056-1013005120.htm
|
| [12] |
Moon GS, Pyun YR, Kim WJ. Expression and purification of a fusion-typed pediocin PA-1 in Escherichia coli and recovery of biologically active pediocin PA-1[J]. International Journal of Food Microbiology, 2006, 108(1): 136-140. DOI:10.1016/j.ijfoodmicro.2005.10.019 |
| [13] |
陈信全, 都立辉, 鞠兴荣, 等. 乳酸片球菌素PA-1在大肠杆菌中的表达与纯化[J]. 食品科学, 2016, 37(3): 97-102. DOI:10.7506/spkx1002-6630-201603019 |
| [14] |
韩烨, 周志江, 王培培, 等. 片球菌素基因的克隆及表达[J]. 华北农学报, 2009, 24(2): 32-35. DOI:10.7668/hbnxb.2009.02.007 |
| [15] |
van Reenen CA, Dicks LM, et al. Isolation, purification and partial characterization of plantaricin 423, a bacteriocin produced by Lactobacillus plantarum[J]. J Appl Microbiol, 1998, 6: 1131-1137. |
| [16] |
Beaulieu L, Groleau DC, Jette J, et al. Production of pediocin PA-1 in the methylotrophic yeast Pichia pastoris reveals unexpected inhibition of its biological activity due to the presence of collagen-like material[J]. Protein Exp Purif, 2005, 43(2): 111-125. DOI:10.1016/j.pep.2005.05.012 |
| [17] |
苏鹏, 龚国利. 优化大肠杆菌表达外源蛋白的研究进展[J]. 生物技术通报, 2017, 33(2): 16-23. |
| [18] |
Schägger H, Jagow GV. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa[J]. Anal Biochem, 1987, 2: 368-379. |
| [19] |
Izard JW, Doughty MB, Kendall DA. Physical and conformational properties of synthetic idealized signal sequences parallel their biological function[J]. Biochemistry, 1995, 31: 9904-9912. |
| [20] |
韦雪芳, 王冬梅, 刘思, 等. 信号肽及其在蛋白质表达中的应用[J]. 生物技术通报, 2006(6): 38-42. |
| [21] |
Chen H, Kim J, Kendall DA. Competition between functional signal peptides demonstrates variation in affinity for the secretion pathway[J]. J Bacteriol, 1996, 178(23): 6658-6664. DOI:10.1128/jb.178.23.6658-6664.1996 |
| [22] |
杨运桂, 等. 信号肽疏水性的提高促进青霉素G酰化酶分泌[J]. 生物化学与生物物理学报, 2000, 32(2): 163-168. |