2. 江苏省海洋资源开发研究院,连云港 222005
2. College of Fisheries and Marine Life, Huaihai Institute of Technology, Lianyungang 222005
黑色素(Melanin)是广泛存在于自然界中的一种色素,大量存在于动植物和微生物中[1]。黑色素结构上为非均质的多聚物,可因组成单元与聚合过程的不同而出现极大差异,是一类结构复杂的多酚类或吲哚类异源多聚芳香族化合物的总称[2]。目前的研究证明,黑色素有许多重要的生物学方面的功能:一是可以提供机械力保护蛋白质不被降解;二是其形成过程具有进化上的保守性,特别是如巯基(·SH)和氨基(·NH2)亲核性的基团,使其获得抗生素特性。虽然黑色素对于生物的生长、发育并非不可或缺,但是却能提高生物体生存和竞争的能力[3]。由于在生物体内能起到抗紫外辐射、清除自由基的作用,具有抗氧化[4]、防衰老等功能[5],黑色素被广泛应用于化妆品、染发剂中,还可以作为生物杀虫剂的光保护剂[6]。另外,作为新型天然药物载体,黑色素还可以用来治疗某些与黑色素缺乏有关的神经系统疾病[7]。近年来发现一些可溶性黑色素在体外对艾滋病病毒有显著的抑制作用,使天然黑色素可望成为一种新的抗艾滋病药物[8]。
天然黑色素虽然广泛存在于动植物及微生物中,但动植物受季节、气候、产地、复杂工艺等因素的影响,提取的色素价格昂贵,大规模生产受到局限。只有微生物具有发酵周期短、成本低廉、易于工业化的特点,并且微生物所产黑色素是体内的酪氨酸酶催化酪氨酸形成L-多巴,然后继续氧化形成,属于氨基酸的衍生物,无毒无害[3]。因此,研究微生物发酵生产黑色素,并对其进行开发利用,具有很大的优势,并越来越得到广泛的重视[9]。本研究从海洋样品中筛选产黑色素真菌,对菌株进行鉴定,对其产黑色素的性质进行了初步研究,为今后该色素的开发奠定科学基础和提供了理论依据。
1 材料和方法 1.1 材料 1.1.1 样品来源样品为海州湾海域采集的海水、海泥等(N34°43'28″,E119°29'73″)
1.1.2 试剂微生物直接PCR裂解缓冲液(Lysis Buffer for Microorganism to Direct PCR)购自TAKARA公司,其他试剂均为国产分析纯。
1.1.3 培养基海水PDA培养基:马铃薯200 g、葡萄糖20 g、琼脂20 g、天然海水1 000 mL,pH自然。
1.2 方法 1.2.1 菌种的筛选和保存梯度稀释样品并涂布于PDA培养基。在27℃培养72 h后挑取形态不同的菌落用划线法分离纯化,纯化后的菌株接种至PDA斜面保存。挑选生长快、颜色深、色素扩散圈大的菌株进行进一步研究。
1.2.2 菌落观察点植法接种少量孢子于PDA培养基,平皿接种点呈三角形。将接种平皿在27℃培养7 d。逐日观察记录菌落形态、颜色及生长状况。
1.2.3 菌株的形态学鉴定待上述菌株培养7 d后,观察成熟菌落大小、颜色、形态、边缘等特征。再用插片法培养,观察自然生长条件下菌丝形态,并在电子显微镜下观察菌株的孢子梗及孢子特征,对其进行初步鉴定。
1.2.4 ITS序列扩增及系统发育分析利用微生物直接PCR裂解缓冲液(Lysis Buffer for Microorganism to Direct PCR)获得菌株的总DNA。PCR扩增采用引物为真菌通用引物ITS1(5'-TCCGTAGGTGAACCT-GCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3'),由上海生物工程有限公司合成。PCR反应体系(50 μL)为:Premix Taq(Ex Taq version 2.0)25 μL,引物各1 μL,模板5 μL,加无菌双蒸水补至50 μL。PCR反应条件为:94℃预变性10 min,94℃变性30 s,52℃退火30 s,72℃延伸1 min,重复30个循环,72℃温育10 min。PCR产物送上海生物工程有限公司测序。将测序的ITS序列在GenBank数据库中进行同源性比对,并用Mega7.0软件,采用邻接法(Neighbor joining method)进行聚类分析和系统进化树构建,确定菌种生物学分类地位。
1.2.5 黑色素的发酵与提取菌株接种于100 mL液体PDA发酵培养基,在27℃、180 r/min条件发酵培养7 d,13 400×g离心10 min,取上清液,加入与上清液等体积乙酸乙酯萃取,静置过夜。使用旋转蒸发仪蒸发萃取相至干粉状,得到黑色素的粗提物。用10 mL乙醇溶解黑色素粗提物,将溶液转移至药剂瓶中,烘干至恒重。
1.2.6 色素的光谱性质将黑色素粗提物溶解成0.1%浓度溶液,用UV-1800型紫外可见光光度计进行光谱扫描,以溶剂为参照,在200-700 nm波长范围内扫描分析。
1.2.7 色素的稳定性实验 1.2.7.1 自然光对色素稳定性的影响将0.1%浓度色素分装于8支透明试管中,对照样品避光保存,其他样品在室内光亮处放置7 d,每24 h取样品测定OD220。
1.2.7.2 温度对色素稳定性的影响将0.1%浓度的黑色素密闭分装于试管中,分别置于4、20、40、60、80、100℃水浴。水浴2 h后分别测定其OD220值。
1.2.7.3 pH对色素稳定性的影响将0.1%浓度黑色素分别加入pH为2、3、4、5、6、7、8、9、10、11的缓冲液中,得到终浓度相同的不同pH色素溶液,避光放置24 h后分别测试其OD220值。
1.2.7.4 金属离子对色素稳定性的影响向0.1%浓度的黑色素溶液中分别加入浓度为0.01 mol/L和1 mol/L的Mg2+、Ca2+、Cu2+、Fe3+、Na+、K+、Al3+、Zn2+,振荡均匀后避光保存24 h,测OD220值。
1.2.7.5 食品添加剂对色素稳定性的影响向0.1%浓度的黑色素溶液中分别加入10 g/L的苯甲酸钠、柠檬酸和山梨酸钾,振荡混匀后避光保存24 h,测OD220值。
1.2.8 色素的抑菌性取滤纸片,分别加10 μL和20 μL的0.1%浓度的黑色素粗提物。分别将滤纸片三点放置于生长了金黄色葡萄球菌和大肠杆菌的培养皿中。倒置培养,2 d后观察,通过抑菌圈的大小判断其抑菌性。
2 结果 2.1 产色素菌株筛选结果在初筛获得的21株产色素菌株中,菌株CX-PF01和CXPF05产生的色素分别使发酵液变为黑色和深棕色。CXPF01产生色素速度较快,2-3 d即可使发酵液完全变色,采用CXPF01进行下一步研究。
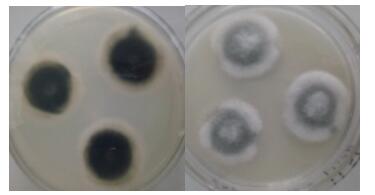
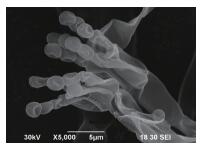
2.2 菌株鉴定 2.2.1 菌株的培养性状及形态学鉴定CXPF01在PDA培养基上27℃培养3 d后,菌株菌落呈圆形,直径约30 mm。菌落中心有突起,墨绿色,菌丝绒毛状,较致密。菌落底部黑色,无色素扩散圈,推断菌株产生黑色素。边缘菌丝呈白色绒毛状,菌落周围无分泌物产生(图 1)。在电子显微镜下观察,可以清晰观察到该菌的孢子梗和孢子。孢子梗表面光滑,宽度约20 μm,梗间有间隔(图 2);孢子呈球状,多个孢子成簇存在,孢子直径约2 μm(图 3)。
|
| 图 1 CXPF01的菌落形态 |

|
| 图 2 孢子梗电镜照片 |
|
| 图 3 孢子电镜照片 |
对CXPF01菌株的ITS序列扩增获得538 bp的序列。将序列在GenBank中进行BLAST比对,选取10株相关菌株进行系统发育分析,用MEGA 7软件中的Neighbor-Joining法构建系统发育树(图 4),可以看出,CXPF01菌株与Cladosporium cladosporioides CAF032(KU821454.1)相聚于同一支,其置信度达到93%。

|
| 图 4 基于ITS序列构建的菌株CXPF01的系统发育树 注:括号内为Genbank登录号;分支点上数字为自展百分比;线段0.001为核酸替代率 |
结合菌落培养特征、生理生化特征和基于ITS基因序列的系统发育分析,可将CXPF01菌株的分类地位确定至属的水平,即CXPF01菌株属于枝孢菌属(Cladosporium)。
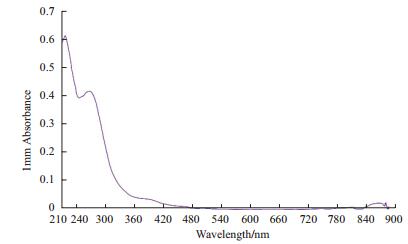
2.3 色素的光谱特性取0.1%浓度黑色素溶液用UV-1800型紫外可见光光度计进行光谱扫描,以溶剂为参照,在200-700 nm波长范围内扫描分析。根据光谱图可知,色素在220 nm处有最大吸收峰,在可见光区内没有特征吸收峰,吸收值随波长增大而减小(图 5)。
|
| 图 5 黑色素紫外-可见吸收光谱扫描图 |
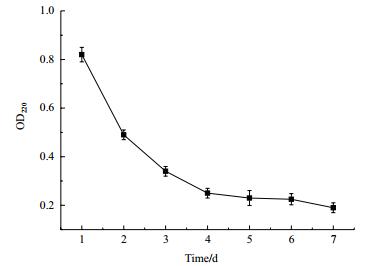
从图 6可以看出,自然光对色素稳定性影响结果表明,在自然光照条件下,黑色素的吸光度呈下降趋势,且第1天降幅最大,第7天色素吸光值仅为第1天的22.3%。结果表明色素对光照较为敏感。
|
| 图 6 自然光对色素稳定性的影响 |
如图 7所示,随着温度的升高,黑色素的OD220值下降。在4-20℃的范围内,黑色素的吸光值变化较小,温度对色素的稳定性影响较小。当温度大于20℃时,色素OD220值急速下降,色素稳定性受到影响大。当温度高于80℃时,色素挥发,无数据。结果表明该色素对温度敏感,在0-30℃范围内具有较好稳定性。
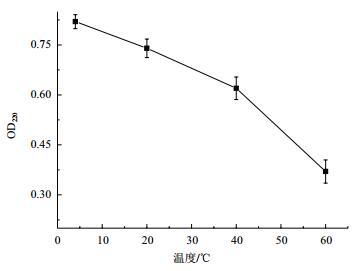
|
| 图 7 温度对色素稳定性的影响 |
图 8可以看出,pH7-8时,色素保持稳定,吸光值几乎无变化。当pH小于7或大于8时,色素吸光度急剧下降,稳定性下降,在pH为11时吸光度达到最小。说明色素在酸性或碱性条件中不稳定,在中性条件下较稳定。

|
| 图 8 pH值对色素稳定性的影响 |
从图 9中可以看出,黑色素溶液中添加0.01 mol/L浓度的金属离子后,加入Fe3+的黑色素溶液的吸光度几乎无变化;加入K+后溶液吸光度降低;加入Cu2+、Mg2+和Na+的黑色素溶液吸光度显著降低。添加浓度1 mol/L的金属离子后,加入Fe3+的黑色素溶液吸光度无变化,K+、Cu2+、Mg2+和Na+的黑色素溶液吸光度均减少,Na+和Mg2+离子的溶液吸光度减少最多。结果说明本黑色素对Fe3+稳定,对K+较为稳定,对Cu2+、Mg2+和Na+不稳定。
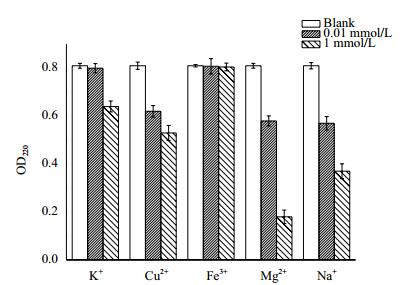
|
| 图 9 金属离子对色素稳定性的影响 |
由图 10可以看出,仅山梨酸钾使色素的OD220显著变高,说明山梨酸钾对CXPF01菌株产的黑色素具有增色或者护色作用。柠檬酸和苯甲酸钠使色素吸光度略微下降,说明色素对苯甲酸钠和柠檬酸钠较为稳定。
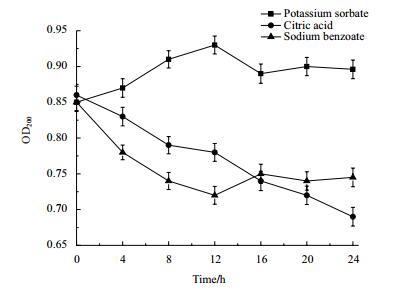
|
| 图 10 食品添加剂对色素稳定性的影响 |
0.1 %浓度黑色素溶液在Staphylococcus aureus和Escherichia coli培养皿中都有抑菌圈产生,且色素添加量20 μL产生的抑菌圈大于10 μL(表 1)。
微生物产黑色素相较于动植物产的黑色素具有发酵周期短、成本低廉、易于工业化的特点,并且微生物所产黑色素是体内的酪氨酸酶催化酪氨酸形成L-多巴,然后继续氧化形成,属于氨基酸的衍生物,无毒无害。因此,研究微生物发酵生产黑色素,并对其进行开发利用,具有很大应用前景。目前所发现的具有产黑色素能力的微生物以细菌为主,主要有坚强芽孢杆菌、放线菌、链霉菌、微球菌等[7, 10-11],产黑色素的真菌鲜有报道。CXPF01产黑色素在200-700 nm波长范围内扫描分析。根据光谱图可知,色素在220 nm处有最大吸收峰,在可见光区内没有特征吸收峰,吸收值随波长增大而减小。这与Sigma公司所提供的标准黑色素的光谱图不同,与徐静等[12]研究中发现放线菌所产黑色素的光谱扫描图谱显著不同,但与叶明等[13]研究的暗盘菌YM421所产黑色素类似,与戴德慧等[14]研究的丝状真菌D447所产黑色素相似度最高,且在相近波长具有吸收峰,但CXPF01所产黑色素在可见光区内吸收几乎为零,推测这种差异是因为真菌产黑色素在结构上有异于细菌产黑色素,下一步将借助其它分析测试手段对菌株CXPF01产的黑色素结构进行进一步的研究和比较。
光照稳定性实验结果表明该黑色素在自然光照条件下稳定性一般。丝状真菌D447产黑色素与链霉菌G-HD-4产黑色素相比,对光照较为敏感,但其光照稳定性仍强于本色素[11, 14]。CXPF01黑色素对pH较为敏感,在pH为7.0-8.0时最稳定,这与其他菌种所产黑色素有显著不同,一般微生物色素在碱性环境较为稳定,如丝状真菌D447所产黑色素仅在pH12有最好的稳定性[14]。
根据金属离子对黑色素稳定性实验的结果,CXPF01黑色素对大部分阳离子不稳定,加入微量的Cu2+、Mg2+和Na+离子后,黑色素的吸光度也会迅速减少。黑色素对金属离子不稳定可能是因为微生物产黑色素作为一类由酪氨酸氧化转化而来的生物多聚物,其结构中具有带负电的羧基和去质子化的羟基,对阳离子有明显的结合作用[3]。
4 结论从海州湾的海水、海泥样品中筛选到产黑色素菌株CXPF01,结合形态学和ITS序列分析将其初步鉴定为Cladosporim cladosporioides。该菌株所产黑色素在220 nm处有最大吸收峰,在0-30℃、pH7.0-8.0时具有良好稳定性,对Staphylococcus aureus和Escherichia coli有抑菌效果。该色素对常见食品添加剂苯甲酸钠、柠檬酸钠、山梨酸钾不敏感。性质表明本色素有应用于食品产业的潜力。
| [1] |
Riley PA. Melanin[J]. International Journal of Biochemistry & Cell Biology, 1997, 29(11): 1235. |
| [2] |
Toledo AV, Franco MEE, Yanil Lopez SM, et al. Melanins in fungi: Types, localization and putative biological roles[J]. Physiological and Molecular Plant Pathology, 2017, 99: 2-6. DOI:10.1016/j.pmpp.2017.04.004 |
| [3] |
Helene C. Eisenman, Arturo Casadevall. Synthesis and assembly of fungal melanin[J]. Applied Microbiology and Biotechnology, 2012, 93(3): 931-940. DOI:10.1007/s00253-011-3777-2 |
| [4] |
Zou Y, Hu W, Ma K, et al. Physicochemical properties and antioxidant activities of melanin and fractions from Auricularia auricula fruiting bodies[J]. Food Science and Biotechnology, 2015, 24(1): 15-21. DOI:10.1007/s10068-015-0003-5 |
| [5] |
王玉洁, 符坚, 刘楠, 等. 重要的生物资源黑色素及其功能的机理[J]. 氨基酸和生物资源, 2003, 25(1): 12-14. |
| [6] |
van De Sande WW, de Kat J, Coppens J, et al. Melanin biosynthesis in Madurella mycetomatis and its effect on susceptibility to itraconazole and ketoconazole[J]. Microbes Infect, 2007, 9(9): 1114-1123. DOI:10.1016/j.micinf.2007.05.015 |
| [7] |
倪丽娜. 一株高产黑色素细菌的分离及鉴定[J]. 微生物学通报, 2004, 31(1): 55-59. |
| [8] |
Cordero RJB, Casadevall A. Functions of fungal melanin beyond virulence[J]. Fungal Biology Reviews, 2017, 31(2): 99-112. DOI:10.1016/j.fbr.2016.12.003 |
| [9] |
Nosanchuk JD, Arturo C. The contribution of melanin to microbial pathogenesis[J]. Cellular Microbiology, 2003, 5(4): 203-223. DOI:10.1046/j.1462-5814.2003.00268.x |
| [10] |
李鹏, 苗增良, 王健鑫. 一株产黑褐色色素海洋放线菌的研究[J]. 海洋环境科学, 2011, 30(5): 689-693. |
| [11] |
郑晨娜, 方柏山, 罗菊香, 等. 链霉菌G-HD-4产黑色素的提取及理化性质[J]. 华侨大学学报:自然版, 2009, 30(3): 292-296. |
| [12] |
徐静, 吴少杰, 阎斌伦, 等. 产黑色素海洋放线菌的分离、鉴定和产色素条件优化[J]. 微生物学通报, 2012, 39(12): 1711-1719. |
| [13] |
叶明, 陈晓, 朱立, 等. 暗盘孢属YM421黑色素稳定性及其抗氧化活性[J]. 菌物学报, 2010, 29(2): 254-260. |
| [14] |
戴德慧, 胡伟莲. 丝状真菌D447胞外黑色素性质的研究[J]. 安徽农业科学, 2013, 8(8): 3303-3305. |





