2. 华东理工大学,上海 200237
2. Shanghai East China University of Science and Technology, Shanghai 200237
硒是人体和动物所必须的微量元素之一,能够维持甲状腺激素代谢、心血管系统、抗氧化防御系统和免疫系统的正常功能[1]。研究发现,克山病、大骨节病、白内障、糖尿病等40余种疾病均与硒缺乏有关[2]。我国属于严重缺硒国家,国土面积72%地区的土壤硒元素缺乏(< 0.6 mg/kg),其中30%的地区严重缺硒[3]。当前,硒的来源主要是通过饮食[4],我国大部分人群平均每天摄入量26-32 µg,明显低于世界卫生组织制定的硒参考每天摄入量40-200 µg[5]。因此,富硒产品的发展对提高国民健康水平具有重要意义。
富硒酵母被认为是一种安全有效的硒源,比无机硒更安全、更有效,通常用作营养强化剂[6]。目前发现的天然富硒酵母有酿酒酵母、产朊假丝酵母、红酵母和黏红酵母等[7-10],但天然富硒酵母常常富硒量不高,因此研究人员采用多种方法以提高酵母的富硒量,如优化硒盐添加周期、优化培养条件和培养工艺等。Ponce[11]曾经在酿酒酵母的对数生长期和稳定期添加不同量硒盐,将富硒量提高了20%-30%;Suhajda[12]和Yin[13]通过培养基pH值、溶氧量等条件的优化,使酿酒酵母硒含量分别达到了1 200-1 400 µg/g和639 µg/g。研究也发现,酸胁迫有利于促进亚硒酸钠的同化和生物转化,使硒在酵母细胞中富集[14];脉冲电场处理酵母细胞会提高酵母的耐受性或改变酶活性使富硒能力提高,细胞中的硒离子累积量增加了65%[15]。然而,由于目前各种酵母仍然存在富硒能力不稳定、富硒量与生物量不适配等缺陷,仍是微生物富硒生产中经常遇到的瓶颈问题,与工业生产要求具有一定差异[11-12]。并且,一个酵母细胞理论上能够结合的最大硒量依赖于细胞中甲硫氨酸和半胱氨酸(残基)的含量,大约为6 000 mg/kg[16],硒代氨基酸完全替代甲硫氨酸和半胱氨酸也是不可能的。要获得高富硒酵母,进一步筛选能在细胞内积累大量硒蛋氨酸的酵母菌种仍然很有必要。为此,本研究以富硒土壤为基础,筛选富硒酵母,期望通过研究培养基营养组分、硒盐和微量元素等对酵母生长和硒富集的影响,优化酵母培养工艺以提高酵母的硒含量,为富硒酵母的开发提供一定的参考。
1 材料与方法 1.1 材料 1.1.1 样品采集选择位于新疆天山北坡的富硒区域为样品采集地点,主要采集石河子市和沙湾县北部农田区的中上等富硒土壤(经检测土壤中硒含量在0.6-8.2 mg/kg,包括新疆生产建设兵团农八师142团12连、13连、14连、15连和16连(沙湾县境)的葡萄园土壤)。每个采样地随机设置5个采样点,采集地表面下5-10 cm适合微生物生长的土壤,总计采集50个样品。
1.1.2 培养基研究所用的培养基有马丁培养基和YPD培养基两种。其马丁培养基用于酵母的筛选,主要成分为:0.5%蛋白胨、1%葡萄糖、0.1%磷酸二氢钾、0.05%硫酸镁、2%琼脂、0.03%孟加拉红溶液、0.01%氯霉素。YPD培养基用于酵母培养的基础培养基,主要成分为:2%葡萄糖、1%酵母粉和2%蛋白胨。在配置固体培养基时,额外加入2%的琼脂。
1.2 方法 1.2.1 菌株筛选为了筛选样品中的酵母菌株,在150 mL锥形瓶中加入99 mL的无菌水和1 g的土壤样品,放置到30℃、180 r/min的摇床中孵育12 h。然后吸取100 μL锥形瓶中的溶液加入到固体马丁培养基中,在30℃培养箱中倒置培养4-5 d,由于马丁培养基中含有链霉素,所以培养基上只能生长酵母菌与霉菌,并且酵母菌与霉菌在菌落形态上有较大差异,其中酵母菌菌落呈现粉红色,边缘为光滑、圆润、凸起,而霉菌菌落呈现白色,边缘为疏松、丝状[17]。根据酵母菌株和细胞的形态特征,用肉眼观察马丁培养基生长的菌落,挑取培养基中形态较为光滑、圆润的粉红色菌落,进而在显微镜下观察其细胞形态,最终确定是否为酵母细胞。
为了从众多野生酵母中筛选出初始富硒能力较强的酵母菌株,选用在硒浓度为50 mg/L的YPD培养基中进行培养,培养时间为36 h,培养温度为30℃。利用原子荧光光度计检测酵母中硒含量,同时用紫外分光光度计检测其生物量。
1.2.2 酵母细胞中硒含量的测定酵母细胞中硒含量采用原子荧光光度计进行测定。吸取1 mL培养的酵母细胞于1.5 mL离心管中,离心收集菌体,用去离子水反复洗涤3次以洗去与酵母细胞未结合的硒离子和硒盐,然后置于聚四氟乙烯坩埚中,加入10 mL混合酸及几粒玻璃珠,浸泡过夜,使样品冷消化,以免反应过烈,导致样品损失。次日,电热板加热消解,当溶液变为清亮无色并伴有白烟时,再继续加热至剩余体积2 mL左右。冷却,加入5.0 mL 6 mol/L盐酸,继续加热至溶液变为清亮无色并伴有白烟出现,将Se6+还原成Se4+。冷却后转移至50 mL容量瓶中定容,混匀备用。同时做空白试验,吸取10 mL试样消化液于15 mL离心管中,加2 mL盐酸,1 mL铁氰化钾混匀。
用原子荧光光度计(北京万拓,AFS-820)检测硒浓度,仪器参考条件为在负高压340 V、灯电流100 mA、原子化温度800℃、炉高8 mm、载气流速500 mL/min、屏蔽气流速1 000 mL/min、延迟时间1 s、读数时间15 s和加液时间为8 s时,进样开始检测,每个样品做3次平行实验。
2 结果 2.1 富硒酵母的筛选与鉴定通过马丁培养基的初筛和富硒能力的富晒,从50个样品中总共筛选到160株酵母菌株,从中选择出一株生物量和富硒量均相对较高的X-20酵母为初始菌株,其初始富硒量为790 µg/g,生物量为4.64 g/L。
在YPD固体培养基上培养X-20酵母菌株,发现在培养过程中菌苔颜色由珊瑚红逐渐变为橙红色,表面可由光滑到褶皱,有光泽,质地粘稠。通过扫描电镜观察黏红酵母形态特征(图 1),发现该细胞呈卵形,宽度为3.5-5.0 µm,长度为6.0-10 µm,多边芽殖。
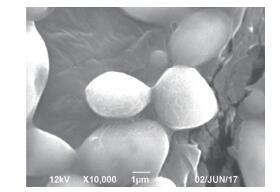
|
| 图 1 黏红酵母的扫描电镜图 |
对样品的18S rDNA序列进行PCR扩增,测序后提交至NCBI进行BLAST序列比对,结果显示,样品基因序列与数据库中的黏红酵母基因序列的匹配度为99%,从而确定该样品为黏红酵母Rhodotorula glutinis,命名为X-20,构建系统发育树(图 2)。菌株保藏至中国典型培养物保藏中心,保藏号为CCTCCM2017225。

|
| 图 2 菌株Rhodotorula glutinis X-20 18S rRNA系统发育树 |
分别以2%的蔗糖、甘油、葡萄糖和果糖为培养基碳源,并在培养基中加入50 μg/mL的亚硒酸钠培养Rhodotorula glutinis X-20,采用原子荧光光度计测定酵母的硒含量,结果如图 3所示。从黏红酵母生长情况来看,葡萄糖和果糖效果较好,蔗糖次之,甘油较差(图 3-A);从黏红酵母富硒情况来看,甘油富硒效果最佳,而葡萄糖和果糖最低(图 3-B)。葡萄糖和果糖有助于黏红酵母的生长,但富硒效果较差,虽然以甘油作为培养基碳源时,黏红酵母的生物量较低,但其富硒量极高,考虑到本实验目的为黏红酵母的富硒强化,因此,选择甘油作为培养基的碳源。
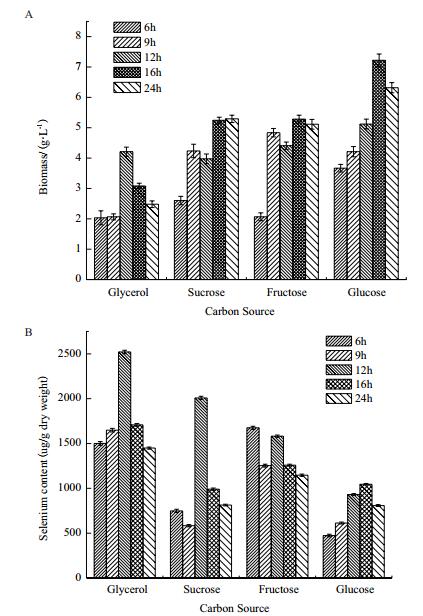
|
| 图 3 碳源对Rhodotorula glutinis X-20生长和富硒的影响 A:碳源对酵母生物量的影响;B:碳源对酵母富硒量的影响 |
分别以2%蛋白胨、硫酸铵、尿素和硝酸钠为培养基中的氮源,在培养基中加入亚硒酸钠对酵母进行富硒培养,培养60 h后,采用原子荧光光度计测定酵母细胞的硒含量,结果如图 4所示。当蛋白胨为氮源时,生物量和富硒量最佳。当硝酸钠为氮源时,生物量较好,但富硒量较低。当硫酸铵和尿素为氮源时,酵母的富硒和生长情况均远低于蛋白胨。因此,选择适宜酵母生长和富硒的蛋白胨作为培养基中的氮源。
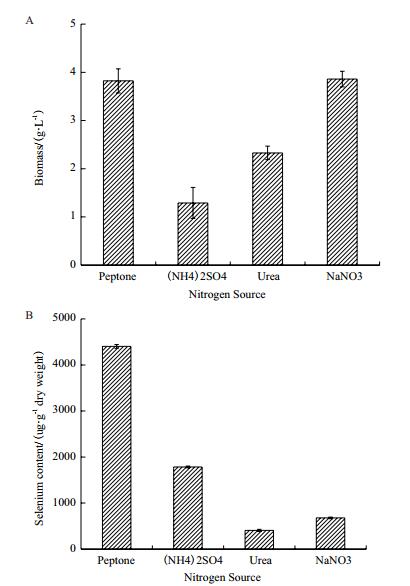
|
| 图 4 氮源对Rhodotorula glutinis X-20生长和富硒的影响 A:氮源对酵母生物量的影响;B:氮源对酵母富硒量的影响 |
分别在酵母细胞培养的第6 h、9 h、12 h、16 h和24 h向培养基中加入浓度为50 µg/mL的亚硒酸钠,以甘油作为培养基碳源,以蛋白胨作为培养基中的氮源,对酵母进行富硒培养。采用原子荧光光度计对实验样品的硒含量进行测定,结果如图 5所示。从黏红酵母富硒情况来看,硒盐添加时间在12 h时富硒量最佳,为2 520.65 µg/g,生物量为4.21 g/L。酵母在24 h时添加硒盐,富硒量最低。因此,确定硒盐添加时间为12 h。
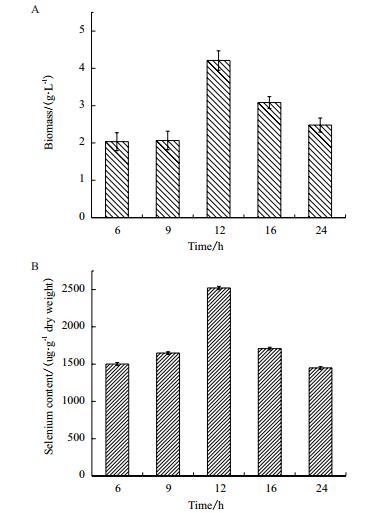
|
| 图 5 硒盐添加时间对Rhodotorula glutinis X-20生长和富硒的影响 A:硒盐添加时间对酵母生物量的影响;B:硒盐添加时间对酵母富硒量的影响 |
以甘油为碳源,蛋白胨为氮源,第12 h为硒盐添加时间,在培养初期分别添加不同浓度的磷酸盐,研究磷元素对酵母富硒能力的影响,结果如图 6所示。磷酸盐对黏红酵母的生长和富硒能力有一定的影响。当磷酸盐浓度为0.1-0.4 mmol/L时,会促进黏红酵母的富硒。当培养基中磷酸盐浓度为0.8-7.5 mmol/L时,高浓度的磷酸盐对黏红酵母的富硒产生了抑制作用。磷酸盐浓度在0.4 mmol/L时富硒效果最佳,富硒量为5 009 µg/g,生物量为2.26 g/L。

|
| 图 6 磷元素对酵母富硒量和生物量的影响 |
本研究在新疆富硒葡萄园中,通过马丁培养基进行筛选,得到一株具有较好富硒能力的天然野生黏红酵母菌株Rhodotorula glutinis X-20。据报道,黏红酵母可以在细胞内将亚硒酸钠还原成Se0并富集[18],纳米胶体形式的Se0可以加强富硒酵母的抗氧化活性,并且还具有新的生物活性,如抗氧化剂、化疗剂和化学预防剂[19]。另外,黏红酵母可以广泛合成工业生产中有价值的化合物,如类胡萝卜素、脂类和酶[9]等,如由于黏红酵母的脂肪含量高,可以将其作为饲料添加剂来替代鱼粉用于水产养殖中[20]。与其它普通酵母菌株相比,Rhodotorula glutinis X-20可以更好的吸收利用硒,通过优化培养基组分和添加微量元素,最终使酵母的富硒量达5 009 µg/g,是目前报道中富硒量最高的。Ponce[11]、Marek Kieliszek[21]等通过探究酵母中硒的富集方式对于硒累积量的影响,得到酵母总富硒量分别为2 354 µg/g、1 841 µg/g;Suhajda[12]和Yin[13]通过优化培养基pH值等条件,使酵母中硒含量分别达到了1 200-1 400 µg/g和639 µg/g。
研究发现甘油有利于黏红酵母的富硒,可能与甘油通过3-磷酸甘油醛和部分少量的糖酵解代谢降解生成的乙醇和过氧化氢加强酵母细胞抵抗外界胁迫环境的生理机制[22],并且调节胞内渗透压的平衡和氧化还原势的平衡[23]有关。磷元素可以强化黏红酵母的富硒能力,可能与酵母对硒的耐受性和转运有关。有研究表明,高亲和力磷酸盐转运蛋白与低亲和力磷酸盐转运蛋白均参与硒的吸收,当酵母细胞生长在低浓度磷酸盐环境中时,高亲和力转运蛋白Pho84p参与硒的转运,当酵母细胞处于高浓度磷酸盐环境中时,低亲和力转运蛋白Pho87p和Pho90p促进硒的吸收[8, 23]。
4 结论本研究在富硒地带的葡萄园土壤中筛选到一株初始富硒量较高的野生酵母菌株,经形态和分子生物学鉴定,命名为Rhodotorula glutinis X-20。通过优化培养基的碳源、氮源,硒盐添加时间,培养基的微量元素强化Rhodotorula glutinis X-20富集硒能力,最后将酵母菌株的富硒量提高到了5 009 µg/g。
| [1] |
Easterling ER, French WT, Hernandez R, et al. The effect of glycerol as a sole and secondary substrate on the growth and fatty acid composition of Rhodotorula glutinis[J]. Bioresour Technol, 2009, 100(1): 356-361. DOI:10.1016/j.biortech.2008.05.030 |
| [2] |
Rayman MP. Selenium and human health[J]. The Lancet, 2012, 379(9822): 1256-1268. DOI:10.1016/S0140-6736(11)61452-9 |
| [3] |
史泽旭, 朱莉, 高敏杰, 等. 优化碳源及Na2SeO3补料策略强化发酵生产富硒酵母[J]. 食品与发酵工业, 2016(7): 48-52. |
| [4] |
Kieliszek M, Błażejak S. Current knowledge on the importance of selenium in food for living organisms: a review[J]. Molecules, 2016, 21(5): 609. DOI:10.3390/molecules21050609 |
| [5] |
Navarro-Alarcon M, Cabrera-Vique C. Selenium in food and the human body: a review[J]. Science of the total environment, 2008, 400(1): 115-141. |
| [6] |
Dumont E, Vanhaecke F, Cornelis R. Selenium speciation from food source to metabolites: a critical review[J]. Analytical and bioanalytical chemistry, 2006, 385(7): 1304-1323. DOI:10.1007/s00216-006-0529-8 |
| [7] |
Kieliszek M, Błażejak S, Gientka I, et al. Accumulation and metabolism of selenium by yeast cells[J]. Applied microbiology and biotechnology, 2015, 99(13): 5373-5382. DOI:10.1007/s00253-015-6650-x |
| [8] |
Pérezsampietro M, Serracardona A, Canadell D, et al. The yeast Aft2 transcription factor determines selenite toxicity by controlling the low affinity phosphate transport system[J]. Sci Rep, 2016, 6: 32836. DOI:10.1038/srep32836 |
| [9] |
Kot AM, Błażejak S, Kurcz A, et al. Rhodotorula glutinis—potential source of lipids, carotenoids, and enzymes for use in industries[J]. Applied Microbiology and Biotechnology, 2016, 100(14): 6103-6117. DOI:10.1007/s00253-016-7611-8 |
| [10] |
ünlü AE, Takaç S. Investigation of the simultaneous production of superoxide dismutase and catalase enzymes from Rhodotorula glutinis under different culture conditions[J]. Artif Cells Blood Substit Immobil Biotechnol, 2012, 40(5): 338-344. DOI:10.3109/10731199.2012.668910 |
| [11] |
Ca PDL, Bayón MM, Paquin C, et al. Selenium incorporation into Saccharomyces cerevisiae cells: a study of different incorporation methods[J]. J Appl Microbiol, 2002, 92(4): 602-610. DOI:10.1046/j.1365-2672.2002.01562.x |
| [12] |
Suhajda A, Hegóczki J, Janzsó B, et al. Preparation of selenium yeasts Ⅰ. Preparation of selenium-enriched Saccharomyces cerevisiae[J]. J Trace Elem Med Biol, 2000, 14(1): 43-47. DOI:10.1016/S0946-672X(00)80022-X |
| [13] |
Yin H, Fan G, Gu Z. Optimization of culture parameters of selenium-enriched yeast(Saccharomyces cerevisiae)by response surface methodology(RSM)[J]. LWT-Food Science and Technology, 2010, 43(4): 666-669. DOI:10.1016/j.lwt.2009.11.010 |
| [14] |
Zhang GC, Wang DH, Wei GY. The mechanism of improved intracellular organic selenium and glutathione contents in selenium-enriched Candida utilis by acid stress[J]. Applied Microbiology and Biotechnology, 2017, 101(5): 2131-2141. DOI:10.1007/s00253-016-8016-4 |
| [15] |
Pankiewicz U, Sujka M, Kowalski R, et al. Effect of pulsed electric fields(PEF)on accumulation of selenium and zinc ions in Saccharomyces cerevisiae cells[J]. Food Chemistry, 2017, 221: 1361-1370. DOI:10.1016/j.foodchem.2016.11.018 |
| [16] |
Ruocco MHW, Chan CS, Hanson TE, et al. Characterization and distribution of selenite reduction products in cultures of the marine yeast Rhodotorula mucilaginosa-13B[J]. Geomicrobiology Journal, 2014, 31(9): 769-778. DOI:10.1080/01490451.2014.888909 |
| [17] |
Morales A, Alvear M, Valenzuela E. Screening, evaluation and selection of phosphate-solubilising fungi as potential biofertiliser[J]. Journal of Soil Science and Plant Nutrition, 2011, 11(4): 89-103. DOI:10.4067/S0718-95162011000400007 |
| [18] |
Wang J, Wang B, Zhang D, et al. Selenium uptake, tolerance and reduction in Flammulina velutipes supplied with selenite[J]. Peer J, 2016, 4: e1993. DOI:10.7717/peerj.1993 |
| [19] |
Lorenz E, Runge D, Marbà-Ardébol A M, et al. Systematic development of a two-stage fed-batch process for lipid accumulation in Rhodotorula glutinis[J]. J Biotechnol, 2017, 246: 4-15. DOI:10.1016/j.jbiotec.2017.02.010 |
| [20] |
Kieliszek M, Błażejak S, Kurek E. Binding and conversion of selenium in Candida utilis ATCC 9950 yeasts in bioreactor culture[J]. Molecules, 2017, 22(3): 352. DOI:10.3390/molecules22030352 |
| [21] |
Patil Y, Junghare M, Müller N. Fermentation of glycerol by Anaerobium acetethylicum and its potential use in biofuel production[J]. Microb Biotechnol, 2017, 10(1): 203-217. DOI:10.1111/1751-7915.12484 |
| [22] |
陈献忠, 王正祥, 诸葛健. 酵母细胞甘油代谢与生理功能研究进展[J]. 中国生物工程杂志, 2010, 30(5): 140-148. |
| [23] |
Lazard M, Blanquet S, Fisicaro P, et al. Uptake of selenite by Saccharomyces cerevisiae involves the high and low affinity orthophosphate transporters[J]. J Biol Chem, 2010, 285(42): 32029-32037. DOI:10.1074/jbc.M110.139865 |




