2. 江苏天江药业有限公司,江阴 214400
2. Tianjiang Pharmaceutical Industry of Jiangsu Province, Jiangyin 214400
纤维素酶在生物乙醇的生产过程中具有重要作用。但纤维素酶生产成本较高,在一定程度上限制了生物能源行业的发展[1]。目前,工业上常采用液体发酵法生产纤维素酶,其中原材料就占到了生产成本的40%-60%[2]。可见控制原材料的成本可以有效地降低纤维素酶的生产成本。此外,工业上还通过筛选高产菌株来控制生产成本[3]。
我国每年大概产生3 000万t左右的中药药渣。中药药渣的大量排放,已经对环境造成了严重的破坏,同时也严重制约了中药产业的发展[4]。目前,药渣过剩的问题已经引起了越来越多的关注。特别是利用生物发酵技术对药渣进行再利用研究,已经成为目前的研究热点。如敖杨等[5]利用生物发酵将金莲花药渣转化为饲料添加剂,其可以显著改善肉鸡的生产性能。黄凡等[6]利用黑曲霉固态发酵三七药渣生产纤维素酶。
甘草是临床上常用药,每年仅其制剂及提取物的消耗量就达近万吨,也因此产生了大量的废弃甘草药渣[7]。研究发现,甘草药渣不仅可以作为提取药用活性成分的原料,还可以作为廉价的生物质资源。甘草药渣中除含有丰富药用活性成分外[8-9],其纤维素、半纤维素及木质素的含量分别达到17.4%、16.95%和9.54%[10]。近年来,关于甘草药渣的研究主要是对其生物活性物质的再利用研究,如张娟等[11]利用甘草药渣制备甘草查尔酮A; 方诗琪等[7]从甘草药渣中分离出具有抗氧化活性的物质。但甘草药渣在提取有效成分以后,其残余的固体物质仍会对环境造成污染。由此可见,仅利用甘草药渣的有效成分,仍不能有效的处置甘草药渣。因此,需要对甘草药渣中的有效成分和纤维素资源进行综合利用,尤其是纤维素资源的再利用研究。本实验的主要目的是筛选能够有效降解甘草药渣的菌株,确定菌株的最佳产酶工艺,同时研究该酶对甘草药渣的降解效率,以及酶解后药渣中药用活性成分提取率的变化。旨在合理处置甘草药渣,同时生产成本低廉、性能良好的纤维素酶。
1 材料与方法 1.1 材料 1.1.1 菌株草酸青霉G2由本实验室从腐烂的甘草植株(甘肃定西)中分离得到。
1.1.2 甘草药渣甘草药渣由江阴天江药业提供,经南京中医药大学段金廒教授鉴定为乌拉尔甘草药渣。甘草药渣经自然风干、烘干、粉碎、过60目筛后,置于干燥器中备用。
1.1.3 培养基选择培养基:(NH4)2SO4 3 g/L、尿素0.3 g/L、KH2PO4 2 g/L、甘草药渣50 g/L、MgSO4 0.5 g/L; CMC-Na平板:(NH4)2SO4 3 g/L、尿素0.3 g/L、KH2PO4 2 g/L、MgSO4 0.5 g/L、CMC-Na 10 g/L、琼脂15 g/L; PDA培养基:土豆200 g/L、葡萄糖10 g/L、琼脂15 g/L; 种子培养基:酵母膏1 g/L、葡萄糖1 g/L、(NH4)2SO4 3 g/L、尿素0.3 g/L、KH2PO4 2 g/L; 初始发酵培养基:甘草药渣、(NH4)2SO4 3 g/L、尿素0.3 g/L、KH2PO4 2 g/L、MgSO4 0.5 g/L、0.1%金属离子(FeSO4·7H2O 0.005 g/L、MnSO4·H2O 0.001 6 g/L、ZnSO4·7H2O 0.001 4 g/L、CoCl2 0.002 g/L)、0.1%吐温-80。
1.2 方法 1.2.1 菌株的筛选与鉴定菌株筛选:取腐烂的甘草或土壤1 g。将其分别置于以药渣为唯一碳源的选择培养基上进行富集,30℃、培养48 h。再将培养液适当的稀释,并涂抹到CMC-Na平板上,30℃、培养72 h。刚果红染色,挑选透明圈较明显的菌落置于PDA平板上进行纯化。同时,对纯化后的菌株进行液体发酵复筛。菌株的鉴定:对复筛后的菌株,进行形态学观察,同时外出送样进行测序。
1.2.2 培养方法斜面培养:将菌株划线接种于PDA斜面,30℃培养48 h。种子培养:每支斜面加5 mL无菌水,取1 mL接入种子培养基中,转速180 r/min,30℃、培养24 h。发酵培养:250 mL三角瓶中装入发酵培养基80 mL,按5%接种量接入种子培养液,转速180 r/min摇床培养。
1.2.3 酶活测定发酵液经4 000 r/min离心30 min,收集上清液即为粗酶液。参照文献[12],粗酶液经适当稀释后,采用DNS比色法,测定滤纸酶、内切酶活力。参照文献[13],粗酶液经适当稀释后,测定β-葡萄糖苷酶活。(1 mL酶液在pH4.8、50℃恒温水浴条件下水解底物,1 min内生成1 μmol葡萄糖定义为一个酶活单位,用U/mL表示。)
1.2.4 草酸青霉G2产酶条件分析分别考察药渣含量、初始pH、发酵温度、发酵时间、原材料预处理方式等因素对草酸青霉G2液体发酵的影响,并测量各发酵液的纤维素酶活力。
1.2.4.1 药渣含量对酶活的影响在初始发酵培养基中分别添加1%、3%、5%、7%、9%、11%的甘草药渣,其它条件不变,30℃、自然pH发酵120 h。
1.2.4.2 初始pH对酶活的影响在单因素实验1.2.4.1的结果下,将发酵培养基的pH分别调至3.0、4.0、5.0、6.0、7.0、8.0,30℃发酵120 h,测量各发酵液的纤维素酶活性。
1.2.4.3 发酵温度对酶活的影响在单因素实验1.2.4.1和1.2.4.2的结果下,发酵温度分别为20、25、30、35、40℃的条件下培养120 h,测量各发酵液的纤维素酶活性。
1.2.4.4 发酵时间对酶活的影响在单因素实验1.2.4.1-1.2.4.3的结果下,分别发酵24、48、72、96、120、144、168、192 h,测量各发酵液的纤维素酶活性。
1.2.4.5 原材料预处理方式对酶活的影响以分别经过超声2 h、5% NaOH静置24 h、5% NaOH超声2 h处理的甘草药渣为基质配制培养基。在发酵培养基起始pH6.0、药渣含量3%、及培养基其它条件不变的情况下,30℃发酵144 h,测量各发酵液的纤维素酶活。以空白组的酶活为100%,计算相对酶活。
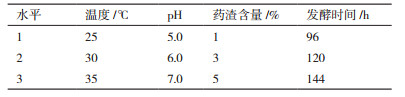
1.2.5 草酸青霉G2产酶条件优化在单因子实验基础上,采用对发酵结果影响较大的药渣用量、发酵时间、初始pH值、发酵温度4个因素,进行L9(34)正交实验(见表 1),以滤纸酶活及内切酶活为指标用于优化草酸青霉G2液体发酵条件。
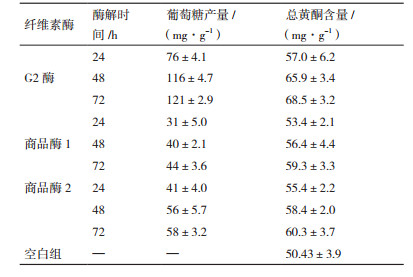
参考文献[14],利用G2酶、商品酶1(Sigma)、商品酶2(Novozymes)对甘草药渣进行酶解研究。G2酶组、商品酶1组、商品酶2组中酶的用量为10 U/g(每克甘草药渣),所有组中固液比1:50(pH4.8的柠檬酸缓冲盐),空白组最后加入相同量的缓冲液。在50℃、200 r/min的条件下分别酶解24、48、72 h,取样测定葡萄糖含量及总黄酮的含量。依据文献[15]利用葡萄氧化酶法测定葡萄糖量。甘草总黄酮的提取:料液比1:20,70%乙醇超声提取30 min,提取两次,过滤,合并两次滤液。参考文献[16],测定甘草总黄酮的含量。
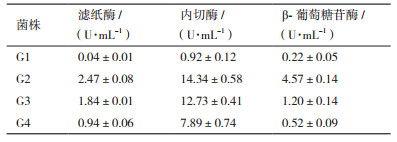
2 结果 2.1 甘草药渣降解菌的筛选及鉴定 2.1.1 菌种初筛从腐烂的甘草、土壤中筛选得到25株能以甘草药渣为唯一碳源生长的菌株,其中4株长势最佳,且在纤维素-刚果红平板上透明圈较大。同时,经过液体发酵酶活力初步测定(表 2),菌株G2最优,故挑选该菌做后续研究。
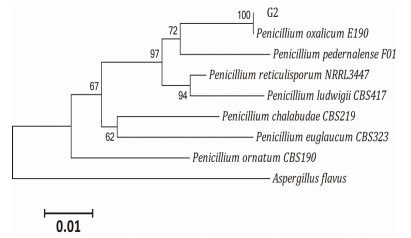
将菌株G2接种于PDA培养基上28℃培养3 d,菌落平坦或近于平坦,质地绒状,菌丝初为白色后逐渐变为暗绿色,分生孢子易脱落,分生孢子结构大量产生,分生孢子面深橄榄绿色,渗出液缺乏,反面近于无色,可溶性色素缺乏。根据以上特征,参照《真菌鉴定手册》和《中国真菌志》,菌株可初步判定为半知菌纲(Fungi Imperficti)壳霉目(Sphaeropsidales)杯霉科(Discellaceae)青霉属(Penicillium)。菌株经18S rDNA鉴定为草酸青霉菌(Penicillium oxalicum),命名为草酸青霉菌G2。
|
| 图 1 草酸青霉菌G2的18S rDNA进化树分析 |
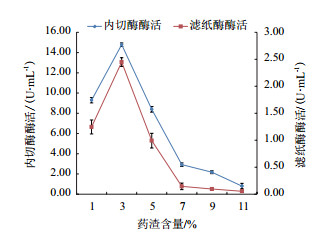
利用甘草药渣作为唯一碳源,考察培养基中不同含量的甘草药渣对酶活的影响。结果如图 2所示。培养基中甘草药渣含量为3%时,滤纸酶和内切酶活均为最高。当药渣含量高于3%时,滤纸酶和内切酶活均开始出现不同程度的降低,尤其是滤纸酶活力降低的较为明显。
|
| 图 2 不同含量药渣对酶活的影响 |
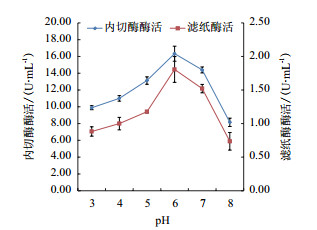
图 3为在液态发酵条件下滤纸酶和内切酶活力变化曲线。当培养基的初始pH6-7时,内切酶与滤纸酶活力均较高。当培养基的初始pH3-6时,随着pH的增加内切酶与滤纸酶活力均逐渐增加; 培养基的初始pH大于7时内切酶和滤纸酶活均显著降低,pH8.0时,内切酶与滤纸酶活均到达最低值。
|
| 图 3 初始pH对酶活的影响 |
如图 4所示,发酵温度20℃时,酶活力最低。发酵温度30℃时,滤纸酶活和内切酶活均达到最高。当发酵温度高于30℃时,酶活开始下降,内切酶活下降的较为明显,但滤纸酶活下降并不明显。温度为40℃时,内切酶活和滤纸酶活均高于20℃。
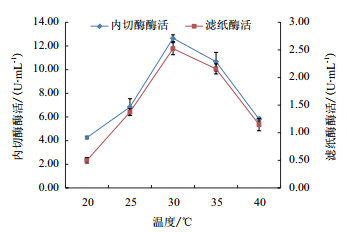
|
| 图 4 温度对酶活的影响 |
如图 5所示,随着发酵时间的延长,酶活力逐渐升高,发酵144 h时,滤纸酶活和内切酶活均达到最大值。发酵时间低于144 h时,随着发酵时间的增加,滤纸酶活和内切酶活出现不同程度的升高。当发酵时间高于144 h时,此时滤纸酶活和内切酶活开始显著下降。
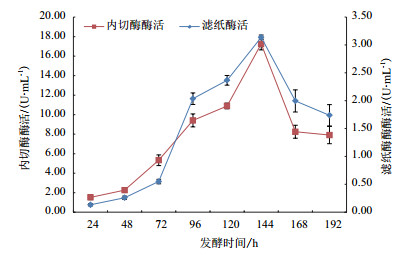
|
| 图 5 发酵时间对酶活的影响 |
以经过不同预处理方式的甘草药渣为基质配制发酵培养基,其对酶活的影响如图 6。结果表明,预处理组的酶活均低于未处理组。其中NaOH超声2 h组,产生的酶活最低。在所有预处理组中,滤纸酶活力下降的水平比内切酶更显著。由于原材料的预处理,导致滤纸酶活力的显著下降,因此采用不经预处理的甘草药渣进行发酵。
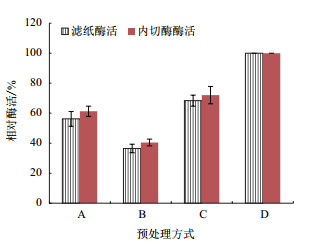
|
| 图 6 原材料预处理方式酶活的影响 A:超声2 h; B:NaOH超声2 h; C:NaOH静置24 h; D:空白 |
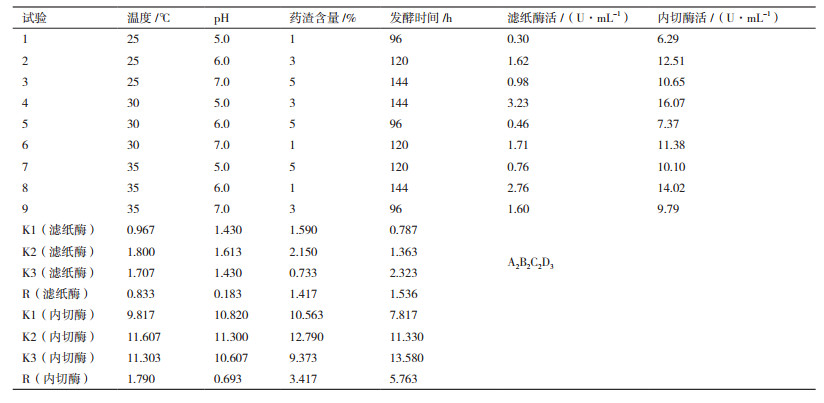
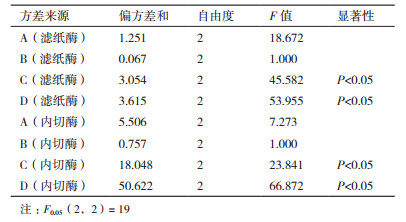
在单因子实验基础上,采用对发酵结果影响较大的发酵温度(A)、初始pH值(B)、药渣含量(C)、发酵时间(D)4个因素,以滤纸酶活及内切酶活为指标,进行L9(34)的正交实验,用于优化草酸青霉G2液体发酵条件。试验安排及结果见表 3,方差分析见表 4。实验结果显示,上述4个因素对滤纸酶活与内切酶活的影响一致。由直观分析可知,4个因素对滤纸酶与内切酶活的影响顺序D>C>A>B。表 4方差分析结果表明,因素C、D的不同水平对滤纸酶活有显著影响(P < 0.05,P < 0.05),这与直观分析的结果一致。因此,最佳发酵工艺条件为A2B2C2D3,即发酵温度30℃、起始pH6.0、药渣含量3%、发酵时间144 h。
通过正交实验优选出的最佳组合A2B2C2D3,并未出现在正交实验中。因此需要进行工艺验证。结果最优组合的滤纸酶活为3.43 U/mL,较正交试验中的较优组合3.23 U/mL提高了6.2%;内切酶活为16.89 U/mL,高于正交试验中的较优组合16.07 U/mL,提高了5%。因此,G2的最适发酵条件为:甘草药渣含量3%、温度30℃、起始pH6.0、发酵时间144 h。
2.5 甘草药渣的酶解研究如表 5所示,G2酶对甘草药渣的降解作用明显优于商品酶1及商品酶2。在酶解72 h时,G2酶组葡萄糖产量达到最大值121 mg/g,同时总黄酮含量达到68.5 mg/g,与空白组相比总黄酮提取率提高36.2%。酶解72 h时,商品酶1组的葡萄糖产量达到最大值44 mg/g,总黄酮含量达到59.3 mg/g,与空白组相比总黄酮提取率提高17.7%;商品酶2组的葡萄糖产量达到最大值58 mg/g,总黄酮含量达到60.3 mg/g,与空白组相比总黄酮提取率提高了19.6%。
筛选性能优良纤维素酶生产菌,是降低纤维素酶生产成本的有效途径之一[17]。本试验以腐烂的甘草及土壤为筛选对象。同时,为了避免遗漏优良菌种,除了采用传统的刚果红平板法进行初筛外,还以多种纤维素酶活为指标,利用甘草药渣为底物进行液体发酵复筛。最后从腐烂的甘草中筛选出纤维素降解菌G2,结合形态学以及18S rDNA分析结果确定为草酸青霉。目前,关于草酸青霉的研究较多,不同的研究结果表明,菌株发酵产纤维素酶的性能受培养基组成、原料的品质、菌种数量、操作条件等因素的影响。如李洋等[18]研究发现,碳源、氮源、发酵初始pH对草酸青霉菌株产酶性能有显著影响。
本试验考察了药渣含量、发酵温度、发酵起始pH、发酵时间以及原材料预处理方式对草酸青霉G2发酵影响。培养基的碳氮比直接影响了发酵效率和微生物的产酶能力[18]。当培养基中药渣含量发生变化时,其碳氮比也会发生明显变化,从而导致微生物的产酶效率发生不同程度的变化。发酵起始pH6-7时,G2的产酶性能较高; pH﹥7时,G2的产酶性能显著降低。草酸青霉菌适宜在酸性条件下生长[19],因此当环境pH呈酸性时利于菌体的生长以及菌株发酵性能的提高。发酵时间低于144 h时,随着发酵时间的增加,滤纸酶活和内切酶活出现不同程度的升高,这与生物量逐渐增加以及菌体的活力逐渐达到最大值有关。当发酵时间高于144 h时,此时滤纸酶活和内切酶活显著下降,这可能与发酵液中营养物质的减少以及菌体的活力下降有关。原材料经超声和NaOH处理均能有效的破坏其木质素的结构,从而暴露纤维素[20-21]。但甘草药渣经超声和碱处理以后,酶活却出现了降低,推测是由于实验菌株G2分离于腐烂的甘草,G2的生长可能依赖于甘草中的某些成分如:三萜皂苷、黄酮、多糖及蛋白等。本研究虽然应用的是甘草药渣,对其成分分析结果显示仍含有一定量的这些成分,但这些成分在预处理过程中会大量损失,如超声处理可促进这些成分进入溶媒中,碱处理可破坏这些成分,两者结合会使这些成分的损失更加严重,损失越多越不利于菌株G2的生长,从而导致菌株的产酶效率降低,图 6的结果似乎亦支持这一推测。
正交分析结果表明,药渣含量、发酵时间对菌种的发酵影响较大。同时,还确定了G2的最佳产酶条件:药渣含量3%、温度30℃、起始pH6.0、发酵时间144 h。G2利用优化后的工艺进行发酵,滤纸酶活和内切酶活分别达到了3.43 U/mL和16.89 U/mL,滤纸酶活高于此前报道的草酸青霉IODBF-5液体发酵的酶活2.7 U/mL[22]。
甘草药渣的酶解结果表明,G2酶对甘草药渣的酶解效率高于商品酶1、2。李琼翠等[10]用商品酶酶解甘草药渣葡萄糖产率仅为29.07 mg/g,低于本试验的121 mg/g。商品酶在纯化的过程中,其成分会出现一定程度上的损失,从而导致其酶活降低[23]。因此,有可能导致商品酶在酶解效率上低于G2生产的粗酶液。已有研究表明,生产纤维素酶的底物与酶解底物为同一原材料时,其生产的纤维素酶对该材料的酶解效率更高[12]。
4 结论草酸青霉G2液体发酵甘草药渣可以产生活力较高的纤维素酶,并且该酶能够有效地糖化甘草药渣,同时使药渣中有效成分的提取率得到显著提高。
| [1] |
Maeda RN, Barcelos CA, Santa Anna LM, et al. Cellulase production by Penicillium funiculosum and its application in the hydrolysis of sugar cane bagasse for second generation ethanol production by fed batch operation[J]. J Biotechnol, 2013, 163(1): 38-44. DOI:10.1016/j.jbiotec.2012.10.014 |
| [2] |
Ncube T, Howard RL, Abotsi EK, et al. Jatropha curcas seed cake as substrate for production of xylanase and cellulase by Aspergillus niger FGSCA733 in solid-state fermentation[J]. Industrial Crops & Products, 2012, 37(1): 118-123. |
| [3] |
Dhillon GS, Kaur S, Brar SK, et al. Potential of apple pomace as a solid substrate for fungal cellulase and hemicellulase bioproduction through solid-state fermentation[J]. Industrial Crops & Products, 2012, 38(3): 6-13. |
| [4] |
段金廒, 宿树兰, 等. 中药废弃物的转化增效资源化模式及其研究与实践[J]. 中国中药杂志, 2013, 38(23): 3991-3996. |
| [5] |
敖杨, 等. 金莲花药渣发酵物对肉仔鸡生产性能、抗氧化指标及免疫功能的影响[J]. 饲料研究, 2014(11): 38-43. |
| [6] |
黄凡, 谭显东, 胡伟, 等. 黑曲霉固态发酵三七渣产纤维素酶[J]. 环境工程学报, 2015, 9(9): 4547-4552. DOI:10.12030/j.cjee.20150973 |
| [7] |
方诗琦. 甘草药渣中黄酮类活性成分研究[D]. 南京: 南京中医药大学, 2016. http://www.doc88.com/p-8758618129219.html
|
| [8] |
豆康宁, 王飞, 罗海澜, 等. 甘草及提取物在食品中的应用进展[J]. 食品研究与开发, 2014(21): 140-142. DOI:10.3969/j.issn.1005-6521.2014.21.037 |
| [9] |
白阳, 孙正旺, 刘春莹, 等. 甘草总黄酮的制备及其抗皮肤老化功能[J]. 大连工业大学学报, 2015(5): 317-319. |
| [10] |
李琼翠, 段晓健, 等. 酸碱复合处理和酶浓度对药渣纤维素水解效率的影响[J]. 化工进展, 2013(9): 2200-2204. |
| [11] |
张娟, 卿德刚, 孙宇, 等. 甘草药渣中甘草查尔酮A的制备[J]. 新疆中医药, 2016, 34(2): 39-40. |
| [12] |
Li Q, Wei TN, Jin CW. Isolation, characterization and application of a cellulose-degrading strain Neurospora crassa S1 from oil palm empty fruit bunch[J]. Microb Cell Fact, 2014, 13(1): 157. DOI:10.1186/s12934-014-0157-5 |
| [13] |
Delabona PS, Farinas CS, Da SM, et al. Use of a new Trichoderma harzianum strain isolated from the Amazon rainforest with pretreated sugar cane bagasse for on-site cellulase production[J]. Bioresour Technol, 2012, 107(2): 517. |
| [14] |
Dave BR, Parmar P, Sudhir A, et al. Cellulases production under solid state fermentation using agro waste as a substrate and its application in saccharification by Trametes hirsuta NCIM[J]. Journal of Microbiology Biotechnology & Food Sciences, 2015, 04(3): 203-208. |
| [15] |
Zhao XH, Wang W, Tong B, et al. A Newly Isolated Penicillium oxalicum 16 Cellulase with high efficient synergism and high tolerance of Monosaccharide[J]. Appl Biochem Biotechnol, 2016, 178(1): 173-183. DOI:10.1007/s12010-015-1866-x |
| [16] |
Xu MS, Chen S, Wang WQ, et al. Employing bi-functional enzymes for enhanced extraction of bioactives from plants:flavonoids as an example[J]. J Agric Food Chem, 2013, 61(33): 7941-8. DOI:10.1021/jf402125y |
| [17] |
Sørensen A, Teller PJ, et al. Onsite enzyme production during bioe-thanol production from biomass:screening for suitable fungal stra-ins[J]. Appl Biochem Biotechnol, 2011, 164(7): 1058-1070. DOI:10.1007/s12010-011-9194-2 |
| [18] |
李洋, 高晓蓉, 张健, 等. 草酸青霉菌生产纤维素酶的反应条件优化[J]. 生物技术通报, 2016, 32(2): 152-157. |
| [19] |
李争明, 张娟, 等. 纤维素酶产生菌的筛选、鉴定及发酵产酶条件优化[J]. 生物技术通报, 2015, 31(5): 146-152. |
| [20] |
Leite P, Salgado JM, et al. Ultrasounds pretreatment of olive pomace to improve xylanase and cellulase production by solid-state fermentation[J]. Bioresour Technol, 2016, 214: 737-746. DOI:10.1016/j.biortech.2016.05.028 |
| [21] |
Kim JS, Lee YY, Kim TH. A review on alkaline pretreatment technology for bioconversion of lignocellulosic biomass[J]. Bioresour Technol, 2015, 199: 42-48. |
| [22] |
Saini R, Saini JK, Adsul M, et al. Enhanced cellulase production by Penicillium oxalicum for bio-ethanol application[J]. Bioresour Techno, 2015, 188: 240-246. DOI:10.1016/j.biortech.2015.01.048 |
| [23] |
Lin C, Shen Z, Qin WS. Characterization of xylanase and cellulase produced by a newly isolated Aspergillus fumigatus, N2 and its efficient saccharification of barley straw[J]. Applied Biochemistry & Biotechnology, 2017, 182(2): 559-569. |