2. 山东农业大学生命科学学院,泰安 271018
2. College of Life Sciences, Shandong Agricultural University, Tai'an 271018
为了实现农产品的高产和稳产,农业生产过程往往会大量的施用化学肥料和农药,致使生态环境日趋严重[1]。为了农业的可持续发展,现代农业向绿色农业、生态农业方向转变已成为必然,微生物菌剂在其中的作用也日趋突出[2]。近年来,微生物菌剂被广泛的应用于生物防治中,迄今已有木霉菌[3]、枯草芽孢杆菌[4]和哈茨木霉[5]等微生物菌剂的相关报道,但关于黄赭色链霉菌菌剂的研制尚属空白。
由于微生物菌剂对外界环境因素(湿度、温度和光照等)比较敏感,容易导致菌剂储存的稳定性差[6],因此在实际生产微生物菌剂的过程中,可通过添加一些助剂来提高菌剂的稳定性,延长菌剂的保存期限[7]。目前国内外已有关于助剂对假单胞菌菌剂[8-9]、解淀粉芽孢杆菌BA-12可湿性粉剂[10]等的相关报道,而关于助剂对黄赭色链霉菌菌剂的影响鲜有报道。黄赭色链霉菌SN16为本实验室分离筛选并保藏的放线菌,对水稻恶苗病菌、层出镰刀菌、尖孢镰刀菌等有较好的拮抗作用。
因此,本试验将在前期研究工作的基础上,根据黄赭色链霉菌SN16的特性,对载体、保护剂和分散剂等进行筛选,旨在研发出一种便于贮藏的黄赭色链霉菌SN16菌剂,并探究其对小麦幼苗生长的影响,为新型的黄赭色链霉菌SN16菌剂的工业化生产提供理论依据。
1 材料与方法 1.1 材料供试菌株为黄赭色链霉菌SN16,由山东农业大学微生物工程实验室提供; 供试小麦品种:“优麦2号”,购自购自泰安市泰山区农大种业。
供试试剂:小米粉、麦麸、硅藻土、非耕作层黄土、高岭土、碳酸钙、碳酸镁、几丁质、羧甲基纤维素钠(CMC)、海藻酸钠、腐植酸、十二烷基硫酸钠(SDS)、Tween-80。培养基:高氏1号培养基[11],固体培养基(小米粉麦麸培养基)。
1.2 方法 1.2.1 黄赭色链霉菌SN16种子液的制备将保藏的黄赭色链霉菌SN16接入高氏1号培养基平板上活化,28℃培养3 d。然后将菌株SN16接种于装有100 mL高氏1号液体培养基的三角瓶(250 mL)中,于28℃,180 r/min条件下培养48 h,备用。
1.2.2 黄赭色链霉菌SN16原粉的制备以黄赭色链霉菌SN16固态发酵制备原粉,即80%小米粉与20%麦麸混匀,加入蒸馏水,使初始含水量达到50%,接种量10%,pH自然,28℃培养7 d。待发酵完成后取出培养物,于35℃恒温鼓风干燥。粉碎后即为黄赭色链霉菌SN16原粉,备用。
1.2.3 不同载体对黄赭色链霉菌SN16生长的影响选用硅藻土、非耕作层黄土、高岭土、碳酸钙、几丁质和碳酸镁等6种材料作为载体,分别以5%的量添加到含该菌的液体高氏1号培养基中,于28℃,180 r/min培养48 h。采用平板菌落计数法[11],并观察不同载体下SN16菌落生长情况。
1.2.4 载体对黄赭色链霉菌SN16菌剂的影响在1.2.3的基础上,将对菌株SN16生长具有促进作用的载体以5:8的比例与黄赭色链霉菌SN16原粉混合,分别包裹于牛皮纸中,以不添加载体的处理组为对照(CK),置于54℃培养7 d,采用平板菌落计数法测定各处理的存活率。每个处理重复3次。
1.2.5 保护剂的筛选以腐植酸、海藻酸钠作为保护剂,根据其化学性质,分别配制成0.1%、0.5%和1%浓度的溶液,以5:6的比例与黄赭色链霉菌SN16原粉混合,并于54℃培养7 d。采用平板菌落计数法测定各处理的存活率,每个处理重复3次。
1.2.6 分散剂的筛选以十二烷基硫酸钠(SDS)、Tween-80和羧甲基纤维素钠(CMC)为分散剂,分别配制成0.1%、0.5%和1%浓度的溶液,以5:6的比例与黄赭色链霉菌SN16原粉混合,并于54℃培养7 d。采用平板菌落计数法测定各处理的存活率,每个处理重复3次。
1.2.7 贮存时间对黄赭色链霉菌SN16菌剂的影响将优化后的载体、保护剂和分散剂按比例与黄赭色链霉菌SN16原粉混合,分别置于28℃和4℃的环境中储存,以不添加任何物质的原粉为对照组(CK),于1、7、15、30、45和60 d时定期取样,采用平板菌落计数法测定各处理的活菌数。每个处理重复3次。
1.2.8 黄赭色链霉菌SN16菌剂对小麦幼苗生长的影响精选大小一致、无病害的小麦种子,经5%的次氯酸钠表面消毒后,播种于含有310 g无菌土的花盆中(下直径10 cm,上直径15.5 cm,高度12.5 cm),每盆10粒种子。待小麦出芽后对其进行根灌处理,分别取5 mL 1%、2%和3%浓度的SN16菌剂浇于小麦根部,对照组施用等量无菌水,采用完全随机排列。培养期间浇灌清水保持土壤湿润,于培养45 d后测定相关指标。
1.2.9 测定项目及方法采用平板菌落计数法测定相关活菌数,存活率(%)=第n天活菌数/初始活菌数×100%。
从各个处理组随机选取5株小麦幼苗,采用卷尺测定小麦幼苗的株高和根长; 采用分析天平测定幼苗的株鲜重; 将幼苗于105℃杀青15 min,80℃烘干至恒重后,采用分析天平测定其株干重。
1.2.10 数据处理试验数据采用SPSS Statistics 22软件分析处理,采用Excel 2010作图,以LSD法做多重比较分析。
2 结果 2.1 黄赭色链霉菌SN16菌粉的助剂优化结果 2.1.1 载体对黄赭色链霉菌菌株SN16活性的影响由表 1所可知,添加硅藻土和非耕作土的处理,SN16菌株的生物量均显著高于对照(P < 0.05),添加碳酸钙和高岭土的处理与CK间的差异不显著(P> 0.05),而添加几丁质和碳酸镁的处理,SN16菌株的生物量均显著低于对照(P < 0.05)。这说明硅藻土与非耕作土对SN16菌株的生长具有促进作用,碳酸钙和高岭土对SN16菌株的生长没有显著影响,而几丁质和碳酸镁对SN16菌株的生长具有抑制作用。因此,硅藻土、非耕作土、碳酸钙和高岭土均可作为载体,而几丁质和碳酸镁不适合作为载体。
硅藻土、非耕作土、碳酸钙和高岭土等4种载体分别和菌粉混匀,于54℃的环境下贮存7 d,发现不同处理的活菌数出现了显著变化(图 1)。平均值多重比较结果(α=0.05),以硅藻土、碳酸钙为载体的菌粉与非耕作土、高岭土和空白对照的差异显著。表明硅藻土和碳酸钙对菌株的保护作用较好,7 d后菌剂的活菌数分别是CK的3.04倍和2.08倍; 非耕作土和高岭土对菌株的保护作用较差,但活菌数也均高于CK。

|
| 图 1 不同载体对黄赭色链霉菌SN16菌粉热贮稳定性的影响 |
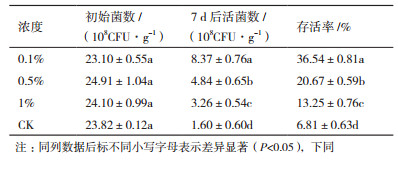
由表 2可知,腐植酸可以提高菌粉的热稳定性,当腐植酸添加量为0.1%时,黄赭色链霉菌SN16的存活率达36.54%,与CK相比提高了29.73%,但继续增大腐植酸的添加量,黄赭色链霉菌SN16的活菌数减少,存活率降低。从表 3可知,在热贮存的条件下,随着海藻酸钠浓度的增加,黄赭色链霉菌SN16的活菌数不断减少,存活率也不断降低,其中0.1%浓度的海藻酸钠对黄赭色链霉菌SN16的保护作用最好,存活率达到64.35%,与CK相比提高了58.00%。这表明适宜添加量的腐植酸和海藻酸钠对SN16菌粉具有保护作用。在热贮存7 d后,添加0.1%海藻酸钠的菌粉的存活率比添加了0.1%腐植酸的菌粉高出27.81%,说明添加0.1%海藻酸钠更利于SN16菌粉的贮藏。因此,本研究选取0.1%的海藻酸钠作为保护剂。
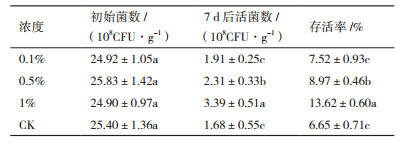
由表 4-6可知,在热贮存条件下,添加CMC、SDS和Tween-80后的菌剂存活率明显高于CK。其中,添加1%的CMC的菌粉的存活率为15.70%,添加1%的SDS菌粉存活率为13.62%,添加1%的Tween-80菌粉存活率为14.31%,均与CK差异显著(P < 0.05)。其中以添加1% CMC的菌粉存活率和活菌数最高,分别比CK提高了9.17%、2.45×108 CFU/g,这可能是CMC对孢子的分散和活力的提高都有促进作用。因此,本研究选取1%的CMC为最佳分散剂。
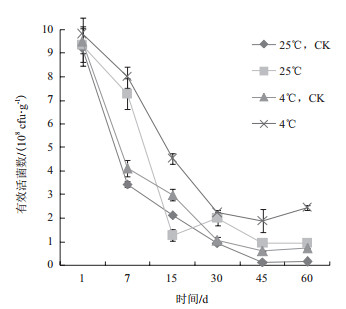
由图 2可知,黄赭色链霉菌SN16在添加的助剂中存活情况随着培养时间的延长而发生改变,添加助剂的菌剂的活菌数均高于CK。添加助剂的菌剂在常温(25℃)下,其活菌数下降迅速,但在15 d后活菌数趋于稳定,到60 d时,活菌数为0.94×108 CFU/g,存活率达到10.00%。添加助剂的菌剂在4℃的贮存条件下,活菌数下降较为缓慢,到60 d时,其活菌数是2.45×108 CFU/g,存活率为24.90%,与不添加任何助剂的CK的存活率相比,高17.34%。说明加入助剂的菌剂比未加入助剂的菌剂更利于贮藏,生物活性更稳定。
|
| 图 2 菌剂有效活菌数测定结果 |
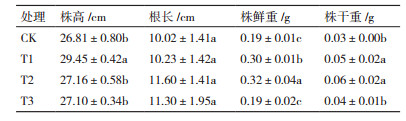
黄赭色链霉菌SN16菌剂对小麦幼苗生长的影响如表 7所示。施用1%黄赭色链霉菌SN16菌剂的处理(T1),小麦幼苗的株高比对照提高了9.85%,达到了显著水平(P < 0.05),而施用2%和3%的处理(T2和T3),小麦幼苗的株高与对照差异不显著(P> 0.05)。与对照相比,T1和T2的根鲜重与根干重均显著增大(P < 0.05);T1和T2之间,虽然根鲜重差异显著(P < 0.05),但根干重差异并不显著(P> 0.05);T3的根鲜重与根干重与对照差异不显著(P < 0.05)。综合考虑应用效果和使用成本,宜选择1%为黄赭色链霉菌SN16菌剂最佳施用量。
微生物菌剂的贮存稳定性直接影响其产品质量与应用效果。选择合适的载体和添加保护剂可以提高微生物菌剂的贮存稳定性。硅藻土的主要成分为SiO2,其结构呈微孔状,孔隙度较宽、孔洞排列整齐、吸收性好、比表面积大、耐磨、热稳定好,附着力强,对微生物有保护作用,是生产微生物菌剂常用的载体之一[12-13]。本研究证实硅藻土作为黄赭色链霉菌SN16的载体,其应用效果优于高岭土、碳酸钙、几丁质等常用载体,这与骞天佑[16]报道一致。
放线菌具有适应环境的能力强,能够在植物根系和根周围的土壤中定殖,并产生多种抗生素和分泌多种胞外水解酶[14],能产生存活时间长的孢子等优点,有利于工业化生产及应用,但放线菌必须与合适的助剂混合到一起,才能发挥更好的作用[15]。许多性状优良的放线菌制剂已经应用于农业生产中,骞天佑等[16]采用添加非耕作层黄土的生防放线菌153活菌剂明显提高了茄子的防病能力; 申光辉等[17]研究表明,硅酸钾与密旋链霉菌Act12菌剂配施可显著促进连作草莓生长,提高果实产量及品质。然而目前国内尚无黄赭色链霉菌菌剂的相关报道。本研究盆栽试验表明,施用一定浓度的黄赭色链霉菌SN16菌剂能够有效促进小麦的根长、株鲜重、株干重,这与田琴[18]的研究结果相一致。本研究初步确定了黄赭色链霉菌SN16菌剂的各项组分,并探讨了其对小麦幼苗生长的影响,而对于黄赭色链霉菌SN16菌剂在田间的应用效果如何,后续试验对此将进一步深入研究。
4 结论通过单因素实验确定了菌剂的最佳配方:黄赭色链霉菌SN16原粉20%,海藻酸钠溶液(1 mg/mL)24%,CMC溶液(10 mg/mL)24%,硅藻土32%。添加这3种助剂后,黄赭色链霉菌SN16活体粉剂于4℃保存60 d后其生物量为2.45×108 CFU/g,存活率达到24.90%,常温保存60 d后能达到0.94×108 CFU/g。盆栽实验结果表明,1%浓度的黄赭色链霉菌SN16菌剂能够对小麦幼苗的株高、鲜重、株干重具有显著的促进作用,分别比对照组提高了9.85%、57.90%和66.67%。
| [1] |
许景钢, 孙涛, 李嵩. 我国微生物肥料的研发及其在农业生产中的应用[J]. 作物杂志, 2016(1): 1-6. |
| [2] |
毛开云, 陈大明, 江洪波. 微生物肥料新品种研发及产业化发展态势分析[J]. 农业生物技术, 2014, 3(5): 33-40. |
| [3] |
李琼芳, 曾华兰, 叶鹏盛, 等. 哈茨木霉(Trichoermaharzianum)T23生防菌筛选及防治中药材根腐病的研究[J]. 西南大学学报:自然科学版, 2007, 29(11): 119-122. |
| [4] |
李秀明. 生防木霉菌T4和枯草芽孢杆菌B99-2制剂的研制及田间试验[D]. 上海: 华东理工大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10251-1013155308.htm
|
| [5] |
Harman GE. Myths and dogmas of biocontrol-changcs in perceptions derived from research on Trichoderma hargianura T-22[J]. Plant Disease, 2000, 84(4): 377-393. DOI:10.1094/PDIS.2000.84.4.377 |
| [6] |
朱昌雄, 振华, 蒋细良, 等. 微生物农药剂型研究发展趋势[J]. 现代化工, 2003, 23(3): 4-8. |
| [7] |
刘振华, 邢雪琨. 微生物农药助剂研究进展[J]. 基因组学与应用生物学, 2016, 35(8): 2109-2113. |
| [8] |
李慧, 王平, 肖明. 硅藻土和滑石粉作为荧光假单胞菌P13菌剂的载体研究[J]. 中国生物防治, 2009, 25(3): 239-244. |
| [9] |
王婧, 方蕊, 蒋秋月, 等. 载体和保护剂对桔黄假单胞菌JD37微生物肥料活性的影响[J]. 上海师范大学学报:自然科学版, 2012, 41(2): 179-185. |
| [10] |
李姝江, 方馨玫, 曾艳玲, 等. 解淀粉芽孢杆菌BA-12可湿性粉剂研制及对核桃根腐病的防治效果[J]. 中国生物防治学报, 2016, 32(5): 619-626. |
| [11] |
沈萍, 陈向东. 微生物学实验[M]. 北京: 高等教育出版社, 2007, 29-31.
|
| [12] |
Anderson WA, Bay P, Legge RL, et al. Adsorption of Streptococcus facials on diatomite carriers for use in bio-transformations[J]. Chemical Techno Biotechnology, 1990, 47(2): 93-100. |
| [13] |
Ding C, Shen Q, Zhang R, et al. Evaluation of rhizosphere bacteria and derived bio-organic fertilizers as potential biocontrol agents against bacterial wilt(Ralstonia solanacearum)of potato[J]. Plant Soil, 2013, 366(1): 453-466. |
| [14] |
Gopalakrishnan S, Pande S, Sharma M, et al. Evaluation of actionmycete isolates obtained from herbal vermicompost for the biological control of Fusarium wilt of chickpea[J]. Crop Protection, 2011, 30: 1070-1078. DOI:10.1016/j.cropro.2011.03.006 |
| [15] |
Zhu Z, Zhang G Y, Luo Y, et al. Production of lipopeptides by Bacillus amyloliquefaciens XZ -173 in solid state fermentation using soybean flour and rice straw as the substrate[J]. Bioresour Technol, 2012, 112(1): 254-260. |
| [16] |
骞天佑, 唐彩乐, 田晓丽, 等. 生防放线菌153活菌剂填料的选择及其防病促生作用研究[J]. 西北农林科技大学学报, 2009, 37(4): 169-172. |
| [17] |
申光辉, 薛泉宏, 陈秦, 等. 硅酸钾与密旋链霉菌Act12菌剂配配施对连作草莓生长、果实产量及品质的影响[J]. 中国生态农业学报, 2012, 20(3): 315-321. |
| [18] |
田琴. 小麦内生放线菌的分离鉴定及防病促生作用研究[D]. 杨凌: 西北农林科技大学, 2012. http://xuewen.cnki.net/CMFD-1012437024.nh.html
|