2. 西藏农牧学院食品科学学院,林芝 860000
2. Agricultural and Animal Husbandry College, Tibet University, Linzhi 860000
喜马拉雅紫茉莉(Mirabilis himalaica)主要分布于我国甘肃、陕西、云南、四川及西藏等地,生长在海拔700-3 300 m的草地或者山坡路旁,为外来入侵种植物[1-2]。作为西藏地区传统的藏药植物[3-4],近年来,已经有一些文献报道了喜马拉雅紫茉莉种子和根提取物中含有大量的化感作用抑制物质[5-6],这也是其产生连作障碍的主要因素之一[7-8]。
受化感抑制作用影响的植物,多表现为种子萌发率下降,幼苗的鲜重、根长和苗高受到明显抑制[9-12]。这些表观形态上的变化,究其本质,是这些植物在细胞和分子水平上受化感作用影响所产生的综合效应[13-17]。植物的根长期固着于土壤中,为植株的生长提供必需的水分和矿物质营养,其细胞结构及功能的完整性对植株的生长和发育起到至关重要的作用,利用化感物质提取物处理幼苗,会使得幼苗根部的组织细胞及细胞器均受到不同程度的影响并做出相应的改变[18]。因此,对这些受化感作用影响的植物形态及细胞显微结构变化的研究,将有利于深入探讨化感作用的微观机制,也是近年来研究的热点[19]。目前,对于藏药植物喜马拉雅紫茉莉的研究,尤其是在其化感抑制作用方面的研究和报道还相对较少,且主要集中在生理和生态学的宏观层面上,对于植物化感抑制作用导致的目标植物细胞水平上的结构变化和损伤情况还未见报道。本研究依托透射电子显微镜和扫描电子显微镜技术[20]对喜马拉雅紫茉莉根部的水浸提液处理后的小麦和绿豆的根尖细胞的超微结构、细胞分裂及幼苗初期的生理形态的变化进行了比较和研究,旨为揭示喜马拉雅紫茉莉根部化感物质在细胞水平上的作用机制提供新的依据。
1 材料与方法 1.1 材料喜马拉雅紫茉莉釆自海拔3 000 m左右的西藏林芝地区,以常见的小麦、绿豆作为供试实验材料。本研究中所使用到的主要试剂有:双蒸水,3%的戊二醛溶液,1.5%的高锰酸钾溶液,30%、50%、70%、80%、90%以及100%的无水乙醇,磷酸缓冲液,醋酸异戊酯,导电胶,丙酮,包埋剂,醋酸铀; 仪器:超高速万能粉碎机,100目筛,恒温震荡摇床,0.22 μm滤膜,离子溅射仪,莱卡IJC-6型超薄切片机(德国莱卡公司),日立S4800扫描电镜以及透射电镜。
1.2 方法 1.2.1 喜马拉雅紫茉莉根部水浸提液制备将喜马拉雅紫茉莉根部用清水洗净,室温自然干燥,用超高速万能粉碎机磨成粉状,过100目筛,称取100 g干燥粉末于试剂瓶中,加入1L双蒸水,置于摇床震荡提取24 h,温度设置成室温22℃,将转速调高至200 r/min,以保证充分提取。将粗提液经两层纱布过滤后,再用两层滤纸过滤,将过滤后的浸提液过0.22 μm滤膜除菌,配制成0.1 g/mL的浸提液母液,用无菌蒸馏水分别配制成浓度为0.012 5、0.025、0.05、0.1 g/mL的处理液,置于4℃冰箱中备用。
1.2.2 实验材料的处理选取小麦、绿豆萌发状态一致的种子,处理液为喜马拉雅紫茉莉根部的水浸提液,整株形态变化比较试验中将浓度设置为:0.012 5 g/mL、0.025 g/mL、0.05 g/mL、0.l g/mL,以蒸馏水作为空白对照,每组设置3个平行重复,于处理后8 d进行拍照比较[21]。扫描电镜以及透射电镜比较实验中,设定两个浓度的处理液:0.025 g/mL、0.l g/mL,同样以蒸馏水作为空白对照,以小麦和绿豆作为实验材料,于处理后8 d取根尖,进行制样和拍照比较。
1.2.3 扫描电镜样品的制备取材:切取0.2-0.4 cm的植物样品的根尖; 前固定:把切好的根尖样品置于洗净的青霉素的小瓶中,加入3%的戊二醛溶液,4℃低温下处理4 h; 后固定:常温下,倒掉磷酸缓冲液,加入1.5%的高锰酸钾溶液固定2-3 h,吸出固定液,再用磷酸缓冲液冲洗3-4次,每次10-15 min; 脱水:吸去缓冲液,依次加入梯度浓度的乙醇溶液,30%乙醇15 min,50%乙醇15 min,70%乙醇(可过夜),80%乙醇30 min,90%乙醇30 min,100%乙醇4次,每次30 min; 置换乙醇:吸出小瓶中的乙醇溶液,将醋酸异戊酯加入,并完全没过材料,过夜处理; 样品干燥:采用CO2临界点进行干燥; 粘贴样品:在样品台上涂少量导电胶,然后用镊子夹起样品,轻轻放到样品台上,调整位置,使材料观察面向上; 样品表面喷金:用离子溅射仪对粘贴好的样品表面喷金。
1.2.4 扫描电镜观察:将做好的样品置于日立S4800电镜下扫描并照相[22]。 1.2.5 透射电镜样品的制备和观察 1.2.5.1 样品的制备取材:把材料统一摆放整齐,切取0.5 cm左右的根尖进行处理; 前固定:同1.2.3;后固定:同1.2.3;脱水:同1.2.3;过渡:乙醇逐级脱水后,倒掉乙醇,加入丙酮溶液2次,每次20 min; 渗透:按照Epon-812包埋剂的配方,将4种成分准确量取并充分搅拌混匀,静置片刻后按下列步骤加入瓶中,丙酮:包埋剂=2:1,浸1 h; 丙酮:包埋剂=1:2,浸2 h; 纯包埋剂2 d; 包埋:用解剖针挑取材料,小心加入PCR小管中,使材料垂直静置,加入纯包埋剂,每个小管放一个材料,标明样品名称; 聚合:样品包埋后,将其放入烘箱中,45℃下聚合6-7 h,60℃下聚合24 h。
1.2.5.2 超薄切片制作和透射电镜观察包埋好的材料,经修块后置于莱卡IJC-6型超薄切片机(德国莱卡公司)切片,厚度约为70 nm,之后铜网载片。醋酸铀染液染色后在透射电镜下观察并拍照[23-24]。
2 结果 2.1 喜马拉雅紫茉莉根的水浸提液对植物幼苗形态的影响经不同浓度喜马拉雅紫茉莉根的水浸提液处理8 d后,小麦、绿豆幼苗与对照相比,整株、根和叶片的形态均发生了明显的变化(图 1)。随着水浸提液浓度的升高,幼苗叶片生长迟缓,叶片偏小、柔软且出现黄化现象。对照幼苗根部生长状态良好,根尖发育正常且颜色为白色或乳白色,侧根较多,而经过处理的幼苗侧根数明显减少,根的生长受到明显的抑制,根长短于对照组,且根的颜色变黄,出现褐化。
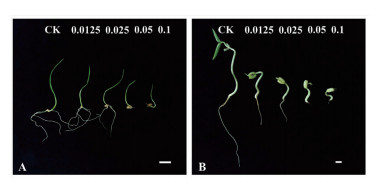
|
| 图 1 喜马拉雅紫茉莉根的水提液对植物幼苗生长形态的影响 A:小麦; B:绿豆(Bar=1 cm) |
通过扫描电镜的观察可以发现,与对照组相比,经喜马拉雅紫茉莉根的水浸提液处理后的小麦和绿豆根尖组织结构发生了明显的变化(图 2,图 3),用蒸馏水作对照培养的小麦和绿豆,根尖部位结构完整,根尖的4个区紧密有序排列,根冠顶部细胞生长良好,伸长区和成熟区细胞很规则的排列,形态饱满,呈长圆形(图 2-A,图 3-A)。用0.025 g/mL浓度的水浸提液处理后,小麦和绿豆的根尖结构松动,伸长区和成熟区细胞部分脱落,细胞间出现空隙,尤其在绿豆中,根尖表皮细胞脱落现象严重(图 2-B,图 3-B)。当处理浓度达到0.1 g/mL时,植物的根尖部位严重变形,大量细胞开始脱落、破裂,细胞间出现较大的空隙,失去连续性,在小麦中,细胞皱缩严重,伸长区和成熟区细胞脱水萎蔫,组织中出现沟壑状空腔(图 2-C,图 3-C)。

|
| 图 2 喜马拉雅紫茉莉根的水提液对小麦根尖表面的影响 A:蒸馏水; B:0.025 g/mL浸提液处理; C:0.1 g/mL浸提液处理 |

|
| 图 3 喜马拉雅紫茉莉根的水提液对绿豆根尖表面的影响 A:蒸馏水; B:0.025 g/mL浸提液处理; C:0.1 g/mL浸提液处理 |
根部的成熟区是由根尖顶端的分生细胞通过分裂分化而来,由外到内主要包括表皮、皮层和中柱。利用SEM电镜对植物横切面进行观察,可以较好地显示各部分的组织形态和特征。如图 4-A、图 5-A中所示,小麦和绿豆在正常生长状态下,横切面呈规则的圆形,各部分组织完整,表皮细胞、皮层细胞及中柱细胞排列紧密,细胞形态饱满、规则,而经浸提液处理后,植物的根尖横切结构破损,不再呈正常的圆形,组织间出现断层,细胞内开始出现空洞(图 4-B,图 5-B),当水浸提液浓度升高到0.1 g/mL的时候,小麦和绿豆根尖受损更加严重,脱水干瘪,失去组织结构和特征,横切面出现较大的组织断层和空腔,细胞空洞化,内含物消失(图 4-C,图 5-C)。

|
| 图 4 喜马拉雅紫茉莉根的水提液对小麦根尖横切面的影响 A:蒸馏水; B:0.025 g/mL浸提液处理; C:0.1 g/mL浸提液处理。 |

|
| 图 5 喜马拉雅紫茉莉根的水提液对绿豆根尖横切面的影响 A:蒸馏水; B:0.025 g/mL浸提液处理; C:0.1 g/mL浸提液处理。 |
对纵切面、横切面的细胞进行观察发现,对照细胞形态结构规则,呈长圆形,彼此排列较紧密,细胞内胞质完整(图 6-A、图 7-A),经喜马拉雅紫茉莉根的水浸提液处理过的小麦、绿豆根尖细胞,细胞形态出现扭曲,部分细胞的内含物渗出,细胞空泡化,细胞排列变得疏松,结构受到严重破坏(图 6-B、6-C,图 7-B、7-C)。

|
| 图 6 喜马拉雅紫茉莉根的水提液对小麦根尖纵切面的影响 A:蒸馏水; B:0.025 g/mL浸提液处理; C:0.1 g/mL浸提液处理 |

|
| 图 7 喜马拉雅紫茉莉根的水提液对绿豆根尖横切面的影响 A:蒸馏水; B:0.025 g/mL浸提液处理; C:0.1 g/mL浸提液处理 |
与对照组相比,经喜马拉雅紫茉莉根的水浸提液处理后的小麦、绿豆根尖细胞形态发生了明显的改变,这些变化主要体现在细胞与细胞间的联系、细胞膜系统与结构、细胞超微结构及各细胞器的结构等方面(图 8,图 9)。
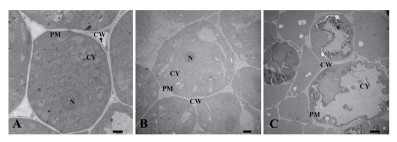
|
| 图 8 喜马拉雅紫茉莉根的水提液对小麦根尖细胞结构的影响(Bar=2 μm) A:蒸馏水; B:0.025 g/mL浸提液处理; C:0.1 g/mL浸提液处理。PM:细胞膜; CW:细胞壁; CY:细胞质 |
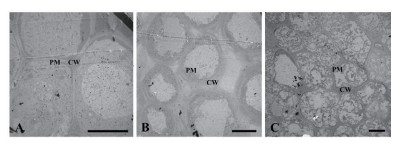
|
| 图 9 喜马拉雅紫茉莉根的水提液对绿豆根尖细胞结构的影响(Bar=10 μm) A:蒸馏水; B:0.025 g/mL浸提液处理; C:0.1 g/ml浸提液处理。PM:细胞膜; CW:细胞壁; CY:细胞质 |
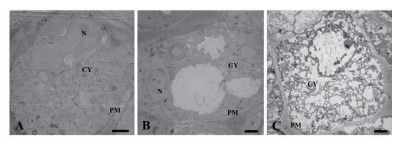
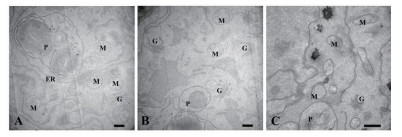
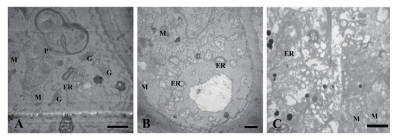
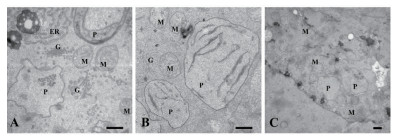
正常生长的小麦、绿豆细胞间排列紧密(图 10-A、图 11-A),形状呈规则的圆形或椭圆形,细胞结构完整,细胞核结构清晰,胞质均一,内含大量的细胞器:线粒体、内质网、高尔基体、质体等,它们含量丰富,显示出良好结构与功能状态,分工合作完成细胞复杂的生理代谢活动(图 12-A、13-A、14-A和15-A); 而经浓度为0.025 g/mL的浸提液处理后,小麦和绿豆根尖细胞膜皱缩,细胞失水,细胞之中出现了部分空泡,细胞质不再呈均一性(图 10-B、11-B),细胞器的数量和种类减少,线粒体数量降低且结构发生改变,有些细胞器解体消失(图 12-B、14-B和15-B)。绿豆的根尖细胞则开始出现质壁分离现象,细胞间的空隙增大,彼此失去了联系(图 9-B),细胞核开始消融,胞内细胞器数量也急剧下降,有些结构遭到了一定程度的破坏,线粒体双层膜内的脊的结构开始解体,高尔基体形态卷曲,丧失其顺序性,各质体变得空泡化,结构和功能均受到损伤(图 13-B); 当浸提液浓度达到0.1 g/mL时,两种植物细胞遭破坏程度更加严重,小麦根尖细胞普遍发生质壁分离,细胞形态不正常,胞内含有很大的液泡,细胞质被挤到一边(图 8-C、10-C),核仁已经消失,胞内的细胞器只残存其外部的膜,膜内结构几乎消融,已无法分辨各细胞器形态。在小麦和绿豆根尖细胞中,细胞整体形态受损,除细胞核外,其他细胞器结构均已严重改变和破坏(图 11-C、12-C),线粒体和内质网与高尔基体几乎全部消失,结构模糊不清(图 13-C、14-C和15-C)。
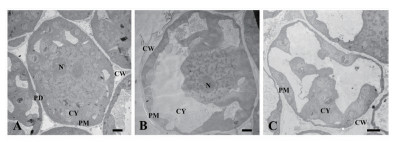
|
| 图 10 喜马拉雅紫茉莉根的水提液对小麦根尖细胞的影响。(Bar=2 μm) A:蒸馏水; B:0.025 g/mL浸提液处理; C:0.1 g/mL浸提液处理。PM:细胞膜; CW:细胞壁; CY:细胞质; PD:胞间连丝; N:细胞核; |
|
| 图 11 喜马拉雅紫茉莉根的水提液对绿豆根尖细胞的影响(Bar=2 μm) A:蒸馏水; B:0.025 g/mL浸提液处理; C:0.1 g/mL浸提液处理; PM:细胞膜; CW:细胞壁; CY:细胞质; PD:胞间连丝; N:细胞核; |
|
| 图 12 喜马拉雅紫茉莉根的水提液对小麦根尖细胞器的影响(Bar=500 nm) A:蒸馏水; B:0.025 g/mL浸提液处理; C:0.1 g/mL浸提液处理; M:线粒体; P:质体; ER:内质网; G:高尔基体; |
|
| 图 13 喜马拉雅紫茉莉根的水提液对绿豆根尖细胞器的影响(Bar=1 μm) A:蒸馏水; B:0.025 g/mL浸提液处理; C:0.1 g/mL浸提液处理; M:线粒体; P:质体; ER:内质网; G:高尔基体; |
|
| 图 14 喜马拉雅紫茉莉根的水提液对小麦根尖细胞超微结构的影响(Bar=500 nm) A:蒸馏水; B:0.025 g/mL浸提液处理; C:0.1 g/mL浸提液处理; M:线粒体; P:质体; ER:内质网; G:高尔基体; |
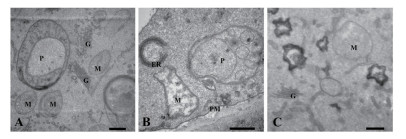
|
| 图 15 喜马拉雅紫茉莉根的水提液对绿豆根尖细胞超微结构的影响(Bar=500 nm) A:蒸馏水; B:0.025 g/mL浸提液处理; C:0.1 g/mL浸提液处理; M:线粒体; P:质体; ER:内质网; G:高尔基体; |
近年来,植物化感作用[25]在农作物生产和实践中的影响和作用越来越多的受到了人们的关注与重视,尤其是在药用植物的培育和种植方面,学者们对化感作用的作用机理以及发挥作用的主要化感物质做了大量的探索和研究,并且得到了一定的结果,但在更深层次,更加微观的分子和细胞学水平上的研究还比较少。本文在前期研究的基础上[26-31],观察并分析了小麦、绿豆在经过喜马拉雅紫茉莉根的水浸提液处理后,生理形态上受到的较强的化感抑制作用的影响情况。本研究发现随着水浸提液浓度的升高,抑制效应会越发明显。通过整株比较可以看出,水浸提液处理过的植物幼苗长势减弱,植株的长势要明显的弱于对照组,且随着处理浓度的增加,幼苗长势越来越弱,说明化感抑制作用越明显,具有浓度效应。这两种植物受到化感作用后,其地上部分生长缓慢,叶片黄化,植株出现萎蔫等现象,而地下部分主要是根部的侧根数明显减少,根长变短,脱水并发生褐化,植物的生长发育受到了严重的抑制。植物的根从土壤中吸收大量的水分和矿物质营养,为地上部分提供生长所需的能量和物质,它的吸收作用主要依靠位于顶端的根尖来完成,根据形态和功能的差异,可将根尖分为四个区,分别是最前端的根冠、其后分生区、最末端的伸长区和成熟区。与地上部分相比,植物的地下部分更易受到化感作用的抑制,这是因为喜马拉雅紫茉莉根部产生的化感物质主要分布和渗透在土壤中,而化感作用的部位也主要是植物的根部,且通过依靠植物根部的吸收和渗透作用使化感物质作用于邻近植物。这与多数文献所报道的结果相一致[21, 25, 32-33]。根作为植物生长发育必不可少的器官,起到吸收和运输水分、矿物质的重要作用,也具有其他多种重要的生理功能[15, 26]。以小麦和绿豆两种典型作物为研究材料,我们发现处理后的植物形态受损,叶片萎蔫黄化,根部蜷缩褐化,根细胞的生理功能遭到破坏,进而抑制根的发育,进一步影响植物整株的生命活动[34-35]。利用透射电子显微镜和扫描电子显微镜研究发现,对照组根尖的4部分结构相对较为完整,细胞排列紧密,结构规则,而经浸提液处理后的根部横切面细胞排列混乱,出现了断裂面和大量空隙,根尖的根冠细胞、表皮细胞明显脱落,使根系不能正常吸收水分和营养物质,生长发育受到严重干扰和抑制,这表明喜马拉雅紫茉莉在发挥化感抑制作用时,会破坏和损伤植物的根系细胞,导致细胞死亡,抑制其生命活动。喜马拉雅紫茉莉根的水浸提液处理后,小麦和绿豆的根尖细胞、细胞内各细胞器的数量及形态都较对照发生了明显的改变,处理后的细胞间隙增大,细胞与细胞间的联系减少,细胞中出现质壁分离现象,细胞核渐渐解体,胞质中的细胞器数量减少,形态变得不规则,线粒体变得空泡化,内部的脊消失,数量也急剧下降,高尔基体形态扭曲,不再具备正反面的结构特征,并随着浸提液浓度的升高而解体、消融。这些主要细胞器是细胞正常生长必不可少的,它们形态和功能的改变或是损伤都会影响到整个细胞的功能。细胞超微形态与结构的变化导致受体根尖细胞生理代谢功能紊乱,生长发育受到严重抑制,这说明喜马拉雅紫茉莉主要是通过破坏植物根系细胞结构、干扰其生理功能的方式来发挥化感抑制作用[36-37]。入侵植物紫茎泽兰化感物质对旱稻根也能产生与本研究类似的形态及细胞结构的负面影响,表明不同植物化感作用在作用机理上可能存在一定的共性。本研究为解释化感作用在细胞水平上的作用机理研究提供新的实验证据,为药用植物种植及农业生产也有一定的指导作用。
4 结论本实验利用扫描电镜和透射电镜技术,对小麦和绿豆两种农作物的根部形态和细胞结构在喜马拉雅紫茉莉根的水浸提液处理后的化感作用响应做了初步的探索和研究。通过与对照组相比,发现处理后的受体植物,无论是在植物形态上还是在细胞学水平上都受到了不同程度的破坏和损伤,且不同浓度的喜马拉雅紫茉莉根的水浸提液对绿豆和小麦均存在不同程度的化感作用,具有浓度效应。
| [1] |
卢骁, 兰小中, 杨凤娇, 等. 喜马拉雅紫茉莉瘦果粘液对种子低温萌发的保护[J]. 草地学报, 2014, 22(6): 1281-1287. DOI:10.11733/j.issn.1007-0435.2014.06.021 |
| [2] |
何锦峰. 外来植物入侵机制研究进展与展望[J]. 应用与环境生物学报, 2008, 14(6): 863-870. |
| [3] |
中国科学院西北高原生物研究所. 藏药志[M]. 西宁: 青海人民出版社, 1991.
|
| [4] |
马世林, 宇妥·元丹贡布. 四部医典[M]. 上海: 上海科学技术出版社, 1987.
|
| [5] |
辛福梅, 臧建成, 兰小中. 喜马拉雅紫茉莉种子化感作用初探[J]. 中国园艺文摘, 2012(11): 22-24. |
| [6] |
马世尧, 刘胜利, 等. 喜马拉雅紫茉莉根水浸提液对五种植物的化感作用研究[J]. 亚热带植物科学, 2015, 44(1): 29-35. |
| [7] |
杨盼盼, 范海霞, 杨丽花, 等. 喜马拉雅紫茉莉根部化学成分研究[J]. 安徽农业科学, 2012, 40(18): 9641-9643. DOI:10.3969/j.issn.0517-6611.2012.18.025 |
| [8] |
曹光球, 林思祖, 等. 马尾松根化感物质的生物活性评价与物质鉴定[J]. 应用与环境生物学报, 2005, 11(6): 686-689. |
| [9] |
张远莉, 陈建群, 卫春, 等. 薄荷化感物质的作用及其初步分离[J]. 应用与环境生物学报, 2003, 9(6): 611-615. |
| [10] |
韩志军, 陈静, 郑寒, 等. 花椒叶浸提液对大豆种子萌发和幼苗生长的化感作用[J]. 应用与环境生物学报, 2011, 9(4): 585-588. |
| [11] |
汪思龙, 陈龙池, 廖利平, 等. 几种化感物质对杉木幼苗生长的影响[J]. 应用与环境生物学报, 2002, 8(6): 588-591. |
| [12] |
Bais HP, Vepachedu R, Gilroy S, et al. Allelopathy and exotic plant invasion:from molecules and genes to species interactions[J]. Science, 2003, 301(5638): 1377-1380. DOI:10.1126/science.1083245 |
| [13] |
林娟, 殷全玉, 杨丙钊, 等. 植物化感作用研究进展[J]. 中国农学通报, 2007, 23(1): 68-72. |
| [14] |
张爱华, 郜玉钢, 许永华, 等. 我国药用植物化感作用研究进展[J]. 中草药, 2011, 42(10): 1885-1890. |
| [15] |
王海斌, 何海斌, 邱龙, 等. 低磷诱导水稻化感抑草能力增强的分子生理特性[J]. 应用与环境生物学报, 2009, 15(3): 289-294. |
| [16] |
李键, 刘奕, 吴承祯, 等. 木麻黄的两种化感物质对其水培幼苗叶绿素荧光参数的影响[J]. 应用与环境生物学报, 2013, 19(5): 781-786. |
| [17] |
周艳丽; 程智慧; 孟焕文. 大蒜根系分泌物对不同受体蔬菜的化感作用[J]. 应用生态学报, 2007, 18(1): 81-86. |
| [18] |
Abenavoli MR, Sorgona A, Albano S, et al. Coumarin differentially affects the morphology of different root types of maize seedlings[J]. J Chem Ecol, 2004, 30(9): 1871-1883. DOI:10.1023/B:JOEC.0000042407.28560.bb |
| [19] |
何大澄, 翟中和. 扫描电镜及其在生物学研究中的应用[J]. 生物学通报, 1980(02): 41-43. |
| [20] |
李香菊, 张米茹, 等. 黄顶菊水提取液对植物种子发芽及胚根伸长的化感作用研究[J]. 杂草科学, 2007(4): 15-19. |
| [21] |
肖媛, 刘伟, 汪艳, 等. 生物样品的扫描电镜制样干燥方法[J]. 实验室研究与探索, 2013, 32(5): 45-53. |
| [22] |
徐柏森, 张耀丽, 何开跃, 等. 植物透射电镜样品制备技术探讨[J]. 中国野生植物资源, 2006, 25(3): 41-43. |
| [23] |
刘仁林, 虞功清, 邹伟民, 等. 植物透射电镜样品制备技术的改进[J]. 江西林业科技, 2008(1): 41-43. |
| [24] |
高丹, 胡庭兴, 黄绍虎, 等. 巨桉根浸提液对三种牧草的化感作用初步探讨[J]. 福建林业科技, 2007, 34(4): 87-90. |
| [25] |
Rice EL. Allelopathy[M]. New York: Academic Press, 1984.
|
| [26] |
魏莎, 李素艳, 孙向阳, 等. 根分泌物及其化感作用研究进展[J]. 北方园艺, 2010(18): 222-226. |
| [27] |
唐秀丽, 谭万忠, 付卫东, 等. 外来入侵杂草黄顶菊的发生特性与综合控制技术[J]. 湖南农业大学学报自然科学版, 2010, 36(6): 694-699. |
| [28] |
万方浩, 刘万学, 等. 外来植物紫茎泽兰的入侵机理与控制策略研究进展[J]. 中国科学:生命科学, 2011, 41(1): 13-21. |
| [29] |
Yang GQ, Wan FH, Liu WX, et al. Physiological effects of allelochemicals from leachates of Ageratina adenophora(Spreng.)on rice seedlings[J]. Allelopathy J, 2006, 18: 237-246. |
| [30] |
Yang GQ, Wan FH, et al. Influence of two allelochemicals from Ageratina adenophora Sprengel on ABA, IAA and ZR contents in roots of upland rice seedlings[J]. Allelopathy J, 2008, 21: 253-262. |
| [31] |
李兰茹, 马慧萍. 喜马拉雅紫茉莉总多酚含量测定的方法学研究[J]. 实用药物与临床, 2015, 18(9): 1078-1081. |
| [32] |
郭鹏辉, 刘慧霞, 高丹丹. 4种中草药根水浸液对萝卜的化感作用研究[J]. 现代农业科技, 2015(22): 73-74. DOI:10.3969/j.issn.1007-5739.2015.22.039 |
| [33] |
杨春雪, 卓丽环, 柳参奎. 植物显微及超微结构变化与其抗逆性关系的研究进展[J]. 分子植物育种, 2008(2): 341-346. |
| [34] |
唐秀丽, 付卫东, 张国良, 等. 黄顶菊浸提液对玉米幼苗生长及其根尖显微结构的影响[J]. 山东农业大学学报自然科学版, 2012, 43(3): 341-346. |
| [35] |
王英, 凯撒.苏来曼, 李进, 等. 伊贝母植株水浸提液自毒作用研究[J]. 种子, 2009, 28(10): 1-3. |
| [36] |
代松家, 魏晶晶, 兰小中. 喜马拉雅紫茉莉对干旱的生理生态响应[J]. 北方园艺, 2015(8): 152-156. |
| [37] |
彭莲. 藏药喜马拉雅紫茉莉的化学成分及质量评价研究[D]. 北京: 北京中医药大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10026-1015385901.htm
|




