2. 农业部阿拉尔作物有害生物科学观测站,阿拉尔 843300;
3. 新疆生产建设兵团第一师阿拉尔农场,阿拉尔 843300
2. Scientific Observing and Experimental Station of Crop Pests in Alar, Ministry of Agriculture, Alar 843300;
3. Alar Farm of the First Planners in Xinjiang Production and Construction Corps, Alar 843300
转基因抗虫棉在我国种植已有20多年历史[1],转Bt棉可降低棉田虫害程度,减轻农药污染,已成为我国棉花主栽类型[2-3]。然而,随抗虫棉种植时间推移,其对棉铃虫的防治效果有下降趋势,棉铃虫室内生测也发现2代发生期的转Bt棉叶致死率高于3、4代发生期[4],这种转Bt棉抗虫性波动与棉花生育期Bt毒蛋白表达呈前期强、中后期弱有关[7],在空间分布上叶片杀虫蛋白含量高于生殖器官[5-6]。另外,外部环境对Bt蛋白表达也有较大影响,极端低温与湿度互作使Bt棉开花后的抗虫性有明显下降[8],38℃以上,棉蕾的Bt蛋白表达量均显著下降[9]。施氮肥能明显促进棉叶Bt蛋白的表达,其Bt蛋白表达量与可溶性蛋白、游离氨基酸及全氮含量呈极显著正相关关系[10]。转Bt棉开花后用赤霉酸或缩节胺处理可促进Bt蛋白表达[11]。利用表油菜素内酯、甲哌嗡和水杨酸混合处理能提高转Bt棉在盛蕾期上部叶片、花铃期下部叶片及果枝叶的毒蛋白含量[12]。因而Bt蛋白表达含量波动较大,既与植株内在因素有关,又受外部环境等因素影响。本文以当地较为常见的种植品种为研究对象,通过检测主茎不同叶序棉叶Cry1Ab/c蛋白和总水溶性蛋白含量,分析Cry1Ab/c蛋白含量的时空变化规律,为棉花生产中构建棉铃虫防控体系提供理论依据。
1 材料与方法 1.1 材料 1.1.1 实验材料抗虫棉X-37和M-49,采自阿拉尔垦区棉田。随机选择5株生长一致、叶片大小相近棉花,采集主茎由下往上的第2、4、6、8、10、12、14叶片,于-80℃冰箱保存备用。采样时期分别为现蕾期(6月3日)、初花期(6月27日)、花铃期(8月6日)和铃期(8月26日)。
1.1.2 仪器电子分析天平(AL204,梅特勒-托利多仪器有限公司)、高通量组织研磨器(SCIENTZ-48,宁波新芝生物科技股份有限公司)、酶标仪(Multiskan FC,Thermo)、紫外可见分光光度计(E220,Thermo)、冷冻离心机(X1R,Thermo)、Cry1Ab/c试剂盒(AP003,EnviroLogix公司)。
1.2 方法 1.2.1 样品液的提取用打孔器取转Bt棉叶片直径1 cm,并万分之一天平称重后放入2 mL离心管中,加入PH7.4磷酸-吐温(PBS-T)提取液1.2 mL,置于高通量组织研磨器65 HZ研磨匀浆,在4℃,5 000 r/min离心15 min,取上清液为待测样品液。
1.2.2 水溶性总蛋白质含量测定参考考马斯亮蓝(G-250)染色法[13]:取待测样品液0.1 mL,稀释10倍,分别加入2.5 mL考马斯亮蓝(G-250)、混匀,放置5 min后,于波长595 nm处比色,测定吸光度,并通过标准曲线查的蛋白质含量。
1.2.3 Cry1Ab/c蛋白含量的测定采用EnviroLogix公司Cry1Ab/c的抗体夹心ELISA定量检测试剂盒(AP003)进行Bt蛋白含量测定。
1.2.4 数据处理以Excel 2007进行数据处理及作图,利用SPSS17.0进行多重比较(Duncan氏新复极差检测)相关统计分析。
Cry1Ab/c蛋白含量(ng/g)=Cry1Ab/c蛋白含量(ng)/样品叶片鲜重(g);
Cry1Ab/c蛋白比=Cry1Ab/c蛋白含量(ng/g)/水溶性总蛋白含量(µg/g)
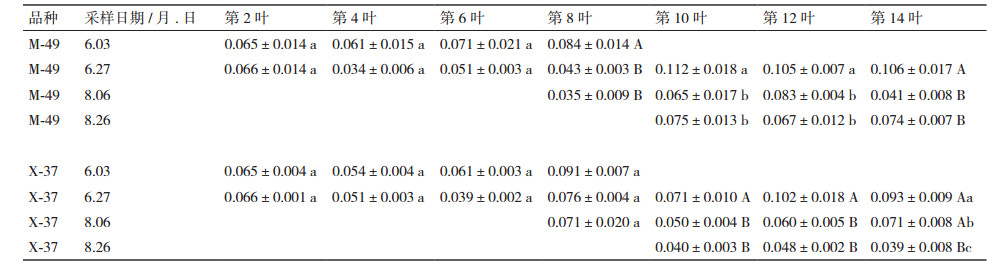
2 结果 2.1 两种转Bt棉Cry1Ab/c蛋白叶片含量的时空分布M-49转Bt棉主茎叶片的Cry1Ab/c蛋白含量由顶端叶片向底层叶片逐渐增加趋势(图 1),其中现蕾期(6月3日)第2、4叶Cry1Ab/c蛋白含量显著(P < 0.05)高于第6、8叶; 第2、4叶和6叶极显著(P < 0.01)高于第8叶。在初花期(6月27日)第2叶Cry1Ab/c蛋白明显高于其他叶片,达极显著水平(P < 0.01);除第12叶外,其他叶片Cry1Ab/c蛋白含量无明显差异。花铃期(8月6日)和铃期(8月26日)中上部叶片第8、10、12和14叶Cry1Ab/c蛋白均无明显差异。
|
| 图 1 M-49转Bt棉Cry1Ab/c蛋白叶片含量的时空分布 注:大写字母代表差异极显著(P < 0.01);小写字母代表差异显著(P < 0.05),下同 |
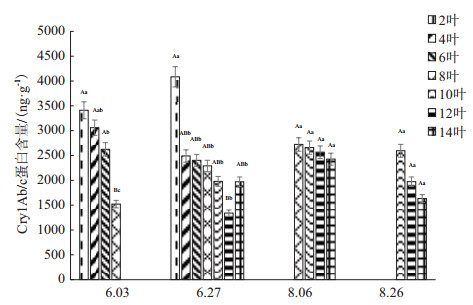
X-37转Bt棉主茎叶的Cry1Ab/c蛋白含量由上至下也呈逐渐增加趋势(图 2)。但不同在于现蕾期(6月3日)第2叶Cry1Ab/c蛋白含量显著(P < 0.05)高于第4、6和8叶,其中第6、8叶达极显著水平(P < 0.01)。在初花期(6月27日)第2、4叶的Cry1Ab/c蛋白含量极显著(P < 0.01)高于其他叶片; 第6叶Cry1Ab/c蛋白含量也极显著(P < 0.01)高于第8、10、12和14叶。花铃期(8月6日)第14叶Cry1Ab/c蛋白显著(P < 0.05)低于第8、10和12叶。铃期(8月26日)中上部叶片第10、12和14叶Cry1Ab/c蛋白均无明显差异。

|
| 图 2 X-37转Bt棉Cry1Ab/c蛋白叶片含量的时空分布 |
因此,这两种转Bt棉主茎不同叶序棉叶Cry1Ab/c蛋白含量分布均由下至上逐渐减少,随生育期的推进呈先增后降,现蕾期的Cry1Ab/c蛋白含量较高,初花期、花期、花铃期逐渐降低。整体上,X-37主茎叶Cry1Ab/c蛋白含量较高于M-49。
2.2 两种转Bt棉Cry1Ab/c蛋白的总蛋白比分析M-49和X-37两种抗虫棉主茎底层叶片第2、4和6叶Cry1Ab/c蛋白与总蛋白比均无显著差异,花铃期(8月6日)和铃期(8月26日)的第10、12叶Cry1Ab/c蛋白比呈稳定减少趋势(表 1)。但在初花期(6月27日)第10、12和14叶的Cry1Ab/c蛋白比显著(P < 0.05)高于花铃期和铃期。
转Bt基因棉M-49和X-37在时空分布上存在明显差异,主茎叶片Cry1Ab/c蛋白含量由下至上逐渐减少,这与Rochester[14]、余恩等[15]报道一致,如浙大13-1转基因抗虫杂交棉的主茎下部叶Bt蛋白含量显著高于上部叶,但不同于转Bt新棉33B和GK3上部棉叶Bt蛋白含量显著高于老叶[16],以及浙大13-2和其亲本的两部位叶片Bt蛋白含量差异并不明显[15]。这可能与转基因抗虫棉品种有关系。另外,转Bt棉M-49和X-37生育前期的叶片Cry1Ab/c蛋白含量明显高于生育中后期,这与邢朝柱等[16]和王冬梅等[17]研究结果相近。这种时空分布将会导致新疆南疆棉区的棉铃虫能较好的防治2代棉铃虫,但3、4代棉铃虫防治效果会整体呈现下降趋势[18]。因此,为了避免加速棉铃虫对转Bt棉产生抗性,有必要筛选抗虫表现更好的棉花品种,结合常规棉花布局建立庇护所[19],更有利于棉铃虫的治理。
转基因棉M-49和X-37主茎上部叶片在生育期后期Cry1Ab/c蛋白含量明显下降。这可能与棉株的外部环境和内在因素的影响较大有关,极端温度、氮肥、盐碱等不良外界因素对Bt杀虫蛋白表达存在影响[8, 10, 14, 20],在前期棉株体内代谢旺盛,Cry1Ab/c蛋白积累较多,而后期棉花由营养生长转为生殖生长,Cry1Ab/c基因表达受到一定影响[17]。研究表明GPT、GOT等活性与Cry1Ab/c蛋白含量存在极显著的正相关[21]。总体上,组织中Bt杀虫蛋白与总可溶性蛋白含量呈正相关[9, 21],但不同时期和部位叶片表现有一定差异,而主茎中上部叶片第8、10、12和14叶在初花期的杀虫蛋白比值变化显著较大。此外,棉花生长后期的Bt蛋白含量下降的内因可能由于棉花生长前期Bt基因过量表达,而使后期基因沉默或启动子甲基化[22]; 或因某种降解蛋白酶降解,单宁的结合使其失活[23]。因此,还需进一步明确Bt杀虫蛋白的下降主因,分析初花期后的Cry1Ab/c蛋白比变化内在因素,为更好地指导转Bt基因棉的生产应用提供参考。
4 结论转基因棉M-49和X-37品种主茎叶片Cry1Ab/c蛋白含量存在时空差异,时间上随棉花生育期的推进呈先增后降,同时期由下部至上部叶片逐渐减少,但叶片中的水溶性总蛋白比值有上升趋势。
| [1] |
郭三堆, 王远, 孙国清, 等. 中国转基因棉花研发应用二十年[J]. 中国农业科学, 2015, 48(17): 3372-3387. DOI:10.3864/j.issn.0578-1752.2015.17.005 |
| [2] |
崔洪志, 郭三堆. 我国抗虫转Bt基因棉花研究取得重大进展[J]. 中国农业科学, 1996, 29(1): 93. |
| [3] |
汪若海, 李秀兰. 我国转基因抗虫棉应用现状及建议[J]. 生物技术通报, 2000(5): 1-6. |
| [4] |
吕丽敏, 雒珺瑜, 等. 冀鲁豫棉区Bt棉Cry1A蛋白表达及对棉铃虫控制效果监测[J]. 棉花学报, 2013, 25(5): 459-466. |
| [5] |
束春娥, 等. 转基因棉Bt毒性表达的时空动态及对棉铃虫生存、繁殖的影响[J]. 棉花学报, 1998, 10(3): 131-135. |
| [6] |
丁瑞丰, 等. 新疆南部棉区转Bt基因棉花对棉铃虫抗性的季节性变化规律[J]. 植物保护学报, 2012, 39(3): 193-199. |
| [7] |
Luo Z, Dong HZ, Li WJ, et al. Individual and combined effects of salinity and waterlogging on Cry1Ac expression and insecticidal efficacy of Bt cotton[J]. Crop Protection, 2008, 27: 1485-1490. DOI:10.1016/j.cropro.2008.06.006 |
| [8] |
陈源, 韩勇, 花明明, 等. 低温和湿度胁迫对盛铃期Bt棉叶片Bt蛋白表达量的影响[J]. 棉花学报, 2014, 26(4): 290-294. |
| [9] |
陈源, 韩勇, 等. 高温对Bt棉盛蕾期蕾中Bt蛋白表达及氮代谢生理的影响[J]. 应用生态学报, 2014, 25(9): 2623-2628. |
| [10] |
杨长琴, 徐立华, 等. 氮肥对抗虫棉Bt蛋白表达的影响及其氮代谢机理的研究[J]. 棉花学报, 2005, 17(4): 227-231. |
| [11] |
张祥, 马爱丽, 房静, 等. 赤霉酸和缩节胺对转Bt基因抗虫棉棉铃Bt毒蛋白表达及氮代谢的影响[J]. 棉花学报, 2010, 22(2): 150-156. |
| [12] |
宋国琦. Bt抗虫棉不同叶位Bt基因时空表达差异及调控[D]. 杨凌: 西北农林科技大学, 2003, 25-38. http://www.oalib.com/references/16758879
|
| [13] |
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版, 2000, 184-185.
|
| [14] |
Rochester IJ. Effect of genotype, edaphic, environmental conditions, and agronomic practices on Cry1Ac protein expression in transgenic cotton[J]. Journal of Cotton Science, 2006, 10: 252-262. |
| [15] |
余恩, 蔡芸菲, 赵茹冰, 等. 2个转基因抗虫杂交棉Bt蛋白含量的时空表达特性研究[J]. 浙江大学学报:农业与生命科学版, 2016, 42(1): 17-22. |
| [16] |
邢朝柱, 等. 转Bt基因棉杀虫蛋白含量时空分布及对棉铃虫产生抗性的影响[J]. 棉花学报, 2001, 13(1): 11-15. |
| [17] |
王冬梅, 丁瑞丰, 等. 新疆南部棉区转Bt基因棉花Bt杀虫蛋白表达规律研究[J]. 植物保护, 2011, 37(6): 97-101. |
| [18] |
王冬梅, 李海强, 等. 新疆北部地区转Bt基因棉外源杀虫蛋白表达时空动态研究[J]. 棉花学报, 2012, 24(1): 18-26. |
| [19] |
李号宾, 吴孔明, 等. 新疆南部棉区棉铃虫发生趋势及Bt棉花的控制效率[J]. 中国农业科学, 2006, 39(1): 199-205. |
| [20] |
夏兰芹, 郭三堆. 高温对转基因抗虫棉中Bt杀虫基因表达的影响[J]. 中国农业科学, 2004, 37(11): 1733-1737. DOI:10.3321/j.issn:0578-1752.2004.11.027 |
| [21] |
Chen DH, Ye GY, Yang CQ, et al. The Effect of high temperature on the insecticidal properties of Bt cotton[J]. Environmental and Experimental Botany, 2005, 53: 333-342. DOI:10.1016/j.envexpbot.2004.04.004 |
| [22] |
Dong GZ, Li WJ. Variability of endotoxin expression in Bt transgenic cotton[J]. Journal of Agronomy and Crop Science, 2007, 193: 21-29. DOI:10.1111/jac.2007.193.issue-1 |
| [23] |
董双林, 文绍贵, 王月恒. 转Bt基因棉对棉铃虫存活、生长及为害的影响[J]. 棉花学报, 1997, 9(4): 176-182. |