甘草(Glycyrrhiza uralensis Fisch.),别名国老、甜草、甜根子,豆科甘草属多年生草本植物,是一种补益的中草药,药理作用显著,我国传统中药配方制剂的80%都把它作为主要成分。甘草黄酮因其良好的抗氧化、抗菌、抗肿瘤、抗HIV病毒等特性成为甘草中一类主要成分。植物体内黄酮类化合物的生物合成均源于苯丙烷代谢途径,多种含苯丙烷骨架的次生代谢产物都是由这一途径直接或者间接生成[1]。肉桂酸-4-羟化酶(Cinnamate 4-hydroxylase,C4H)是苯丙烷代谢途径的第2个酶,催化反式肉桂酸生成β香豆酸,是黄酮类化合物合成的关键酶之一,它是植物P450单加氧酶中首个被鉴定、被克隆、被确认功能的酶,在植物各组织中均具有很高的活性[2-4]。C4H在转录水平上的丰度和蛋白质水平上的活性能有效影响植物中芳香族化合物和黄酮类化合物的生物合成[5]。茉莉酸甲酯(Methyl jasmonate,MeJA)是植物次生代谢途径中最主要的信号分子,它常常作为第二信使参与植物次生代谢物尤其是黄酮类化合物的合成调控[6]。本实验根据已报道的刺甘草C4H基因序列设计引物,用RT-PCR从甘草悬浮细胞中克隆C4H基因的编码区并进行序列分析,同时通过实时荧光定量PCR技术检测了悬浮体系中添加MeJA后各时间段甘草细胞中C4H的表达水平,为深入研究C4H基因在甘草黄酮类化合物生物合成途径上的分子调控机制提供依据,对进一步构建转基因高产甘草黄酮的基因工程细胞株具有重要意义。
1 材料与方法 1.1 材料供试的甘草品种为乌拉尔甘草,种子购自内蒙古自治区鄂尔多斯市达拉特旗。愈伤组织由幼嫩的甘草无菌苗下胚轴和子叶诱导而来,在固体MS培养基附加0.5 mg/L 2,4-D、0.5 mg/L NAA与0.5 mg/L 6-BA上培养和继代。悬浮培养系统的建立:取6 g分散性强、生长状态良好的固体细胞置于250 mL三角瓶中,120 r/min震荡培养,悬浮培养基为100 mL液体MS培养基+30 g/L蔗糖+0.5 mg/L NAA+0.5 mg/L 6-BA,光照强度36 μmol/m2·s,光照时间16 h/d,培养温度25℃[7]。
总RNA抽提试剂盒、M-MLV逆转录酶、DNA限制性内切酶、T4-DNA连接酶、胶回收试剂盒、质粒小量制备试剂盒和pUM-T载体均购自大连宝生物技术有限公司。大肠杆菌(Escherichia coli)DH5α购自天根生化科技(北京)有限公司。
1.2 方法 1.2.1 甘草悬浮细胞总RNA的提取及cDNA的合成将悬浮培养的甘草细胞抽滤后迅速转移至研钵中研磨,同时向研钵不间断地添加液氮,研磨成细细的粉末即可。总RNA提取步骤严格按照TaKaRa Total RNA提取试剂说明书进行操作。以提取的甘草悬浮细胞总RNA为模板,利用Prime ScriptTM Reverse Transcriptase Kit合成cDNA第一链。
1.2.2 引物设计根据GenBank中刺甘草C4H基因序列(序列号:D87520.1),利用Primer Premier 5.0软件设计了3对引物(表 1),由生工生物工程(上海)股份有限公司生产的。
用cDNA作为模版,对C4H基因的3对不同的引物分别进行PCR扩增,确定甘草C4H基因的最适引物。对PCR产物中1 800 bp左右处的条带进行胶回收。通过胶回收(OMEGA Gel Extraction Kit试剂盒)对PCR产物进行纯化,纯化产物与宝生物购买的克隆载体(pMD18-T载体)连接,重组质粒pMD18-T-C4H转化大肠杆菌感受态细胞。菌落PCR筛选阳性克隆,提取重组质粒,进行质粒DNA检测与双酶切验证。把提取的质粒和保存的菌液寄到生工生物工程(上海)股份有限公司进行测序分析。
1.2.4 序列分析用DNAMAN软件对测序结果进行拼接并对其完整开放阅读框进行氨基酸翻译,得到氨基酸序列,与GenBank中其他植物的C4H蛋白进行Blast同源性对比,利用MEGA7.0软件构建系统发育进化树。对甘草C4H蛋白进行分析(http://web.expasy.org/protparam/),推测C4H蛋白的分子量。利用ProtScale工具(http://web.expasy.org/protscale/)对甘草C4H蛋白进行亲水/疏水性分析。通过PORTER(http://distill.ucd.ie/porter/)进行分析,C4H蛋白中各个氨基酸残基对应的二级结构进行预测。将C4H基因编码的氨基酸序列提交SWISS-MODEL在线分析软件,预测蛋白质的三级结构。
1.2.5 甘草细胞C4H基因在不同MeJA诱导处理时间的表达分析以甘草悬浮细胞系为研究对象,将生长状态良好的种子细胞接种于新鲜培养基培养48 h后,添加100 μmol/mL的MeJA进行诱导,以加入无水乙醇(配置MeJA的溶剂)为对照组,分别在添加后1、3、6、9和12 h取样,提取RNA,并反转录成cDNA,对C4H基因进行荧光定量PCR,以Actin作为内参基因,参照2×SYBR Prime Script TM RT-PCR Kit(TaKara)荧光定量试剂盒说明书进行荧光定量试验。采用2(-△△Ct)法对数据进行分析。
2 结果 2.1 甘草细胞总RNA的提取紫外可见分光光度计测得RNA的OD260/280在1.8-2.2之间,浓度在1 000 ng/μL左右。电泳结果(图 1)显示,28S及18S rRNA两条主带清晰可见,且不含有DNA及蛋白质杂带。RNA质量良好,可用于反转录得到cDNA。
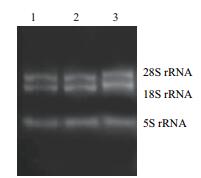
|
| 图 1 甘草细胞总RNA琼脂糖凝胶电泳图 |
对3对不同的引物分别进行PCR反应,得到第二对引物为甘草C4H基因的最适引物,进行50 μL体外扩增(图 2)。对PCR产物中1 800 bp左右处的条带进行胶回收,将回收的片段与pMD18-T载体进行连接,转化大肠杆菌,37℃过夜倒置培养至出现单菌落。挑取单菌落6个,按体系进行菌落PCR检验,1%琼脂糖凝胶电泳检测。图 3中可见3号菌落中目的基因已被插入,挑取该菌落培养。
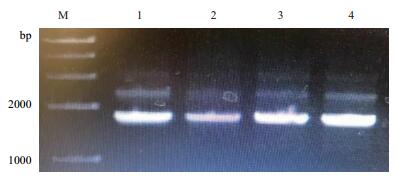
|
| 图 2 甘草细胞C4H基因克隆 M:1 kb DNA Ladder Markers;1-4:PCR产物,大小约为1 800 bp |

|
| 图 3 菌落PCR筛选阳性克隆 M:1 kb DNA Ladder Markers;1-4:PCR产物 |
用DNAMAN软件把测序结果进行拼接,其中cDNA序列包含1个1 515 bp的ORF,共编码504个氨基酸。在GenBank中下载其他植物C4H基因编码的氨基酸序列与甘草离体细胞的序列进行同源性对比,利用MEGA7.0软件构建系统发育进化树。
根据图 4所示分枝的长短,计算出乌拉尔甘草与其他物种亲缘关系由近及远依次为:蒙古黄芪、狭叶羽扇豆、橄榄、麻风树、喜树、川椒、马铃薯、相思木、蔓花生、菜豆、绿豆、玫瑰、大豆、苜蓿及红车轴草。其中,乌拉尔甘草与豆科植物蒙古黄芪亲缘关系较近,相比之下,与豆科红车轴草(即三叶草)亲缘关系较远。

|
| 图 4 系统发育进化树 |
把甘草C4H蛋白进行分析(http://web.expasy.org/protparam/),推测C4H蛋白的分子量为57.8 kD,等电点为9.14。通过PORTER(http://distill.ucd.ie/porter/)进行分析,对C4H蛋白中各个氨基酸残基对应的二级结构进行预测。结果表明,该蛋白中α-螺旋为49.71%、β-折叠为17.15%、无规卷曲为33.14%,所以C4H蛋白二级结构以α-螺旋和无规卷曲为主。将C4H基因编码的氨基酸序列提交SWISS-MODEL在线分析软件,进行蛋白质的三级结构预测,结果见图 5。
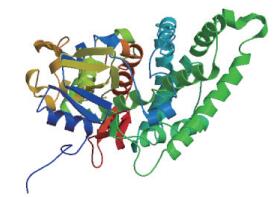
|
| 图 5 C4H蛋白的三级结构预测 |
使用SYBR Green化学染料,运用相对定量的方法进行荧光定量PCR实验。数据采用2(-△△Ct)法进行分析,即先根据“△Ct=Ct目-Ct对”计算,再根据“△△Ct=△Ct实-△Ct对”进行计算,最后依据“相对表达=2(-△△Ct)”计算出相对表达数值。再以处理时间为横坐标,相对表达量为纵坐标做图。
由图 6可以看出,在1-12 h期间,C4H基因在添加MJ诱导后的相对表达量都大于对照组,并且在9 h表达量最高,说明甘草黄酮生物合成的关键基因酶C4H的表达明显响应信号分子MeJA的诱导。
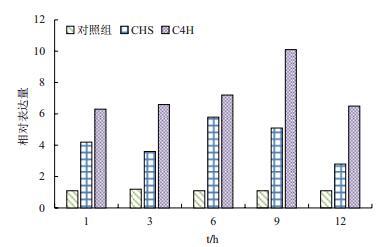
|
| 图 6 MeJA诱导后甘草细胞C4H基因的表达分析 |
肉桂酸4-羟基化酶(C4H)是植物苯丙烷代谢途径上的关键酶,能够催化反式肉桂酸的苯环C4位羟基化生成β-香豆酸,经4-香豆酰辅酶A连接酶转变为香豆酰辅酶A,为木质素、类黄酮等下游次级代谢途径提供前体物质[8]。逆境胁迫下,植物可通过调节一系列合成相关酶基因的转录水平从而影响其黄酮类和芳香族类的合成与积累[9],其中就包括C4H。Cheniany等[10]研究发现,茶树儿茶素含量与PAL和C4H基因的表达水平正相关。有研究发现在模式植物拟南芥ref3突变体中AtC4H蛋白的失活会造成植株木质素和类黄酮的含量降低[11];Liang等[12]在黑莓中发现,黄酮积累量与C4H表达量在果实发育的不同时期表现了同步增加或减少的变化趋势。黄酮类化合物是中药甘草的重要有效成分之一[13-14],解析其生物合成途径及分子调控机理是构建高产的基因工程细胞株的分子基础。
本研究从甘草悬浮细胞中克隆到一个C4H基因的全长cDNA并对其进行生物信息学分析,序列比对分析发现其包含完整的细胞色素P450保守结构域,并与多种植物的C4H氨基酸序列具有较高的同源性,说明此C4H属于C4H基因家族。克隆出甘草细胞C4H基因的cDNA序列,对其进行系统的生物信息学分析和比较全面的功能预测,有助于进一步研究甘草黄酮合成的分子调控机制和作用机理。另外植物次生代谢产物的合成受环境因子所诱导,如信号分子ABA、SA、MeJA等。其中,MeJA是植物次生代谢途径中最主要的次生代谢信号分子,可以显著诱导次生代谢物的合成,如外源的MeJA对于重要的药用次生代谢产物如紫杉醇、长春碱、东蓑若碱、尼古丁、青蒿素等均有显著的诱导合成作用[15-18]。本研究以甘草悬浮细胞为研究对象,在接种于新鲜培养基48 h后加入信号分子MeJA诱导,用荧光定量PCR技术检测诱导不同时间后C4H基因的表达情况,结果表明添加MeJA后明显提高了C4H基因的表达,且在诱导后9 h表达量最高,MeJA诱导后不同时间段的差异性表达有利于进一步了解C4H在甘草细胞悬浮培养过程中调控黄酮合成作用。
4 结论从乌拉尔甘草悬浮细胞中克隆到C4H基因编码区序列,并对其进行生物信息学分析。另外,采用q-PCR方法对C4H基因受MeJA诱导后的表达模式进行分析,结果表明C4H基因的表达受MeJA的诱导。
| [1] | Li XH, Park NI, Xu H, et al. Differential expression of flavonoid biosynthesis genes and accumulation of phenolic compounds in common buckwheat(Fagopyrum esculentum)[J]. J Agric Food Chem, 2010, 58 (23): 12176–12181. DOI:10.1021/jf103310g |
| [2] | Fahrendorf T, Dixon RA. Stress responses in alfalfa(Medicago sativa L.)XVIII:Molecular cloning and expression of the elicitor-inducible cinnamic acid 4-hydroxylase cytochrome 450[J]. Arch Biochem Biophys, 1993, 305 (2): 509–515. DOI:10.1006/abbi.1993.1454 |
| [3] | Li W, Yang LX, Jiang LZ, et al. Molecular cloning and functional characterization of a cinnamate 4-hydroxylase-encoding genefrom Camptotheca acuminata[J]. ACTA Physiologiae Plantarum, 2016, 38 (11): 255–263. DOI:10.1007/s11738-016-2273-9 |
| [4] | Liu XY, Yu HN, Gao S, et al. The isolation and functional characterization of three liverwort genes encoding cinnamate 4-hydroxylase[J]. Plant Physiol Biochem, 117:42-50. http://www.ncbi.nlm.nih.gov/pubmed/28587992 |
| [5] | 李莉, 赵越, 马君兰. 苯丙氨酸代谢途径关键酶:PAL、C4H、4CL研究新进展[J]. 生物信息学, 2007, 5(4): 187–189. |
| [6] | 张梅, 林棋. 茉莉酸甲酯对锦绣杜鹃黄酮的累积及相关酶活性的影响[J]. 甘肃农业大学学报, 2015, 50(4): 65–169. |
| [7] | 李雅丽, 孟婷婷, 王毛毛, 等. 甘草细胞在搅拌式生物反应器中的放大培养[J]. 植物生理学报, 2015, 51(3): 302–306. |
| [8] | 张东雪, 王艳, 井妍, 等. 大豆GmC4H基因的克隆及同源基因的生物信息学分析[J]. 基因组学与应用生物学, 2016, 35(10): 2768–2774. |
| [9] | 陈鸿翰, 袁梦求, 李双江, 等. 苦荞肉桂酸羟化酶基因(FtC4H)的克隆及其UV-B胁迫下的组织表达[J]. 农业生物技术学报, 2013, 21(2): 137–147. |
| [10] | Cheniany M, Ganjeali Ali. Developmental role of phenylalanine-ammonia-lyase(PAL)and cinnamate 4-hydroxylase(C4H)genes during adventitious rooting of Juglans regia L. Microshoots[J]. Acta Biol Hung, 2016, 67 (4): 379–392. DOI:10.1556/018.67.2016.4.4 |
| [11] | Sykes RW, Gjersing EL, Foutz K, et al. Down-regulation of p-coumaroyl quinate/shikimate 3′-hydroxylase(C3′H)and cinnamate 4-hydroxylase(C4H)genes in the lignin biosynthetic pathway of Eucalyptus urophylla × E. grandis leads to improved sugar release[J]. Biotechnology for Biofuels, 2015, 8 : 128–138. DOI:10.1186/s13068-015-0316-x |
| [12] | Liang L, Han X, Zhang Z, et al. Cloning and expression analysis of cinnamate 4-hydroxylase(C4H)reductase gene from Aquilaria sinensis[J]. China Journal of Chinese Materia Medica, 2014, 39 (10): 1767–1771. |
| [13] | Li YL, Meng TT, Zhang XL. Study on enzymatic browning in suspension cultures of licorice cells[J]. Biotechnol. & Biotechnol, Equipment, 2016, 30 (2): 277–283. |
| [14] | Li YL, Yang Y, et al. Production of Glycyrrhizin in cell suspension of Glycyrrhiza inflata Batalin cultured in bioreactor[J]. Biotechnol. & Biotechnol. eq, 2012, 26 (5): 3231–3235. |
| [15] | 冯盼盼, 陈鹏, 洪文杰, 等. 拟南芥MYB转录因子家族研究进展[J]. 生命科学研究, 2016, 20(6): 555–560. |
| [16] | 杨艳. 茉莉酸甲酯处理雷公藤悬浮细胞的基因差异表达分析[D]. 杨凌: 西北农林科技大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10712-1011402917.htm |
| [17] | 刘雅静. 蒙古黄芪悬浮细胞系的建立及茉莉酸甲酯对其黄酮含量的调控[D]. 呼和浩特: 内蒙古大学, 2011. |
| [18] | 蔡静, 马赟, 陈建伟, 等. 茉莉酸甲酯对明党参植株和悬浮细胞中呋喃香豆素积累的影响[J]. 中国药学杂志, 2017, 42(1): 76–82. |





