烟草病毒能侵染危害烟草、番茄、辣椒和土豆等多种作物。20世纪50年代以来,病毒病先后在世界各国农作物上发生,烟草花叶病毒病(Tobacco mosaic virus,TMV)具有种类多、分布广的特点,给农业生产造成了巨大损失,成为主要病害之一[1]。PeaT1是从极细链格孢菌中分离的一种能诱导植物广谱抗性的蛋白激发子[2],能诱导植物提高自身的免疫抗性,对多种植物病毒病有较好的控制作用[3]。因此,利用蛋白激发子作为植物免疫诱导剂,通过激发植物自身的免疫防御系统以控制农作物病毒病,具有安全、高效和防效持久的优点,是当前农业生产上控制植物病毒病的有效措施之一。井冈霉素是由吸水链霉菌井岗变种产生的抗生素,对控制水稻纹枯病有特效,已推广使用多年,表现出良好的抗病增产效果,但其对防治病毒病是否有效还未见报道。张穗等[4]曾报道,井冈霉素能够诱导水稻抗病性。为了明确井冈霉素对病毒病的作用效果,以及其与蛋白激发子PeaT1联合使用对水稻病毒病等的防治效果,本研究以模式植物烟草为例,验证井冈霉素以及蛋白激发子PeaT1-井冈霉素复合剂对烟草花叶病毒病(TMV)的防控效果,以期为新型复合生物药剂同时防治多种农作物病害提供科学依据。
1 材料与方法 1.1 材料 1.1.1本生烟(Nicotiana benthamiana cv. Huangmia-oyu)播种于防虫温室的苗盘中,温度25-30℃,光照14 h条件下土培(灭菌土:草炭土:蛭石= 1:1:1)生长,待长至3-4叶龄时移栽到直径为13 cm的花盆中,每盆1-2株。4-5叶期时用于配方筛选试验,5-7叶期用于抗药性试验。
1.1.2 TMV-GFP[5]TMV-GFP病毒是将绿色荧光蛋白(GFP)插入TMV病毒的外壳蛋白(CP)与开放阅读框(ORF)之间所构成的重组病毒,重组病毒的侵染和移动不受影响[6]。TMV-GFP病毒在UV灯的照射下会发出绿色荧光以便观察[7],在可见光的照射下没有明显枯斑反应。携带TMV-GFP的农杆菌由清华大学刘玉乐教授馈赠。
1.1.3 供试药剂井冈霉素(60%,浙江龙游东方农药有限公司生产)、蛋白激发子PeaT1可湿性粉剂(3%,河南普绿通生物科技有限公司生产)、蛋白激发子PeaT1-井冈霉素复合制剂(自行配制)。
1.2 方法 1.2.1 TMV-GFP的制备与接种在LB培养基(含50 mg/L卡那霉素和50 mg/L利福平)中发酵培养携带TMV-GFP的农杆菌GV3101,28℃、200 r/min、36 h;将发酵液离心,加少量ddH2O重悬,获得TMV-GFP悬浮液。将少量的金刚砂撒在待接种叶片上,取10 μL TMV-GFP悬液点滴在叶片上[8],用棉棒在叶片上轻轻摩擦接种。接种后的叶片用水轻轻冲洗,置于25℃黑暗培养12 h后放回温室培养。3-5 d后观察叶片在UV灯照射下可见大面积荧光时,将叶片在液氮中研磨成粉。按1:3体积比加ddH2O,4℃、8 000 r/min离心10 min,上清液冰浴备用。为保证病毒活性,农杆菌侵染的叶片暂时不用的情况下应于-80℃冰箱保存,病毒上清液应在使用前配制。
1.2.2 复合制剂配方的筛选将蛋白激发子PeaT1和井冈霉素按质量比为(3:1、3:2、3:3、3:4、3:5)称取后均匀混合,备用。参照杀菌剂农药室内生物测定实验准则(农业部行业标准NY/T1156.14-2008)和创制生物农药活性评价SOP(杀菌剂卷),采用喷雾法处理烟草。试验烟草幼苗分别用不同的混配药剂,采用1 000 mL手动喷雾器对烟草全株进行均匀喷雾处理,以清水为对照,与蛋白激发子PeaT1或井冈霉素的单剂处理分别进行对比。每处理设3个重复,在施药后5 d接种烟草花叶病毒、接种后10 d调查不同处理对烟草花叶病毒的防治效果。使用孙文沛的共毒系数法[9]计算共毒系数:
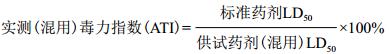
理论混用毒力指数(TTI)=A的毒力指数A在混用中的含量(%)+B的毒力指数B在混用中的含量(%)

共毒系数大于120为增效作用;若小于80为拮抗作用;若大于80小于120,表明为相加作用。
1.2.3 复合制剂诱导烟草系统抗性试验试验设3个实验组:清水CK、井冈霉素、蛋白激发子PeaT1、蛋白激发子PeaT1-井冈霉素复合制剂(3:4配方)。将5-7片叶的烟草苗用纸袋套住上三片叶,用各处理的1 000倍稀释液喷施植株。48 h后在套袋叶片上摩擦接种TMV-GFP病毒。在接种TMV-GFP病毒后,从72 h开始每隔24 h调查一次,每次每处理调查15片叶,连续调查4次。将调查得到的病斑数据用SPSS Statistics 19进行方差齐性检验、单因素方差分析、LSD、Duncan多重比较,计算相对防效。

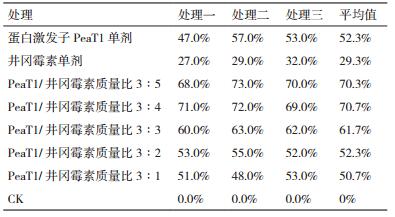
单剂生物活性测定结果表明,蛋白激发子PeaT1对烟草花叶病毒病的防效达到47.0%-57.0%,井冈霉素单剂对烟草花叶病毒病的防效达到27.0%-32.0%。蛋白激发子PeaT1·井冈霉素5个配比的生物活性测定结果见表 1。
毒力指数和共毒系数分析结果(表 2)表明,蛋白激发子PeaT1和井冈霉素质量比为(3:1、3:2、3:3、3:4、3:5)时均表现为控制烟草花叶病毒病具有增效作用,其中蛋白激发子PeaT1和井冈霉素质量比为3:4时增效作用的性价比为最好。
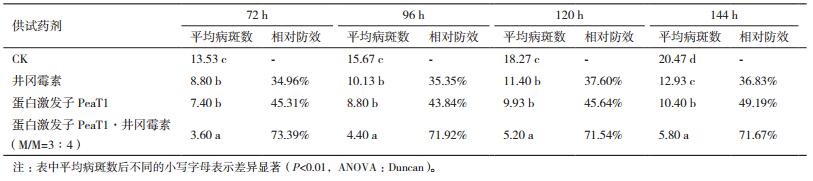
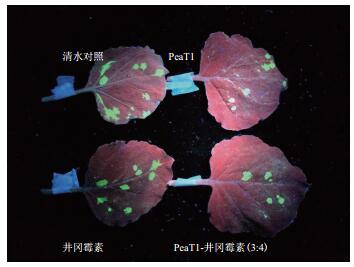
从表 3中可以看出,在接病毒后72 h、96 h、120 h的计数结果,蛋白激发子PeaT1-井冈霉素、井冈霉素、蛋白激发子PeaT1与清水对照差异性极显著,井冈霉素和蛋白激发子PeaT1单剂间没有显著性差异;在144 h时4者之间差异性极显著(图 1)。蛋白激发子PeaT1-井冈霉素复合制剂(3:4)相对防效最佳,达到了73.39%。
|
| 图 1 各处理对本生烟抗TMV-GFP病毒能力 |
烟草病毒病是严重影响我国农作物生产的主要病毒病害之一,造成的经济损失巨大。目前生产上防治烟草病毒病主要通过土壤消毒、隔离毒源等方法进行控制,没有直接作用于作物本身的有效药物。赵秀云[10]等研究发现一种青霉蛋白激发子EPTP可以诱导烟草产生系统获得性抗性,能够引起烟草叶片抗性基因转录水平上调,并诱导水杨酸茉莉酸途径相关抗性基因的表达。廖建松等[11]研究表明蛋白激发子PeaT1与氨基寡糖素的复合制剂对烟草花叶病防效达到了88.73%。李宏光等[12]研究表明7%井冈霉素·极细链格孢蛋白激发子PeaT1可湿性粉剂对烟草病毒病的防治效果在60%以上。蛋白激发子PeaT1主要是通过提高植物自身的免疫系统从而增强烟草对于烟草花叶病毒病的抗性[13]。井冈霉素是一类开发较早的抗生素,它能够进入烟草植株体内对感染植物的菌类进行抑制而达到杀菌效果[14]。井冈霉素作为抗生素类内吸性杀菌剂,在抗病毒病上一直鲜有报道,而蛋白激发子PeaT1在诱导植物自身抗病能力上一直是本实验室研究的方向。蛋白激发子PeaT1诱导烟草对病毒病的抗性,井冈霉素也可进入烟草体内杀菌,本研究基于二者对烟草病害的防治机理不同,通过将二者结合,筛选出了蛋白激发子PeaT1与井冈霉素3:4的最佳复配比例。
本研究将蛋白激发子PeaT1与井冈霉素科学配伍,充分利用两种成分的相互增效作用,提高作物对烟草病毒病的抗性,减轻烟草病毒病的发生程度,有效地控制病毒病的发生,为蛋白激发子PeaT1的应用提供了一个新的复配方案。
4 结论本研究通过筛选蛋白激发子PeaT1与井冈霉素不同配比的复配制剂,发现在蛋白激发子PeaT1与井冈霉素的比例为3:4时增效性价比最高,共毒系数达到157.64。将此复配制剂喷施于烟草叶片上,与蛋白激发子PeaT1、井冈霉素和清水进行比较,结果表明复配制剂与其他处理相比差异极显著,相对防效在72 h达到73.39%。
| [1] | 彭曙光. 我国烟草病毒病的发生及综合防治研究进展[J]. 江西农业学报, 2011, 23(1): 115–117. |
| [2] | 刘权, 李广悦, 曾红梅, 等. 微生物蛋白激发子PeaT1的获得及诱导水稻抗旱性的初步研究[J]. 中国农业科技导报, 2009, 11(3): 51–55. |
| [3] | 陈梅, 邱德文, 刘峥, 等. 植物激活蛋白对烟草花叶病毒RNA复制及外壳蛋白合成的抑制作用[J]. 中国生物防治学报, 2006, 22(1): 63–66. |
| [4] | 张穗, 郭永霞, 唐文华, 等. 井冈霉素A对水稻纹枯病菌的毒力和作用机理研究[J]. 农药学学报, 2001, 3(4): 31–37. |
| [5] | 张薇, 杨秀芬, 邱德文, 等. 激活蛋白PeaT1诱导烟草对TMV的系统抗性[J]. 植物病理学报, 2010, 40(3): 290–299. |
| [6] | Shivprasad S, Pogue GP, Lewandowski DJ, et al. Heterologous sequences greatly affect foreign gene expression in tobacco mosaic virus-based vectors[J]. Virology, 1999, 255 (2): 312–323. DOI:10.1006/viro.1998.9579 |
| [7] | Liu Y, Schiff M, Marathe R, et al. Tobacco Rar1, EDS1 and NPR1/NIM1 like genes are required for N-mediated resistance to tobacco mosaic virus[J]. Plant Journal, 2002, 30 (4): 415–429. DOI:10.1046/j.1365-313X.2002.01297.x |
| [8] | Wang B, Yang X, Zeng H, et al. The purification and characterization of a novel hypersensitive-like response-inducing elicitor from Verticillium dahliae that induces resistance responses in tobacco[J]. Appl Microbiol Biotechnol, 2012, 93 (1): 191–201. DOI:10.1007/s00253-011-3405-1 |
| [9] | 朱卫刚, 胡伟群, 陈定花, 等. 丙环唑和苯醚甲环唑复配对水稻纹枯病的联合毒力[J]. 农药, 2008, 47(5): 365–366. |
| [10] | 赵秀云, 祁高富, 李娜, 等. 一种青霉蛋白激发子EPTP及其在提高植物抗病性中的应用: 中国, CN106146630A[P]. 2016-11-23. |
| [11] | 李宏光, 易图永, 肖艳松, 等. 7%井冈霉素·极细链格孢激活蛋白可湿性粉剂对烟草病毒病的防效研究[J]. 现代农业科技, 2014(24): 126–126. DOI:10.3969/j.issn.1007-5739.2014.24.074 |
| [12] | 廖建松, 周路, 张承琴. 2种生物农药对烟草病毒病防治效果对比试验[J]. 现代农业科技, 2015(23): 133. DOI:10.3969/j.issn.1007-5739.2015.23.079 |
| [13] | 郑建华, 杨秀芬, 等. 激活蛋白PeaT1在烟草细胞膜上的结合位点及其特性[J]. 植物病理学报, 2010, 40(4): 364–372. |
| [14] | 刘海民. 井冈霉素防治水稻纹枯病作用机理研究[D]. 福州: 福建农林大学, 2008. |