木薯(Manihot esculenta)是大戟科块根植物,其块根富含淀粉,是热带、亚热带地区重要的粮食作物和经济作物。然而,在大田生产中木薯块根产量常常受到干旱、低温、遮荫等非生物胁迫的影响。木薯具有较好的抗旱的生物学特性,但这种抗性在某种程度上正是以牺牲其产量为代价的:在较为严重的干旱条件下,木薯生长缓慢、光合作用下降,其块根产量会显著减少[1]。作为典型的热带作物,木薯对低温非常敏感,极端的低温天气可造成木薯产量大量减产甚至绝收[2]。此外,在某些经济落后的地区(如拉丁美洲),农民常常将木薯和其他作物(如玉米、橡胶树等)间作或是增加木薯的种植密度,以达到土地使用效率最大化。在这种条件下,木薯常常遭受到不同程度的遮荫,其产量也会显著减少[3]。因此,进一步挖掘木薯抗逆重要基因,研究其在各种胁迫条件下的表达特征及功能,对通过遗传改良提高木薯的抗逆性进而增加其块根产量具有重要意义。
海藻糖是由2个葡萄糖分子通过α-1,1糖苷键结合而成的非还原性双糖。在干旱、低温、高盐等非生物胁迫条件下,植物体内海藻糖含量被大量积累,植株抗逆性得到增强[4-5]。海藻糖-6-磷酸合成酶(Trehalose-6-phosphate synthase,TPS)是海藻糖生物合成途径中的一个关键酶,其表达量的变化与海藻糖含量有着直接关系[5-6]。目前为止,已经先后从拟南芥(Arabidopsis thaliana)[7]、水稻(Oryza sativa)[6]、棉花(Gossypium hirsutum)[8]、碱茅(Puccinellia tenuiflora)[9]、茶树(Camellia sinen-sis)[10]、香蕉(Musa acuminata)[11]、辣椒(Cap-sicum annuum)[12]、和坛紫菜(Pyropia haitanen-sis)[13]等植物中克隆到TPS基因,并对其展开了较为深入的研究。将拟南芥TPS基因转入烟草(Nicotiana tabacum)后,植物体内的海藻糖含量明显提高,其耐受盐胁迫的能力显著增强[4]。在干旱、低温和高盐条件下,水稻OsTPS1转基因植株抗性明显增强,而且与对照相比,转基因植株体内海藻糖含量显著增加[5-6]。基因表达分析显示:在干旱胁迫条件下,海带(Saccharina japonica)TPS和棉花TPS的表达量显著增强[8, 14];在低温胁迫条件下,辣椒TPS和茶树TPS的表达量显著增强[10, 12];在高温和干旱胁迫条件下,坛紫菜TPS基因的表达量显著上调[13];在遮荫胁迫条件下,玉米(Zea mays)TPS基因的表达量也发生了显著的变化[15]。此外,TPS基因在植物不同组织器官中还呈现差异性表达的特点[10, 12]。这些研究充分表明,TPS基因的表达受到干旱、低温、和盐胁迫等诱导,在非生物胁迫条件下可以增强植物的抗逆性,但目前有关木薯TPS基因在非生物胁迫下的功能研究尚未见报道。
本研究从木薯栽培种Ku50叶片中克隆了一个TPS基因(MeTPS9),分析了其在木薯野生种和栽培种之间的结构变异,研究了其在不同品种之间、同一品种不同组织之间,以及在干旱、低温和遮荫胁迫条件下的表达模式,旨在为进一步研究MeTPS9的功能及抗逆分子机理奠定基础与提供参考。
1 材料与方法 1.1 材料本试验所用材料包括木薯栽培品种Ku50和Arg7,以及野生种W14,由中国热带农业科学院热带生物技术研究所提供。其中,栽培种Ku50的叶片用于MeTPS9基因克隆。
1.2 方法 1.2.1 材料种植与处理木薯种植按照丁泽红等[16]方法进行:在木薯种植季节,将Ku50种茎切成长度大约15 cm的茎段,挑选芽眼(3-4个/茎段)且粗细均匀一致的茎段扦插于塑料盆(高18.8 cm,上直径18.5 cm,下直径14.8 cm)中,1茎段/盆。基质采用营养土与蛭石以1:1的体积比进行混合。木薯种植约10 d后进行间苗,保留1苗/盆。
PEG模拟干旱处理:种植60 d后,选取长势一致的植株采用20%的PEG 6000溶液进行浇灌处理,同时设置对照(浇灌自来水,不施PEG)。在处理0、3和24 h后,分别收集叶片(包括未展开叶、第一片完全展开叶及老叶)和根的样品,液氮速冻、-80℃超低温冰箱保存。
低温处理:将种植60 d后且长势一致的植株放置于光照培养箱,进行4℃低温胁迫处理。在处理0、6和24 h后,分别收集未展开叶、第一片完全展开叶和根的样品,液氮速冻、-80℃超低温冰箱保存。
遮荫处理:遮荫处理的木薯种植于橡胶树底下,对照处理的木薯种植于室外。种植60 d后,选择生长状况较一致的植株,收集未展开叶、第一片完全展开叶和老叶的样品,液氮速冻、-80℃超低温冰箱保存。
为了比较不同木薯品种包括野生种(W14)和栽培种(Ku50、Arg7)中MeTPS9基因的表达情况,在大田种植90 d后收集了木薯叶片和根的样本,用于qRT-PCR分析;为了比较同一品种不同组织中MeTPS9基因的表达情况,收集了木薯Ku50叶片、叶柄、茎、须根和储藏根的样本,用于qRT-PCR分析。
1.2.2 RNA的提取及cDNA合成木薯总RNA采用RNA提取试剂盒(天根生化科技有限公司)进行提取,之后用Revert Aid First Strand cDNA Synthesis试剂盒(Fermentas公司)将总RNA反转录成cDNA,-20℃储存备用。
1.2.3 引物合成及qRT-PCR用Primer 6.0设计引物,由生工生物工程(上海)股份有限公司合成,包括actin基因引物(L1:5′-TGATGAGTCTGGTCCAT-CCA-3′;R1:5′-CCTCCTACGACCCAATCTCA-3′)[16],MeTPS9基因qRT-PCR引物(L2:5′-ATTGACCGT-CCTGTTCCTCG-3′;R2:5′-GTGCGAGGAGAATCCG-ATGT-3′),和MeTPS9基因全长扩增引物(L3:5′-ATGGTGTCAAGATCCTGTATGA-3′;R3:5′-TCA-AATAGCACTCTCAAAAGAGA-3′)。qRT-PCR采用SYBR Green Ⅰ试剂盒(TaKaRa公司),按照操作手册在Mx 3005P荧光定量PCR仪(Stratagene,美国)上进行。每个样品3次生物学重复,表达量按照2-ΔΔCt计算[16]。
1.2.4 生物信息学分析用BLASTP搜索Phytozome数据库,获取其他物种中与MeTPS9同源性较高的序列;用ClustalX进行序列比对;用MEGA5.2软件构建进化树;用DnaSPv5进行SNP分析及ka/ks计算;用NCBI-CDD数据库进行保守结构域分析;用PlantCARE进行启动子元件分析;用ExPASy ProtParam软件分析蛋白质的分子量和等电点;用Plant-mPLoc软件预测亚细胞定位情况。木薯栽培种Ku50和木薯野生种W14中MeTPS9基因序列由前期全基因组测序确定[17];栽培种AM560中MeTPS9序列从Phytozome数据库下载。
2 结果 2.1 MeTPS9基因克隆本实验室前期转录组数据发现了一个在干旱条件下差异表达的木薯TPS基因(cassava4.1_001517m),其表达量上升了约4.5倍,之后根据木薯数据库提供的参考序列,设计引物进行PCR扩增(图 1)。从Ku50叶片中扩增测序后得到一个全长为2 598 bp的序列,编码865个氨基酸,根据其与拟南芥TPS基因的同源性将其命名为MeTPS9。经与基因组信息比对,MeTPS9基因含有3个外显子和2个内含子。预测的蛋白质分子量为97 778.1 Da,理论等电点(pI)为5.70。亚细胞定位预测该蛋白质定位于叶绿体。蛋白质结构域分析表明,MeTPS9编码的蛋白含有TPS家族保守结构域(Glyco_transf_20,图 2),进一步表明克隆到的基因为MeTPS9基因。
|
| 图 1 MeTPS9基因全长cDNA电泳图 M:DNA marker;1:MeTPS9基因cDNA全长 |

|
| 图 2 MeTPS9蛋白质结构域分析 |
经BlastP在线比对,获取了与MeTPS9同源性较高的其他物种的蛋白质序列(图 3)。系统进化树表明,这些基因被聚类为3组:第Ⅰ组以C4物种为代表,包括谷子(Setaria italica)、狗尾草(Setaria viridis)、柳枝稷(Panicum virgatum)、玉米、高粱(Sorghum bicolor)和二穗短柄草(Brachypodium distachyon),并且水稻也聚类到了这一组,它与二穗短柄草亲缘关系较近;第Ⅱ组以十字花科的物种为代表,包括白菜型油菜(Brassica rapa)、荠菜花(Capsella grandiflora)、琴叶拟南芥(Arabidopsis lyrata)和拟南芥,MeTPS9也被聚类到了这一组,它与荠菜花Cagra.0605s0033和拟南芥AT1G23870的亲缘关系较近,序列相似性分别达到76.2%和75.6%;而杞柳(Salix purpurea)、鼠耳芥(Arabidopsis halleri)和杨树(Populus trichocarpa)被聚类到第Ⅲ组(图 4)。

|
| 图 3 MeTPS9与其他物种TPS蛋白质序列比对 |

|
| 图 4 MeTPS9基因与其他物种TPS基因系统进化树 |
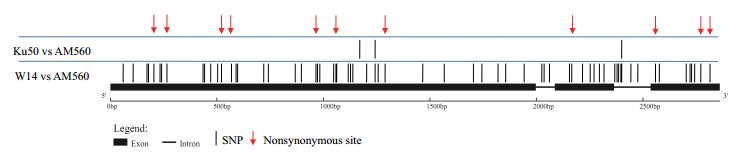
为了揭示MeTPS9在基因组结构上的变异,依据参考基因组信息,将栽培种AM560和Ku50、和野生种W14中MeTPS9的DNA序列进行比对分析,共发现66个SNP,其中有11个为非同义突变(图 5)。整体上这些变异的分布是比较均匀的。
|
| 图 5 MeTPS9基因结构变异 |
品种间两两比较表明,MeTPS9的结构变异主要来自于栽培种与野生种之间的差异,栽培种与栽培种之间的差异很小,仅有3个SNP。其中1个位于非编码区,2个位于编码区且都为同义突变。栽培种与野生种ka/ks的值介于0.083-0.088之间,暗示MeTPS9基因在进化的过程中受到了纯化选择。
2.4 MeTPS9基因启动子元件分析选取了MeTPS9起始密码子上游1 500 bp进行启动子元件分析,发现了许多与非生物胁迫相关的元件,如干旱相关元件MBS、低温相关元件LTR、热胁迫相关元件HSE等。在分析过程中发现了一个脱落酸(Abscisic acid,ABA)相关元件ABRE。除此之外,还发现了赤霉素相关元件GARE-motif,以及和与光相关的元件,如Sp1、Box Ⅰ和Box 4等。这些结果表明,MeTPS9可能参与木薯干旱、低温、激素、和光照(如遮荫)相关的基因调控。
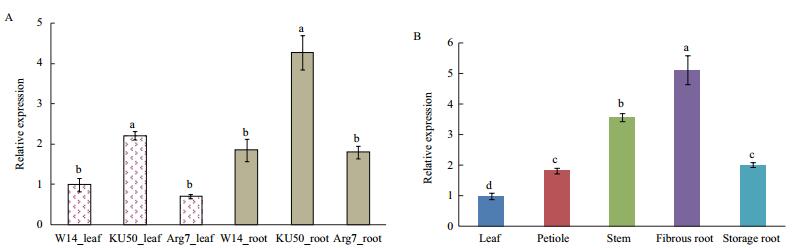
2.5 MeTPS9基因在不同品种和组织中的表达分析首先,分别比较了MeTPS9基因在木薯野生种和栽培种叶片和根中的表达情况。结果(图 6-A)表明,无论是叶片还是根中,MeTPS9基因在KU50中的表达量都要显著地高于W14和Arg7,而MeTPS9的表达量在W14和Arg7之间没有显著差异。不管是野生种还是栽培种,MeTPS9在根中的表达量都要明显的高于叶片,表明MeTPS9主要在木薯的根中起作用。
|
| 图 6 MeTPS9基因在木薯不同品种和组织中的表达分析 A:木薯野生种(W14)和栽培种(Ku50、Arg7)叶片和根中MeTPS9的表达情况;B:栽培种Ku50不同组织中MeTPS9的表情况。数据用均值±标准差表示,不同的字母表示Duncan’s多重比较显著(P < 0.05) |
其次,比较了MeTPS9基因在栽培种KU50不同组织中的表达情况。结果(图 6-B)表明,MeTPS9基因的表达量在须根中最高;其次是茎,然后是叶柄和储藏根,而在叶片中表达最低。这些结果进一步表明MeTPS9基因主要在木薯的须根中起作用。
2.6 MeTPS9基因在不同胁迫条件下的表达分析分别考察了MeTPS9基因在干旱、低温、和遮荫胁迫条件下不同组织中的表达情况。
在PEG 6000模拟干旱胁迫条件下,MeTPS9的表达量在未展开叶中被显著的抑制了,在胁迫3 h和24 h后分别下降了61%和24%。MeTPS9的表达量在第一片完全展开叶中没有明显变化;在老叶中3 h后有轻微上升,24 h后表达量最高、约上升了4.6倍。与前面结论一致,MeTPS9的表达量在根中最高,且被干旱胁迫显著的诱导了,在胁迫3 h和24 h后分别增加了2和1.6倍(图 7-A)。

|
| 图 7 MeTPS9基因在不同胁迫条件下的表达分析 A:干旱处理;B:低温处理;C:遮荫处理。FL:未展开叶、FEL:第一片完全展开叶、BL:老叶、RT:根。00、03、06和24分别代表胁迫处理0、3、6和24 h。数据用均值±标准差表示,不同的字母表示Duncan’s多重比较显著(P < 0.05),星号(*)表示t-test差异显著(P < 0.05) |
在低温胁迫条件下,无论是在未展开叶中、第一片完全展开叶还是在根中,MeTPS9的表达量都被显著的诱导了,在6 h后其表达量分别上升了1.8、1.4和2.2倍,而在24 h后其表达量分别上升了2.3、2.7和4.2倍(图 7-B)。
在遮荫条件下,MeTPS9的表达量在未展开叶中和第一片完全展开叶中都被显著的诱导了,分别增加了1.9和2.0倍。尽管MeTPS9的表达量在老叶中也有轻微上升,但差异不显著(图 7-C)。
这些结果充分表明,干旱、低温、和遮荫处理能够显著诱导MeTPS9基因的表达。
3 讨论TPS是海藻糖生物合成途径中的关键酶,在植物干旱、低温等逆境胁迫中扮演着重要角色。植物中TPS基因以基因家族的形式存在,大部分TPS蛋白都含有TPS基因家族保守结构域[7, 15]。目前,已经先后从拟南芥、水稻、棉花等多个物种中克隆了TPS基因,并对其功能进行了深入研究[6-7],但在木薯中尚没有相关的报道。本研究从木薯叶片克隆了一个TPS基因,命名为MeTPS9。序列分析表明,MeTPS9编码865个氨基酸,含有TPS家族保守结构域。同源性分析表明,它与荠菜花和拟南芥中的TPS氨基酸序列存在较高的相似性,分别为76.2%和75.6%。研究表明,植物中TPS9具有抵御干旱、低温等非生物胁迫的能力:在水稻中超表达TPS9可以增强转基因植株在低温和盐胁迫下的存活率[6];此外,在干旱和盐胁迫条件下杨树和拟南芥中TPS9基因的表达量也显著上调[18]。
基因结构变异可以引起其表达量的改变[19]。本研究比较了MeTPS9基因在木薯野生种和栽培种之间的序列差异,共发现66个SNP,其中有11个为非同义突变。尽管也观察到了MeTPS9的表达量在栽培种和野生种(例如Ku50 vs W14)存在显著差异,但表达量的差异是否由这11个非同义突变引起的,还需要进一步研究。进化分析表明,MeTPS9在进化的过程中受到了纯化选择,这一点与前人在其他物种中的研究报道一致[18]。在杨树、拟南芥和水稻中共发现34个TPS基因,这些基因在TPS保守结构域都受到了纯化选择,特别是AtTPS1、OsTPS1、PtTPS1、和PtTPS2基因,它们比其它TPS基因受到了更强的纯化选择[18]。
在干旱、低温等逆境胁迫条件下,植物体内会快速积累各种代谢物(如海藻糖)以提高细胞液浓度、降低其渗透势来维持细胞的正常生长。相应地,负责各种代谢物合成的基因的表达量就会被迅速诱导。TPS是参与海藻糖生物合成的一个关键酶,其表达量在植物不同组织器官中呈现差异性表达的特点[10, 12],暗示TPS基因在植物不同组织中扮演着不同的功能。通过比较木薯不同品种不同组织、以及同一品种不同组织中MeTPS9基因的表达量,发现MeTPS9基因在须根中的表达量最高、在叶片中的表达量最低,表明MeTPS9基因主要在木薯的须根中起作用。
TPS基因的表达量受到干旱、低温、遮荫等非生物胁迫的诱导。在干旱胁迫条件下棉花TPS和海带TPS的表达量被显著诱导[8, 14];在低温胁迫条件下茶树TPS和辣椒TPS的表达量显著增强[10, 12];在遮荫胁迫条件下,玉米TPS基因的表达量也发生了相应的变化[15]。本研究中,我们对MeTPS9基因的启动子序列进行分析,发现了干旱、低温、和光照相关的元件。为此,我们分别在干旱、低温、和遮荫胁迫条件下,在木薯不同叶片和根中对MeTPS9基因的表达进行了详细的研究。结果表明,MeTPS9基因能被干旱、低温、和遮荫显著地诱导。
ABA是一种非常重要的植物激素。在干旱、低温等非生物胁迫条件下,植物体内ABA含量会被迅速累积。研究表明,ABA信号是植物响应干旱、低温等非生物胁迫的主要调控路径之一[20]。尽管我们在MeTPS9基因的启动子区域也发现了ABA相关的元件(如ABRE),但MeTPS9是否通过ABA路径响应干旱、低温等非生物胁迫仍不清楚,还需要进一步研究。
4 结论本研究克隆了木薯MeTPS9基因,分析了其基因序列和蛋白质结构的特点,并详细考察了其在木薯不同品种不同组织、同一品种不同组织,以及多种胁迫条件下基因表达量的变化。这些结果将有助于了解木薯响应干旱、低温、遮荫等非生物胁迫的分子机制。
| [1] | Okogbenin E, Setter TL, Ferguson M, et al. Phenotypic approaches to drought in cassava:review[J]. Frontiers in Physiology, 2013, 4 (1): 93. |
| [2] | 卢赛清, 盘欢, 马崇熙, 等. 2008年广西木薯低温冻害情况及应对措施[J]. 广西热带农业, 2009, 1(1): 21–22. |
| [3] | Okoli PSO, Wilson GF. Response of cassava(Manihot esculenta Crantz)to shade under field conditions[J]. Field Crops Research, 1986, 14 (4): 349–359. |
| [4] | 郭蓓, 胡磊, 何欣, 等. 海藻糖-6-磷酸合成酶转基因烟草提高耐盐性的研究[J]. 植物学报, 2008, 25(1): 41–49. |
| [5] | Garg AK, Kim JK, Owens TG, et al. Trehalose accumulation in rice plants confers high tolerance levels to different abiotic stresses[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99 (25): 15898–15903. DOI:10.1073/pnas.252637799 |
| [6] | Li HW, Zang BS, Deng XW, et al. Overexpression of the trehalose-6-phosphate synthase gene OsTPS1 enhances abiotic stress tolerance in rice[J]. Planta, 2011, 234 (5): 1007–1018. DOI:10.1007/s00425-011-1458-0 |
| [7] | Delorge I, Figueroa CM, Feil R, et al. Trehalose-6-phosphate synthase 1 is not the only active TPS in Arabidopsis thaliana[J]. Biochemical Journal, 2014, 466 (2): 283–290. |
| [8] | Kosmas SA, Argyrokastritis A, Loukas MG, et al. Isolation and characterization of drought-related trehalose 6-phosphate-synthase gene from cultivated cotton(Gossypium hirsutum L.)[J]. Planta, 2006, 223 (2): 329–339. DOI:10.1007/s00425-005-0071-5 |
| [9] | 李莹, 柳参奎. 碱茅6-磷酸海藻糖合成酶基因的克隆及其耐逆性分析[J]. 草业学报, 2015, 24(1): 99–106. DOI:10.11686/cyxb20150113 |
| [10] | 丁菲, 庞磊, 李叶云, 等. 茶树海藻糖-6-磷酸合成酶基因(CsTPS)的克隆及表达分析[J]. 农业生物技术学报, 2012, 20(11): 1253–1261. |
| [11] | 邢文婷, 李科明, 贾彩红, 等. 香蕉海藻糖合成酶基因(MaTPS5)生物学及表达特性分析[J]. 生物技术通报, 2017, 33(2): 118–124. |
| [12] | 魏兵强, 王兰兰, 张茹, 等. 辣椒TPS家族成员的鉴定与CaTPS1的表达分析[J]. 园艺学报, 2016, 43(8): 1504–1512. |
| [13] | 史健志, 徐燕, 纪德华, 等. 坛紫菜6-磷酸海藻糖合成酶(TPS)家族基因的克隆及表达特征分析[J]. 水产学报, 2015, 39(4): 485–495. |
| [14] | Deng Y, Wang X, Guo H, et al. A trehalose-6-phosphate synthase gene from Saccharina japonica(Laminariales, Phaeophyceae)[J]. Molecular Biology Reports, 2014, 41 (1): 529. DOI:10.1007/s11033-013-2888-5 |
| [15] | Henry C, Bledsoe SW, Siekman A, et al. The trehalose pathway in maize:conservation and gene regulation in response to the diurnal cycle and extended darkness[J]. Journal of Experimental Botany, 2014, 65 (20): 5959–5973. DOI:10.1093/jxb/eru335 |
| [16] | 丁泽红, 付莉莉, 铁韦韦, 等. 木薯MeNCED3基因克隆、结构变异及其表达分析[J]. 生物技术通报, 2016, 32(10): 148–153. |
| [17] | Wang W, Feng B, Xiao J, et al. Cassava genome from a wild ancestor to cultivated varieties[J]. Nature Communications, 2014, 5 (5): 5110. |
| [18] | Yang HL, Liu YJ, Wang CL, et al. Molecular evolution of trehalose-6-phosphate synthase(TPS)gene family in populus, Arabidopsis and rice[J]. PLoS One, 2012, 7 (8): e42438. DOI:10.1371/journal.pone.0042438 |
| [19] | Hao GP, Zhang XH, Wang YQ, et al. Nucleotide variation in the NCED3 region of Arabidopsis thaliana and its association study with abscisic acid content under drought stress[J]. Journal of Integrative Plant Biology, 2009, 51 (2): 175–183. DOI:10.1111/jipb.2009.51.issue-2 |
| [20] | Shinozaki K. Gene networks involved in drought stress response and tolerance[J]. Journal of Experimental Botany, 2007, 58 (2): 221–227. |




