2. 海南大学农学院,海口 570228
2. Hainan University, Haikou 570228
ABA是以异戊二烯为基本结构的倍半萜类,同时也是类胡萝卜素代谢途径的下游产物。新黄质与堇菜黄质是ABA合成的前体物质[1]。同时,ABA也是一类重要的植物抗逆激素,在调控植物的衰老等方面有着重要的作用[2]。翁倩等[3]通过使用不同浓度的外源ABA喷施番茄果实发现,外源ABA能够促进番茄红素的积累,但其含量随着外源ABA浓度的增加呈现先增加后减少的趋势。王贵元等[4]用外源ABA处理转色前的红肉脐橙果实发现其加速了果皮叶绿素的降解,但同时也抑制果皮中类胡萝卜素的积累。
木薯(Manihot esculenta Crantz)为大戟科木薯属植物,不仅具有高光效和高淀粉积累特性,而且耐贫瘠和干旱,对环境适应能力强。木薯与马铃薯和红薯并列世界三大薯类作物,是世界热区近8亿人的主粮[5-6]。木薯块根中的β-胡萝卜素占总类胡萝卜素含量90%以上[7],因此β-胡萝卜素是评价块根营养含量的重要指标之一。目前对于木薯块根类胡萝卜素调控的研究主要集中在超量表达类胡萝卜素相关基因、干旱胁迫、盐胁迫等方面[8-9]。而通过外源ABA对木薯块根类胡萝卜素含量变化的研究较少。本研究通过喷施外源ABA及其生物合成抑制剂钨酸钠对木薯块根类胡萝卜素合成及降解途径的相关基因和酶的表达水平的变化,探讨ABA对块根类胡萝卜素含量及相关酶和基因的影响,旨为提高木薯块根类胡萝卜素提供理论及实践依据。
1 材料与方法 1.1 材料实验于2014-2015年在海南省儋州市中国热带农业科学院热带作物品种资源研究所进行。供试材料来源于国家木薯种质资源圃所提供的华南9号木薯(Manihot esculenta Crantz SC9)品种。
1.2 方法 1.2.1 材料处理选取长度相近的木薯茎干植于盆栽中。待其生长至9个月(2016年10月20日前后)成熟期(9个月是木薯块根的成熟期,块根β-胡萝卜素的含量相较于膨大期(6个月)与形成期(3个月)稳定)后进行外源ABA及其生物抑制剂钨酸钠(Na2WO4)对植株叶面进行正反面喷施及灌根,以叶面滴水为限。其中ABA的浓度为20 μg/L,钨酸钠浓度为2 000 mg/L[10],每5 d处理一次,共喷施4次。以清水对照作为处理,每种处理6盆,并至于温室大棚中进行看护。与2016年11月10日开始挖取木薯块根,每种处理挖取3次,并以清水洗净后切碎液氮冻存。
1.2.2 木薯块根β-胡萝卜素的提取木薯块根β-胡萝卜素的提取参照Lucia[11]方法进行。称取5.0 g SC9清水对照、SC9 ABA处理、SC9钨酸钠处理木薯块根(去皮、首尾和中间三段)用液氮碾磨至粉末状,每个品种3次重复。转入10 mL离心管,加入2 mL冷丙酮涡混,再加入2 mL冷冻石油醚涡混。4℃,3 000 r/min,离心5 min后取上清液,转入10 mL离心管,剩余残渣加入1 mL石油醚再次涡混、离心,重复抽提3次,直到残渣变成无色,收集的样品液用氮气吹干,加入500 µL丙酮溶解后转入棕色样品瓶中。YCM Carotenoid S-3柱、柱温30℃、流动相甲醇/叔丁基甲醚(70:30,V:V)、1 mL/min流速、20 µL进样量并于450 nm测定波长进行HPLC分析。
1.2.3 RNA样品的提取及反转录参照TIANGEN RNAprep Pure Plant Kit多糖多酚试剂盒说明进行木薯块根总RNA的提取。用1%的琼脂糖凝胶电泳检测,如图 1所示,从图中可以看出3个样本的总RNA条带清晰,没有降解。以1000ng的RNA进行反转录,RNA反转录参照TaKaRa公司的PrimeScriptTM RT regant Kit with gDNA Eraser(Perfect Real Time)进行基因组去除及反转录。
|
| 图 1 不同处理下木薯块根样品总RNA凝胶电泳分析 |
木薯块根Actin、DXS、DXR、ZEP、NCED3、Or、PAP1、PAP3和PAP14基因表达分析依照TaKaRa公司的SYBR Prime Ex Taq试剂的要求进行反应液混合:SYBR Prime Ex Taq Ⅱ 5 µL,上游引物0.5 µL,下游引物0.5 µL,cDNA模板1 µL,dH2O 3 µL。PSY1、PSY2、PDS、ZDS、HYD、CCD1、LCYE和LCYB基因的表达量参照ThermoFisher公司的TaqMan Fast Advanced Master Mix试剂的要求进行反应液的混合。与类胡萝卜素代谢通路相关的上述基因实时定量PCR引物序列,如表 1所示。PCR反应循环条件为:94℃1.5 min;94℃ 30 s,59℃30 s,72℃30 s,共40个循环;绘制熔解曲线。以SC9清水对照下和各个处理的Actin为看家基因,采用2-ΔΔCt分析不同处理下的基因表达量。每个处理3次重复。以Actin为内参基因,分析1-脱氧-D-木酮糖-5-磷酸还原异构酶基因(DXR)、1-脱氧-D-木酮糖-5-磷酸合成酶基因(DXS)、八氢番茄红素合成酶基因(PSY1和PSY2)、八氢番茄红素脱氢酶基因(PDS)、ζ-胡萝卜素脱氢酶基因(ZDS)、番茄红素β-环化酶基因(LYCB)、番茄红素ε-环化酶基因(LYCE)、β-胡萝卜素羟化酶基因(HYD)、玉米黄质环化酶基因(ZEP)、胡萝卜素裂解双加氧酶(CCD1)、9-顺式-环氧类胡萝卜素双加氧酶(NCED3)和质体发育基因(OR),以及脂类相关质体蛋白基因(PAP1、PAP3、PAP14)的表达水平。
参照Carvalho等[12]丙酮沉淀法提取块根蛋白质,后加入适量的(1×SDS loading buffer[1 mol/L Tris-HCl(pH6.8)]、0.2 mol/L DTT、4% SDS、20%甘油)熔解。采用SDS-PAGE对溶解后的蛋白样品进行电泳,电泳结束后置于转膜仪(iBlotTM Dry Blotting System)转移到醋酸纤维膜(PVDF)后进行Western blot检测。相关方法参照Carvalho等[12]。以各个处理Actin作为内参,其中:抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)、超氧化物歧化酶(Fe-SOD、Cu/Zn-SOD)、番茄红素β-环化酶(LCYB)、玉米黄质环氧酶(ZEP)、原纤蛋白(FBN1a)抗体稀释倍数分别为1:1 000、1:1 000、1:2 000、1:2 000、1:2 000、1:2 000和1:1 500,稀释倍数参照Agrisera说明书,各2次重复。
1.2.6 统计分析Western Blot条带利用Image J(版本1.38e)软件进行图片数据量化分析用EXCEL 2016 plus和SPSS 22.0统计软件对数据进行分析,差异显著性(0.05水平)分析采用新复极差法(Duncan)和最小显著差异法(LSD)。
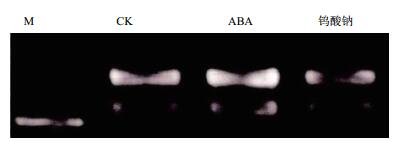
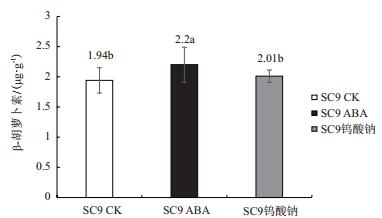
2 结果 2.1 ABA与钨酸钠处理对块根β-胡萝卜素含量的影响在ABA的处理下,块根β-胡萝卜素的含量有所提高,达到2.2 μg/g,对比清水处理达到显著水平(P < 0.05)。在ABA的抑制剂钨酸钠处理下,块根的β-胡萝卜素的含量显著低于喷施ABA组处理的木薯块根,但与清水处理组的相比略有升高但并未达到显著水平(图 1)。
|
| 图 1 不同处理下块根β-胡萝卜素含量变化 |
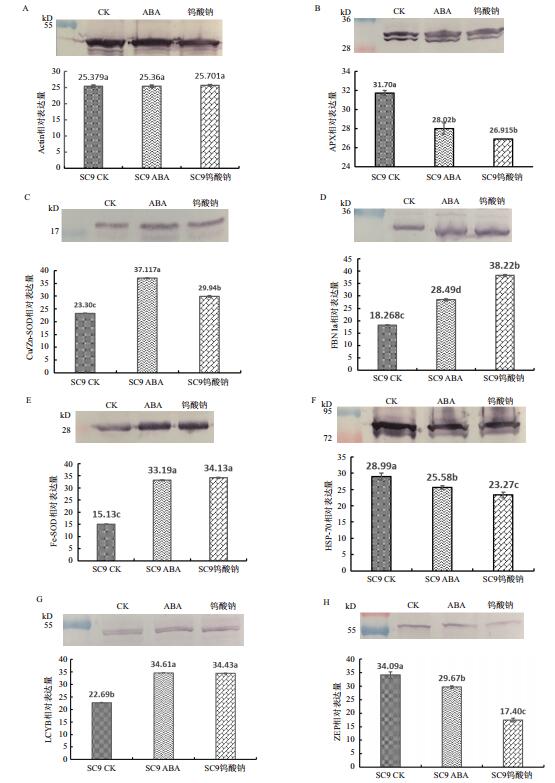
木薯内参蛋白Actin的表达量来衡量各个上样量是否一致。经比对,Actin的表达量(图 2-A)在各个处理间的水平一致,表明可以继续进行各个酶的表达水平分析。本研究选用与ROS信号相关的酶类(GR、APX、Fe-SOD、Cu/Zn-SOD)、类胡萝卜素合成途径相关的酶类(LCYB、ZEP)、质体相关蛋白(FBN1a)对外源ABA及钨酸钠喷施处理的SC9木薯块根类胡萝卜素代谢进行综合分析。与ROS相关的酶类中,清水对照的APX(图 2-B)的表达量要显著高于其他处理,钨酸钠处理同ABA处理相比则略有下调但差异并不显著。在GR的表达量(图 2-F)中,ABA、钨酸钠处理组与对照相比差异并不显著。在Fe-SOD(图 2-E)的表达量中ABA和钨酸钠的处理组显著高于对照但两者间差异不大。而ROS中Cu/Zn-SOD(图 2-C)的表达量在ABA和钨酸钠的处理组显著高于对照,且喷施ABA的木薯块根表达量要显著高于其抑制剂钨酸钠组。质体相关酶FBN1a(图 2-D)在ABA、钨酸钠处理组的表达量要显著高于对照,且钨酸钠处理组的表达量更高于ABA组。
|
| 图 2 类胡萝卜素相关蛋白表达水平变化 A:肌动蛋白相对表达量;B:抗坏血酸过氧化物酶相对表达量;C:铜与锌超氧化物歧化酶相对表达量;D:原纤丝蛋白相对表达量;E:铁超氧化物酶相对表达量;F:谷胱甘肽过氧化物酶相对表达量;G:玉米黄质环化酶相对表达量;H:番茄红素β-环化酶相对表达量 |
在类胡萝卜素合成途径相关的两个酶类中,LCYB的表达量(图 2-H)在外源ABA、钨酸钠处理显著高于对照,但处理组两者间的表达量差异不大。同样,ZEP(图 2-G)ABA与钨酸钠处理组的表达量受到显著抑制,但钨酸钠处理后的块根受到抑制的程度更大。
2.3 ABA与钨酸钠处理下类胡萝卜素相关代谢基因表达水平分析在外源喷施ABA与钨酸钠的处理组中,MEP途径的DXS、DXR基因在ABA处理组中均小幅上调,但在钨酸钠处理组中显著下调表达。核心酶基因PSY2两处理组均上调表达,并达到显著水平(P>0.05)。但PSY1在两个处理组都下调表达,其中钨酸钠组受到抑制程度大雨ABA组。在脱氢酶基因PDS和ZDS中,ABA处理组均上调表达并达到显著,而钨酸钠组的PDS基因下调表达,而ZDS基因上调表达。分支酶基因LCYB与LCYE基因表达量上存在巨大差别。LCYB基因在喷施ABA与钨酸钠下均显著上调表达且ABA组显著高于后者。而在LCYE基因中,两者均受到抑制,显著下调,且ABA组的下调幅度更大。在HYD基因,两个处理组均上调表达,但钨酸钠组上调表达的幅度更大,而ZEP基因的表达与HYD基因相反。降解相关的CCD1与NCED3基因中表达变化差距明显。在CCD1中,ABA处理组与钨酸钠处理组均显著上调表达但喷施ABA后的块根的CCD1上调更高(P>0.05)。相反在NCED3上,两者均诱导显著下调表达而喷施钨酸钠的处理组下调幅度更大。OR基因在4个在质体相关蛋白基因中变动幅度最大,两个处理组的表达量均达到显著水平,但钨酸钠上调更多。PAP1在两个处理组下均上调表达,且钨酸钠组略微高于ABA组。而PAP3、PAP14的表达量均受到抑制,ABA处理下的PAP14受到抑制的程度更为显著,但钨酸钠处理下PAP3与PAP14差异不大(图 3)。
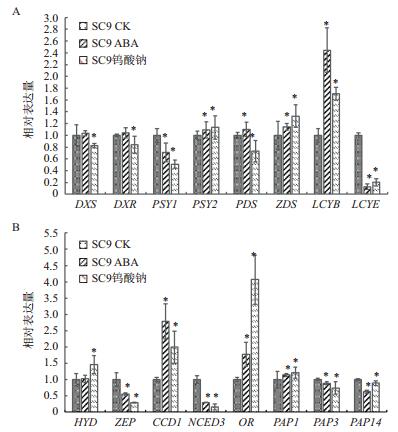
|
| 图 3 外源ABA及钨酸钠对类胡萝卜素相关基因的影响 Actin:木薯看家基因;DXS:1-脱氧-D-木酮糖-5-磷酸合成酶基因;DXR:1-脱氧-D-木酮糖-5-磷酸还原异构酶基因;PSYI、PSY2:八氢番茄红素合成酶基因;PDS:八氢番茄红素脱氢酶基因;ZDS:ζ-胡萝卜素脱氢酶基因;HYD:β-胡萝卜素羟化酶基因;CCD1:胡萝卜素裂解双加氧酶;LCYE:番茄红素ε-环化酶基因;LCYB:番茄红素β-环化酶基因;ZEP:玉米黄质环化酶基因;NCED3:9-顺式-环氧类胡萝卜素双加氧酶;OR:质体发育基因;PAP1、PAP3、PAP14:脂类相关质体蛋白基因 |
为了了解外源喷施ABA及抑制剂对木薯块根类胡萝卜素积累的调控机理。本研究对参与类胡萝卜素合成、降解、贮存等相关基因进行了转录水平分析。同时也对部分基因相对应的蛋白进行了Westernblot分析。ABA处理的木薯块根中,除去PSY1、LCYE外与类胡萝卜素合成相关的基因都上调表达。在植物中,PSY是决定组织中类胡萝卜素含量的核心催化酶[13]。木薯中共含有3个PSY基因,其中,PSY1主要在叶片中表达,PSY2在块根中有高表达而PSY3基本不表达[8]。PSY2的上调表达表明了类胡萝卜合成的能力增强。而番茄红素的环化也是类胡萝卜素代谢中重要的分支点,而LCYB与LCYE是参与其中的两个关键酶[14]。LCYB转录水平的显著上升与LCYE的转录水平显著下调使得类胡萝卜素的代谢向下游β-途径的转化要高于α途径。同时WB也显示喷施ABA的LCYB的表达量要显著高于对照。这恰好可以解释β-胡萝卜素在块根中的含量上升。高等植物中类胡萝卜素降解途径主要有两部分,分别是类胡萝卜素裂解双加氧酶(CCDs)与9-顺式-环氧类胡萝卜素双加氧酶(NCEDs),而NCED是合成ABA的限速酶,它能够催化紫黄质及新黄质裂解形成ABA前体[15]。此外玉米环氧化酶(ZEP)在ABA的合成中有着重要作用。最近有研究表明NCED3在木薯块根中高表达且能被PEG,NaCl处理诱导[16]。研究发现,喷施ABA后ZEP在转录水平上被抑制且WB也显示相同的结果,而ZEP能够催化玉米黄质向紫黄质的转化。NCED3显著下调表明β-胡萝卜素向ABA的转化减少,以至于阻碍了类胡萝卜素的降解。相反CCD1与NCED3呈现巨大的差异,暗示CCD1在类胡萝卜素降解途径中扮演其他重要的作用。
ABA合成抑制剂钨酸钠通过抑制ABA合成中的醛氧化酶原(ABA-aldehydeoxidase)使得ABA醛不能转化为ABA[17]。本研究显示,钨酸钠处理木薯块根对类胡萝卜素合成相关基因的DXS、DXR、PDS等有抑制作用,但对PSY2、LCYB都有促进作用表明其也能够促进类胡萝卜素的合成。但在类胡萝卜素降解途径中,ZEP、NCED3的表达量都显著下降,表明类胡萝卜素降解同样受到抑制但程度低于ABA组。而喷施钨酸钠的木薯块根β-胡萝卜素的含量相对与对照仅略微升高,猜测其对类胡萝卜素的影响存在不同途径。
有研究认为,植物内活性氧相关酶的表达水平的提高是番茄及辣椒叶绿体向有色体转变的主要特点之一[18-19]。本研究中,喷施外源ABA与钨酸钠后Fe-SOD与Cu/Zn-SOD都有提高。一方面ROS可以作为第二信使诱导质体中与类胡萝卜素相关基因转录水平的提高[20];另一方面氧化还原酶活性的提高能够保护质体中的组分避免来自活性氧的伤害[22]。有研究报道喷施外源ABA能够促进细胞内SOD和POD的活性[21]。因此,推测ABA处理能够提高块根内ROS及其ROS相关酶的含量,并提高类胡萝卜素相关基因的表达活性及减轻活性氧对块根质体的伤害,进而提高β-胡萝卜素的含量。而APX和GR可能在类胡萝卜素其他代谢通路中扮演作用。
质体小球是类胡萝卜素合成与积累的载体,原纤蛋白(FBN)又称为质体相关蛋白(PAP)或有色体与类胡萝卜素相关的特殊蛋白(CHRC)[22],同时Or基因也是第一个被报道关于有色体形成的关键基因[23]。FBN蛋白被发现其紧密联系在富含类胡萝卜素的有色体中,且是红色辣椒有色体中含量最高的蛋白质[24]。有研究发现转FBN基因的能够提高类胡萝卜素的含量[25]。本研究发现,喷施外源ABA及钨酸钠都能够促进Or及PAP1的表达,且与PAP1基因相对应的FBN1a的表达量也同步升高,表明了转录水平与翻译水平的一致性。推测这些基因的表达提高了有色体原纤蛋白的表达并增加了质体小球的数目,而类胡萝卜素主要储存于有色体结构当中[26],因此β-胡萝卜素高于清水对照。而PAP3及PAP14基因可能定位与类囊体或叶绿体中[27],因此它们的表达变化可能不涉及块根中类胡萝卜素含量的变化。
4 结论综上所述,本研究通过喷施外源ABA提高了类胡萝卜素合成途径关键基因PSY2表达量与LCYB的活性并抑制降解途径NCED3的表达及ZEP的活性,并提高与质体相关的基因Or和PAP1及相对应的FBN1a的表达量,同时通过提高细胞内ROS相关酶Fe-SOD与Cu/Zn-SOD的表达间接促进与类胡萝卜素相关基因并降低活性氧对类胡萝卜素的破坏,这三者相互作用提高了木薯块根β-胡萝卜素的含量。ABA的抑制剂钨酸钠在上述三者所起的作用与外源ABA的相似,但对提高β-胡萝卜素并不显著,对其内在的相关性仍需要进一步的研究。
| [1] | Zeevaart J, Creelman R. Metabolism and physiology of abscisic acid[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1988, 39 : 439–473. DOI:10.1146/annurev.pp.39.060188.002255 |
| [2] | Taylor IB, Burbidge A, Thompson AJ. Control of abscisic acid synthesis[J]. Journal of Experiment Botony, 2000, 51 : 1563–1574. DOI:10.1093/jexbot/51.350.1563 |
| [3] | 翁倩, 周宝利, 于洋, 等. 外源ABA、BR和ETH对番茄果实番茄红素含量的影响[J]. 沈阳农业大学学报, 2007, 38: 787–784. |
| [4] | 王贵元, 夏学仁, 周开兵. 外源ABA和GA3对红肉脐橙果皮主要色素含量变化和果皮着色的影[J]. 武汉植物学研究, 2004, 22(3): 273–276. |
| [5] | 张振文, 李开绵, 叶剑秋, 等. 木薯光合作用特性研究[J]. 云南大学学报, 2007, 29(6): 628–632. |
| [6] | 陈冠喜, 李开绵, 叶剑秋, 等. 6个木薯品种生长发育及产量性状的初步研究[J]. 热带农业科学, 2009, 29: 6. DOI:10.3969/j.issn.1009-2196.2009.05.002 |
| [7] | Ortega-Flores CI, Lopes da Costa MA, Cereda P. Bioavailabilty of β-carotenein dehydrated yellow cassava(Manihot esculenta Crantz). La biodisponibilidad de β-caroteno en yuca deshidratada hojas(Manihot esculenta Crantz)[J]. Cienc Tecnology Alim, 2003, 23 : 473–477. DOI:10.1590/S0101-20612003000300030 |
| [8] | Arango J, Wust J, Welsch, et al. Characterization of phytoene synthases from cassava and their involvement in abiotic stress-mediated response[J]. Planta, 2010, 232 : 1251–1262. DOI:10.1007/s00425-010-1250-6 |
| [9] | Ralf W, Jacobo A, Cornelia B, et al. Provitamin A accumulation in cassava(Manihot esculenta)roots driven by a single nucleotide polymorphism in a phytoene synthase gene[J]. Plant Cell, 2010, 22 (10): 3348–3356. DOI:10.1105/tpc.110.077560 |
| [10] | 王淑娟. ABA对木薯块根淀粉积累影响机制初探[D]. 海口: 海南大学, 2014. |
| [11] | Lucia M, Alcides R, Ronoel L, et al. Retention of total carotenoid and β-carotene in yellow sweet cassava(Manihot esculenta Crantz)after domestic cooking[J]. Food Nutrition Research, 2012, 56 : 15788. DOI:10.3402/fnr.v56i0.15788 |
| [12] | Camalho LJ, Lippolis J, Chen S, et al. Characterization of carotenoid-protein complexes and gene expression analysis associatedwith carotenoid sequestration in pigmented cassava(Manihot esculenta Crantz)storage root[J]. Open Biochemical Journal, 2012, 6 : 116–130. DOI:10.2174/1874091X01206010116 |
| [13] | Burkhardt PK, Beyer P, Wunn J, et al. Transgenic rice(Oryza sativa)endosperm expressing daffodil(Narcissus pseudonarcissus)phytoene synthase accumulates phytoene, a key intermediate of provitamin A biosynthesis[J]. Plant Journal, 1997, 11 : 1071–1078. DOI:10.1046/j.1365-313X.1997.11051071.x |
| [14] | Cazzonelli C, Pogson B. Source to sink:regulation of carotenoid biosynthesis inplants[J]. Trends in Plant Science, 2010, 15 : 266–274. DOI:10.1016/j.tplants.2010.02.003 |
| [15] | Nambara E, Marion-Poll A. Abscisic acid biosynthesis and catabolism[J]. Annual Review of Plant Biology, 2005, 56 : 165–185. DOI:10.1146/annurev.arplant.56.032604.144046 |
| [16] | 丁泽红, 付莉莉, 铁韦韦, 等. 木薯MeNCED3基因克隆、结构变异及其表达分析[J]. 生物技术通报, 2016, 32(10): 148–153. |
| [17] | 刘剑锋, 张春吉, 程云清, 等. ABA及其合成抑制剂钨酸钠处理对榛胚珠发育的影响[J]. 园艺学报, 2013, 40(2): 213–220. |
| [18] | Barsan C, Zouine M, Maza E, et al. Proteomic analysis of chloroplast-to-chromoplast transition in tomatoreveals metabolic shifts coupled with disrupted thylakoid biogenesis machinery and elevatedenergy-production components[J]. Plant Physiol, 2012, 160 : 708–725. DOI:10.1104/pp.112.203679 |
| [19] | Marti MC, Camejo D, Olmos E, et al. Characterisation and changes in the antioxidant system of chloroplasts and chromoplast isolated from pepper fruits[J]. Plant Biology, 2009, 11 : 613–624. DOI:10.1111/plb.2009.11.issue-4 |
| [20] | Bouvier F, Backhaus RA, Camara B. Induction and control of chromoplast-specific carotenoid genes by oxidative stress[J]. Journal of Biological Chemistry, 1998, 273 : 30651–30659. DOI:10.1074/jbc.273.46.30651 |
| [21] | Egea I, Barsan C, Bian WP, et al. Chromplast differentiation:current status and perspectives[J]. Plant and Cell Physiology, 2010, 51 : 1601–1611. DOI:10.1093/pcp/pcq136 |
| [22] | 李馨园, 杨晔, 张丽芳, 等. 外源ABA对低温胁迫下玉米幼苗内源激素含量及Asr1基因表达的调节[J]. 作物学报, 2017, 43(1): 141–148. |
| [23] | Lu S, Van Eck J, Zhou X, et al. The cauliflower Or gene encodes a DnaJ cysteine-rich domain-containingprotein that mediates high levels of beta-carotene accumulation[J]. Plant Cell, 2006, 18 : 3594–3605. DOI:10.1105/tpc.106.046417 |
| [24] | Li L, Paolillo DJ, Parthasarathy MV, et al. A novel gene mutation that confers abnormal patterns of β-carotene accumulation in cauliflower(Brassica oleracea var. botrytis)[J]. Plant Journal, 2001, 26 (1): 59–67. DOI:10.1046/j.1365-313x.2001.01008.x |
| [25] | Wang YQ, Yong Y, Fei ZJ, et al. Proteomic analysis of chromoplasts from six crop species reveals insights into chromoplasts function and development[J]. Journal Experiment Botony, 2013, 64 : 949–961. DOI:10.1093/jxb/ers375 |
| [26] | Rey P, Gillet B, Romer S, et al. Over-expression of a pepper plastid lipid-associated protein in tobacco leads tochanges inplastid ultrastructure and plant development upon stress[J]. Plant Jornal, 2000, 21 : 483–494. DOI:10.1046/j.1365-313x.2000.00699.x |
| [27] | Lundquist PK, Poliakov A, Bhuiyan NH, et al. The functional network of the Arabidopsis thaliana plastoglobule proteome based on quantitative proteomics and genomewide co-expression analysis[J]. Plant Physiology, 2012, 58 : 1172–1192. |