众所周知,肿瘤已经成为威胁人类健康的第一杀手,重要原因是肿瘤早期诊断的不足和肿瘤治疗药物不能准确到达治疗部位。随着肿瘤的治疗手段由细胞攻击模式向靶向性治疗模式转变,靶向药物目前在乳腺癌、胰腺癌和结肠癌等癌症治疗中得到临床应用。大部分靶向分子药物的发现得益于人们对肿瘤发生发展机制的深入研究,这也推动了高靶向性的递药系统的出现,基于纳米材料的递药系统也越来越多地应用于肿瘤治疗中[1-4]。
纳米材料,即指微粒尺寸为纳米级(10-9 m)的超细材料,通常介于1-100 nm之间。因其具有表面效应、体积效应和量子尺寸效应,公认为是21世纪最有前途的研究领域[5-6]。由纳米材料制成的递药系统有着突出的优点,它不仅可以使药物纳米化,还可以随环境的变化或刺激产生响应而发生性能或结构的变化,继而顺利通过体内的屏障最终实现靶向给药,提高疗效,减少因生物分布太广所带来的不良反应。人们对纳米材料相关的递药系统研究广泛,主要是因其能特异地和肿瘤细胞的配体结合,并在配体的引导下靶向杀死肿瘤细胞从而达到治疗的目的,现阶段研究较多的配体有核酸适配子、叶酸和脂质体等。
核酸适配子(Aptamer),是用指数富集配基系统进化技术(Systematic evolution of ligands by exponential enrichment,SELEX)筛选而来的寡核苷酸,能特异性结合靶标的双链DNA或单链RNA分子。核酸适配子的靶标非常广泛,可以是小分子、蛋白质、细胞乃至组织等,相较于抗体,核酸适配子有许多优点,如分子量小,免疫反应小,因其可折叠成独特的二级或三级结构从而对靶标有非常高的亲和性和特异性,易于化学合成且重复性好,性质稳定,易于修饰使其可以和多种功能分子结合发挥最优生物学效应。本文主要结合无机纳米材料,阐述核酸适配子结合无机纳米材料在肿瘤研究中的应用。
1 核酸适配子结合贵金属纳米材料无机纳米材料,根据来源不同主要分为金属类材料和非金属类材料。金属类材料主要包括贵金属纳米材料、磁性铁、层状双金属纳米材料等;非金属类材料主要包含碳纳米材料和介孔二氧化硅等。金属纳米材料是对纳米材料基本物理化学性质研究的理想模型,其独特的光、热、电、磁及催化性能等方面优越的性质使其在生物医学研究领域中扮演着越来越重要的角色。
贵金属纳米材料作为纳米材料中的重要组成部分,主要包括金、银、铂、钌等8种元素。由于其将贵金属独特的性能与纳米材料独有的特点有机结台起来,使其在化学催化、生物传感和医学等领域有着广阔的应用前景,得到了越来越广泛的重视。
金纳米微粒作为贵金属纳米材料研究最为广泛,主要有球形金纳米粒、空球状、棒状、管状、线状、及核-壳结构复合纳米等多种存在形式[7],银纳米材料主要有颗粒状、丝状及复合材料,如金银复合纳米粒子。较大的金纳米粒由于其散射横截面较大,由纳米粒子表面等离子体共振(Surface plasmon resonance,SPR)引起的光散射增强,在暗场下可检测到散射光,由此可用于生物成像;而小的金纳米粒则多用于制备递药系统,结合配体将药物递送至癌细胞,并在癌细胞内自组装成大的粒子簇,导致SPR吸收带由可见光区红移到700-1 000 nm的近红外区。由于正常人体细胞仅对可见光区(350-700 nm)和红外光区( > 1 000 nm)有良好吸收,可利用金纳米粒子的该特性在650-900 nm的近红外区给予激光照射,从而对肿瘤组织进行光热疗法。
Kim等[8]将靶向前列腺特异性抗原的RNA适配子结合在金纳米球上,成功实现靶向LNCaP前列腺内皮细胞且CT成像强度高于对照组4倍;接着他们利用与RNA适配子互补序列中连续的GC碱基对将阿霉素装载于双链内,发现阿霉素-适配子-金纳米球组成的递药系统特异性好且能杀伤靶细胞;Chen等[9]则是将cRGD、DNA适配子AS1411和金纳米球组装成主要的复合纳米材料,携带近红外区的荧光染料MPA后可直接显示肿瘤原发的位置,利于成像。当他们将MPA换为阿霉素后发现可有效导致肿瘤细胞发生凋亡。近几年对于金纳米和适配子结合的研究领域,不仅有生物成像、递药系统,还有对于肿瘤标志物超敏检出的方法学上的创新。Miao等[10]将金纳米与DNA通过二硫键结合后,利用适配子Sgc8与酪氨酸激酶-7(Tyrosine kinase -7,PTK-7)结合前后DNA结构的变化从而可超敏检出细胞碎片中的PTK-7,对肿瘤初筛有重要意义。
基于前期研究表明,金纳米棒在肿瘤光热治疗和生物成像较金纳米球更有优势[11],但是由于金纳米棒在制备过程中需要使用十六烷基三甲基溴化铵(Cetyltrimethylammonium bromide,CTAB),而据报道,CTAB对多种细胞均存在毒性[12-14],可与细胞膜发生静电作用、甚至可导致细胞死亡[15]。为解决这个问题,Yasun等[16]在金纳米棒表面用牛血清白蛋白包裹,在结合适配子Sgc8靶向作用于CCRF-CEM细胞进行光热治疗同时将细胞膜上的非特异性位点封闭,可明显减少由CTAB带来的毒性作用。
在对于银纳米材料的研究中,人们多是选取金-银复合纳米材料结合特定的适配子用于肿瘤治疗,如对急性淋巴白血病选择性地光热治疗不造成周围组织细胞损伤[17];通过组装适配子作为靶向探针将金-银-金纳米材料指引至所需治疗的部位,在指引成像的基础上对肿瘤进行治疗[18]。生物成像、光热治疗是纳米材料结合适配子常用的研究领域,Qiu等[19]的研究则拓宽了该领域,P-糖蛋白过表达的肿瘤细胞是多重耐药的机制之一,他们通过设计靶向肿瘤细胞膜的适配子,同时绕过P-糖蛋白进入细胞内后在激光的照射下可以将装载在金-银纳米棒内的阿霉素释放,继而进入细胞核内发挥作用,将光热治疗、靶向递药治疗有机结合从而显著提高了对肿瘤细胞的杀伤力并能有效避免多重耐药的产生。
2 核酸适配子结合磁性纳米材料磁性纳米材料由于其在纳米尺度上的特殊的磁学性质,即磁性纳米粒子的粒径小于其超顺磁性的临界值时可显现出超顺磁性,以及磁性纳米材料有良好的磁导向性、生物相容性、生物可降解性及可用表面官能团加以修饰等特点[20],使得磁性纳米材料的研究领域逐步向生物医学方向靠近,如磁共振成像系统、磁热疗及生物检测等方向。日前,提高对肿瘤细胞的检测限是早期发现、诊断肿瘤的重要手段。利用磁性纳米微粒的磁导向性能,Khoshfetrat等[21]将Fe3O4磁性纳米材料覆盖在金纳米颗粒上,通过双硫键共价结合靶向白血病细胞的适配子Sgc8c,在外加磁场下筛选出与靶细胞结合的检测复合体,借助在适配子的发夹结构中嵌入溴化乙锭对靶细胞进行实时定量,经实验证实可将检测限度提高到10-106个细胞/mL。Bamrungsap等[22]基于磁性纳米材料超顺磁性发展的磁性弛豫开关技术,在靶向肿瘤细胞后不仅能灵敏检出靶细胞还可准确区分肿瘤细胞和正常细胞;Sun等[23]将金纳米颗粒包裹在Fe3O4磁珠上,利用反应产生过氧化氢在辣根过氧化物酶催化反应下放大信号从而提高了对肝癌细胞的检出率。肿瘤的早期发现有赖于肿瘤标志物的检测和影像学的初筛,核磁共振成像是其中一种方法。磁性纳米材料结合适配子可作为成像的造影剂用于核磁共振成像,辅助诊断胰腺癌[24]和肝癌[25];Li等[26]设计的磁性纳米分子探针发现,通过适配子AS1411可以靶向多种癌细胞如乳腺癌细胞、肾脏上皮癌细胞、结肠癌细胞等并利用这些癌细胞内的过表达的谷胱甘肽激活核磁共振的成像。
3 核酸适配子结合非金属类无机纳米材料 3.1 核酸适配子结合碳纳米材料碳纳米材料是无机纳米材料重要的组成部分,有富勒烯、碳纳米管、石墨烯及三维的石墨和金刚钻等各个维度的材料。富勒烯是一种由碳原子形成的一系列笼形分子的总称C60。碳纳米管是一种由碳原子sp2杂化形成的石墨烯片层形成的无缝、中空的管体[27],根据管壁层数的不同,可大致分为单壁碳纳米管(Single-walled carbon nanotube,SWNT)、双壁碳纳米管及多壁碳纳米管。石墨烯则是一种由碳原子以sp2杂化轨道组成的六角形呈蜂巢晶格的平面薄膜,仅有一个碳原子厚度[28]。碳纳米管因具有独特的机械性、良好的电导率和热导率及其表面可修饰性强等优点使其成为非金属无机纳米材料中热门的研究对象[29]。基于碳纳米管良好的拉力和弹力性能,Taghavi等[30]将适配子MUC1-5TR结合到经聚乙二醇和聚乙烯亚胺修饰的SWNT上并装载Bcl-xL shRNA,成功且高效地将ShRNA转染进靶细胞即MCF7乳腺癌细胞并引发其凋亡;同样是针对乳腺癌细胞,Mohammadi等[31]则是将RNA适配子结合到SWNT上靶向EpCAM(Epithelial cell adhesion molecule)成功下调BCL9l(B-cell CLL/lymphoma 9 like)蛋白水平引发癌细胞的凋亡。适配子结合碳纳米材料不仅用于递药系统的研究,在肿瘤标志物的检测中也越来越受到重视。Amouzadeh Tabrizi等[32]将针对血管内皮生长因子(Vascular endothelial growth factor 165,VEGF165)的DNA适配子结合在介孔碳-金纳米复合材料上,通过适配子和VEGF165反应对界面产生的影响即可高效检测出VEGF165的含量从而鉴别诊断出肺癌;对碳纳米材料的研究不仅在于检测肿瘤标志物,还可以利用双链带荧光基团的DNA适配子锚定在还原型石墨烯纳米片上,从而超敏检出γ-干扰素[33]。
3.2 核酸适配子结合介孔二氧化硅介孔二氧化硅(Mesoporous silica nanoparticles,MSN)纳米颗粒,是一类在2-50 nm范围内可连续调节介孔孔径的纳米材料,有着孔道规则、骨架结构稳定、内外表面易于修饰及生理毒性低等特点,MSN具有巨大的比表面积( > 900 m2/g)和比孔容( > 0.9 cm3/g),可以在孔道内负载药物,并对药物起到缓释的作用,提高药效的持久性[34]。Xie等[35]利用已报道的可特异性结合EpCAM的DNA适配子共价结合羧基化修饰的介孔二氧化硅纳米材料,并在其介孔内装载阿霉素,靶向EpCAM阳性的SW620结直肠癌细胞,通过SW620细胞和Romas淋巴瘤细胞的研究证实,在pH5.5时阿霉素的释放率明显高于pH7.4的释放率;由DNA适配子-阿霉素-介孔二氧化硅形成的新型递药系统可降低EpCAM的表达、抑制肿瘤细胞的增殖同时可促进肿瘤细胞的晚期凋亡和坏死。同样是用介孔二氧化硅装载阿霉素,Tang等[36]将带负电荷的氧化石墨烯纳米薄片包裹在介孔二氧化硅表面,并通过非共价键结合带有Cy5.5荧光基团标记的AS1411的DNA适配子靶向核仁蛋白阳性的MCF-7乳腺癌细胞,在激光的作用下实现阿霉素释放的“开关”控制。在其研究中表明,经AS1411直接特异性靶向MCF-7细胞后,凭借Cy5.5产生的荧光作为实时观测指标,继而在激光照射下,可实现阿霉素的靶向“开关”释放,且该光响应型药物递药系统对肿瘤细胞的治疗效果比单一的阿霉素化疗或光热治疗均要显著。
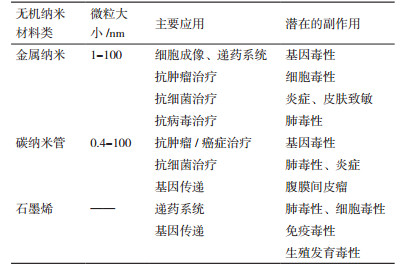
4 无机纳米材料及核酸适配子在肿瘤诊断与治疗中的安全性无机纳米材料基于独特的物理化学性能使其在递药系统和生物成像等研究领域有良好的前景,但相较于同种元素的大分子材料,纳米级的尺寸大小的材料可能对人体有较高的毒性。此外,无机纳米材料的制备过程所使用的材料是否足够绿色化学、修饰及装载药物过程是否能做到尽量少用低毒无毒的试剂需要考量;一定浓度的核酸适配子进入到细胞组织内是否会出现非特异性核酸免疫反应同样需要思考。表 1中列举了常用的无机纳米材料对人体健康可能存在的副作用。金属类纳米材料主要的毒性作用在于产生活性氧、急性细胞毒作用及DNA损伤,如金纳米[38]、银纳米颗粒[39],这些共同促进细胞启动程序性凋亡。据报道,未经表面修饰的二氧化钛纳米颗粒对A594肺腺癌细胞有明显的基因和细胞毒性,经柠檬酸盐或二氧化硅修饰也不能降低其毒性[40]。但有报道称长期低剂量使用钴纳米颗粒有致癌风险[41]。也据报道,金纳米结合适配子AS1411作用于多个肿瘤细胞系,在老鼠体内最大耐受剂量下仍未造成急性毒性,也未引起病理学改变[42]。这可能与金纳米结合适配子提高了递药系统的靶向性后避免了非特异性结合从而降低了其毒性作用。非金属类纳米材料也存在一定的毒性,单分散的二氧化硅纳米材料会引起细胞周期阻滞带来基因毒性[43]此外,高剂量的抗肿瘤药物的注入到患有腹腔肿瘤的病人中导致局部毒性和药物分子的快速吸收进入血液循环从而导致系统性毒性[44]。但金属纳米材料的基因毒性为肿瘤细胞的放疗增敏作用提供了新思路,据Lenka Štefančíková等[45]报道,粒径仅有3 nm的钆纳米颗粒可提高脑胶质瘤的放射治疗效应。目前,不同实验室在研究纳米材料的毒性时因实验设计条件、选取的研究对象、纳米材料的暴露条件等不同而缺乏可比性;另一方面,现有的对纳米材料的毒性研究主要是体外研究,基于人体是复杂的生物系统,核酸适配子-无机纳米材料进入人体后生物分布、对机体新陈代谢的影响、机体对纳米复合材料的排泄,甚至在进行光热治疗过程中是否会对DNA造成损伤等方面都需要研究。建立通用、标准的实验评价体系是研究纳米毒理学的基础;增加对纳米材料的多水平、多对象的在体毒理研究可以消减公众对纳米材料不安全的担忧,促进纳米医学的成果转化,更好地为临床服务。
5 结语综上所述,核酸适配子结合无机纳米材料在肿瘤的研究中具有一定的共性,即适配子负责特异性结合肿瘤靶细胞,无机纳米材料主要是发挥载体的作用或是进行生物成像、光热治疗,装载的药物如阿霉素则是为了更好地抑制肿瘤细胞的增殖,从而达到靶向综合诊治的效果。日前,已有科学家开展针对适配子的靶向作用基础上进一步发挥其对靶标的作用的研究,从而实现靶向治疗,相信结合无机纳米材料可以更好地为肿瘤靶向治疗提供新思路。在纳米医学发展日新月异的同时能尽量减少由纳米材料带来的生物安全隐患是我们的期待。总体而言,越来越多针对不同水平靶标(如小分子、蛋白和细胞等)的核酸适配子结合日益先进的纳米技术应用于生物医学,特别是肿瘤研究领域,是将研究的效益最大化。与此同时,也需要更多的科学家对纳米医学做出更为深入的研究。
| [1] | Bao C, Conde J, Curtin J, et al. Bioresponsive antisense DNA gold nanobeacons as a hybrid in vivo theranostics platform for the inhibition of cancer cells and metastasis[J]. Scientific Reports, 2015, 5 : 12297. DOI:10.1038/srep12297 |
| [2] | Han H, Valdeperez D, Qiao J, et al. Dual enzymatic reaction-assisted gemcitabine delivery systems for programmed pancreatic cancer therapy[J]. Acs Nano, 2017, 11 (2): 1281–1291. DOI:10.1021/acsnano.6b05541 |
| [3] | Yang L, Fang Y, Yuan C, et al. Magnetic nanoliposomes as in situ microbubble bombers for multimodality image-guided cancer theranostics[J]. Acs Nano, 2017, 11 (2): 1509–1519. DOI:10.1021/acsnano.6b06815 |
| [4] | Zhang Y, Leonard M, et al. Overcoming tamoxifen resistance of human breast cancer by targeted gene silencing using multifunctional pRNA nanoparticles[J]. Acs Nano, 2016, 11 (1): 335–346. |
| [5] | Goesmann H, Feldmann C. ChemInform abstract:nanoparticulate functional materials[J]. Cheminform, 2010, 41 : 1362–1395. |
| [6] | 张中太, 林元华, 唐子龙, 等. 纳米材料及其技术的应用前景[J]. 材料工程, 2000(3): 42–48. |
| [7] | Wang CC, Wu SM, et al. Biomedical applications of DNA-conjugated gold nanoparticles[J]. Chembiochem, 2016, 17 : 1052–1062. DOI:10.1002/cbic.201600014 |
| [8] | Kim D, Yong YJ, Jon S. A drug-loaded aptamer-gold nanoparticle bioconjugate for combined CT imaging and therapy of prostate cancer[J]. Acs Nano, 2010, 4 (7): 3689–3696. DOI:10.1021/nn901877h |
| [9] | Chen D, Li B, Cai S, et al. Dual targeting luminescent gold nanoclusters for tumor imaging and deep tissue therapy[J]. Biomaterials, 2016, 100 : 1–16. DOI:10.1016/j.biomaterials.2016.05.017 |
| [10] | Miao X, Li Z, Zhu A, et al. Ultrasensitive electrochemical detection of protein tyrosine kinase-7 by gold nanoparticles and methylene blue assisted signal amplification[J]. Biosensors & Bioelectronics, 2016, 83 : 39–44. |
| [11] | Arnida, Malugin A, Ghandehari H. Cellular uptake and toxicity of gold nanoparticles in prostate cancer cells:a comparative study of rods and spheres[J]. J Appl Toxicol, 2010, 30 (3): 212–217. |
| [12] | Hauck TS, Ghazani AA, Chan WC. Assessing the effect of surface chemistry on gold nanorod uptake, toxicity, and gene expression in mammalian cells[J]. Small, 2008, 4 (1): 153–159. DOI:10.1002/(ISSN)1613-6829 |
| [13] | Alkilany AM, Nagaria PK, Hexel CR, et al. Cellular uptake and cytotoxicity of gold nanorods:molecular origin of cytotoxicity and surface effects[J]. Small, 2009, 5 (6): 701–708. DOI:10.1002/smll.v5:6 |
| [14] | Qiu Y, et al. Surface chemistry and aspect ratio mediated cellular uptake of Au nanorods[J]. Biomaterials, 2010, 31 : 7606–7619. DOI:10.1016/j.biomaterials.2010.06.051 |
| [15] | Wang L, Jiang X, Ji Y, et al. Surface chemistry of gold nanorods:origin of cell membrane damage and cytotoxicity[J]. Nanoscale, 2013, 5 (18): 8384–8391. DOI:10.1039/c3nr01626a |
| [16] | Yasun E, Li C, Barut I, et al. BSA modification to reduce CTAB induced nonspecificity and cytotoxicity of aptamer-conjugated gold nanorods[J]. Nanoscale, 2015, 7 (22): 10240–10248. DOI:10.1039/C5NR01704A |
| [17] | Huang YF, Sefah K, Bamrungsap S, et al. Selective photothermal therapy for mixed cancer cells using aptamer-conjugated nanorods[J]. Langmuir, 2008, 24 (20): 11860–11865. DOI:10.1021/la801969c |
| [18] | Shi H, et al. Au@Ag/Au nanoparticles assembled with activatable aptamer probes as smart "nano-doctors" for image-guided cancer thermotherapy[J]. Nanoscale, 2014, 6 (15): 8754–8761. DOI:10.1039/C4NR01927J |
| [19] | Qiu L, Chen T, Öçsoy I, et al. A cell-targeted, size-photocontrolla-ble, nuclear-uptake nanodrug delivery system for drug-resistant cancer therapy[J]. Nano Letters, 2015, 15 (1): 457–463. DOI:10.1021/nl503777s |
| [20] | 陈功, 殷珺. 磁性纳米材料在生物医学领域的应用[J]. 中国医学装备, 2006, 3(8): 30–32. |
| [21] | Khoshfetrat SM, Mehrgardi MA. Amplified detection of leukemia cancer cells using an aptamer-conjugated gold-coated magnetic nanoparticles on a nitrogen-doped graphene modified electrode[J]. Bioelectrochemistry, 2017, 114 : 24–32. DOI:10.1016/j.bioelechem.2016.12.001 |
| [22] | Bamrungsap S, Chen T, Shukoor MI, et al. Pattern recognition of cancer cells using aptamer-conjugated magnetic nanoparticles[J]. Acs Nano, 2012, 6 (5): 3974–3981. DOI:10.1021/nn3002328 |
| [23] | Sun D, Lu J, Zhong Y, et al. Sensitive electrochemical aptamer cytosensor for highly specific detection of cancer cells based on the hybrid nanoelectrocatalysts and enzyme for signal amplification[J]. Biosens Bioelectron, 2016, 75 : 301–307. DOI:10.1016/j.bios.2015.08.056 |
| [24] | Zhu H, et al. Aptamer-PEG-modified Fe3O4@Mn as a novel T1-and T2-dual-model MRI contrast agent targeting hypoxia-induced cancer stem cells[J]. Sci Rep, 2016, 6 : 39245. DOI:10.1038/srep39245 |
| [25] | Wei Z, Wu Y, Zhao Y, et al. Multifunctional nanoprobe for cancer cell targeting and simultaneous fluorescence/magnetic resonance imaging[J]. Analytica Chimica Acta, 2016, 938 : 156–164. DOI:10.1016/j.aca.2016.07.037 |
| [26] | Li J, Wang S, Wu C, et al. Activatable molecular MRI nanoprobe for tumor cell imaging based on gadolinium oxide and iron oxide nanoparticle[J]. Biosens Bioelectron, 2016, 86 : 1047–1053. DOI:10.1016/j.bios.2016.07.044 |
| [27] | Iijima S. Helical microtubules of graphitic carbon[J]. Nature, 1991, 354 (6348): 56–58. DOI:10.1038/354056a0 |
| [28] | 张金超, 杨康宁, 张海松, 等. 碳纳米材料在生物医学领域的应用现状及展望[J]. 化学进展, 2013, 25(2): 397–408. |
| [29] | Kwon T, Park J, Lee G, et al. Carbon nanotube-patterned surface-based recognition of carcinoembryonic antigens in tumor cells for cancer diagnosis[J]. J Phys Chemi Lett, 2013, 4 (7): 1126. DOI:10.1021/jz400087m |
| [30] | Taghavi S, et al. Preparation and evaluation of polyethylenimine-functionalized carbon nanotubes tagged with 5TR1 aptamer for targeted delivery of Bcl-xL shRNA into breast cancer cells[J]. Colloids & Surfaces B Biointerfaces, 2015, 140 (3): 28–39. |
| [31] | Mohammadi M, Salmasi Z, Hashemi M, et al. Single-walled carbon nanotubes functionalized with aptamer and piperazine-polyethylenimine derivative for targeted siRNA delivery into breast cancer cells[J]. Int J Pharm, 2015, 485 (1-2): 50–60. DOI:10.1016/j.ijpharm.2015.02.031 |
| [32] | Tabrizi MA, Shamsipur M. A high sensitive electrochemical aptase-nsor for the determination of VEGF165 in serum of lung cancer patient[J]. Biosens Bioelectron, 2015, 74 (12): 764–769. |
| [33] | Kim MG, Shon Y, Lee J, et al. Double stranded aptamer-anchored reduced graphene oxide as target-specific nano detector[J]. Biomaterials, 2014, 35 (9): 2999–3004. DOI:10.1016/j.biomaterials.2013.12.058 |
| [34] | 袁丽, 王蓓娣, 等. 介孔二氧化硅纳米粒子应用于可控药物传输系统的若干新进展[J]. 有机化学, 2010(5): 640–647. |
| [35] | Xie X, Li F, Zhang H, et al. EpCAM aptamer-functionalized mesoporous silica nanoparticles for efficient colon cancer cell-targeted drug delivery[J]. Eur J Pharm Sci, 2016, 83 : 28–35. DOI:10.1016/j.ejps.2015.12.014 |
| [36] | Tang Y, Hu H, Zhang MG, et al. An aptamer-targeting photoresponsive drug delivery system using "off-on" graphene oxide wrapped mesoporous silica nanoparticles[J]. Nanoscale, 2015, 7 (14): 6304–6310. DOI:10.1039/C4NR07493A |
| [37] | Lam PL, Wong WY, et al. Recent advances in green nanoparticulate systems for drug delivery:efficient delivery and safety concern[J]. Nanomedicine(Lond), 2017, 12 : 357–385. |
| [38] | Chompoosor A, et al. The role of surface functionality on acute cytotoxicity, ROS generation and DNA damage by cationic gold nanoparticles[J]. Small, 2010, 6 (20): 2246–2249. DOI:10.1002/smll.v6:20 |
| [39] | Han JW, Jeong JK, Gurunathan S, et al. Male-and female-derived somatic and germ cell-specific toxicity of silver nanoparticles in mouse[J]. Nanotoxicology, 2016, 10 (3): 361–373. DOI:10.3109/17435390.2015.1073396 |
| [40] | Stoccoro A, et al. Multiple endpoints to evaluate pristine and reme-diated titanium dioxide nanoparticles genotoxicity in lung epithelial A549 cells[J]. Toxicol Lett, 2017, 276 : 48–61. DOI:10.1016/j.toxlet.2017.05.016 |
| [41] | Annangi B, Bach J, et al. Long-term exposures to low doses of cobalt nanoparticles induce cell transformation enhanced by oxidative damage[J]. Nanotoxicology, 2015, 9 (2): 138–1347. DOI:10.3109/17435390.2014.900582 |
| [42] | Dam DH, et al. Biodistribution and in vivo toxicity of aptamer-loaded gold nanostars[J]. Nanomedicine, 2015, 11 : 671–679. DOI:10.1016/j.nano.2014.10.005 |
| [43] | Gonzalez L, et al. Co-assessment of cell cycle and micronucleus frequencies demonstrates the influence of serum on the in vitro genotoxic response to amorphous monodisperse silica nanoparticles of varying sizes[J]. Nanotoxicology, 2014, 8 : 876–884. DOI:10.3109/17435390.2013.842266 |
| [44] | Gao N, Bozeman EN, Qian W, et al. Tumor penetrating theranostic nanoparticles for enhancement of targeted and image-guided drug delivery into peritoneal tumors following intraperitoneal delivery[J]. Theranostics, 2017, 7 (6): 1689–1704. DOI:10.7150/thno.18125 |
| [45] | Štefančíková L, et al. Effect of gadolinium-based nanoparticles on nuclear DNA damage and repair in glioblastoma tumor cells[J]. J Nanobiotechnology, 2016, 14 : 63. DOI:10.1186/s12951-016-0215-8 |