2. 湖北医药学院生物医学工程学院,十堰 442000
2. School of Biomedical Engineering, Hubei University of Medicine, Shiyan 442000
血管生成素样蛋白8(ANGPTL8)又名Betatrophin,是在胰岛素抵抗2型糖尿病小鼠肝脏中最新发现的一种异常高表达的分泌性蛋白[1-3]。大量流行病统计学结果显示在2型糖尿病患者血浆中的ANGPTL8浓度明显高于正常人群[4-7],尤其在最新诊断的2型糖尿病患者体内ANGPTL8浓度与胰岛素含量、糖耐受等呈一定相关性[8]。Melton等[2]利用一种胰岛素受体拮抗剂S961诱导小鼠胰岛素抵抗模型时,发现ANGPTL8异常高表达并且可能是通过特异高效促进胰腺β细胞增殖,提高糖耐受改善胰岛素抵抗。然而,2014年Yang等[3]发现在小鼠肝脏过表达ANGPTL8,只引起小鼠胰腺或者移植在肾被膜下的小鼠β细胞增殖,对移植在肾被膜下人胰岛β细胞无任何作用。最近Viktoria等[9]研究发现,ANGPTL8并非是β细胞发挥功能或增殖的必要条件。面对Viktoria的质疑,Yi和Melton等[10]承认之前实验存在疏漏,认同Viktoria等的研究结果:ANGPTL8并不是通过高效特异促进β细胞增殖来提高糖耐受。所以ANGPTL8改善糖耐受即其调控糖代谢作用机制目前还不清楚。本研究将利用水动力转染技术在小鼠肝脏过表达ANGPTL8分析在进食期该基因对糖耐受影响,然后利用前期构建的ANGPTL8-/-和ANGPTL8++ HepG2细胞为细胞模型,探讨其可能调控机制。所以对ANGPTL8调控糖代谢机制研究,将为进一步研究ANGPTL8在胰岛素抵抗时提高糖耐受作用机制奠定基础,并为ANGPTL8临床治疗糖尿病的药物开发提供一定理论依据。
1 材料与方法 1.1 材料 1.1.1 细胞HepG2购自中国典型培养物保藏中心(CCTCC)。37℃,5%二氧化碳和饱和湿度条件下恒温培养箱中培养,培养基为含10%胎牛血清(FBS)的α-MEM或DMEM加有双抗液(青霉素100 U/mL,链霉素100 μg /mL)。
1.1.2 动物6-8周BALA/C雄鼠(购自华中科技大学同济医学院实验动物中心)。在湖北医药学院SPF级动物实验中心饲养,有关动物的实验操作得到了该中心实验动物伦理委员会的认可和批准。
1.1.3 试剂ONETOUCH@ SursStep@血糖测定试纸购自美国LIfe Scan公司;荧光素酶底物(D-luciferin)购自美国Caliper Life Sciences公司;β-actin抗体购自Abcam公司;AKT,Phospho-AKT(Ser473),GSK3-β,Phospho-GSK-3β(Ser9),FoxO1,Phospho-FoxO1(Thr24),Phospho-IRS1(Ser307),Phospho-IRS1(Ser302),IRS1,等抗体购自Santa Cruz公司;Flag抗体购自sigma公司;碱性磷酸酶标记(AP)羊抗兔,羊抗鼠二抗,彩色预染蛋白质分子量标准品、Western blotting及IP细胞裂解液、PMSF(100 mmol/L)、SDS-PAGE凝胶快速配制试剂盒、SDS-PAGE电泳液、6×上样缓冲液等均购自碧云天生物技术研究所购自碧云天生物科技公司;蛋白酶抑制剂,磷酸化蛋白酶抑制剂(PhosStop)购自Roche公司;qPCR supermix-UDG with ROX kit购自Invitrogen公司;胰岛素、D-葡萄糖购自Sigma公司;PAS糖原染色试剂盒购自森贝伽公司。本实验所用其他试剂均为国产分析纯。
1.2 方法 1.2.1 水动力转染技术将待转染质粒同生理盐水稀释至小鼠体重10%,如2 mL(20 μg质粒)/20 g(小鼠体重);用固定架把小鼠固定,75%酒精消毒尾巴,干棉球擦干,暴露尾静脉;注射器吸取混匀的质粒溶液,经尾静脉8-10 s快速注射入小鼠体内,每组3-5只,对照组为LUC(pGL4.51[luc2/CMV/Neo])质粒组;分别在转染质粒0、24、48、72、96、120和168 h后,小鼠活体成像仪观察对照组的荧光素酶表达情况,从而确定目的质粒在小鼠体内表达最高时间点。
1.2.2 血糖的测定采用剪尾测血糖法:将血糖仪调好,试纸插入血糖仪装好;固定小鼠,用手术刀切除尾部1-0.5 mm,挤出一滴血,直接滴入血糖试纸,用纱布或者棉球给鼠尾压迫止血;记录血糖仪读数。
1.2.3 测定小鼠禁食过夜至少12 h,按1 mg(D-glucose)/g(小鼠体重)腹腔注射D-glucose溶液,采用如前所述的剪尾测血糖法分别在注射0 min和60 min,120 min和240 min检测小鼠血糖变化。
1.2.4 引物设计本实验所用到引物,见表 1。
PCR Real-time PCR(qPCR)过程根据SYBR Green RT-PCR试剂盒与扩增仪说明,用β-actin基因上为内参对照。加样(每组样品设2-3个复空),贴膜密封后使用StepOneTM Real-Time PCR Systems(Applied Biosystems)进行PCR反应。数据分析根据软件默认值自动分析。得到精确的Ct值后导出数据,根据公式:2-ΔΔCt值确定目的基因与内标基因之间的相对表达倍数,绘制图表。独立样本T-test(两个样品间比较)来进行处理间的差异比较分析。
1.2.6 Western blottingSDS-PAGE电泳后,取出凝胶,将胶浸入转膜缓冲液中15 min,将滤纸、凝胶、NC膜等按一定次序放叠在一起后,放入转膜仪器中进行转膜(15 V,30 min)。转膜后,取NC膜于5%脱脂奶粉中封闭1h。封闭后,NC膜浸泡于1×TBST溶液中清洗3次,每次5 min。清洗后,置NC膜于一抗稀释液(V/V=1:1 000)中孵育1 h,随后,取出NC膜用TBST洗涤3次,加入二抗稀释液(V/V=1:1 000)孵育1 h,取出NC膜洗涤完毕后即可显色(注意避光),观察实验结果。
1.2.7 PAS染色法检测糖原合成PAS染色(Peri-odic Acid-Schiff stain)按试剂盒说明书操作并稍加修改:将待检测细胞去除培养基,ddH2O洗2-3次,加入细胞固定液室温固定10 min;去除固定液,ddH2O洗2-3次,每次5 min,加入高碘酸酒精溶液室温(17-20℃的室温为最佳)孵育10 min;用ddH2O充分洗,吸水纸吸干水;Schiff氏试剂避光染色10-15 min;流动自来水冲洗10 min;显微镜下观察并照相。
1.2.8 细胞处理(1) ANGPTL8表达检测:将He-pG2细胞用无糖无血清培养基饥饿处理24 h后,分别向培养基中添加胰岛素、葡萄糖及两者组合培养12 h,收取细胞提取RNA,用于RT-PCR。
(2) 胰岛素磷酸蛋白检测方法:参考Zhou等[11]方法,分别把前期构建的ANGPTL8++、ANGPTL8-/-和野生型HepG2三种细胞各分为两组,一组正常培养,一组向培养基中添加100 nmol/L的胰岛素,培养20 min,Western blotting分别检测AKT与pAKT(磷酸化AKT蛋白)表达变化。
2 结果 2.1 肝脏过表达ANGPTL8对小鼠血糖影响作为新基因ANGPTL8的功能还存在很多争议,为了确定ANGPTL8是否影响糖代谢,将在小鼠体内重复Melton利用水动力转染方法的实验,检测在肝脏过表达ANGPTL8后对糖耐受影响。利用活体成像仪器观察水动力转染对照质粒pGL4.51-LUC在小鼠肝脏转染前0 h和转染后不同时间点荧光素酶(LUC)表达情况,如图 1-A所示,对照质粒可持续在小鼠体内表达至少7 d,在转染后48 h表达最高。根据对照质粒LUC在小鼠表达情况,选取在转染人ANGPTL8-Flag和鼠ANGPTL8-Flag质粒(前期工作已构建)后0、48、72和168 h四个时间点提取小鼠肝脏组织蛋白,Western blotting检测hANGPTL8-Flag和mANGPTL8-Flag表达情况。如图 1-B所示,hANGPTL8和mANGPTL8质粒在小鼠肝脏的表达趋势基本和对照质粒一致。根据以上结果在转染目的基因48 h后,小鼠禁食过夜(≤12 h)后,按1 mg(D-glucose)/g(小鼠体重)腹腔注射D-glucose溶液,进行血糖测定实验。如图 1-B所示,在禁食过夜后转染人和鼠ANGPTL8质粒与对照组小鼠血糖无明显差异,腹腔注射葡萄糖1-2 h注射人和鼠ANGPTL8质粒组血糖明显低于对照组,而注射葡萄糖4 h后人ANGPTL8和鼠ANGPTL8质粒组的血糖又恢复到与对照组基本一致。结果显示ANGPTL8在小鼠的进食期发挥重要作用,可提高糖耐受。
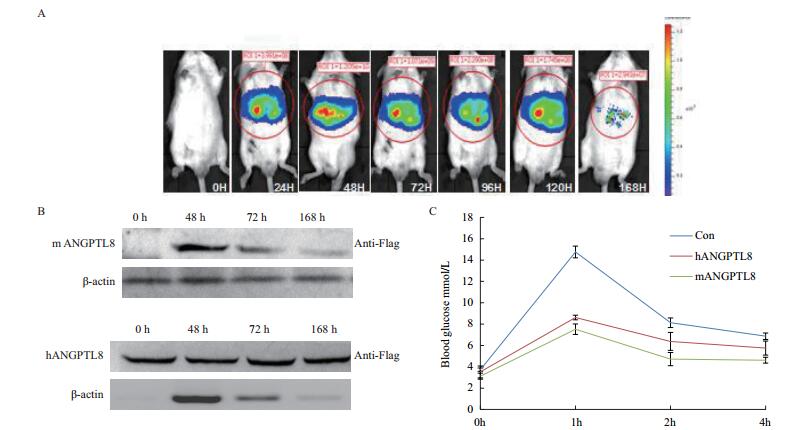
|
| 图 1 ANGPTL8在小鼠肝脏过表达对血糖影响 A:活体成像检测水动力转染pGL4.51-LUC质粒在小鼠肝内表达情况(n=3);B:水动力转染人和鼠ANGPTL8质粒后小鼠糖耐受检测(各组n=5) |
用胰岛素、葡萄糖及两者组合处理HepG2细胞后,RT-PCR和qPCR结果(图 2-A)表明单独添加葡萄糖、胰岛素都不会引起ANGPTL8表达升高,而两者组合能显著提ANGPTL8表达。为进一步分析在HepG2细胞中ANGPTL8的表达是否与胰岛素剂量和作用时间相关,我们分别用100 nmol/L胰岛素培养基(含5.5 mmol/L葡萄糖)处理0、1、4、16、36和48 h,如图 2-B显示,随着胰岛素作用时间的延长,ANGPTL8的表达逐渐升高;当用不同浓度胰岛素处理的结果(图 1-C)显示随着胰岛素浓度的增加ANGPTL8的表达也逐渐升高。所以以上结果解释为什么在进食期和胰岛素抵抗时ANGPTL8表达显著上调,因为这两个时期机体都会出现高血糖和胰岛素尤其在胰岛素抵抗初期。
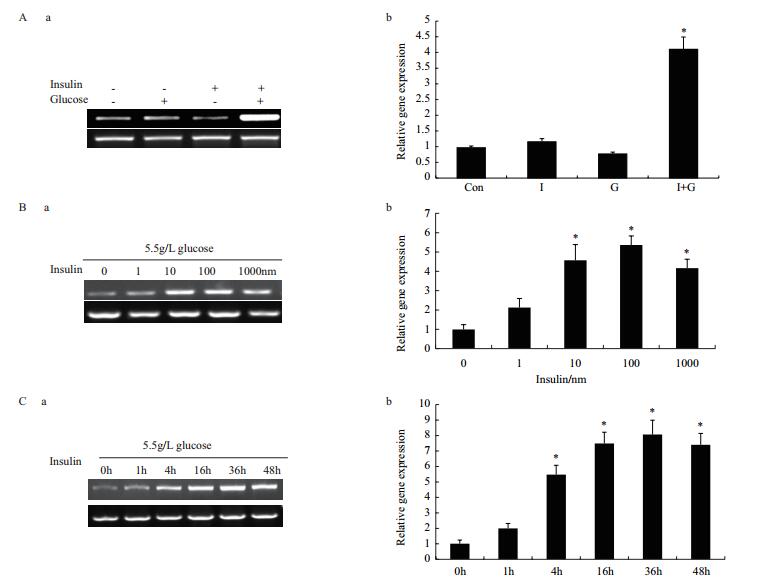
|
| 图 2 不同因素对ANGPTL8 mRNA表达影响 A:饥饿处理HepG2细胞后,RT-PCR(a)和qPCR(b)分别检测胰岛素、葡萄糖及其组合后对ANGPTL8 mRNA表达影响。Con:对照;I:胰岛素;G:葡萄糖;I+G:胰岛素+葡萄糖;B:RT-PCR(a)和qPCR(b)分别检测不同浓度胰岛素对ANGPTL8 mRNA表达影响;C:100 nm/L胰岛素分别处理HepG2细胞0、1、4、16、36和48 h后,RT-PCR(a)和qPCR(b)分别检测ANGPTL8 mRNA表达变化(* P < 0.05 vs. Control.) |
Western blot结果(图 3)显示,当有胰岛素存在时,ANGPTL8++、ANGPTL8-/-和野生型HepG2三种细胞的AKT蛋白磷酸化显著上调,并且ANGPTL8++细胞株中AKT蛋白磷酸化程度明显高于野生型和ANGPTL8-/-细胞株,而野生型和ANGPTL8-/-细胞株中AKT蛋白磷酸化水平没有明显区别。以上结果说明ANGPTL8可促进由胰岛素介导的AKT蛋白磷酸化。
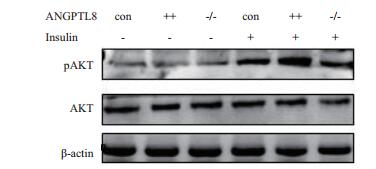
|
| 图 3 Western blotting检测在HepG2细胞中ANGPTL8对AKT和pAKT蛋白表达影响 Con:野生型细胞;++:ANGPTL8++细胞;-/-:ANGPTL8-/- cell;-:正常培养条件;+:培养基中添加胰岛素。pAKT:磷酸化的AKT蛋白 |
为了检测ANGPTL8是否通过影响PI3K/AKT信号通路中AKT上游蛋白磷酸化来调节AKT磷酸化,我们分别检测了其上游关键蛋白IRS-1、JNK及其磷酸化变化。结果(图 4)显示,无论有无胰岛素存在,IRS-1、JNK、pIRS-1(ser307)、pIRS-1(ser302)和pJNK在三组细胞中表达均无明显差异。以上结果说明ANGPTL8可能不是通过对IRS-1和JNK蛋白直接磷酸化来调控影响AKT蛋白磷酸化。
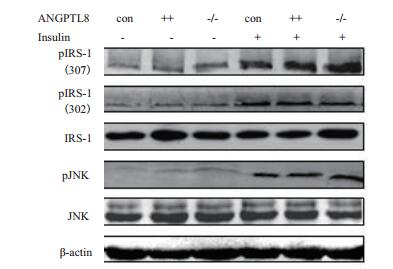
|
| 图 4 Western blotting检测在HepG2细胞中ANGPTL8对IRS-1和JNK蛋白及其磷酸化蛋白表达影响 pIRS-1(ser307):Ser307位点磷酸化的IRS-1;pIRS-1(ser302):ser302位点磷酸化的IRS-1;pJNK:磷酸化的JNK |
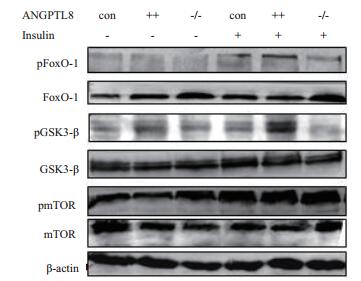
进一步分析ANGPTL8通过对AKT蛋白磷酸化后对其下游GSK-3β、FoxO1和mTOR蛋白磷酸影响。如图 5结果所示,无论有无胰岛素ANGPTL8对GSK-3β、FoxO1和mTOR总蛋白表达没有影响,在胰岛素作用下GSK-3β、FoxO1和mTOR蛋白磷酸化表达明显上调,但ANGPTL8++细胞株中pGSK-3β和pFoxO1蛋白表达明显高于野生型和ANGPTL8-/-细胞株,然而pmTOR在3组细胞中无明显差异。以上结果说明ANGPTL8可调控由胰岛素介导的AKT/FoxO1 or GSK-3β信号通路,但不影响AKT/mTOR通路。
|
| 图 5 Western blotting检测在HepG2细胞中ANGPTL8对GSK-3β、FoxO1和mTOR蛋白及其磷酸化表达影响 pGSK-3β:Ser9位点磷酸化的GSK-3β;pFoxO1:Ser256位点磷酸化的FoxO1;pmTOR:ser2448位点磷酸化mTOR |
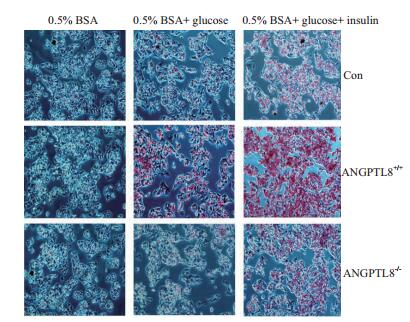
利用PAS染色检测ANGPTL8对糖原合成影响,结果(图 6)显示,经过不同处理后对照组(培养基只含0.5% BSA)中3种细胞的糖原含量基本无明显差异;0.5% BSA+glucose和0.5% BSA+glucose+insulin处理组中ANGPTL8++细胞中糖原含量明显高于与对照和ANGPTL8-/-细胞,随着胰岛素的加入ANGPTL8促进糖原合成更加明显,然而对照与ANGPTL8-/-细胞在这两个处理组中的糖原含量无明显差异。
|
| 图 6 PAS染色分析ANGPTL8对糖原合成影响 |
以上结果表明在HepG2细胞中,ANGPTL8可提高胰岛素敏感,促进胰岛素对PI3K/AKT信号通路的FoxO1和GSK-3β蛋白磷酸化,从而促进糖原合成,提高糖耐受。
3 讨论PI3K/AKT信号通路是胰岛素的主要下游调控分子通路。当人或动物进食后,由血糖升高的刺激胰腺胰岛β细胞分泌产生的胰岛素,胰岛素入血后作用于肝细胞膜表面的胰岛素受体,使其位于细胞内的β亚基的酪氨酸位点自磷酸化激活。激活的胰岛素受体可通过磷酸化胰岛素受体底物-1/2(IRS-1/2)酪氨酸位点而激活IRS-1/2,进而激活PI3K[12-13]。活化的PI3K可以催化4,5-二磷酸磷脂酰肌醇(PIP2)变成PIP3。PIP3是AKT第二信使,可激活AKT,后者可以通过调节GSK3β等一系列下游分子的活性增加糖原合成[14-16],同时可磷酸化FoxO1使其出核失活,从而降低葡萄糖-6-磷酸酶和磷酸烯醇式丙酮酸羧激酶等糖异生基因的表达,抑制糖异生,最终发挥降低血糖的作用[17]。PI3K-AKT信号通路的调节已是多种疾病包括糖尿病在内的潜在干预靶点。
作为一个新发现的基因,ANGPTL8的功能还存在很多争议,为了明确其对糖代谢影响,我们首先在小鼠肝脏过表达ANGPTL8,发现人和鼠ANGPTL8基因都可以改善糖耐受。在小鼠体内ANGPTL8 mRNA表达明显受到进食和禁食的调节,它在进食期表达明显升高,禁食期表达降低[18-19]。Ren等[20]和我们分别在3T3-L1和HepG2细胞中,发现ANGPTL8 mRNA表达受胰岛素和葡萄糖的共同调控,然而单独的胰岛素或葡萄糖不会上调ANGPTL8 mRNA的表达。这些研究结果提示ANGPTL8可能通过调控胰岛素信号通路影响糖耐受。为进一步研究其改善糖耐受作用机制,我们以前期已构建的ANGPTL8++和ANGPTL8-/-的HepG2细胞[21]为研究对象,分析ANGPTL8调控糖代谢的可能分子作用机制。通过RT-PCR、qPCR、Western blotting、PAS染色等检测方法,我们发现胰岛素可促进ANGPTL8表达,而高表达的ANGPTL8又可通过提高胰岛素介导PI3K/AKT信号通路中AKT,FoxO1,GSK-3β蛋白磷酸化,提高HepG2细胞对胰岛素敏感性,促进糖原合成,改善糖耐受;而ANGPTL8的低表达或缺失并不影响胰岛素对PI3K/AKT信号通路蛋白磷酸化。所以以上结果提示ANGPTL8可能是通过胰岛素介导PI3K/AKT信号通路调控肝脏糖代谢,改善肝细胞糖耐受。然而ANGPTL8调控PI3K-AKT信号通路的作用方式即ANGPTL8可能直接作用于此信号通路中哪个蛋白的磷酸化尚不清楚,还需要后期深入研究。
4 结论本研究利用前期工作已构建的ANGPTL8++和ANGPTL8-/-的HepG2细胞为研究对象,首次从分子水平分析新基因ANGPTL8在肝细胞中调控糖代谢的可能作用机制。
| [1] | Gusarova V, Alexa CA, Na E, et al. ANGPTL8/betatrophin does not control pancreatic beta cell expansion[J]. Cell, 2014, 159 (3): 691–696. DOI:10.1016/j.cell.2014.09.027 |
| [2] | Yi P, Park JS, Melton DA. Betatrophin: A hormone that controls pancreatic beta cell proliferation[J]. Cell, 2013, 153 (4): 747–758. DOI:10.1016/j.cell.2013.04.008 |
| [3] | Jiao Y, Le L, Yu M, et al. Elevated mouse hepatic ANGPTL8 expression does not increase human beta-cell replication in the transplant setting[J]. Diabetes, 2014, 63 (4): 1283–1288. DOI:10.2337/db13-1435 |
| [4] | Fu Z, Berhane F, Fite A, et al. Elevated circulating lipasin/betatrophin in human type 2 diabetes and obesity[J]. Scientific Reports, 2014, 4 (11): 5013. |
| [5] | Daniel MM, Per OC. Increased circulating betatrophin concentrations in patients with type 2 diabetes[J]. Int J Endocrinol, 2014, 10 (5): 323407–323413. |
| [6] | Tokumoto HY, Fujimoto K, Yamaguchi E, et al. Correlation of circulating betatrophin concentrations with insulin secretion capacity, evaluated by glucagon stimulation tests[J]. J Clin Endocr Metab, 2015, 19 (1): 111–119. |
| [7] | Chen X, Lu P, He W, et al. Circulating betatrophin levels are increased in patients with type 2 diabetes and associated with insulin resistance[J]. J Clin Endocrinol Metab, 2015, 100 (1): E96–E100. DOI:10.1210/jc.2014-2300 |
| [8] | Hu H, Sun W, et al. Increased circulating levels of betatrophin in newly diagnosed type 2 diabetic patients[J]. Diabetes Care, 2014, 37 (10): 2718–2722. DOI:10.2337/dc14-0602 |
| [9] | Viktoria G, Erqian Na, Panayiotis E, et al. ANGPTL8/betatrophin does not control pancreatic beta cell expansion[J]. Cell, 2014, 159 : 691–696. DOI:10.1016/j.cell.2014.09.027 |
| [10] | Yi P, Park JS, Melton DA. Perspectives on the activities of ANGPTL8/betatrophin[J]. Cell, 2014, 159 (3): 467–468. DOI:10.1016/j.cell.2014.09.028 |
| [11] | Zhou L, Sell H, Eckardt K, et al. Conditioned medium obtained from in vitro differentiated adipocytes and resistin induce insulin resista-nce in human hepatocytes[J]. Febs Letters, 2007, 581 (22): 4303–4308. DOI:10.1016/j.febslet.2007.07.076 |
| [12] | Neri LM, Borgatti P, Capitani S, et al. The nuclear phosphoinositide 3-kinase/AKT pathway: a new second messenger system[J]. Biochimica et Biophysica Acta, 2002, 1584 (23): 73–80. |
| [13] | Cantley LC. The phosphoinositide 3-kinase pathway[J]. Science, 2002, 296 (5573): 1655–1657. DOI:10.1126/science.296.5573.1655 |
| [14] | Liu P, Cheng H, Roberts TM, et al. Targeting the phosphoinositide 3-kinase pathway in cancer[J]. Nat Rev Drug Discov, 2009, 8 (8): 627–644. DOI:10.1038/nrd2926 |
| [15] | Lochhead PA, Coghlan M, Rice SQ, et al. Inhibition of GSK-3 selectively reduces glucose-6-phosphatase and phosphatase and phosphoenolypyruvate carboxykinase gene expression[J]. Diabetes, 2001, 50 (5): 937–946. DOI:10.2337/diabetes.50.5.937 |
| [16] | Ishikawa M, Yoshida K, Okamura H, et al. Oral porphyromonas gingivalis translocates to the liver and regulates hepatic glycogen synthesis through the AKT/GSK-3beta signaling pathway[J]. Biochimica et Biophysica Acta, 2013, 1832 (12): 2035–2043. DOI:10.1016/j.bbadis.2013.07.012 |
| [17] | Banks MJ, Mastracci TL, Kofler NM, et al. Dissociation of the glucose and lipid regulatory functions of FoxO1 by targeted knock in of acetylation-defective alleles in mice[J]. Cell Metab, 2011, 14 (5): 587–597. DOI:10.1016/j.cmet.2011.09.012 |
| [18] | Zhang R. Lipasin, a novel nutritionally-regulated liver-enriched factor that regulates serum triglyceride levels[J]. Biochem Bioph Res Co, 2012, 424 (4): 786–792. DOI:10.1016/j.bbrc.2012.07.038 |
| [19] | Fu ZY, Yao FY, Abou-Samra AB, et al. Lipasin, thermoregulated in brown fat, is a novel but atypical member of the angiopoietin-like protein family[J]. Biochem Bioph Res Co, 2013, 430 (3): 1126–1131. DOI:10.1016/j.bbrc.2012.12.025 |
| [20] | Ren G, Kim JY, Smas CM. Identification of RIFL, a novel adipocyte-enriched insulin target gene with a role in lipid metabolism[J]. Am J Physiol Endocrinol Metab, 2012, 303 (3): E334–351. DOI:10.1152/ajpendo.00084.2012 |
| [21] | 郭兴荣, 陈云, 李东升. TALEN介导的Betatrophin敲除HepG2细胞株的建立[J]. 湖北医药学院学报, 2015, 10(5): 427–431. |





