肝癌是世界范围内最常见的恶性肿瘤之一,其发病率和死亡率呈逐年上升趋势,严重威胁着人类的健康[1]。在中国,由于存在较为严重的乙型肝炎病毒(HBV)感染等致癌风险因素,肝癌的发病率和死亡率态势尤为严峻。肝癌的治疗手段主要包括肝移植、肿瘤切除及非切除性局部疗法如肝动脉化疗栓塞等[2]。由于肝癌特别是原发性肝癌(HCC)早期易发生转移以及治疗后易复发[3],因此,寻找一个可以准确判断预后的指标和有效的肝癌治疗靶点具有重要意义。
早期诊断和治疗是提高原发性肝细胞癌疗效的关键因素之一。磷脂酰肌醇蛋白聚糖3(Glypican 3,GPC3)作为硫酸乙酰肝素蛋白聚糖家族成员,该基因编码580个氨基酸能够产生大约70 kD的核心蛋白。核心蛋白由两个亚基构成,弗林蛋白在358-359氨基酸位置将该核心蛋白裂解为N端和C端两个亚基,N末端存在着一种分泌型信号蛋白,C末端通过与糖基磷脂酰肌醇(GPI)共价结合,从而使GPC3核心蛋白锚定于肝细胞膜上,且C端最末50个氨基酸决定两条硫酸乙酰肝素链(HS)插入点的位置,使该链靠近细胞膜[4]。GPC3在胚胎及重要组织例如肝脏,肺,肾脏中大量表达,然而,在成人器官中的表达量较低。此外,有研究显示GPC3原发性肝癌中特异性高表达,而在成人正常肝组织低表达或不表达。从而提示GPC3对肝癌诊断具有显著的灵敏性和特异性,可作为识别原发性肝癌组织(HCC)特异性肿瘤标志物[5-7]。
本实验以克隆的人肝癌磷脂酰肌醇蛋白聚糖3全长基因(GPC3)为目的基因,重组后的表达载体转化E. coli BL21(DE3)。经IPTG诱导表达获得GPC3蛋白,并使用Western blot技术鉴定蛋白表达。利用亲和层析的方法纯化his-融合蛋白并免疫Balb/c小鼠,制备抗血清,旨为后续进一步实验研究奠定基础。
1 材料与方法 1.1 材料 1.1.1 实验菌株和实验动物E.coli DH5α感受态细胞、E.coli BL21表达菌株、质粒pET28a质粒,均由新疆大学生物资源基因工程重点实验室提供;Balb/c小鼠购自新疆医科大学实验动物中心。
1.1.2 试剂限制性核酸内切酶EcoR I与Xho I、T4 DNA连接酶、Ex-Taq酶、蛋白预染Marker、DL5000 DNA Marker均购自TaKaRa大连宝生物工程有限公司产品,质粒提取试剂盒、胶回收试剂盒、PCR产物纯化回收试剂盒均购自上海生工生物工程技术服务有限公司产品;SDS-PAGE凝胶制备试剂盒、IPTG均购自北京索莱宝有限公司产品。PVDF膜为Minipore公司产品。His标记的鼠源一抗,HRP标记的山羊抗鼠二抗IgG均为北京全式金生物技术有限公司产品。
1.2 方法 1.2.1 重组载体的构建根据GenBank数据库提供的人GPC3 cDNA的核苷酸序列设计扩增GPC3基因全长去信号肽的一对引物,上下游分别带有EcoR I和Xho I酶切位点。引物序列:Primer1:5' -CGGAATTCATGCAGCCCCCGCCGCCGCCGCCGGACGCCACCTG-3' Primer2:5' -CCCTCGAGTCAGTGCACCAGGAAGAAGAAGCAC-3' 上下游引物划线处分别为限制性内切酶EcoR I和Xho I。引物由上海生工生物工程技术服务有限公司合成。PCR反应总体系为50 μL:缓冲液5 μL;模板DNA 1 μL;dNTP 2.5 μL;上下游引物各0.5 μL;Ex-Taq酶0.5 μL;补灭菌水至50 μL。PCR反应条件:95℃ 3 min;95℃ 20 s,55℃ 30 s,72℃ 2 min,共30个循环;72℃ 5 min。用1%琼脂糖凝胶电泳检测PCR片段大小,利用PCR产物纯化回收试剂盒回收PCR产物,将回收的目的片段与pET28a质粒于37℃过夜双酶切后,通过切胶方法回收经双酶切的目的片段和pET28a载体,然后利用T4 DNA连接酶于16℃过夜连接。连接产物转化E.coli DH5α感受态细胞。挑取形态大小较好的单克隆先进行菌液PCR鉴定,再进行双酶切鉴定,最后将重组质粒送去上海生工生物工程技术服务有限公司测序鉴定,鉴定正确后转化入E.coli BL21表达菌株。
1.2.2 重组蛋白的表达检测与纯化选取经鉴定正确的重组菌株过夜培养,以1:200转接入新鲜的LB培养基中,待OD600值约为0.6时,加入终浓度0.5 mmol/L IPTG,37℃诱导培养6 h,收集菌体用PBS重悬并放置-80℃反复冻融,然后用超声仪器破碎细胞,利用亲和层析的方法纯化his-融合蛋白,通过SDS-PAGE电泳检测蛋白的纯度,并用过BCA法测定蛋白含量。
1.2.3 GPC3融合蛋白免疫小鼠选取6周龄的Balb/c小鼠,100 μg/只免疫GPC3蛋白,第一次免疫采用弗氏完全佐剂,纯化后的GPC3融合蛋白与弗氏完全佐剂1:1混匀,充分乳化后,于小鼠背部皮下多点注射。2周后加强免疫,剂量同上,用不完全弗氏佐剂充分乳化后,于小鼠腹部皮下多点注射,二免10 d后进行第3次加强免疫,三免10 d后Balb/c小鼠眼眶采血,将血样于37℃孵育20 min,然后放入4℃冰箱中过夜可见有血清析出,3 500 r/min离心10 min后取上清,于-80℃冰箱中保存备用。
1.2.4 鼠抗人GPC3多克隆抗体制备(1) 采用ELISA法检测GPC3抗血清效价,简要步骤:先将纯化的GPC3蛋白作为抗原稀释至4 μg/mL于对应的96孔板中加入100 μL,然后每孔加入包被液体100 μL,4℃过夜包被,使GPC3蛋白附着于板中。次日将包被液弃去,加入200 μL的5%脱脂奶粉封闭,37℃孵育2 h,PBST洗涤后,每孔加入100 μL倍比稀释的不同滴度一抗溶液(每个滴度选用3个重复),37℃孵育120 min,PBST洗涤后,每孔加入100 μL二抗(1:1 500稀释),37℃孵育60 min,PBST充分洗涤后加入显色液50 μL,37℃避光显色10 min;加入终止液50 μL,于酶标仪450 nm处读数。(2) Western Blot分析抗体特异性,将纯化的GPC3蛋白经SDS-PAGE电泳跑胶,转膜,封闭后,用鼠抗人GPC3多克隆抗体(1:500稀释)作为一抗,羊抗鼠IgG-HRP(1:5 000稀释)做为二抗进行孵育,经TBST充分洗涤后,用DAB显色液避光显色即可。
2 结果 2.1 GPC3基因PCR扩增鉴定以人肝癌细胞HepG2总RNA反转录的cDNA为模板,用GPC3基因特异性去信号肽引物进行PCR扩增后,经1%琼脂糖凝胶电泳鉴定(图 1),可见1 749 bp预计目的条带。

|
| 图 1 PCR扩增cDNA琼脂糖凝胶电泳鉴定 M:DL5000 DNA marker;1-6:目的基因GPC3条带;-:阴性对照; |
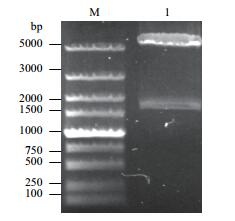
先将PCR扩增的去信号肽的目的基因产物进行回收,然后将回收产物与pET28a质粒经EcoR I与Xho I双酶切后,利用T4 DNA连接酶连接,转化E.coli DH5α感受态细胞。随机挑取单克隆先进行菌液PCR鉴定(图 2),再进行双酶切鉴定,均获得约1 749 bp片段(图 3),与目的基因大小一致;测序结果显示与预测基因序列相同,证明成功构建重组质粒。

|
| 图 2 重组质粒菌液PCR鉴定 M:DL5000 DNA marker;-:阴性对照;+:阳性对照;1:目的基因GPC3条带 |
|
| 图 3 重组质粒经EcoR I与Xho I双酶切鉴定 M:DL5000 DNA marker;1:目的基因GPC3条带 |
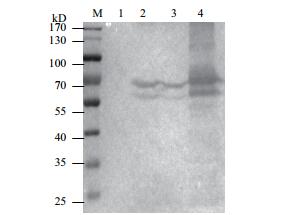
为验证重组蛋白的表达情况,重组质粒经IPTG诱导后进行SDS-PAGE电泳检测,结果(图 4)显示获得70 kD的蛋白条带,包含GPC3蛋白65 kD及pET28a质粒自带的5 kD His标签蛋白,重组蛋白表达与预期大小一致。并利用Western blot进一步验证表达(图 5)。

|
| 图 4 重组质粒SDS-PAGE鉴定 M:protein marker;1,2:分别为pET28a空载体诱前,诱后;3-6:分别为pET28a-GPC3转BL21诱前、诱后、上清、沉淀 |
|
| 图 5 重组质粒Western Blot鉴定 M:protein marker;1-4:分别为pET28a-GPC3转BL21诱前、诱后、上清、沉淀 |
对重组表达菌株进行诱导培养,收集菌体并用PBS重悬菌体,将重悬的菌液进行超声破碎,离心收集上清,利用亲和层析的原理,通过Ni柱对GPC3重组蛋白进行纯化。用SDS-PAGE电泳对纯化后的重组蛋白分子进行检测(图 6)。

|
| 图 6 融合蛋白纯化SDS-PAGE鉴定 M:protein marker;1:GPC3融合蛋白 |
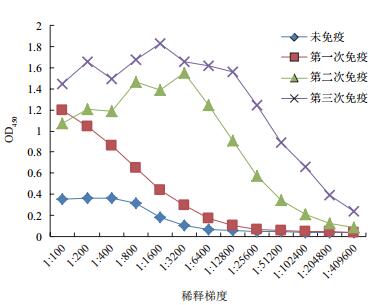
免疫前鼠血清与抗原无免疫反应,第3次加强免疫后已有明显的免疫反应,抗体效价可达1:51 200(图 7)。
|
| 图 7 GPC3多克隆抗体的效价检测 |
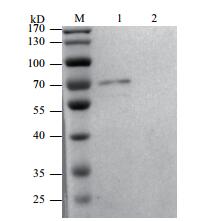
以纯化的GPC3蛋白作为抗原,将鼠抗人GPC3多克隆抗体作为一抗进行检测(图 8),表明免疫前血清与抗原无反应,免疫后血清与抗原能够进行特异性的结合。
|
| 图 8 Western Blot检测多抗特异性 M:protein marker;1,2:分别为免疫后血清,免疫前血清 |
肝细胞癌(HCC)是一种常见的消化系统疾病,其已成为第3种最常见的恶性肿瘤,仅次于胃癌和食道癌[8]。与其它恶性肿瘤一样,肝癌的发病机制尚不清楚。然而,人们普遍认为肝癌与肝硬化、病毒性肝炎以及化学致癌物密切相关。虽然已在肝癌治疗,包括微创外科、介入栓塞化疗和肝脏移植等进步很大,但是仍然不能够防止肿瘤复发和转移。研究表明肝细胞癌早期诊断治疗可大大提高肝癌的治疗率和延长患者的生命[9]。
肝癌诊断中广泛使用的生物标志物是血清α甲胎蛋白(AFP)。甲胎蛋白(AFP)在人类胚胎发育过程中大量表达,出生后停止表达。然而,当肝细胞发生癌变时,AFP的合成被恢复。已有研究表明AFP在肝癌患者血清中占70%-80%。因此,检测肝癌患者血清中的AFP水平被广泛认可[10]。然而,仍有30%-40%的肝癌患者呈阴性且血清中AFP浓度较低[11]。此外,由于其灵敏度相对较低,因此它的临床价值具有局限性。其他的生物标志物,如脱-γ-羧基凝血酶原(DCP)和晶状扁豆凝集素活性部分AFP(AFP-L3),均可作为AFP补充物,但其敏感性有限。此外,成像技术的结果易受检验方法以及成像设备质量等因素影响。因此,未来如何有效的鉴定和诊断HCC生物标志物至关重要[12]。
磷脂酰肌醇蛋白聚糖-3(GPC3)是磷酸乙酰肝素糖蛋白家族中的一员,它参与调控细胞增殖、调控、粘附和迁移等过程[13]。目前,GPC3被用作诊断肝细胞癌特异性标志物,通过计算机断层显像仪发射正电子探针来检测肝癌和正常肝组织中肝良性病变[14]。GPC3靶向治疗,包括GC33、HN3和YP7可能为治疗肝癌提供新的治疗手段[14]。GPC3主要通过激活Wnt等信号通路促进肝癌生长和转移。此外,GPC3在人类肝细胞癌的高表达已被证明,通过cDNA微阵列技术检测肝细胞癌患者血清发现,含有40%的GPC3蛋白,而在肝硬化患者、慢性肝炎患者和健康献血者的血清中不存在该蛋白。因此,GPC3被提议作为一个有用的肿瘤标志物用于肝癌的诊断[15]。
使用Trizol法提取人肝癌细胞HepG2总RNA,反转成cDNA并以其为模板扩增出来所需要的目的片段。本实验借助较为常用的大肠杆菌原核表达系统,该表达系统是发展最早也是最成熟,它能将外源基因借助原核乳糖操纵子结构原理诱导蛋白表达。构建原核表达载体,理论上最好使得融合蛋白在胞内表达,由于通过网络在线工具SignalP-4.1对GPC3所编码的氨基酸序列进行信号肽预测,该蛋白存在信号肽故设计引物时将信号肽切除。通过基因工程方法将去信号肽目的基因与pET28a进行连接,通过菌液PCR及双酶切,测序验证得出成功构建原核表达载体,经诱导得出融合蛋白在上清和沉淀中都有。虽然GPC3重组蛋白在沉淀中的表达量明显高于上清中表达量,但是包涵体的纯化需要用尿素溶解变性,即使先变性后利用透析复性最后上柱纯化,可能会残留的一些尿素,而尿素对柱料的使用寿命会降低。本实验纯化上清中的目的蛋白不仅降低对柱料损害,而且可以保证蛋白的具有活性。
磷脂酰肌醇蛋白聚糖3(Glypican 3,GPC3)可作为识别原发性肝癌组织(HCC)特异性肿瘤标志物,经GPC3融合蛋白免疫小鼠获得的抗血清,通过间接ELISA对3次免疫进行抗血清效价检测,发现随着免疫次数的增加,小鼠的抗血清效价呈现递增的趋势,更好地展现重组GPC3蛋白作为抗原激起了小鼠体内免疫应答反应,达到预期实验效果Western Blot分析表明,制备的鼠抗人GPC3多克隆抗体可特异识别重组GPC3蛋白。此外,获得的抗GPC3蛋白的多抗具有实验操作简单,实验所需周期短,成本相对较低的优势。
4 结论本研究中,将人肝癌细胞HepG2总RNA反转成的cDNA,通过PCR技术扩增出目的条带,并成功构建人GPC3融合基因pET28a重组载体,诱导表达了His-GPC3融合蛋白(约70 kD),将其作为免疫原,免疫Balb/c小鼠,成功制备了鼠抗GPC3血清,并对其进行效价检测,ELISA实验结果显示免疫鼠产生的抗血清效价可达到1:51 200。经Western Blot检查特异性良好。原核表达的重组人GPC3蛋白具有较好的免疫原性。
| [1] | Forner A, Llovet J, Bruix J. Hepatocellular carcinoma[J]. Lancet, 2012, 379 (9822): 1245–1255. DOI:10.1016/S0140-6736(11)61347-0 |
| [2] | Cao H, Phan H, Yang L. Improved chemotherapy for hepatocellular carcinoma[J]. Anticancer Res, 2012, 32 (4): 1379–1386. |
| [3] | Sersté T, Barrau V, Ozenne V, et al. Accuracy and disagreement of computed tomography and magnetic resonance imaging for the diagnosis of small hepatocellular carcinoma and dysplastic nodules: role of biopsy[J]. Hepatology, 2012, 55 (3): 800–806. DOI:10.1002/hep.24746 |
| [4] | Haruyama Y, Kataoka H. Glypican-3 is a prognostic factor and an immunotherapeutic target in hepatocellular carcinoma[J]. World J Gastroenterol, 2016, 22 (1): 275–283. DOI:10.3748/wjg.v22.i1.275 |
| [5] | Tsuchiya N, Sawada Y, Nakatsura T. Biomarkers for the early diagnosis of hepatocellular carcinoma[J]. World Journal of Gastroenterology, 2015, 21 (37): 10573–10583. DOI:10.3748/wjg.v21.i37.10573 |
| [6] | Sung YK, Hwang SY, Park MK, et al. Glypican-3 is overexpressed in human hepatocellular carcinoma[J]. Cancer Sci, 2003, 94 : 259–262. DOI:10.1111/cas.2003.94.issue-3 |
| [7] | Hippo Y, Watanabe K, Watanabe A, et al. Identification of soluble NH2-terminal fragment of glypican-3 as a serological marker for early-stage hepatocellular carcinoma[J]. Cancer Res, 2004, 64 : 2418–2423. DOI:10.1158/0008-5472.CAN-03-2191 |
| [8] | Qin ZN, Wang J, Wang Y, et al. Identifcation of a glypican-3-binding peptide for in vivo non-invasive human hepatocellular carcinoma detection[J]. Macromolecular Bioscience, 2017 . DOI:10.1002/mabi.201600335 |
| [9] | Luo L, Wang YZ, Huang Z, et al. Signifcance of Glypican-3(GPC3) expression in hepatocellular cancer diagnosis[J]. Med Sci Monit, 2017, 23 : 850–855. DOI:10.12659/MSM.899198 |
| [10] | Zhang JW, Li Y, Zeng XC, et al. miR-630 overexpression in hepatocellular carcinoma tissues is positively correlated with alpha-fetoprotein[J]. Med Sci Monit, 2015, 21 : 667–673. DOI:10.12659/MSM.892515 |
| [11] | Cai L, Rao XH, Qi SU, et al. Diagnostic value of Joint Detection of GP73 and AFP-L3 in primary hepatic carcinoma with low concentration of AFP[J]. Journal of International Translational Medicine, 2015, 3 : 28–32. |
| [12] | Attallah AM, El-Far M, Omran MM, et al. GPC-HCC model: a combination of glybican-3 with other routine parameters improves the diagnostic efficacy in hepatocellular carcinoma[J]. Tumor Biol, 2016, 37 : 12571–12577. DOI:10.1007/s13277-016-5127-6 |
| [13] | Kim H, Xu GL, Borczuk AC, et al. The heparan sulfate proteoglycan GPC3 is a potential lung tumor suppressor[J]. American Journal of Respiratory Cell & Molecular Biology, 2003, 29 (6): 694–701. |
| [14] | Wu YL, Liu H, Ding HG. GPC3 in hepatocellular carcinoma: current perspectives[J]. Journal of Hepatocellular Carcinoma, 2016, 3 : 63–67. DOI:10.2147/JHC |
| [15] | Chen CL, Huang XM, Chen CS, et al. Can glypican-3 be a disease-specifcbiomarker?[J]. Clin Trans Med, 2017, 6 (18): 1–6. |
| [16] | J. 萨姆布鲁克, D. W拉塞尔, 黄培堂等译. 分子克隆实验指南[M]. 第3版. 科学出版社, 2002. |




