2. 宁德市富发水产有限公司 大黄鱼育种国家重点实验室,宁德 352103
2. State Key Laboratory of Large Yellow Croaker Breeding, Ningde Fufa Fisheries Company Limited, Ningde 352103
泛素-蛋白酶体途径(Ubiquitin-proteasome pathway,UPP)是真核细胞内一种重要的蛋白降解途径,细胞内80%以上的蛋白质依赖于此途径进行降解,对于细胞内DNA修复、细胞周期调控、细胞凋亡、抗原提呈、基因转录调控等多种代谢活动具有重要的作用[1-2]。UPP的多种组成因子对于性腺发育与成熟、细胞分裂过程中染色质的浓缩与结构的重塑等生殖调控过程具有重要的作用[3]。泛素缀合酶E2(Ubiquitin-conjugating enzymes)是UPP的重要组成部分,在蛋白泛素化过程中作为介导泛素活化酶E1(Ubiquitin-activating enzyme)和泛素连接酶E3(Ubiquitin ligase enzyme)之间的关键性酶,对靶蛋白的特异选择性降解起决定性作用,为细胞周期蛋白的有序降解及细胞周期转换调控所必需[1, 2, 4]。现有研究表明泛素缀合酶E2基因在酿酒酵母(Saccharomyces cerevisiae)[5]、非洲爪蟾(Xenopus laevis)[6]、人类[7, 8]等不同物种的细胞周期进程中均有重要的调控作用,对其深入研究有助于我们进一步了解其生理功能和作用机理。
鱼类是人类重要的优质蛋白源之一,其养殖产量首先受限于苗种繁育的数量,因而对其生殖发育调控机制的研究已成为业内一个重要的研究热点。尽管鱼类的性腺发育受到外界环境影响,但其遗传基础仍是以不同基因的有序表达调控为主导,因此研究不同基因对性腺发育的调控机制有助于进一步丰富鱼类生殖的分子遗传学理论[9]。大黄鱼(Larimichthys crocea)是我国重要的经济养殖鱼类,作为传统四大海洋捕捞对象之首,素有“国鱼”美誉,深受广大消费者喜爱[10]。2015年全国大黄鱼育苗量和养殖产量分别达到27.9亿尾和14.79万t,居于全国海水养殖鱼类之首,在全国鱼类养殖产业中占据着重要地位[11]。在大黄鱼人工养殖产业化过程中,其性腺发育的调控是其育苗产量的关键调节因素,进一步从分子水平角度研究其性腺发育的调控机制从而丰富其遗传调控理论,为后续通过生物技术手段辅助选育新品系/种提供基础,对于大黄鱼产业转型升级具有重要意义[10]。前人的研究表明E2基因对于生物体配子细胞的发生[12-15]、性腺发育[16]以及胚胎发育[17-18]等生殖活动具有重要调控作用,但是该家族基因在大黄鱼性腺发育中的研究尚未见报道。因此,本研究从前期构建的大黄鱼性腺线性化cDNA文库[19-20]中筛选出泛素缀合酶UBE2D4基因片段(命名为Lc-UBE2D4),并首次克隆出其全长cDNA序列,通过qRT-PCR技术检测出该基因在不同组织和性腺不同发育阶段中的表达水平,为进一步研究该基因的生物学功能及其参与大黄鱼性腺发育的分子调控机制奠定基础。
1 材料与方法 1.1 材料所用大黄鱼实验样品取自宁德富发公司的养殖网箱,其中组织差异表达实验鱼体重为约500 g[21],雌雄各5尾,活鱼抽血后剪取其卵巢、精巢、肝脏、脾脏、肾脏、脑及肌肉等组织,并立即于液氮中冻存,后置于-80℃冰箱保存备用。另解剖270日龄、635日龄和1 000日龄的大黄鱼雄鱼和雌鱼的性腺[22],分别为T1、T2、T3期和O1、O2和O3期,各时期均选自4尾大黄鱼样品,以作性腺不同发育阶段差异表达分析。
1.2 方法 1.2.1 总RNA的提取利用RDP试剂及RNA提取方法[23]提取大黄鱼各组织总RNA。
1.2.2 目的基因的获得及其分析从构建的大黄鱼性腺cDNA文库中筛选获得UBE2D4基因片段[24],用SMART-RACE方法克隆其全长cDNA序列,利用VecScreen、Blast、ORF Finder等软件对其序列进行拼接和比对,采用Bioedit、MEGA 4.0等软件及pI、SingalP、TMHMM等在线程序分析其主要结构域和生物信息学特点;以β-actin基因为内参基因[21],采用qRT-PCR技术检测其在不同组织和性腺不同发育阶段中的差异表达,其中每个组织样品分别3次实验重复。
1.2.3 数据分析根据qRT-PCR实验结果,利用SPSS 15.0软件对其进行单因素方差分析,基因表达水平用RQ值的平均值±标准误(x±s)来表示,其中P < 0.05为差异显著,P < 0.01为差异极显著。
2 结果 2.1 Lc-UBE2D4基因全长cDNA序列分析根据UBE2D4基因片段,克隆得到其全长cDNA序列,命名为Lc-UBE2D4(Genbank登录号:FJ800568)。如图 1所示,Lc-UBE2D4全长cDNA序列共798 bp,其中5' UTR为262 bp、3' UTR为75 bp(不含polyA部分)、开放阅读框ORF为441 bp,可编码147个氨基酸,预测其蛋白分子量约为16.596 kD,等电点pI为6.39。根据SingalP和TMHMM等软件分析结果可得该基因不含信号肽和跨膜区,其糖基化位点位于N81-S83区域,并包含5个丝氨酸磷酸化位点(S11、S22、S43、S91和S105)、6个苏氨酸磷酸化位点(T36、T70、T71、T98、T126和T142),以及3个酪氨酸磷酸化位点(Y45、Y60和Y134)。Blastx比对结果显示Lc-UBE2D4蛋白结构序列与大部分物种的UBE2D4蛋白有90%以上的一致性,并含有典型的泛素缀合酶UBC结构域,属于E2基因家族成员,内含E2基因激活位点区域(Y74-L89),其N端第85位Cys(C85)残基是E2基因特有的保守活性位点。

|
| 图 1 Lc-UBE2D4全长cDNA及其推导的氨基酸序列 阴影部分是其保守的泛素缀合酶家族基因UBC结构域序列;单划线序列为5' RACE引物,波浪线是其3' RACE引物;方框部分为其E2基因的激活位点区域,其中双划线加粗部分为其糖基化位点、圆框内是其活性半胱氨酸残基;*表示终止密码子 |
利用Bioedit软件,将大黄鱼Lc-UBE2D4蛋白序列与NCBI数据库中Blast比对搜索得来的其他物种UBE2D4同源蛋白序列进行多重比较,其结果如图 2显示,不同物种间的泛素缀合酶UBC结构域的序列(R5-K136)十分保守,其相似性达到90%以上;同时,其激活位点区域(Y74-L89)高度保守,均含有一个半胱氨酸活性位点(C85)。

|
| 图 2 Lc-UBE2D4与其他物种UBE2D4氨基酸序列的多重比较 多重比较采用GenBank上已注册的UBE2D4氨基酸序列如下:Larimichthys crocea:ACO35043;Labrus bergylta:XP_020513176;Takifugu rubripes:XP_011613481;Oryzias latipes:XP_004072543;Hippocampus comes:XP_019740864;Homo sapiens:NP_057067;Danio rerio:NP_001082922;Cynoglossus semilaevis:XP_008333794;Xenopus laevis:NP_001093355;Scleropages formosus:XP_018589977;Esox lucius:XP_010895954;Oreochromis niloticus:XP_003454097;Lethenteron camtschaticum:AJA90881;Gallus gallus:NP_001026324。红色方框表示保守的UBC结构域,下划线为激活位点区域,糖基化位点用大括号表示,蓝色三角形表示保守的活性Cys残基 |
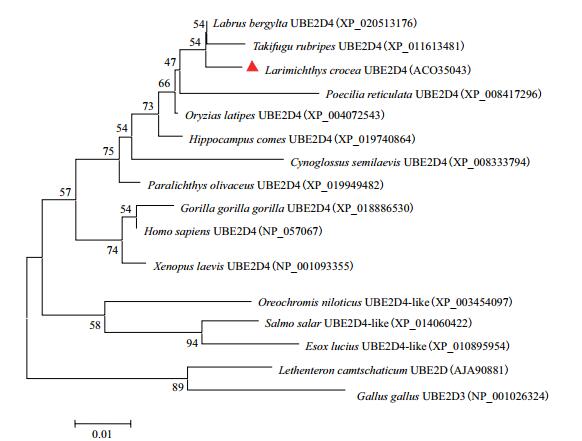
以Mega 4.0软件的临位相接法将不同物种间的UBE2D4同源蛋白质氨基酸序列进行多重比对,构建Lc-UBE2D4系统进化树。如图 3所示,大黄鱼Lc-UBE2D4与贝氏隆头鱼(Labrus bergylta)、红鳍东方鲀(Takifugu rubripes)形成一小簇,三者与其他鱼类形成一个较大的簇,人(Homo sapiens)、猩猩(Gorilla gorilla gorilla)和非洲爪蟾(Xenopus laevis)形成另一簇。同时,其他物种的UBE2D4-like蛋白形成第三簇,而北极七鳃鳗(Lethenteron camtschaticum)的UBE2D和原鸡(Gallus gallus)的UB2D3形成最外缘的一簇,表明亲缘关系最远。
|
| 图 3 利用邻位相接法构建的Lc-UBE2D4系统进化树 |
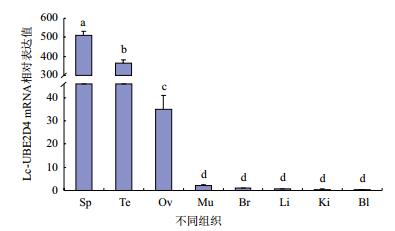
利用荧光定量qRT-PCR技术检测Lc-UBE2D4基因在大黄鱼各组织器官中的表达情况。经分析发现(图 4),Lc-UBE2D4在脾脏中的表达水平最高,在精巢中的表达水平紧随其后,二者之间具有显著性差异(P < 0.05),且二者均极显著高于其他各组织(P < 0.01);同时Lc-UBE2D4在卵巢中的表达水平也显著高于其他各组织(P < 0.05)。
|
| 图 4 Lc-UBE2D4基因在大黄鱼不同组织中的表达情况 Sp:脾脏;Te:精巢;Ov:卵巢;Mu:肌肉;Br:脑;Li:肝脏;Ki:肾脏;Bl:血液;柱上字母不同表示差异显著(P < 0.05),其中a和b之间差异显著(P < 0.05),ab与cd差异极显著(P < 0.01),c和d之间差异显著(P < 0.05) |
利用荧光定量qRT-PCR技术检测Lc-UBE2D4基因在大黄鱼性腺不同发育阶段的表达模式(图 5),Lc-UBE2D4基因在270日龄、635日龄和1 000日龄大黄鱼的精巢均显著高于同时期卵巢的表达水平(P < 0.05),其中T1和T2期的表达水平极显著高于卵巢3个时期(P < 0.01),而在T3期的表达水平与卵巢的差异近于极显著水平(P=0.012)。

|
| 图 5 Lc-UBE2D4基因在大黄鱼性腺不同发育阶段的表达模式 T:精巢;O:卵巢;不同数字表示不同日龄;柱上字母A和a之间无显著差异(P > 0.05),A和b之间差异极显著(P < 0.01),a和b之间差异显著(P < 0.05) |
泛素缀合酶E2是泛素蛋白酶体途径(UPP)的重要组成部分,是泛素活化酶E1和泛素连接酶E3的中间介导载体,它通过硫酯键作用于活化的泛素形成E2-泛素化复合体,并协助特异性泛素连接酶E3将活化的泛素转移至底物蛋白,促使底物蛋白的泛素化降解,对于细胞周期蛋白的周期性降解以及细胞分裂周期调控具有重要的作用[25-26]。本研究首次克隆得到大黄鱼泛素缀合酶E2(Lc-UBE2D4)基因全长,对其功能结构域的分析显示Lc-UBE2D4含有多个磷酸化位点,提示该蛋白是一个功能活跃的蛋白质[4];该蛋白含有一段较长的、高度保守的、具催化活性的UBC催化结构域[27],其中N端第74-89位区域是其E2激活位点,内含调控其活性的Cys残基,是E2-泛素复合体硫酯键形成所必需的重要区域[28-30]。经系统进化树与多重比较分析结果显示,该基因与其他物种的UBE2D高度保守,其相似性达90%以上,这可能与该基因在不同物种间的相似性功能有关,与多基因家族的存在现象较为一致[25]。
脾脏是真骨鱼类唯一的淋巴结样器官,含有许多先天免疫功能因子,具有一定免疫调节作用[31]。研究表明鱼类脾脏的许多内在因子参与了免疫反应,如经鳗弧菌刺激后的鲤鱼Akirin2基因在脾脏中的表达会显著提升[32];大黄鱼受到poly I-C[33]和溶藻弧菌[34-35]的刺激,其脾脏内Mx蛋白基因、beta2微球蛋白、胎盘特异8基因、Cyba、Rab11和IL-10等免疫功能基因均显著上调,表明大黄鱼脾脏内存在多种免疫调节因子以应对各种不同应激物的刺激。泛素缀合酶E2家族基因参与机体内一些重要的免疫调节反应已有相关研究报道,如人UBE2W基因对于TNFα诱导的核转录因子NF-κB的转录活性具有显著抑制作用,并与NF-κB相关的炎症反应和肿瘤形成有关[36];酵母UBE2参与了DNA复制后的修复与蛋白质的降解[37];松江鲈(Trachidermus fasciatus)在鳗弧菌刺激下,其UBE2D2基因在脾脏的表达迅速提升了约40倍,推测UBE2D2基因可能与松江鲈的先天免疫防御有关[38]。大黄鱼作为一种常年在开放海区养殖的鱼类,其养殖过程中受到不同微生物、寄生虫等病害威胁,其机体内存在多种细胞因子参与免疫调节反应[10, 33]。本研究中Lc-UBE2D4基因与松江鲈UBE2D2基因同属于UBE2D家族,其作用机理可能接近,qRT-PCR结果中显示Lc-UBE2D4在脾脏中的表达水平最高,推测该基因可能参与免疫机能,至于如何参与大黄鱼免疫调节有待进一步验证。
泛素缀合酶E2家族基因在生殖系统中具有重要的调节作用[39]。例如,果蝇泛素缀合酶UbcD1基因对细胞有丝分裂和减数分裂过程中染色体的准确定位具有重要的调节作用[40];在甲壳动物中,泛素结合酶UBE2基因对于日本囊对虾(Mar-supenaeus japonicus)[13]、克氏原鳌虾(Procambarus clarkia)[15]、斑节对虾(Penaeus monodon)[16]的性腺发育、配子发生等生殖活动具有重要调节作用;在哺乳动物的配子发生过程中,泛素缀合酶E2基因亦有重要的调节作用[41],如小鼠泛素缀合酶HR6B基因的突变可导致其雄性不育[42, 43];敲除小鼠UBE2B基因,其精母细胞和精子细胞的结构发生异常,成熟精子数量显著减少且活力降低,其畸形率也会显著提高,继而引发雄性不育[44];改变人类UBE2B的mRNA水平会导致男性不育[45]。本研究中Lc-UBE2D4基因在性腺中的表达显著高于脾脏外的其他组织,可能是由于大黄鱼性腺中细胞分裂比其他组织旺盛的多,需要更多的蛋白质进行周期性的合成与降解,因此需要更多的泛素系统相关因子参与细胞周期蛋白的降解以完成细胞分裂,这与已报道的大黄鱼细胞周期调节因子cdc2和cyclinB1[46]以及E3底物受体LcDCAF17[47]在性腺中的表达显著高于其他各组织的结论相一致,表明该基因与大黄鱼的性腺发育密切相关。在大黄鱼性腺发育过程中,其卵巢自8月龄起卵原细胞已发育至第Ⅱ卵母细胞,至2.5年龄时大部分卵母细胞仍处于该时期,卵母细胞内卵原蛋白不断合成,细胞体积不断增大,而精巢自8月龄起精原细胞增殖旺盛,至2年龄起精巢内即已产生大量的成熟精子[47, 48]。本研究中Lc-UBE2D4在精巢3个不同发育时期中的表达水平显著高于同期卵巢,说明该基因的表达与细胞分裂程度显著相关,暗示Lc-UBE2D4对精巢发育的调节作用更强,对精巢发育和精子成熟具有重要的调控作用。
4 结论本研究从大黄鱼性腺cDNA文库中筛选出Lc-UBE2D4基因片段,并首次克隆出其全长cDNA序列,该基因具有典型的UBC结构域,属于泛素缀合酶E2家族。同时,该基因在进化过程中十分保守,可能与其不同物种间的相似功能有关。组织差异表达结果显示,Lc-UBE2D4在脾脏的表达水平最高,而在精巢和卵巢的表达亦显著高于除脾脏外的其他各组织器官;在性腺的不同发育阶段,Lc-UBE2D4在精巢3个时期的表达均显著高于卵巢。本研究结果显示Lc-UBE2D4基因对大黄鱼性腺发育和配子细胞的成熟具有重要的调节作用,脾脏中的高表达也暗示其可能参与免疫机能。
| [1] | 韩坤煌, 张子平, 王艺磊, 等. Cyclin-CDK-CKI及UPP参与生殖调控及在甲壳动物性腺发育中的研究进展[J]. 生物技术通报, 2010(7): 48–54. |
| [2] | Varshavsky A. The Ubiquitin System[J]. Trends Biochem Sci, 1997, 22 (10): 383–387. DOI:10.1016/S0968-0004(97)01122-5 |
| [3] | Baarends WM, Roest HP, Grootegoed JA. The ubiquitin system in gametogenesis[J]. Mol Cell Endocrinol, 1999, 151 (1-2): 5–16. DOI:10.1016/S0303-7207(99)00060-X |
| [4] | 国果, 吴沁怡, 吴建伟, 等. 家蝇泛素结合酶基因的生物信息学分析[J]. 生物技术通报, 2014(2): 107–111. |
| [5] | Schwob E, Böhm T, Mendenhall MD, et al. The B-type cyclin kinase inhibitor p40SIC1 controls the G1 to S transition in S. cerevisiae[J]. Cell, 1994, 79 (2): 233–244. DOI:10.1016/0092-8674(94)90193-7 |
| [6] | Yew PR, Kirschner MW. Proteolysis and DNA replication: the CDC34 requirement in the Xenopus egg cell cycle[J]. Science, 1997, 277 (5332): 1672–1676. DOI:10.1126/science.277.5332.1672 |
| [7] | Reymond F, Wirbelauer C, Krek W. Association of human ubiquitin-conjugating enzyme CDC34 with the mitotic spindle in anaphase[J]. J Cell Sci, 2000, 113 (Pt 10): 1687–1694. |
| [8] | Pati D, Meistrich ML, Plon SE. Human Cdc34 and Rad6B ubiquitin-conjugating enzymes target repressors of cyclic AMP-induced transcription for proteolysis[J]. Mol Cell Biol, 1999, 19 (7): 5001–5013. DOI:10.1128/MCB.19.7.5001 |
| [9] | Von Hofsten J, Olsson PE. Zebrafish sex determination and differentiation: involvement of FTZ-F1 genes[J]. Reprod Biol Endocrinol, 2005, 3 (1): 63. DOI:10.1186/1477-7827-3-63 |
| [10] | 刘家富. 大黄鱼养殖与生物学[M]. 厦门: 厦门大学出版社, 2013. |
| [11] | 农业部渔业渔政管理局. 2016年中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2016. |
| [12] | Manku G, Wing SS, Culty M. Expression of the ubiquitin proteasome system in neonatal rat gonocytes and spermatogonia: role in gonocyte differentiation[J]. Biol Reprod, 2001, 87 (2): 44. |
| [13] | Shen B, Zhang Z, Wang Y, et al. Differential expression of ubiquitin-conjugating enzyme E2r in the developing ovary and testis of penaeid shrimp Marsupenaeus japonicus[J]. Mol Biol Rep, 2009, 36 (5): 1149–1157. DOI:10.1007/s11033-008-9291-7 |
| [14] | Koenig PA, Nicholls PK, Schmidt FI, et al. The E2 ubiquitin-conjugating enzyme UBE2J1 is required for spermiogenesis in mice[J]. J Biol Chem, 2014, 289 (50): 34490–34502. DOI:10.1074/jbc.M114.604132 |
| [15] | 钱照君, 祝天谅, 姜虎成, 等. 克氏原螯虾泛素结合酶E2r基因的克隆及表达分析[J]. 上海海洋大学学报, 2016, 5: 641–651. DOI:10.12024/jsou.20160301702 |
| [16] | 唐蕾, 傅明骏, 刘文生, 等. 斑节对虾UBE2H基因克隆及其表达[J]. 南方农业学报, 2016, 47(11): 1958–1965. DOI:10.3969/jissn.2095-1191.2016.11.1958 |
| [17] | 向云龙, 张亮, 陈卓. 过表达泛素偶联酶(UBE2C)对小鼠胚胎发育的影晌[J]. 黑龙江动物繁殖, 2014, 22(1): 3–7. |
| [18] | 胡月阳. UBE2C基因在斑马鱼胚胎发育中的时空表达规律[D]. 石家庄: 河北医科大学, 2015. http: //cdmd. cnki. com. cn/Article/CDMD-10089-1015324095. htm |
| [19] | Zhou P, Zhang ZP, Wang YL, et al. EST analysis and identification of gonad-related genes from the normalized cDNA library of large yellow croaker, Larimichthys crocea[J]. Comp Biochem Physiol Part D Genomics Proteomics, 2010, 5 (2): 89–97. DOI:10.1016/j.cbd.2010.01.002 |
| [20] | 陈芸, 周鹏, 张子平, 等. 大黄鱼性腺线性化cDNA文库的构建及生殖免疫相关基因的筛选[J]. 生物技术通报, 2011(7): 180–185. |
| [21] | 周鹏, 张子平, 王艺磊, 等. 大黄鱼ubc9基因的克隆和组织表达[J]. 生物技术通报, 2009(8): 76–82. |
| [22] | Jiang Y, Han K, Chen S, et al. Characterization and expression analysis of Lc-Sox4 in large yellow croaker Larimichthys crocea[J]. Gene, 2015, 574 (2): 287–301. DOI:10.1016/j.gene.2015.08.021 |
| [23] | Zhang Z, Wu RS, Mok HO, et al. Isolation, characterization and expression analysis of a hypoxia-responsive glucose transporter gene from the grass carp, Ctenopharyngodon idellus[J]. Eur J Biochem, 2003, 270 (14): 3010–3017. DOI:10.1046/j.1432-1033.2003.03678.x |
| [24] | 周鹏. 若干大黄鱼性腺发育相关基因的克隆与表达[D]. 厦门: 集美大学, 2009. http: //cdmd. cnki. com. cn/Article/CDMD-10390-1011209709. htm |
| [25] | 姚杨, 苏杰, 魏迪, 等. 泛素结合酶基因生物信息学与功能分析[J]. 医学研究生学报, 2014, 11: 1156–1159. DOI:10.3969/j.issn.1008-8199.2014.11.009 |
| [26] | Hochstrasser M. Ubiquitin-Dependent Protein Degradation[J]. Annu Rev Genet, 1996, 30 : 405–439. DOI:10.1146/annurev.genet.30.1.405 |
| [27] | van Wijk SJ, Timmers HT. The family of ubiquitin-conjugating enzymes(E2s): deciding between life and death of proteins[J]. FASEB J, 2010, 24 (4): 981–993. DOI:10.1096/fj.09-136259 |
| [28] | Criqui MC, de Almeida Engler J, Camasses A, et al. Molecular characterization of plant ubiquitin-conjugating enzymes belonging to the UbcP4/E2-C/UBCx/UbcH10 gene family[J]. Plant Physiol, 2002, 130 : 1230–1240. DOI:10.1104/pp.011353 |
| [29] | Michelle C, Vourc'h P, Mignon L, et al. What was the set of ubiquitin and ubiquitin-like conjugating enzymes in the eukaryote common ancestor?[J]. J Mol Evol, 2009, 68 (6): 616–628. DOI:10.1007/s00239-009-9225-6 |
| [30] | Jentsch S. The ubiquitin-conjugation system[J]. Annu Rev Genet, 1992, 26 (1): 179–207. DOI:10.1146/annurev.ge.26.120192.001143 |
| [31] | 唐海蓉, 陈仕均, 王选年. 鱼类免疫组织的研究进展[J]. 现代畜牧兽医, 2006, 9: 52–54. DOI:10.3969/j.issn.1672-9692.2006.03.030 |
| [32] | 张晓研. 鲤鱼Akirin基因的分子克隆及免疫功能研究[D]. 济南: 山东师范大学, 2010. http: //cdmd. cnki. com. cn/Article/CDMD-10445-1011079535. htm |
| [33] | Zheng W, Liu G, Ao J, et al. Expression analysis of immune-relevant genes in the spleen of large yellow croaker(Pseudosciaena crocea) stimulated with poly I: C[J]. Fish Shellfish Immunol, 2006, 21 (4): 414–430. DOI:10.1016/j.fsi.2006.01.006 |
| [34] | 张宇, 韩芳, 刘岚萍, 等. 大黄鱼Rab11基因的克隆与表达分析[J]. 集美大学学报:自然科学版, 2016, 21(3): 167–174. |
| [35] | 郑维兵, 慕鹏飞, 丁连帅, 等. 大黄鱼(Larimichthys crocea)IL-10基因的克隆与表达分析[J]. 海洋学报, 2017, 39(4): 50–60. |
| [36] | 王少鑫, 巩伟丽, 陈媛, 等. UBE2W抑制TNFα诱导的NF-κB转录活性[J]. 科学技术与工程, 2012, 12(35): 9457–9460. DOI:10.3969/j.issn.1671-1815.2012.35.002 |
| [37] | Broomfield S, Hryciw T, Xiao W. DNA postreplication repair and mutagenesis in Saccharomyces cerevisiae[J]. Mutat Res, 2001, 486 (3): 167–184. DOI:10.1016/S0921-8777(01)00091-X |
| [38] | 陈学昭, 张雷, 于珊珊, 等. 松江鲈(Trachidermus fasciatus)泛素结合酶E2-D2基因的分子克隆及组织表达分析[J]. 海洋学报, 2015, 37(10): 133–140. DOI:10.3969/j.issn.0253-4193.2015.10.013 |
| [39] | 王红梅, 祝诚. 泛素—蛋白水解酶复合体通路在生殖系统中的研究进展[J]. 生物化学与生物物理进展, 2002, 29(1): 31–34. |
| [40] | Cenci G, Rawson RB, Belloni G, et al. UbcD1, a Drosophila ubiquitin-conjugating enzyme required for proper telomere behavior[J]. Genes Dev, 1997, 11 (7): 863–875. DOI:10.1101/gad.11.7.863 |
| [41] | 张强, 牟丽莎, 桂耀庭, 等. UBE2B基因与男性不育的研究进展[J]. 中华男科学杂志, 2014, 20(4): 367–371. |
| [42] | Roest HP, van Klaveren J, de Wit J, et al. Inactivation of the HR6B ubiquitin-conjugating DNA repair enzyme in mice causes male sterility associated with chromatin modification[J]. Cell, 1996, 86 (5): 799–810. DOI:10.1016/S0092-8674(00)80154-3 |
| [43] | Baarends WM, Wassenaar E, Hoogerbrugge JW, et al. Loss of HR6B ubiquitin-conjugating activity results in damaged synaptonemal complex structureand increased crossing-over frequency during the male meiotic prophase[J]. Mol Cell Biol, 2003, 23 (4): 1151–1162. DOI:10.1128/MCB.23.4.1151-1162.2003 |
| [44] | Escalier D, Bai XY, Silvius D, et al. Spermatid nuclear and sperm periaxonemal anomalies in the mouse Ube2b null mutant[J]. Mol Reprod Dev, 2003, 65 (3): 298–308. DOI:10.1002/(ISSN)1098-2795 |
| [45] | Yatsenko AN, Georgiadis AP, Murthy LJ, et al. UBE2B mRNA alterations are associated with severe oligozoospermia in infertile men[J]. Mol Hum Reprod, 2013, 19 (6): 388–394. DOI:10.1093/molehr/gat008 |
| [46] | 蔡明夷, 周鹏, 韩坤煌, 等. 大黄鱼cyclin B1和cdc2 cDNA序列特征及组织表达分析[J]. 厦门大学学报:自然科学版, 2014, 53(1): 132–141. |
| [47] | 罗辉玉, 张东玲, 叶坤, 等. 大黄鱼LcDCAF17基因的克隆与表达分析[J]. 集美大学学报:自然科学版, 2017, 22(1): 1–9. |
| [48] | 林丹军, 张健, 骆嘉, 等. 人工养殖的大黄鱼性腺发育及性周期研究[J]. 福建师范大学学报:自然科学版, 1992, 8(3): 81–87. |




