白藜芦醇是一种非黄酮类多酚物质,化学名称为芪三酚,分子式为C14H12O3,无色针状结晶,熔点256-258℃,较难溶于水,易溶于甲醇、乙醇等有机溶剂,光、热稳定性差。广泛存在于蓼科、葡萄科等70多种植物中。它具有良好的治疗阿尔茨海默病、清除易形成聚集体的病理性蛋白、保护心血管系统、抗抑郁及神经保护、抑制肿瘤恶性增殖[1-5]等功效。因其可应用于保健品、化妆品、医药等行业而受到人们的关注。
白藜芦醇的生产方式主要包括植物提取法、化学合成法和生物转化法。张景亚等[6]优化超声提取花生衣中白藜芦醇的工艺,使其平均提取率达0.3%。Guiso等[7]利用3,5-二乙酰氧基苯乙烯与对乙酰氧基碘苯发生Heck反应,水解得到白藜芦醇,总产率达70%。Solladie等[8]应用Perkin反应以对异丙氧基苯乙酸和3,5-二异丙氧基苯甲醛为原料,获得单一顺式构型白藜芦醇,经异构化、脱除保护基得反式白藜芦醇,总收率达55.2%。碳负离子与羰基发生亲核加成反应[9],所得的烃基消除后可以形成双键,合成路线步骤较繁琐,但是该方法利于构型选择。生物转化法中,田天丽等[10]用根霉与中药虎杖共发酵的方法获得产物白藜芦醇;白藜芦醇酶法提取条件温和,提高原料利用率和产物得率,但成本较高。一般采用多种酶复合,应用较多的是糖苷酶和纤维素酶。黄志芳等[11]用纤维素酶将虎杖中的虎杖苷酶解成白藜芦醇,使白藜芦醇得率比醇提法提高近5倍。
植物中游离的白藜芦醇极少,约为0.01%,多结合葡萄糖以苷(虎杖苷)的形式存在;因此从植物中提取白藜芦醇的收率不高。白藜芦醇的光热不稳定性,又限制了化学合成法在白藜芦醇生产中的应用。真菌转化虎杖苷的时间较长,且不便于产物的分离纯化。利用酶法水解,效率稍有提高,但成本也非常高。β-葡萄糖苷酶能够水解结合于末端非还原性的β-D-葡萄糖苷键,同时释放出β-D-葡萄糖和相应的配基[12],虎杖苷可被β-葡萄糖苷酶水解为白藜芦醇。利用能够分泌β-葡萄糖苷酶的菌株转化虎杖苷生成白藜芦醇有效可行,且开发一种转化时间短,反应条件温和,转化率高的生产白藜芦醇的方法尤为重要。
1 材料与方法 1.1 材料 1.1.1 菌种来源采自湖北省随州市常年种植虎杖的土壤。
1.1.2 主要试剂和仪器甲醇(色谱纯),乙腈(色谱纯),白藜芦醇标准对照品(98%)、栀子苷(50%)、虎杖苷(50%)均购自南京狄尔格医药公司。PTC-200型PCR基因扩增仪(MJ Research Inc.)、高效液相色谱仪(安捷伦科技有限公司)、色谱柱(Agilent Zorbax SB-C18)、旋转蒸发仪(瑞士buchi)。
1.1.3 培养基筛选培养基:纯度为50%的栀子苷3 g/L,精氨酸2 g/L,tryptone 10 g/L,yeast extract 5 g/L,NaCl 10 g/L,琼脂20 g/L;种子培养基:精氨酸2 g/L,tryptone 10 g/L,yeast extract 5 g/L,NaCl 10 g/L;转化培养基:牛肉膏5 g/L,tryptone 10 g/L,NaCl 5 g/L,纯度为50%的虎杖苷1 g/L。
1.2 方法 1.2.1 菌种采集与分离纯化用生理盐水冲洗虎杖根,浸泡摇匀后,梯度稀释,分别涂布于含有卡那霉素、氨苄青霉素、0.3%的栀子苷的固体培养基上和含有0.3%的栀子苷的LB固体培养基上,栀子苷与β-葡萄糖苷酶反应发生明显的蓝色变化[13],观察菌落生长情况,编号记录。
1.2.2 底物转化及产物的提取与精制挑取单菌落,接入种子培养基中,培养至对数期后转接入转化培养基中,37℃。220 r/min,摇瓶转化培养。将完成转化的发酵液离心后,弃去上清,向沉淀中加入甲醇,再次离心后取上清,弃去沉淀,利用旋转蒸发仪将甲醇蒸出,得到产物白藜芦醇。
1.2.3 转化产物检测与含量分析利用HPLC-MS检测的方法为:流动相为乙腈:水:甲酸=40:59.94:0.06;色谱柱:GRACE Vydac 218TP-C18;检测波长:306 nm;柱温:35℃。利用1H-NMR(400 MHz)检测参照Christian S等[14]的方法,氘代丙酮(C3D6O)溶解产物干燥粉末样品。利用HPLC检测的方法为:流动相为乙腈:水:磷酸=40:59.82:0.18;色谱柱:Agilent Zorbax SB-C18;检测波长:306 nm;柱温:35℃。配制1 mg/mL白藜芦醇溶液,利用高效液相测定白藜芦醇在进样量分别为0.2、0.4、0.6、0.8、1.0 μL时的峰面积,得到白藜芦醇标准曲线,结果见图 1白藜芦醇浓度与峰面积关系标准曲线。

|
| 图 1 白藜芦醇浓度与峰面积的关系(Y=0.380 5+6.665 5X,R=0.996 28) |
利用1.2.1中所述的方法,筛选得到一株能够分泌β-葡萄糖苷酶的菌株CGMCC 13129,因β-葡萄糖苷酶可水解固体培养基中的栀子苷,生成生产蓝色络合物京尼平,在菌落周围出现了明显的蓝色,如图 2所示,证明该菌株能够分泌β-葡萄糖苷酶。菌株经革兰氏染色呈阳性、短杆状、有芽孢,芽孢中生、不膨胀,属于典型的芽孢杆菌属形态特征,其个体形态如图 3所示。

|
| 图 2 菌株在初筛平板上的菌落形态 |

|
| 图 3 菌株的个体形态(100×10) |
通过PCR获得16S rDNA序列,经测序,分析其大小为1 373 bp,利用NCBI数据库进行对比分析,结果表明该菌与芽孢杆菌属的多个沙福芽孢杆菌具有99%以上的同源性。系统进化树如图 4所示。综合菌株的16S rDNA序列分析,确认该菌株为沙福芽孢杆菌(Bacillus safensis),保藏编号为CGMCC 13129。

|
| 图 4 菌株的系统进化树 |
利用1.2.2中所述方法,将种子液接入发酵培养基中,接菌前培养基澄清,如图 5所示。接菌后进行摇瓶培养,随着菌体大量生产繁殖,培养基变得浑浊;摇瓶培养8 h后,有明显的团状沉淀出现,上清液中菌体浓度明显降低,如图 6所示,产物难溶于水在液体培养基中结晶析出,摇瓶底部出现大量白色沉淀。

|
| 图 5 接种B.safensis菌前的培养液 |

|
| 图 6 接种B.safensis菌后转化8 h的培养液 |
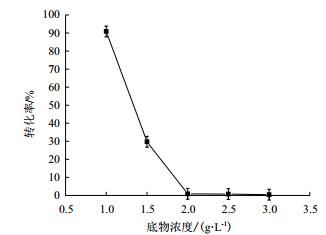
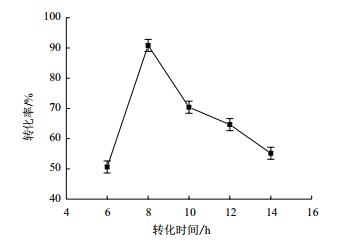
利用1.2.2中所述方法对虎杖苷进行转化,分别对底物浓度和转化时间进行优化,由图 7可知,当底物虎杖苷浓度为0.1%时转化率较高,为90%左右;当底物虎杖苷浓度为0.2%时,转化率趋近于0%。随着底物虎杖苷浓度增加,转化率迅速降低,底物浓度过高影响菌体生长繁殖,而导致底物几乎不被转化。由图 8可知,当转化时间为8 h时,转化率较高,短于或长于8 h,转化率均降低;6 h时因未完全转化导致测得的转化率较低,而转化时间过长,产物白藜芦醇被降解,导致转化率下降,朱屹东[15]也分析了类似的问题,利用沙福芽孢杆菌转化虎杖苷8 h,转化率就能达到90%,可大大缩短转化时间,显著降低白藜芦醇的工业化生产成本。
|
| 图 7 底物浓度与转化率的关系 |
|
| 图 8 转化时间与转化率的关系 |
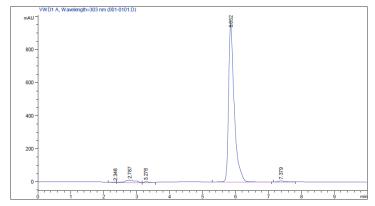
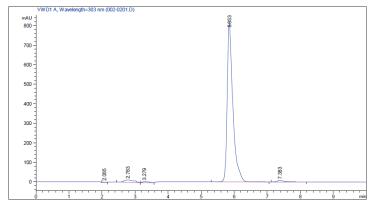
利用1.2.3中方法检测转化产物,对比图 9和图 10可知转化产物与白藜芦醇标准品的出峰时间相同,产物经甲醇萃取一次,纯度可高达99.3%。
|
| 图 9 白藜芦醇标准品HPLC图 |
|
| 图 10 转化产物HPLC图 |
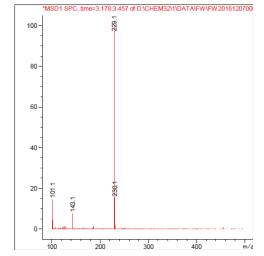
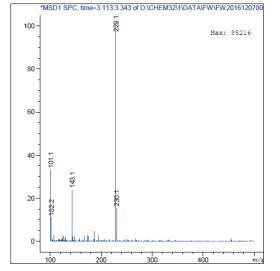
利用1.2.3中方法对产物纯度进行检测,白藜芦醇分子量为:228.25,分析图 11及图 12可知转化产物与白藜芦醇标准品分子量相同,确定转化产物为白藜芦醇,且纯度较高。
|
| 图 11 白藜芦醇标品HPLC-MS图 |
|
| 图 12 产物HPLC-MS图 |
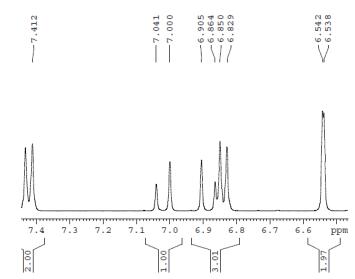
利用1.2.3中1H-NMR检测方法对产物结构进行检测,分析图 13,1H-NMR(400 MHz,C3D6O):δ 7.02(d,J = 16 Hz,1H),6.88(d,J = 16 Hz,1H),可知产物为反式白藜芦醇。
|
| 图 13 产物1H-NMR图 |
目前国内利用微生物转化法生产白藜芦醇的研究已较多,但主要集中在利用黑曲霉[16]、根霉菌[17]、酿酒酵母工程菌[18-21]等真菌转化,真菌转化耗时较长,需5-8 d左右,且不利于产物白藜芦醇的分离纯化。而关于细菌转化白藜芦醇的报道较少,国内朱屹东[15]构建了一株强化酪氨酸合成的白藜芦醇生产菌株,以葡萄糖为底物,最终白藜芦醇产量为71.6 mg/L,副产物主要有白藜芦醇二聚体和氧化白藜芦醇;本方法的产量是其方法的4倍且几乎无副产物。国外的研究中,Watts等[22]以香豆酸作为底物,白藜芦醇产量为100 mg/L;Katsuyarnal等[23]以香豆酰辅酶A为底物,白藜芦醇产量为171 mg/L Lim和Koffas等[24]以对香豆酸为底物,白藜芦醇产量达到2.3 g/L。利用沙福芽孢杆菌转化底物虎杖苷生成白藜芦醇,转化率可达到90%以上,仅8 h即可完成一次转化。转化过程中,培养基由澄清变为浑浊,最后又变得较澄清。在显微镜下观察菌体和产物,发现大多数菌体被包含在产物内部,分析该现象出现的原因是产物白藜芦醇在转化过程中,以菌为晶核,因难溶于水而结晶析出。这个现象为后期产物的分离纯化提供了良好的先决条件,使得产物经一步甲醇萃取过程,纯度便可高达99.3%。
沙福芽孢杆菌分离自常年种植虎杖植物的土壤,而虎杖植物中虎杖苷的含量较低,自然条件下,菌株适应低浓度虎杖苷的环境,对底物虎杖苷的耐受能力较弱,高浓度底物虎杖苷对菌体生长繁殖影响较大,当底物虎杖苷浓度增加时,底物转化率显著下降,甚至无转化产物生成。综合考虑研究中出现的问题,对比构建高效的外源基因表达系统、细胞固定化与敲除底物浓度限制因素的基因等3种方法的优势与劣势,后续会考虑对沙福芽孢杆菌全基因组测序,改造其代谢途径,提高其对底物的耐受性,进一步提高底物的转化率。
4 结论在肉汤培养基中,底物浓度为0.1%,接种量为7%,37℃,220 r/min摇瓶转化8 h,转化率高达90%以上。经甲醇萃取一次,纯度可高达99.3%;通过HPLC、HPLC-MS、1H-NMR检测确定产物为反式白藜芦醇。
| [1] | Tennen RI, Michishita-Kioi E, Chua KF. Finding a target for resveratrol[J]. Cell, 2012, 148 (3): 387–389. DOI:10.1016/j.cell.2012.01.032 |
| [2] | 董雯, 王蓉. 白藜芦醇诱导细胞自噬在神经退行性疾病进展中的作用[J]. 药学学报, 2016(1): 18–22. |
| [3] | Zong Y, Sun L, Liu B, et al. Resveratrol inhibits LPSinduced MAPKs activation via activation of the phosphatidylinositol 3-kinase pathway in murine RAW 264. 7 macrophage cells[J]. PLoS On, 2012, 7 (8): e44107. DOI:10.1371/journal.pone.0044107 |
| [4] | Ferretta A, Gaballo A, Tanzarella P, et al. Effect of resveratrolon mitochondrial function:Implications in parkin-associated familiar Parkinson's disease[J]. Biochim Biophys Acta, 2014, 1842 (7): 902–915. DOI:10.1016/j.bbadis.2014.02.010 |
| [5] | Li Y, Zhu W, Li J, et al. Resveratrol suppresses the STAT3 signaling pathway and inhibits proliferation of high glucoseexposed HepG2 cells partly through SIRT1[J]. Oncol Rep, 2013, 30 (6): 2820–2828. DOI:10.3892/or.2013.2748 |
| [6] | 张景亚, 李朋伟, 仝艳, 等. 超声波辅助提取花生衣中的白藜芦醇[J]. 安徽农业科学, 2011, 9(19): 11940–11941. DOI:10.3969/j.issn.0517-6611.2011.19.222 |
| [7] | Guiso M, Marra C, Farina A. A new efficient resveratrol synthesis[J]. Tetrahedron Lett, 2002, 43 (4): 597–598. DOI:10.1016/S0040-4039(01)02227-4 |
| [8] | Solladie G. A reinvestigation of resveratrol synthesis by Perkins reaction[J]. Tetrahedron, 2003, 59 (18): 3315–3321. DOI:10.1016/S0040-4020(03)00405-8 |
| [9] | Alonso E, Ramon DJ, Yus M. Simple synthesis of 5-substituted resorcinols:A revisited family of interesting bioactive molecules[J]. J Org Chem, 1997, 62 (2): 417–421. DOI:10.1021/jo9610624 |
| [10] | 田天丽. 微生物发酵转化虎杖的研究[D]. 成都: 四川大学, 2007. http://cdmd.cnki.com.cn/article/cdmd-10610-2008027846.htm |
| [11] | 黄志芳, 易进海, 刘倩伶, 等. 酶解法提取纯化虎杖提取物中白藜芦醇的工艺研究[J]. 天然产物研究与开发, 2009, 21(5): 1061–1064. |
| [12] | 任建伟. β-葡萄糖苷酶高产菌株选育及发酵条件优化[D]. 杭州: 浙江大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10335-1016273051.htm |
| [13] | 李大力. 一种产β-葡萄糖苷酶的微生物的筛选方法[P]. 中国专利: 105543334A, 2016-05-04. |
| [14] | Jungong CS, Novikov AV. Practical preparation of resveratrol 3-O-β-D-glucuronide[J]. Synthetic Communications, 2012, 42 (24): 3589–3597. DOI:10.1080/00397911.2011.585733 |
| [15] | 朱屹东. 代谢工程改造大肠杆菌生产白藜芦醇[D]. 无锡: 江南大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10295-1016265340.htm |
| [16] | 许南儿, 罗榴彬, 梅建凤, 等. 生物转化法提高虎杖中白藜芦醇的含量[J]. 药物生物技术, 2012(05): 411–413. |
| [17] | 袁润蕾, 徐萌萌, 孙艳娟, 等. 微生物转化虎杖苷粗提物生成白藜芦醇的研究[J]. 时珍国医国药, 2008(03): 712–714. DOI:10.3969/j.issn.1008-0805.2008.03.103 |
| [18] | 孙萍, 郭丽琼, 黄佳俊, 等. 酿酒酵母工程菌生物合成白藜芦醇[J]. 中国食品学报, 2016(03): 68–74. |
| [19] | Beekwilder J, Wolswinkel R, Jonker H, et al. Production of resveratrol in recombinatmicroorganisms[J]. Applied and Environmental Microbiology, 2006, 72 (8): 5670–5672. DOI:10.1128/AEM.00609-06 |
| [20] | Becker JVW, Armstrong GO, Van der Merwe MJ, et al. Metabolic engineering of Saccharomyces cerevisiae for the synthesis of the wine-related antioxidant resveratrol[J]. FEMS Yeast Research, 2003, 4 (1): 79–85. DOI:10.1016/S1567-1356(03)00157-0 |
| [21] | Zhang YS, Li SZ, Li J, et al. Using unnatural protein fusions to engineer resveratrol biosynthesis in yeast and mammalian cells[J]. Journal of the American Chemical Society, 2006, 128 (40): 13030–13031. DOI:10.1021/ja0622094 |
| [22] | Watts KT, Lee PC, Schmidt-Dannert C. Biosynthesis of plant-specific stilbene polyketides in metabolically engineered Escherichia coli[J]. BMC Biotechnology, 2006, 6 : 12. DOI:10.1186/1472-6750-6-12 |
| [23] | Katsuyama Y, Funa N, Miyahisa I, et al. Synthesis of unnatural fla-vonoids and stilbenes by exploiting the plant biosynthetic pathway in Escherichia coli[J]. Chemistry & Biology, 2007, 14 (6): 613–321. |
| [24] | Lim CG, Fowler ZL, Hueller T, et al. High-yield resveratrol production in engineered Escherichia coli[J]. Applied and Environmental Microbiology, 2011, 77 (10): 3451–3460. DOI:10.1128/AEM.02186-10 |




