2. 漳州卫生职业学院,漳州 363000;
3. 福建农林大学,福州 350000
2. Zhangzhou Health Vocational College, Zhangzhou 363000;
3. Fujian Agriculture and Forestry University, Fuzhou 350000
根际(Rhizosphere)是指植物根系周围受到根系分泌物影响的狭小土壤区域,理化特性以及生物学活性明显不同于原土体[1]。它是植物与外界进行能量与物质交换的主要场所,在该区域拥有种类众多的微生物,该区域微生物所形成的环境对植物生长有着至关重要的作用。根际微生物(Rhizosphere microbe)是指栖于植物根系直接影响的土壤范围内生长繁殖的微生物。在该范围内的微生物通常由细菌、真菌、放线菌、藻类和原生动物等构成[2]。植物根际微生物中包括有益微生物、中性微生物及有害微生物3类。而植物根际促生菌(Plant growth promoting rhizobacteria,PGPR)则是指可促进植物生长及其对矿质营养吸收和利用,而对有害微生物有较强颉颃的一类附生于植物根系或者栖于周围土壤的有益菌[3]。研究证明,植物根际促生菌能多个方面来影响植物,如种子的萌发[4],植物的生长、产量、营养吸收等。一方面,提高植物的养分吸收利用,如部分植物根际促生菌能够促进豆科植物的生物固氮作用,为共生植物提供磷、硫、铁、铜等养分;另一方面,植物根际促生菌通过产生植物类激素,如生长素,以促进植物的生长发育。此外,植物根际促生菌通过促进根际有益菌的生长,抑制植物根际有害微生物的生长,从而保持植物的健康。
目前关于植物根际促生菌在作物方面的研究报道已经较多,但是在药用植物中关于根际促生菌的研究仍相对较少。药用植物是中药体系中最重要的药物来源,是人类赖以防病治病的天然宝库。故本文就国内外近年来就药用植物根际促生菌的研究进展进行总结,旨在为药用植物的研究奠定理论基础,为根据促生菌应用于药用植物的栽培、生产及种质创新提供新思路。
1 根际促生菌植物根际促生菌根据定殖于根际的位置,可分为胞内根际促生菌(Intracellular PGPR,iPGPR)和胞外根际促生菌(Extracellular PGPR,ePGPR);根际促生菌促进植物生长的机理可分为直接方式和间接方式。直接方式表现为根际促生菌促进植物对养分的转化吸收,产生相应的激素类物质,产生铁载体;间接方式表现为抑制病原菌生长。在过去的几年里,已被鉴定出的植物促生菌的数量呈增长趋势。有相当数量的根际微生物已被证实对植物生长有显著的促进作用,报道显示,细菌中的固氮螺菌(Azospirillum)能促进小麦(Triticum aestivum)和玉米(Zea mays)的生长;根瘤菌(Rhizobium)能促进油菜(Brassica campestris)和莴苣(Lactuca sativa的生长;芽孢杆菌(Bacillus)和产碱杆菌(P. alcaligenes)能提高玉米对氮、磷和钾的吸收;假单胞菌(Pseudomonas)能够促进番茄(Lycopersicon esculentum)的生长,具有抑制植物病原菌和促进植物生长的作用;固氮菌(Azotobacter)能刺激鹰嘴豆(Cicer arietinum)的生长和增加产量等等[5-9]。
2 药用植物根际促生菌促生机理研究 2.1 药用植物根际促生菌在固氮方面研究氮是植物生长过程中相当重要的生命元素。有些植物根际促生菌能够将空气中的分子氮转化为有机氮,为植物生长提供氮元素,对改善植物的氮素营养起到相当重要的作用。生物固氮主要包括以下3大类:自生固氮、共生固氮和联合共生固氮。已经发现具有固氮作用的植物根际促生菌有固氮菌、根瘤菌、固氮螺旋菌、假单胞菌及克雷伯氏菌(Klebsiella sp.)等[10-11]。同时,氨化细菌(Ammonifier)能够将土壤中的有机物分解产物最终转变为NH4+,土壤中的氨或铵盐必需在硝化细菌(Nitrifier)跟亚硝化细菌(Nitrite bacteria)共同作用下才能转变为硝酸盐,从而增加植物可利用的氮素营养。
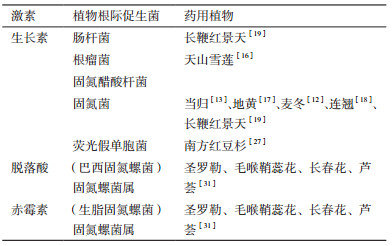
李琼芳[12]研究麦冬[Ophiopogon japonicus(Linn.f.)Ker-Gawl.]根际微生物发现麦冬根际有纤维素分解菌(Cellulose decomposingbacteria)、氨化细菌、硝化细菌和固氮菌。江曙等[13]在当归[Angelica sinensis(Oliv.)Diels]根际微生物种群结构方面的研究中发现其根际有固氮菌和硝化细菌。前人在丹参(Salvia miltiorrhiza Bunge)的根际微生物中发现氨化细菌、亚硝化细菌、好氧固氮菌、厌氧固氮菌和假单胞菌等[14-15]。张国华等[16]在天山雪莲(Saussurea involucrata)根际微生物中发现存在假单胞菌和根瘤菌。陈慧等[17]在地黄(Rehmannia)根际微生物中也发现氨化细菌和固氮菌等。硝化细菌、氨化细菌和固氮菌在也存在连翘[Forsythia suspensa(Thunb.)Vah]根际微生物中[18]。张新军等[19]发现长鞭红景天(Rhodiola fastigiata)根际有假单胞菌和固氮菌等(表 1)。
磷是植物生长发育过程中另一个重要营养素。通常,在土壤中磷的含量相当高,但大部分磷是以不溶的形式存在,因此不能满足植物的生长需要。这些不溶的磷以磷灰石的无机态形式或者以肌醇磷酸盐、磷酸三脂一些有机态存在[24]。而植物根际促生菌可以通过释放有机酸或分泌胞外磷酸酶,溶解土壤中不溶性磷,从而使磷被有效的吸收和利用。在植物根围普遍存在着能溶磷和解磷的细菌,包括圆褐固氮菌(Azotobacter chroococcum)、芽孢杆菌、肠杆菌(Enterobacter)、假单胞菌、根瘤菌、曲霉菌(Aspergillus)和青霉菌(Penicillium)等[25-26]。
林贵兵等[14]在关于丹参(Salvia miltiorrhiza Bunge)栽培对土壤生物区系组成特征的影响研究中发其根际中有机磷分解菌、无机磷分解菌、硫化细菌(Thiobacillus)等微生物的存在。任嘉红等[27]从南方红豆杉(Taxus chinensis var.mairei)根际分离获得4株高效溶无机磷菌株,分别为蜡状芽胞杆菌(B. cereus)、地衣芽胞杆菌(B.licheniformis)、荧光假单胞菌(P. fluorescent)和草木樨中华根瘤菌(S. meliloti),这4株菌是溶磷细菌中较具应用潜力的菌种。张新军等[19]在对长鞭红景天的研究中发现其根际有芽孢杆菌、肠杆菌和青霉属。陆瑞霞等[28]从地八角(Astragalus bhotanensis Baker)的根际中发现具有溶磷能力的菌株,初步鉴定为肠杆菌(表 2)。
植物激素是接受特定环境信号诱导产生的,被从一个合成部位运送到另一个作用部位,并且在极低浓度下有明显的生理效应有机化合物。植物激素能够促进植物的生长发育以及对植物体开花、结实、休眠等其他生命活动进行相互协调地调控。许多研究表明,植物促生细菌可以通过自身代谢产生植物激素如植物生长素(Indole-3-acetic acid,IAA)、赤霉素(Gibberellins,GA3)、细胞分裂素(Cytokinin,CTK)、脱落酸(Abscisic acid,ABA)、乙烯(Ethylene)等[29]。例如,肠杆菌、根瘤菌、固氮醋酸杆菌(Acetobacter diazotrophicus)能产生植物生长素;巴西固氮螺菌(Azospirillum brasilence)能产生脱落酸和生长素;生脂固氮螺菌(Azospirillum lipoferum)能产生赤霉素。Kuklinsky等[30]证明80%的固氮菌和荧光假单胞菌能产生生长素。
研究证明,在当归[13]、地黄[17]、麦冬[12]、连翘[18]和长鞭红景天[19]的根际菌中含有固氮菌、在天山雪莲[16]根际发现根瘤菌;在南方红豆杉中[27]发现荧光假单胞菌;在长鞭红景天[19]根际中还发现肠杆菌。在4种印度药用植物圣罗勒(Ocimum sanctum L.)、毛喉鞘蕊花(Coleus forskholii Briq)、长春花[Catharanthus roseus(L.)G. Don.]、芦荟(Aloe vera)的根际也发现了固氮螺菌属[31]。这些菌都是能产生相应的激素(表 3)。
在生物防治方面,根际促生菌常有直接和间接两种方式来产生效果。直接的方式有产生抗生素、水解酶等,间接方式是通过产生特定物质增强竞争[32]。部分植物根际促生菌能产生抗真菌的抗生素。例如,荧光假单胞菌能够产生抑制致病的真菌生长的2,4-二乙酰基间苯三酚(2,4-Diacetylphloroglucinol,2,4-DAPG)、氰化氢(HCN)和藤黄绿脓素(Pyoluteorin)等[33]。木霉菌(Trichoderma)能通过抗真菌的物质来达到抑制植物病原真菌的生长[34]。部分植物根际促生菌能够产生裂解真菌细胞的酶。例如,部分镰刀菌(Fusarium)是植物致病菌[35],而假单胞菌能产生溶解腐皮镰刀菌菌丝的胞外的几丁质酶和昆布多糖酶。
潘争艳等[36]研究发现,五味子[Schisandra chinensis(Turcz.)Baill.]、穿山龙(Dioscorea nipponica Makino)、龙胆草(Gentiana scabra Bunge)、平贝母(Fritillaria ussuriensis Maxim.)、苍术[Atractylodes lancea(Thunb.)DC.]、威灵仙(Clematis chinensis Osbeck)和百合(Lilium brownii var. viridulum)的根际有曲霉菌和木霉菌。相关的研究也证实了,在三七[Panax notoginseng(Burk.)F.H.Chen][37]、瑞香(Daphne odora Thunb)[38]和人参(Panax ginseng C.A. Mey.)[39]的根际也有曲霉菌和木霉菌存在。马成涛[40]在对地黄的研究中发现,黄绿木霉(T. aureoviride),绿色木霉(T. viride),拟康氏木霉(T. pseudokoningii),哈茨木霉(T. harzinum)4种有益真菌主要通过竞争作用来抑制病原菌的生长。
相关报道显示,植物根际促生菌抑制病原菌的生长是通过产生的高亲和铁的螯合体产物铁载体与植物根际病原微生物争夺铁营养,进而达到抑制病原微生物生长繁殖目的的方式[41]。铁是植物生长不可或缺的元素,由于铁是以溶解度极低的氧化物形式存在,不易被植物吸收利用。而铁载体是微生物产生的一种可以结合铁离子的化合物,其主要基团是异羟肟酸的衍生物,它与Fe3+结合力非常强。进而溶解Fe3+并将铁转运入细胞,以供给植物细胞利用。铁载体的合成受蛋白质、调控因子GacS和GacA、转录因子RpoS、PvdS和FpvI、群体感应诱导物(如N-酰基高丝氨酸内酯)和位点特异重组酶类等的严格调控[42-43]。同时很多的环境因素也可以调控铁载体的合成,包括pH、铁的水平、铁离子存在的形式、其他微量元素的存在以及充足的碳、氮、磷的供应[44]。植物根际促生菌在特定的条件下能产生一定量铁载体。因此,植物根际促生菌与产生铁载体较少或甚至是不能产生铁载体的有害微生物竞争铁素时就处于有利的地位,使得有害微生物获取不到所需的铁素而受抑制,进而达到改善植物的营养的作用[45]。
王英丽等[46]研究发现链霉菌(Streptomyces)、假单胞菌、青霉菌和芽孢杆菌等也可以产生铁载体。苜蓿中华根瘤菌也能产生铁载体[47]。部分荧光假单胞杆菌可抑制一些植物病原真菌的生长与繁殖。国内外研究证实假单胞菌产生的铁载体,不被本属以外的其他微生物利用[48],在防治土传真菌病害方面发挥着重要作用。研究人员证实,在人参根际中发现青霉菌、链霉菌和芽孢杆菌[39],在五味子、三七、牡丹(Paeonia suffruticosa Andr.)、瑞香的根际中分离到青霉菌[49],在药菊根际也发现了解淀粉芽孢杆菌,能有效的抑制药菌的枯萎病病原菌的生长[50]。
3 展望我国地域辽阔,地形地貌多种多样,气候多样,拥有着丰富的药用植物资源,对药用植物的研究亦有悠久的历史,这为我们对药用植物根际促生菌开展研究工作奠定了良好的基础。植物根际促生菌具有促进药用植物对氮、磷等元素的吸收,促进药用植株的生长,增强药用植物对环境的适应能力,有利于药用植物有效成分的含量的提高。研究药用植物及其根际促生菌之间的相互作用,不仅为药用植物的研究奠定理论基础,而且为应用于药用植物种质创新提供新思路。
然而,国内外对植物根际促生菌的研究更多是集中于在对农作物根际促生菌的研究,对药用植物根际促生菌的研究报道较少。同时,目前药用植物根际促生菌对药用植物的作用研究所采用的方法技术还较为单一,尚有较大可开展的空间,故可以借鉴农作物根际促生菌的研究理论来开展药用植物根际促生菌的研究手段,进而加快药用植物根际促生菌的研究。因此,关于药用植物PGPR下一步的研究工作可以从以下几个方面开展:(1)利用16S rDNA结合宏基因组的研究方法,研究药用植物根际促生菌的多样性,结合现有的研究预测微生物的功能;(2)利用微生物纯培养的方法分离药用植物的根际分离培养微生物,通过回接实验进一步研究微生物对药用植物生长发育以及药效物质累积的影响;(3)通过组合不同的根际促生菌以开发出适合于特定药用植物的菌肥,保证药用植物的养分吸收,抵抗土传病害,促进药用植物的生长。总之,充分利用好植物的根际促生菌能够达到减少肥料施用,较少农药施用,促进药用植物生长发育,为发展药用植物供新思路、新方法。
| [1] | 张蕾, 徐慧敏, 朱宝利. 根际微生物与植物再植病的发生发展关系[J]. 微生物学报, 2016, 56(8): 1234–1241. |
| [2] | 郝大程, 陈士林, 肖培根. 基于分子生物学和基因组学的植物根际微生物研究[J]. 微生物通报, 2009, 36(6): 892–899. |
| [3] | 李琬, 刘淼, 张必弦, 等. 植物根际促生菌的研究进展及其应用现状[J]. 中国农学通报, 2014, 30(24): 1–5. DOI:10.11924/j.issn.1000-6850.2013-3360 |
| [4] | Pavlova AS, Leontieva MR, Smirnova TA, et al. Colonization strategy of the endophytic plant growth-promoting strains of Pseudomonas fluorescens and Klebsiella oxytoca on the seeds, seedlings and roots of the epiphytic orchid, Dendrobium nobile Lindl[J]. Journal of Applied Microbiolgy, 2017, 123 (1): 217–232. DOI:10.1111/jam.2017.123.issue-1 |
| [5] | Berg G. Plant-microbe interactions promoting plant growth and health:perspectives for controlled use of microorganisms in agriculture[J]. Appl Microbiol Biotechnol, 2009, 84 (1): 11–18. DOI:10.1007/s00253-009-2092-7 |
| [6] | 秦嗣军, 吕德国, 李志霞, 等. 东北山樱根际细菌群落结构多样性分析[J]. 吉林农业大学学报, 2011, 33(6): 643–648. |
| [7] | 周文杰, 吕德国, 杨丹丹, 等. 根际优势细菌对甜樱桃幼树光合及根系活力的影响[J]. 吉林农业大学学报, 2015, 37(5): 555–561, 567. |
| [8] | Ibiene AA, Agogbua JU, Okonko IO, et al. Plant growth promoting rhizobacteria as biofertilizer:effect on growth of lycopersicum esculentus[J]. Journal of American Science, 2012, 8 (2): 318–324. |
| [9] | Jorquera MA, Crowley DE, Marschner P, et al. Identification of beta-propeller phytase-encoding genes in culturable Paenibacillus and Bacillus spp. from the rhizosphere of pasture plants on volcanic soils[J]. Fems Microbiology Ecology, 2011, 75 (1): 163–172. DOI:10.1111/fem.2010.75.issue-1 |
| [10] | 张秋磊, 林敏, 平淑珍. 生物固氮及在可持续农业中的应用[J]. 生物技术通报, 2008(2): 1–4. |
| [11] | Hayat R, Ali S, Amara U, et al. Soil beneficial bacteria and their role in plant growth promotion:a review[J]. Annal of Microbiology, 2010, 60 (4): 579–598. DOI:10.1007/s13213-010-0117-1 |
| [12] | 李琼芳. 不同连作年限麦冬根际微生物区系动态研究[J]. 土壤通报, 2006, 37(3): 563–565. |
| [13] | 江曙, 段金廒, 严辉, 等. 当归根际微生物种群结构与生态分布的研究[J]. 中国中药杂志, 2009, 34(12): 1483–1488. |
| [14] | 林贵兵, 万德光, 王瑞婷, 等. 丹参栽培对土壤微生物区系组成特征的影响[J]. 华西药学杂志, 2010, 25(4): 438–443. |
| [15] | 陈章. 中江丹参连作土壤微生物特性研究[D]. 成都: 四川农业大学, 2010. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-TRXH201010001049.htm |
| [16] | 张国华, 罗会颖, 丁建南, 等. 新疆天山雪莲根际冻土微生物富集培养的初步研究[J]. 江西科学, 2010, 28(4): 453–460. |
| [17] | 陈慧, 郝慧荣, 熊君, 等. 地黄连作对根际微生物区系及土壤酶活性的影响[J]. 应用生态学报, 2007, 18(12): 2755–2759. |
| [18] | 魏志华, 程茂高, 介晓磊, 等. 连翘根际微生物区系和土壤酶活性变化的研究[J]. 北方园艺, 2010(6): 12–14. |
| [19] | 张新军, 郑维列, 兰小中, 等. 色季拉山长鞭红景天根际微生物初步研究[J]. 中国农学通报, 2011, 27(28): 172–177. |
| [20] | Dos Santos PC, Fang Z, Mason SW, et al. Distribution ofnitrogen fixation and nitrogenase-like sequences amongstmicrobial genomes[J]. BMCGenomics, 2012, 13 : 162. |
| [21] | 王彩红. 假单胞菌lip35低温脂肪酶基因的克隆及其在毕赤酵母中的表达研究[D]. 保定: 河北农业大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-11920-2008074533.htm |
| [22] | 李赛男, 李慷, 王姝芸, 等. 假单胞菌M18中藤黄绿菌素合成限速酶基因的鉴定及表达优化[J]. 微生物学通报, 2012, 39(3): 300–308. |
| [23] | 郑斐, 黄显清, 许煜泉, 等. 假单胞菌M18调控基因ppbR的克隆及功能研究[J]. 微生物学通报, 2008, 35(2): 235–240. |
| [24] | 张智慧, 赵振玲, 金航, 等. 根际促生菌研究进展及其在药用植物上的应用[J]. 云南中医学院学报, 2012, 35(6): 63–67. |
| [25] | Bhattacharyya PN, Jha DK. Plant growth promoting rhizobacteria(PGPR):emergence in agriculture[J]. World Microbiol Biotechnol, 2012, 28 (4): 1327–1350. DOI:10.1007/s11274-011-0979-9 |
| [26] | 马骢毓, 张英, 马文彬, 等. 黄芪根际促生菌(PGPR)筛选与特性研究[J]. 草业学报, 2017, 26(1): 149–159. DOI:10.11686/cyxb2016263 |
| [27] | 任嘉红, 刘辉, 吴晓蕙, 等. 南方红豆杉根际溶无机磷细菌的筛选、鉴定及其促生效果[J]. 微生物学报, 2012, 52(3): 295–303. |
| [28] | 陆瑞霞, 王小利, 李显刚, 等. 地八角溶磷菌溶磷能力及菌株特性研究[J]. 中国草地学报, 2012, 34(4): 101–108. |
| [29] | 李晓倩. 茶树根际促生细菌研究展望[J]. 山东农业大学学报:自然科学版, 2009, 40(2): 301–303. |
| [30] | Kuklinsky SJ, Araujo WL, Mendes R, et al. Isolation and characterization of soybean-associated bacteria and their potential for plant growth promotion[J]. Environmental Microbiology, 2004, 6 (12): 1244–1251. DOI:10.1111/emi.2004.6.issue-12 |
| [31] | Karthikeyan B, Jaleel CA, Lakshmanan GM, et al. Studies on rhizosphere microbial diversity of some commercially important medicinal plants[J]. Colloids Surf B Biointerfaces, 2008, 62 (1): 143–145. DOI:10.1016/j.colsurfb.2007.09.004 |
| [32] | E Y, Yuan J, Yang F, et al. PGPR strain Paenibacillus polymyxa SQR-21 potentially benefits watermelon growth by re-shaping root protein expression[J]. AMB Express, 2017, 7 (1): 104. DOI:10.1186/s13568-017-0403-4 |
| [33] | 江曙, 段金廒, 钱大玮, 等. 根际微生物对药材道地性的影响[J]. 土壤, 2009, 41(3): 344–349. |
| [34] | 肖春萍, 杨利民, 韩梅, 等. 人参主要病原菌生防真菌的筛选及鉴定[J]. 西北农林科技大学学报:自然科学版, 2016, 44(7): 181–201. |
| [35] | 谭勇, 崔尹赡, 季秀玲, 等. 三七连作的根际、根内微生物变化与生态学研究进展[J]. 中草药, 2017, 48(2): 391–399. DOI:10.7501/j.issn.0253-2670.2017.02.029 |
| [36] | 潘争艳, 傅俊范, 周如军, 等. 辽宁省14种药用植物根际土壤真菌种类及数量分析[J]. 沈阳农业大学学报, 2009, 40(4): 481–484. |
| [37] | 官会林, 陈昱君, 刘士清, 等. 三七种植土壤微生物类群动态与根腐病的关系[J]. 西南农业大学学报, 2006, 28(5): 706–709. |
| [38] | 杨航宇, 芦维忠, 袁君辉, 等. 甘肃瑞香根际真菌与内生真菌多样性的研究[J]. 西北农业学报, 2006, 15(2): 78–80. |
| [39] | 陈曦, 孙晓东, 毕思远, 等. 东北地区人参根际土壤真菌多样性研究[J]. 安徽农业科学, 2010, 38(10): 5515–5517. DOI:10.3969/j.issn.0517-6611.2010.10.088 |
| [40] | 马成涛. 地黄病原性连作障碍有益微生物防治技术研究[D]. 济南: 山东师范大学, 2009. http://cdmd.cnki.com.cn/article/cdmd-10445-2009125965.htm |
| [41] | 周文杰, 吕德国, 秦嗣军. 植物与根际微生物相互作用关系研究进展[J]. 吉林农业大学学报, 2016, 38(3): 253–260. |
| [42] | Cornelis P, Matthijs S. Diversity of siderophore-mediated iron uptake systems in fluorescent pseudomonads:not only pyoverdi-nes[J]. Environment Microbiology, 2002, 4 (12): 787–798. DOI:10.1046/j.1462-2920.2002.00369.x |
| [43] | Ravel J, Cornelis P. Genomics of pyoverdine-mediated iron uptake in pseudomonads[J]. Trends Microbiology, 2003, 11 (5): 195–200. DOI:10.1016/S0966-842X(03)00076-3 |
| [44] | 王英丽, 林庆祺, 李宇, 等. 产铁载体根际菌在植物修复重金属污染土壤中的应用潜力[J]. 应用生态学报, 2013, 24(7): 2081–2088. |
| [45] | 邓振山, 李军, 苏永杰. 植物根际促生菌作用机理的研究进展[J]. 安徽农业科学, 2011, 39(10): 5844–5864. DOI:10.3969/j.issn.0517-6611.2011.10.069 |
| [46] | 王英丽, 林庆祺, 李宇, 等. 产铁载体根际菌在植物修复重金属污染土壤中的应用潜力[J]. 应用生态学报, 2013, 24(7): 2081–2088. |
| [47] | 田方, 丁延芹, 朱辉, 等. 烟草根际铁载体产生菌G-229-21T的筛选、鉴定及拮抗机理[J]. 微生物学报, 2008, 48(5): 631–636. |
| [48] | 朱慧明, 张彦, 杨洪江. 高产铁载体假单胞菌的筛选及其对铁氧化物的利用[J]. 生物技术通报, 2015, 30(7): 177–182. |
| [49] | 杨娜, 沈其荣, 徐阳春. 一株抗药用白菊枯萎病生防菌的分离与生防效应研究[J]. 植物营养与肥料学报, 2011, 17(3): 731–736. DOI:10.11674/zwyf.2011.0436 |
| [50] | 潘争艳, 傅俊范, 周如军, 等. 五味子园根际真菌多样性初探及拮抗菌株筛选[J]. 吉林农业大学学报, 2007, 29(6): 636–639. |