2. 宁波中瑞生物科技有限公司,宁波 315821
2. Ningbo Zhongrui Biotechnology Co., Ltd. Ningbo 315821
抗生素为人类作出了巨大的贡献,但由于抗生素滥用,也让人们越来越意识到抗生素的危害性。从瑞典1986年在养殖行业首次禁抗,到2006年欧盟全面禁止使用促生长抗生素,再到2015年我国要求停止生产用于食品动物的部分抗生素制剂。这些都表明无抗养殖已经成为今后的发展趋势,开发新型无抗饲料添加剂,对于国家及企业,都有迫切的需求[1]。
益生菌是指能够以一定数量存活并定殖于宿主肠道内,通过调节肠道菌群平衡,对宿主健康发挥有益作用的活性有益微生物的总称[2]。其主要通过与动物消化道内各种微生相互作用,来改善微生物和酶的平衡,从而改善动物肠道菌群结构、抑制有害菌和提高免疫力[3]。研究表明,某些乳酸菌能产生细菌素[4-8],芽孢杆菌能产生抗菌肽或者是抗菌蛋白[9, 10]等。目前国内外针对可抑制致病菌的益生菌的筛选,也主要集中在乳酸菌和芽孢杆菌上。例如,有关研究筛选到可抑制致病菌的干酪乳杆菌[6]、植物乳杆菌[8]等乳酸菌,以及可抑制致病菌的淀粉液化芽孢杆菌[11]、侧孢短芽孢杆菌[12]等芽孢杆菌。
基于畜禽生态平衡理论推出的新型无抗微生物饲料添加剂,是近年来开发主要方向。目前已有益生菌作为饲料添加剂的相关研究[13-14]。但益生菌饲料添加剂的作用机理尚未研究透彻,优良菌种缺乏,可用于微生态制剂的菌种较少,同时相关产品较为单一,复合菌剂的开发成为重点[15]。因此,筛选优良益生菌,探索其中机理,完善配套应用技术等方面急需深入研究[16]。本实验主要通过从土壤、饲料添加剂和肥料添加剂样品中分离到有抑菌效果的菌株。通过牛津杯法和实验室保存的大量菌株,同时进行抑菌活力的测定,从而筛选到多种能够明显抑制致病菌的菌株,再通过试验初步确定抑菌物质的类型,为进一步开发研制无抗饲料添加剂等微生物制剂提供了基础。
1 材料与方法 1.1 材料 1.1.1 样品和待测菌种样品为土壤、肥料添加剂和饲料添加剂。菌种为本实验室分离保存的4株产酸菌株,分别为保加利亚乳杆菌(Lactobacillus bulgaricus)、干酪乳杆菌(Lactobacillus casei)、鼠李糖乳杆菌(Lactobacillus rhamnosus)和植物乳杆菌(Lactobacillus plantarum)以及23株未知菌株。实验室保存的菌株源自市售酸奶发酵剂、益生菌药品和保健品,以及市售可食用发酵制剂。
1.1.2 主要仪器TC-5000 PCR仪:英国TECHEN;DYY-6C型电泳仪:北京市六一仪器厂,Kylin-Bell VORTEX-5:江苏省海门市其林贝尔仪器制造有限公司,牛津杯规格:内径(6.0±0.1)mm、外径(8.0±0.1)mm,高(10.0±0.1)mm。培养皿规格:内径(90.0±0.1)mm,高(16.5±0.1)mm(上海仪翀科技发展有限公司)。
1.1.3 指示菌大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)和藤黄微球菌(Micrococcus luteus)都为本实验室保存。
1.1.4 主要培养基LB培养基、营养肉汤培养基(NB)、MRS固体培养基和MRS液体培养基。
1.2 方法 1.2.1 菌株的初筛采用涂布平板法[17]:精确称取10 g样品,放入90 mL含有玻璃珠的0.85%的生理盐水中,37℃、180 r/min震荡30 min,80℃水浴10 min。然后将样品进行10倍系列的梯度稀释,分别吸取稀释倍数为10-4、10-5、10-6、10-7的样品100 μL,涂布于LB平板上,37℃培养24 h。挑取能产生抑菌圈的菌落,分离纯化,编号保存。不经水浴加热,同样采取涂布平板法将样品涂布于含1%CaCO3的MRS平板上,挑取有溶钙圈的菌株,分离纯化,编号保存[18]。
1.2.2 牛津杯法复筛[19]检测平板的制备:用接种环挑取在LB平板上生长24 h的指示菌,接到含有生理盐水的无菌试管中,用旋涡震荡器震荡均匀,进行不同倍数的梯度稀释,再震荡均匀,测定OD600值后备用。分别吸取800 μL、OD600为1.6的3种指示菌菌悬液于无菌平板中,然后将灭菌的LB培养基冷却至50-60℃,精确量取20 mL,迅速倒入加过指示菌悬液的平板中,轻轻摇匀,冷却备用。
发酵上清液的制备:LB培养基初筛得到的菌株在LB平板上37℃培养24 h,接种在肉汤培养基中,37℃、180 r/min摇床培养24 h,再以4%的接种量转接在肉汤培养基中,37℃、180 r/min摇床培养24 h。取样,在4℃,8 000 r/min,离心5 min,取上清,用孔径为0.22 μm的水系针头滤器过滤到无菌离心管中备用。以同样的方法和条件将产酸菌株在MRS固、液体培养基上培养后制备发酵上清液。
抑菌活力的测定:对初筛的菌株进行复筛:分别吸取初筛得到的菌株和实验室保存的菌株的发酵上清液200 μL,加入对应编号的3种检测平板的牛津杯中,37℃培养24 h,每个试验做3个平行,拍照并测量抑菌圈直径,直径取3个平行的平均值。
1.2.3 菌株的形态观察及16S rRNA序列分析对复筛得到的菌落形态特征进行观察,革兰氏染色,芽孢染色并镜检。分别对各个未知菌株的基因组进行提取、PCR扩增、产物回收和送样测序。测序序列结果在NCBI数据库中用Blast软件搜索近似序列,将所测得的序列和从GenBank中获得的相关种属的16S rRNA基因序列。运用Mega6.0软件构建系统发育树,用邻接法(Neighbor-joining)进行发育树分析。
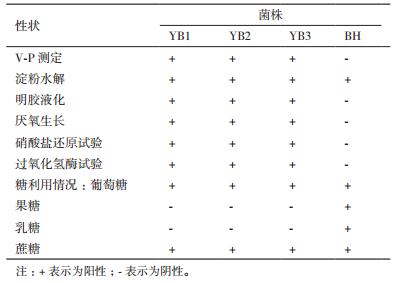
1.2.4 生理生化特征鉴定对复筛得到的未知菌株的生理生化特征进行鉴定[20-21],主要进行了V-P测定、淀粉水解、明胶液化、厌氧生长、硝酸盐还原、过氧化氢酶反应,糖利用情况等试验。
1.2.5 抑菌物质的初步确定为了确定复筛菌株发酵上清液中抑菌物质的性质,进行了如下4种不同的试验。
酸碱作用的验证:测量发酵上清液的pH,并用3 mol/L的NaOH或3 mol/L的HCl调节pH变化较大的发酵上清液,调至与发酵前一致(发酵前NB培养基pH为7.2,MRS液体培养基pH为6.4),分别吸取调过pH的发酵上清液和不调pH的发酵上清液,进行抑菌活力测定。
高温处理:将发酵上清液经115℃、30 min高温处理和不经高温处理,分别进行抑菌活力测定。
蛋白酶处理:将一定浓度的蛋白酶k和胃蛋白酶溶液分别加入发酵上清液,使酶的终浓度为2 mg/mL。调节加入蛋白酶k的上清液至pH为7,加入胃蛋白酶的上清液pH为3,37℃温育4 h,再调回原来的pH,进行抑菌活力的测定。
盐析处理:取10 mL发酵上清液,向其中加入硫酸铵至饱和度为65%,进行盐析。用pH为7的磷酸盐缓冲液将沉淀定容至10 mL,用3.5 kD的透析袋除盐后和磷酸盐缓冲液分别进行抑菌活力的测定。
透析处理:将10 mL发酵上清液经8-14 kD的透析袋透析处理,将透析袋内液和外液分别浓缩至1 mL,并用磷酸盐缓冲液定容至10 mL,分别进行抑菌活力的测定。
2 结果 2.1 菌种的初筛根据不同的样品,采用涂布平板法进行筛选,得到35株能产抑菌圈的菌株。其中6株来自土壤,8株来自肥料添加剂,21株来自饲料添加剂。经溶钙圈试验,其中5株是产酸菌株。
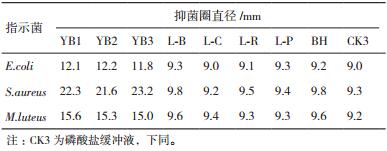
2.2 牛津杯法复筛将初筛得到的35株菌株和实验室保存的27株菌株,用牛津杯法进行抑菌活力的测定,部分抑菌效果见图 1。结果显示,其中8株菌株的发酵上清液对大肠杆菌、金黄色葡萄球菌和藤黄微球菌都有明显的抑制作用。将8株抑菌效果明显的菌株分别命名为,YB1、YB2、YB3、L-B、L-C、L-R、L-P和BH。其中BH筛选自土壤,YB1筛选自饲料添加剂,YB2和YB3筛选自肥料添加剂。L-B、L-C、L-R和L-P为本实验室保存的菌株,分别为保加利亚乳杆菌、干酪乳杆菌、鼠李糖乳杆菌和植物乳杆菌。L-B源自市售酸奶,L-C、L-R和L-P源自市售可食用发酵制剂。通过溶钙圈观察,L-B、L-C、L-R、L-P和BH为产酸菌株。
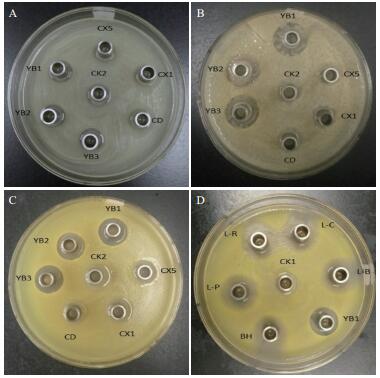
|
| 图 1 抑菌效果图 A:大肠杆菌检测平板;B:金黄色葡萄球菌检测平板;C、D:藤黄微球菌检测平板(CK1为MRS液体培养基对照,CK2为营养肉汤培养基对照下同;YB1、YB2、YB3,L-B、L-C、L-R、L-P、BH、CD、CX1和CX5为部分菌株发酵上清液,下同) |
YB1、YB2和YB3在LB培养基上培养24h,BH在MRS培养基上培养24 h,分别进行形态学观察(图 2)。YB1、YB2和YB3形态特征相似,菌落都为圆形,表面光亮,边缘有微列齿,革兰氏染色呈阳性,芽孢染色并镜检显示,菌体杆状,有芽孢且芽孢中生或侧生;BH菌落圆形,表面湿润,中间有乳白色隆起,革兰氏染色呈阳性,芽孢染色并镜检显示,菌体球状、大多数为多个聚集在一起,无芽孢。由此确定YB1、YB2和YB3为芽孢杆菌,BH为球菌。
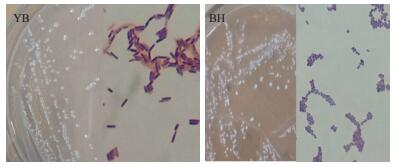
|
| 图 2 菌落和菌体形态特征图 |
将菌株YB1、YB2、YB3和BH的16S rRNA序列分别在GenBank中进行Blast序列比对,然后进行系统发育树的构建。用Neighbor-joining进行发育树分析,结果见图 3。由图 3可知,YB1、YB2、YB3和地衣芽孢杆(Bacillus licheniformis)聚在一个分支上,且同源性≥99%,和枯草芽孢杆菌(Bacillus subtilis)的同源性为97%。BH与乳酸片球菌(Pediococcus acidilactici)聚在一个分支上,且同源性为100%。综合形态学以及16S rRNA序列的分析,确定YB1、YB2和YB3为地衣芽孢杆菌或枯草芽孢杆菌,BH为乳酸片球菌。
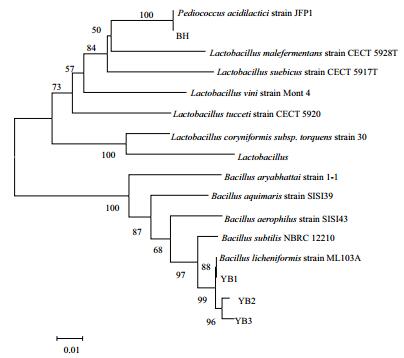
|
| 图 3 基于16S rRNA序列的菌株系统发育树 |
根据形态学特征以及16S rRNA的结果,进行有针对性的生理生化测定。4株菌的部分生理生化特征鉴定结果见表 1。由表 1可知,YB1、YB2和YB3的V-P测定,淀粉水解等生理生化特性一致。由生理生化特征可知YB1、YB2和YB3在厌氧情况下能够生长,通过《常见细菌系统鉴定手册》可知地衣芽孢杆菌能够在厌氧条件下生长,而枯草芽孢杆菌不能在厌氧条件下生长,所以可以确定YB1、YB2和YB3同为地衣芽孢杆菌。BH的生理生化特征和形态学特征以及16S rRNA结果一致,确定为乳酸片球菌。将YB1、YB2、YB3和BH序列提交至NCBI,分别获得登录号,MF326578、MF326579、MF326580和MF326581。
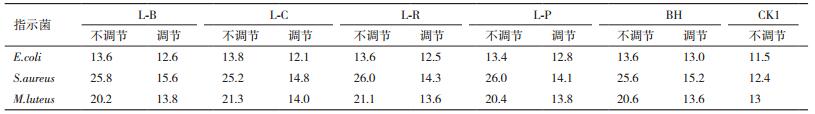
对培养液发酵前后的pH进行测定,芽孢杆菌的发酵上清液pH和发酵前比较,基本不变,在7.2左右。5株产酸菌上清液发酵前pH为6.4,发酵后明显降低,将产酸菌株的发酵上清液pH调至6.4,再做抑菌活力的测定,结果见表 2。由表 2可以看出,pH调回6.4的发酵上清液和不调pH的上清液相比,对金黄色葡萄球菌和藤黄微球菌的抑菌圈直径减少6.0-12.0 mm,对大肠杆菌的抑菌圈直径减少0.6-2.0 mm,抑菌效果明显减弱。
为了研究发酵上清液中的抑菌物质经过高温处理后是否仍然保持抑菌活性,对发酵上清液经过115℃的高温处理30 min和不经高温处理的发酵上清液作对比进行抑菌活力测定。结果(表 3)显示,发酵上清液高温处理相对于不经高温处理,3株芽孢杆菌对藤黄微球菌和金黄色葡萄球菌的抑菌圈直径减少了2.0-6.0 mm,对大肠杆菌的抑菌圈直径减少了0.5-1.0 mm。5株产酸菌株对金黄色葡萄球菌和藤黄微球菌的抑菌圈直径减少0.4-3.0 mm,对大肠杆菌的抑菌圈直径减少0.0-1.0 mm。
发酵上清液经蛋白酶k处理和胃蛋白酶处理前后,进行抑菌活力测定,抑菌圈直径大小相近。由此表明发酵上清液中产生的抑菌物质对蛋白酶K处理和胃蛋白酶不敏感。将发酵上清液经盐析处理,沉淀用磷酸盐缓冲液溶解,再透析除盐后做抑菌活力的测定,测定结果如表 4。由表 4可知,3株芽孢杆菌的盐析沉淀溶解液的抑菌圈直径大小相近。和对照相比,3株芽孢杆菌的盐析沉淀溶解液对大肠杆菌、金黄色葡萄球菌、藤黄微球菌的抑菌圈直径分别增加了2.8-3.2 mm,13.0-14 mm,5.8-6.4 mm。5株产酸菌株盐析沉淀溶解液产生的抑菌圈直径和对照大小接近。
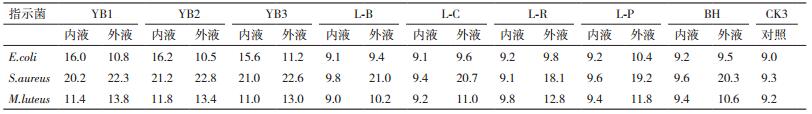
为了确定抑菌物质的大致分子量,将各个菌株的发酵上清液,经透析处理,透析袋内保留液和外液分别浓缩并用磷酸盐缓冲液定容后,进行抑菌活力的测定。测定结果见表 5,由表 5可知,3株芽孢杆菌抑菌圈直径大小相近,相对于对照,透析内液、外液都有更大的抑菌圈直径。且透析内外液对金黄色葡萄球菌的抑菌圈直径最大;藤黄微球菌的抑菌圈直径次之;大肠杆菌的抑菌圈直径最小。而5株产酸菌株的透析内液产生的抑菌圈大小和对照相近,透析外液能产生更大的抑菌圈直径,且对金黄色葡萄球菌的抑菌圈直径最大,藤黄微球菌的抑菌圈直径次之,大肠杆菌的抑菌圈直径最小。
有关研究表明,芽孢杆菌能够抑制番茄叶霉病菌等植物有害菌[22],适合做活菌制剂形式的添加剂[23];某些产酸菌株对李斯特菌,志贺氏菌属也有抑制作用[24];多种乳酸菌都能产生细菌素[4-7],细菌素是由某些细菌在代谢过程中通过核糖体合成机制产生的一类具有抑菌活性的多肽或前体多肽,能够抑制多种致病菌。
本研究筛选到8株可抑制致病菌的益生菌,其中BH筛选自土壤,YB1筛选自饲料添加剂,YB2和YB3筛选自肥料添加剂。实验室保存的保加利亚乳杆菌源自市售酸奶,干酪乳杆菌、植物乳杆菌和鼠李糖乳杆菌源自于市售的可食用发酵制剂中。地衣芽孢杆菌、保加利亚乳杆菌、干酪乳杆菌、植物乳杆菌和乳酸片球菌都是农业部规定的安全微生物,可用于养殖动物[25]。经过大量抑菌活力测定得知这8株菌抑菌活力最强,有望应用于混菌发酵开发新型无抗饲料添加剂。
经抑菌物质的分析试验可知,地衣芽孢杆菌发酵上清液中的抑菌物质非酸碱,而是产生了其它抑菌活性物质,这和已知研究地衣芽孢杆菌能产生多种抗菌活性物质[22, 26-27]相吻合;经过高温处理、蛋白酶处理和盐析处理可知,抑菌物质具有耐高温特性,对蛋白酶K和胃蛋白酶不敏感,盐析产物抑菌效果较强,由此分析抑菌物质可能是一种抗菌肽,和报道某些芽孢杆菌能产生耐高温抗菌肽[10]结果一致。经透析处理内外液都有较强的抑菌活性,可以判断有多种抑菌物质,且有些是能透过8-14 kD的小分子物质,有些是不能透过8-14 kD的大分子物质。5株产酸菌株,发酵上清液的抑菌作用主要是由于产生酸性物质引起的,调节pH后仍有部分抑菌活性,表明产酸菌株发酵上清液中的抑菌物质除了酸外,还有其它抑菌物质,这和已知研究乳酸片球菌能产生乳酸片球菌素[28]的结果相似;经高温处理,盐析处理,透析处理和蛋白酶处理可知,产酸菌株产生的抑菌物质具有耐高温性能,不产生或者产生很少量的抗菌蛋白或者多肽类物质。
4 结论本实验筛选到8株对大肠杆菌、金黄色葡萄球菌和藤黄微球菌3种致病菌均有较强抑制作用的菌株。其中3株均为地衣芽孢杆菌,5株产酸菌株分别为保加利亚乳杆菌、干酪乳杆菌、鼠李糖乳杆菌、植物乳杆菌和乳酸片球菌。其中3株地衣芽孢杆菌能产生多种耐高温的抑菌物质,该抑菌物质对蛋白酶K和胃蛋白酶不敏感,可能是多肽类物质,其包含能透过8-14 kD透析袋的小分子肽和不能透过8-14 kD透析袋的大分子肽。5株产酸菌株产生的耐高温抑菌物质主要是酸性物质。
| [1] | 张群. 饲用微生态制剂的开发与应用[J]. 食品与生物技术学报, 2016, 35(8): 896. |
| [2] | Rasić JL, Kurmann JA. Bifidobacteria and their role. Microbiological, nutritional-physiological, medical and technological aspects and bibliography[J]. Experientia Suppl, 1983, 39 : 1–295. DOI:10.1007/BF01960616 |
| [3] | Alexander Y, Le BG, Boisrame-Gastrin S, et al. Probiotics:a new way to fight bacterial pulmonary infections?[J]. Med Mal Infect, 2014, 44 (1): 9–17. DOI:10.1016/j.medmal.2013.05.001 |
| [4] | Simova ED, Beshkova DM, Angelov MP, et al. Bacteriocin production by strain Lactobacillus delbrueckii ssp. bulgaricus BB18 during continuous prefermentation of yogurt starter culture and subsequent batch coagulation of milk[J]. Journal of industrial microbiology & biotechnology, 2008, 35 (6): 559–567. |
| [5] | Milioni C, Martnez B, Degl'Innocenti S, et al. A novel bacteriocin produced by Lactobacillus plantarum LpU4 as a valuable candidate for biopreservation in artisanal raw milk cheese[J]. Dairy Science & Technology, 2015, 95 (4): 479–494. |
| [6] | Lv X, Hu P, Dang Y, et al. Purification and partial characterization of a novel bacteriocin produced by Lactobacillus casei TN-2 isolated from fermented camel milk(Shubat)of Xinjiang Uygur Autonomous region, China[J]. Food Control, 2014, 43 : 276–283. DOI:10.1016/j.foodcont.2014.03.020 |
| [7] | Srinivasan R, Kumawat DK, Kumar S, et al. Purification and characterization of a bacteriocin from Lactobacillus rhamnosus L34[J]. Annals of Microbiology, 2012, 63 (1): 387–392. |
| [8] | Lv HX, Wang W, Tan Z, et al. Isolation and Preliminary Identifica-tion of Broad-spectrum Bacteriocin-producing Lactobacillus Strain CW3[J]. Agricultural Biotechnology, 2014, 3 (1): 38–39. DOI:10.1016/j.bcab.2013.08.007 |
| [9] | Milner JL, Raffel SJ, Lethbridge BJ, et al. Culture conditions that influence accumulation of zwittermicin A by Bacillus cereus UW85[J]. Appl Microbiol Biotechnol, 1995, 43 (4): 685–691. DOI:10.1007/BF00164774 |
| [10] | 马俊美, 宁亚维, 王志新, 等. 侧孢短芽孢杆菌抗菌肽的结构与性质[J]. 食品与生物技术学报, 2016, 06: 629–634. DOI:10.3969/j.issn.1673-1689.2016.06.011 |
| [11] | 石举然, 别小妹, 吕凤霞, 等. 广谱抗菌芽孢杆菌的筛选及其抗酵母物质的纯化和鉴定[J]. 食品科学, 2017, 38(6): 6–12. DOI:10.7506/spkx1002-6630-201706002 |
| [12] | 剧建格, 于宏伟, 韩军, 等. 广谱高效抑菌物质产生菌的筛选及鉴定[J]. 微生物学通报, 2009, 36(5): 689–693. |
| [13] | Manhar AK, Bashir Y, et al. Cellulolytic potential of probiotic Bacillus Subtilis AMS6 isolated from traditional fermented soybean(Churpi):An in-vitro study with regards to application as an animal feed additive[J]. Microbiol Res, 2016, 186-187 : 62–70. DOI:10.1016/j.micres.2016.03.004 |
| [14] | Larsen N, Thorsen L, Kpikpi EN, et al. Characterization of Bacillus spp. strains for use as probiotic additives in pig feed[J]. Appl Microbiol Biotechnol, 2014, 98 (3): 1105–1118. DOI:10.1007/s00253-013-5343-6 |
| [15] | 王际辉, 刘诗文, 肖珊, 等. 现代生物技术与饲用微生态制剂[J]. 微生物学杂志, 2015, 35(2): 1–8. |
| [16] | 高林, 白子金, 冯波, 等. 微生物饲料添加剂研究与应用进展[J]. 微生物学杂志, 2014, 34(2): 1–6. |
| [17] | 诸葛健, 李华钟. 微生物学[M]. 第2版. 北京: 科学出版社, 2009. |
| [18] | 李清, 王英, 刘小莉, 等. 一株广谱抑菌活性乳酸菌的筛选及特性研究[J]. 微生物学通报, 2015(2): 332–339. |
| [19] | 刘冬梅, 李理, 杨晓泉, 等. 用牛津杯法测定益生菌的抑菌活力[J]. 食品研究与开发, 2006, 27(3): 110–111. |
| [20] | 蔡妙英, 东秀珠. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 52-66. |
| [21] | 布坎南R.E., 吉本斯N.E., 等. 伯杰细菌鉴定手册[M]. 第8版. 北京: 科学出版社, 1984. |
| [22] | 王春晓, 胡永红, 杨文革, 等. 地衣芽孢杆菌NJWGYH 833051的抑菌作用[J]. 湖北农业科学, 2016, 55(4): 904–907. |
| [23] | Wang Z, He Z, et al. Comparison of two live Bacillus species as feed additives for improving in vitro fermentation of cereal straws[J]. Anim Sci J, 2016, 87 (1): 27–36. DOI:10.1111/asj.12346 |
| [24] | Wang G, Ning J, Zhao J, et al. Partial characterisation of an anti-listeria substance produced by Pediococcus acidilactici P9[J]. International Dairy Journal, 2014, 34 (2): 275–279. DOI:10.1016/j.idairyj.2013.08.005 |
| [25] | 饲料添加剂品种目录(2013)[J]. 中国饲料, 2014, 44(1): 66-67. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=gnzb201401019&dbname=CJFD&dbcode=CJFQ |
| [26] | Kim Y, Cho JY, Kuk JH, et al. Identification and Antimicrobial Activity of Phenylacetic Acid Produced by Bacillus licheniformis Isolated from Fermented Soybean, Chungkook-Jang[J]. Current Microbiology, 2004, 48 (4): 312–317. DOI:10.1007/s00284-003-4193-3 |
| [27] | 黄浦, 肖瑜, 覃妍, 等. 地衣芽孢杆菌降解茶皂素的研究[J]. 安徽大学学报自科版, 2016, 40(1): 91–97. |
| [28] | Wang J, Li L, Zhao X, et al. Partial characteristics and antimicrobial mode of pediocin produced by Pediococcus acidilactici PA003[J]. Annals of Microbiology, 2015, 65 (3): 1753–1762. DOI:10.1007/s13213-014-1014-9 |