植物内生菌是指其生活史中某一阶段或整个阶段生活在生长在健康的植物组织或细胞内,并对宿主植物没有引起明显病害症状的一类微生物群[1-2]。内生真菌广泛存在于植物根、茎、叶、花和果实等部位[3-4]。一些植物内生菌在植物体内进行代谢会产生促进植物生长的物质,诸如生长素、赤霉素等[5]。许多资料表明植物与内生菌的共生作用会增强植株的抗逆性[6-7]。大豆作为重要的粮食作物,与人类的生产生活息息相关。有研究表明,栽培大豆在进化的过程中失去一些野大豆具有的优良属性,其中最明显的表现是失去了抗旱、抗盐、抗重金属等特性[8-10]。栽培大豆在进化过程中不仅基因发生变异,同时野大豆原本具有的内生菌在栽培大豆中也逐渐失去[11]。本研究以分离得到的野大豆内生真菌YD02为研究对象,探究其抗重金属镉胁迫和抗植物病原菌的能力,旨为其资源开发和潜在应用价值的挖掘提供一定的实验数据。
1 材料与方法 1.1 材料 1.1.1 样品采集2016年9月于辽宁省沈阳市蒲河湿地采集完野大豆整植株,将其装入灭菌的自封纸袋中,取样后于24 h内进行组织分离。
1.1.2 培养基马铃薯葡萄糖琼脂培养基(PDA):马铃薯20%、葡萄糖2%、琼脂2%,121℃灭菌30 min;马铃薯葡萄糖液体培养基(PDB):马铃薯20%、葡萄糖2%,121℃灭菌30 min;含镉培养基:在PDB中分别加入CdCl2,使培养基中Cd2+浓度分别为0、20、40、60、80、100、120、140、160、180、200 g/L;含盐培养基:在PDB中分别加入NaCl,使培养基中含钠离子浓度分别为3%、5%、7%、9%、11%、13%、15%。
1.1.3 试剂真菌基因组DNA快速抽提试剂盒、ITS序列扩增引物与其余药品及试剂均购自生工生物(上海)股份有限公司。
1.1.4供试菌株见表 1。
将供试野大豆植株根茎叶先用自来水冲洗掉表面的泥土,再用无菌水进一步冲洗,用75%乙醇浸泡1 min,无菌蒸馏水冲洗3-4次,0.1%升汞浸泡30-40 s,无菌水冲洗3-4次。用无菌刀片将根、茎和叶健康组织切成5-10 mm大小组织块,分别贴放于PDA平板上,同时将最后一遍冲洗的无菌水涂布平板作为对照,于28℃培养数天。观察对照平板有无杂菌污染,若无污染,则可将放有组织块培养平板上长出的菌落进行传代培养,直至平板内菌落形态一致,4℃斜面保存备用。
1.2.2 YD02菌株的鉴定形态学鉴定:菌丝形态观察采用直接压片法,于光镜下观察菌丝及孢子形态,菌落形态观察采用平板培养法,观察菌落正反面的形态、颜色等特征。分子生物学鉴定:用真菌基因组快速提取试剂盒提取YD02菌株的基因组DNA。以菌株YD02基因组DNA为模板,18S-ITS1:5′-TCCG-TAGGTGAACCTGCGG-3′和18S-ITS4:5′-TCCTCCG-CTTATTGATATGC-3′为引物进行PCR扩增。采用50 μL PCR反应体系,反应条件为:95℃预变性3 min;95℃变性30 s,55℃退火30 s,72℃延伸60 s,共35个循环;72℃延伸10 min;4℃保存。扩增产物由生工生物工程(上海)股份有限公司进行同源性序列分析与比对。根据测序结果构建系统发育树。
1.2.3 YD02菌株生长特性测定 1.2.3.1 菌株生长曲线的测定挑取备用菌丝至50 mL PDB培养基中,120 r/min振荡培养24 h,制备菌悬液。接种菌悬液到新的50 mL PDB培养基中(每瓶1 mL),分别在0、20、40、60、80、100、120、140、160、180和200 h取样品,每组做3个平行,以不加菌作对照。28℃,120 r/min振荡培养。将滤纸提前1 d于37℃烘干至恒重,称重,将菌丝进行抽滤并用无菌水进行冲洗后37℃烘干至恒重,计算菌丝干重。
1.2.3.2 初始pH对YD02菌株生长的影响将YD02菌液分别转接到pH为1、3、5、7、9、11、13的50 mL PDB培养基中,28℃,120 r/min振荡培养60 h,测量菌菌丝干重,每组做3个平行,以不加菌作为对照。
1.2.3.3 盐浓度对YD02菌株生长的影响将YD02菌液接种到含盐(NaCl)浓度分别为0、3、5、7、9、11、13、15的50 mL PDB培养基中,28℃,120 r/min振荡培养60 h,测量菌丝干重,每组做3个平行,以不加菌作为对照。
1.2.3.4 装液量对YD02菌株生长的影响将YD02菌液转接至含有50、75、100、150 mL PDB培养基的250 mL的三角瓶中,28℃,120 r/min振荡培养60 h,测量菌丝干重,每组做3个平行,以不加菌作为对照。
1.2.3.5 不同碳、氮源对YD02菌株生长的影响以PDB培养基为基础,分别加入2%的葡萄糖,乳糖,麦芽糖,甘露醇,蔗糖,接种YD02菌液,28℃,120 r/min培养60 h,测量菌丝干重,每组做3个平行,以不加额外碳源作对照,筛选最佳碳源;用相同方法在培养基中加入0.3%的牛肉膏、蛋白胨、氯化铵、硫酸铵、硝酸钾作为供试氮源,以不加氮源为对照,筛选最佳氮源。
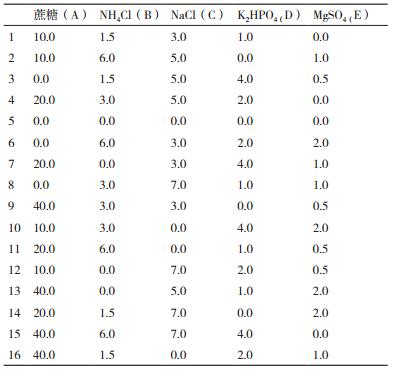
1.2.3.6 正交试验以马铃薯液体培养基为基础,添加碳源、氮源、NaCl、K2HPO4、MgSO4进行四因素五水平正交试验,正交表见表 2。
用氯化镉调PDB培养基重金属含量,设置镉浓度分别为0、20、40、60、80、100、120、140、160、180和200 g/L共7个实验组,接种制备好的的YD02菌液,28℃,120 r/min振荡培60 h,测量菌丝干重,每组做3个平行,以不加菌作为对照。
1.2.5 YD02菌株抑菌活性的测定采用对峙培养法测定YD02菌株对10种植物病原菌的抑菌活性。分别将直径6 mm的病原菌菌块放于平板中央,然后等距离点接菌株,放置培养箱中25℃培养至菌体长满平板,观察有无抑菌圈及抑菌圈大小,计算抑菌率。
抑菌率(%)=r2-(d-r1)/r2×100%
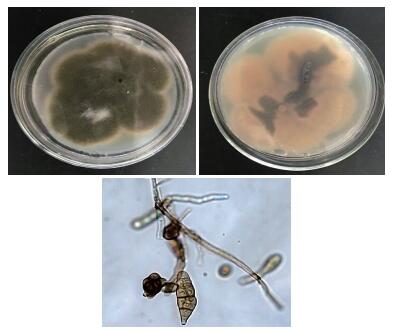
2 结果 2.1 野大豆内生真菌株的分离鉴定经组织分离法自野大豆分离筛选得到1株植物内生真菌YD02。经形态学观察,该菌株在固体培养菌落呈黑色或墨绿色,中央菌丝呈墨绿色或黑色,周围菌丝呈白色,均呈绒状,菌落正反面颜色不一,生长迅速。菌丝分支且产孢,隔和纵隔的壁砖状分隔,暗褐色,常数个成链(图 1)。
|
| 图 1 YD02菌落形态、孢子和菌丝 |
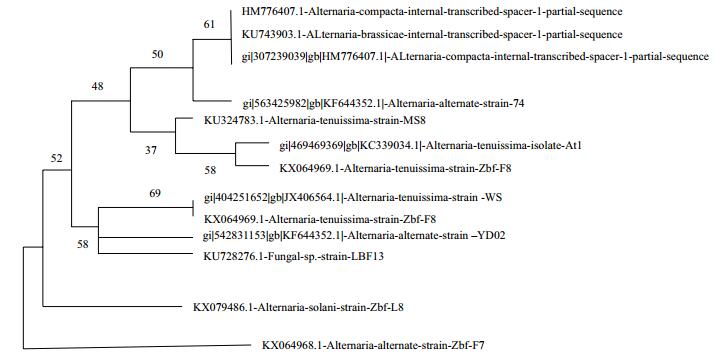
YD02菌株的18S rDNA序列经BLAST比对,可鉴定菌株为链格孢属(Alternaria Nees),基因同源相似度达99%.基于18S r DNA利用MEGA 6.0构建YD02菌株的系统进化树(图 2),由图可知菌株YD02与菌株KU728276.1_Fungal_sp._strain_LBF13同源性最高。
|
| 图 2 YD02菌株系统进化树 |
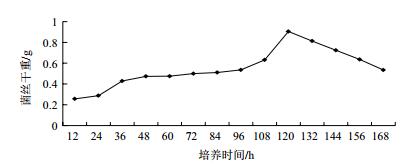
菌株在生长第48 h进入对数期,在120 h为对数期的最高点。120 h至168 h为菌株生长的平台期,168 h之后进入衰亡期(图 3)。
|
| 图 3 YD02菌株的生长曲线 |
初始pH值在1-11之间时,菌株均能生长,其中当培养基初始pH为5和9时,菌丝干重达到最大值,说明菌株在偏酸和偏碱的环境下均能达到最佳生长点(图 4)。
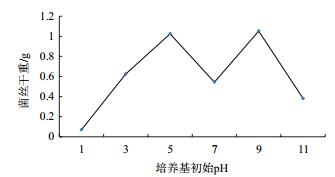
|
| 图 4 初始pH对YD02菌株生长的影响 |
当培养基的初始盐浓度在0-15%之间时,菌株均能生长,初始盐浓度为5%时,菌株的生长状况最为良好(图 5)。
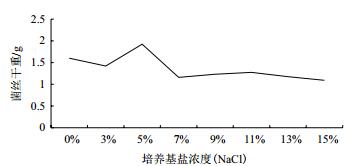
|
| 图 5 盐胁迫对YD02菌株生长的影响 |
菌株在装液量为50、75、100、150 mL的PDB培养基的250 mL三角瓶中均能生长,其中当装液量为150(60%)时,菌株生长状况最好(图 6)。
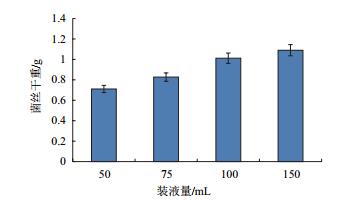
|
| 图 6 装液量对YD02菌株生长的影响 |
对比5种碳源对菌株生长的影响可见,加入碳源后菌株的生长状况与未加碳源相比差异极显著。以蔗糖为碳源培养菌株相比于对照组生长状况提高最为显著(图 7)。
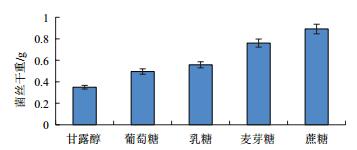
|
| 图 7 不同碳源对YD02菌株生长的影响 |
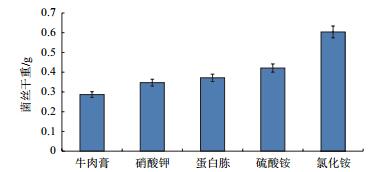
同样,培养基中加入氮源与未加氮源相比,菌株的生长状况有显著差异。其中加入氯化铵后与对照组相比菌丝干重的提高最为显著(图 8)。
|
| 图 8 不同氮源对YD02菌株生长的影响 |
由R值大小得各因素作用的主次顺序为:碳源(蔗糖)>盐(氯化钠)>氮源(氯化铵)>缓冲物质(磷酸氢二钾)>无机盐(硫酸镁)。由上述发酵培养基正交试验结果中的各列K值可知:碳源蔗糖的最适浓度为A4,氮源氯化铵的最适浓度为B4,氯化钠的最佳浓度为C1,磷酸氢二钾的最适浓度为D4,硫酸镁的最适浓度为E2。可确定菌株YD02的发酵培养基的最好水平组合为A4 B4 C1 D4 E2,即:蔗糖4%(40 g/L),氯化铵0.6%、(6 g/L),氯化钠0,磷酸氢二钾0.4%(4 g/L),硫酸镁0.05%(0.5 g/L)。
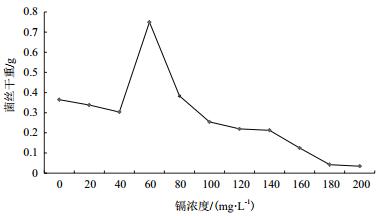
2.5 重金属镉影响下的菌株生长情况测定菌体耐重金属镉的性能较好,在镉浓度为60 mg/L时,菌体的耐性最好,生长状况最为良好,在140 mg/L时依旧可以生长(图 9)。
|
| 图 9 镉胁迫对YD02菌株生长的影响 |
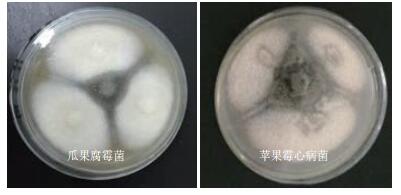
YD02菌株对10株供试病原菌进行抑菌测试,结果(图 10)表明YD02菌株对瓜果腐霉和苹果霉心病菌具有显著的抑菌效果,经测定,对瓜果腐霉和苹果霉心病菌的抑菌半径分别为0.833 cm和1.433 cm,计算抑菌率分别为64.15%和71.68%,抑菌效果显著,可对部分植物病原菌针对性的防治中具有较大的应用潜力。
|
| 图 10 YD02菌株抑菌作用 |
野大豆具有栽培大豆所不具备的众多优良属性,与其特有的内生菌密切相关,这也是当下的一个重要的研究方向[12-14]。目前使大豆增产主要通过施肥的方式,但与此同时带来的土壤板结酸化的问题也日益凸显,而在抗病虫害方面也大多通过使用农药的方式,给环境带来较大的危害。因此,探寻能促进大豆生长,对不良环境有抵御能力的内生菌成为当前研究的目标。
本实验从野大豆中分离获得的内生真菌YD02表现出了比较优良的耐盐能力,盛敏等[15]已经成功的对玉米接种了AM真菌,接种后的玉米表现出了比不接种AM真菌的玉米具有更好的抗盐能力;陈亚平等[16]成功的筛选出了耐盐真菌,并在水稻上检验了其协助植株抗盐胁迫的能力。本实验对YD02的最适pH进行了测定,其结果表明该菌株在pH5、9时生长量均大于中性pH7的点,这表明该菌株具有较好的耐酸耐碱能力,蒙程等[17]将AM真菌接种到紫花苜蓿中,其结果表明接种后紫花苜蓿具有了一定的耐酸能力。YD02菌株具有较好的耐酸碱能力,这对于日后探究YD02菌株协助栽培大豆抗酸碱环境有着一定的指导意义,这使得YD02菌株可以作为生物降解菌的菌株之一。
本实验对YD02菌株的抑菌效果进行了评价,其结果表明该菌株对于瓜果腐霉和苹果腐霉有着明显的抑菌效果,但是对于大豆病原菌的抑菌效果并未进行评价,日后可针对于倪佳俊、张维瑞等[19-20]的实验方案对YD02菌株对于大豆病原菌的抑菌能力进行评价,以便日后研究。
4 结论野大豆内生菌YD02,经经r DNA-ITS序列分析鉴定为链格孢属(Alternaria Nees),其在120 h可以到达最大生长点,在偏酸和偏碱的环境下均可以达到最大生长量,其最佳发酵条件是以PDB培养基为基础,蔗糖4%,氯化铵0.6%,磷酸氢二钾0.4%,硫酸镁0.05%,pH5或pH9,培养温度28℃,装液量为60%,120 r/min发酵60 h,菌株具有优良的耐盐能力和抗重金属镉的能力,对瓜果腐霉、苹果霉心病具有抑菌能力,抑菌率为64.15%和71.68%。
| [1] | 邓墨渊, 王伯初, 杨再昌, 等. 分子生物学技术在植物内生菌分类鉴定中的应用[J]. 氨基酸和生物资源, 2006, 28(3): 9–14. |
| [2] | 贾栗, 陈疏影, 翟永功, 等. 近年国内外植物内生菌产生活性物质的研究进展[J]. 中草药, 2007, 38(11): 1750–1754. DOI:10.3321/j.issn:0253-2670.2007.11.053 |
| [3] | 刘丽莉, 吕国忠, 孙晓东. 林木内生真菌研究进展[J]. 菌物研究, 2006, 4(2): 54–59. |
| [4] | Zheng YK, Qiao XG, Miao CP, et al. Diversity, distribution and biotechnological potential of endophytic fungi[J]. Annals of Microbiology, 2016, 66 (2): 529–542. DOI:10.1007/s13213-015-1153-7 |
| [5] | 张集慧, 王春兰, 等. 兰科药用植物的5种内生菌产生的植物激素[J]. 中国医学科学院学报, 1999, 21(6): 460–465. |
| [6] | 姚领爱, 胡之璧, 王莉莉, 等. 植物内生菌与宿主关系研究进展[J]. 生态坏境学报, 2010, 19(7): 1750–1754. |
| [7] | 徐亚军. 植物内生菌资源多样性研究进展[J]. 广东农业科学, 2011, 38(24): 149–152. DOI:10.3969/j.issn.1004-874X.2011.24.049 |
| [8] | 高小宽, 刘国杰, 白丽荣. 聚乙二醇(PEG)模拟干旱胁迫对野生大豆与栽培大豆萌发的影响[J]. 大豆科学, 2012, 31(6): 1027–1029. |
| [9] | 纪展波, 等. 野生大豆、半野生大豆和栽培大豆对苗期干旱胁迫的生理反应[J]. 大豆科学, 2012, 31(4): 598–604. |
| [10] | 李娜娜, 孔维国, 张煜, 等. 野生大豆耐盐性研究进展[J]. 西北植物学报, 2012, 32(5): 1067–1072. |
| [11] | 董英山. 中国野生大豆研究进展[J]. 吉林农业大学学报, 2008, 30(4): 394–400. |
| [12] | Ratnaweera PB, de Silva ED, Williams DE, et al. Antimicrobial activities of endophytic fungi obtained from the arid zone invasive plant Opuntia dillenii and the isolation of equisetin, from endophytic Fusarium sp[J]. BMC Complementary and Alternative Medicine, 2015, 15 (1): 220. DOI:10.1186/s12906-015-0722-4 |
| [13] | 孔钰凤, 朱先灿, 张建峰, 等. 野生大豆与栽培大豆抗旱性对接种丛枝菌根真菌的响应[J]. 土壤与作物, 2017(1). DOI:10.11689/j.issn.2095-2961.2017.01.001 |
| [14] | 刘海龙, 李春杰, 许艳丽. 生防细菌的抑菌谱和对大豆根腐病的防治[J]. 大豆科技, 2008(1): 10–13. |
| [15] | 盛敏, 唐明, 张峰峰, 等. 盐胁迫下接种AM真菌对玉米耐盐性的影响[J]. 西北植物学报, 2011, 31(2): 332–337. |
| [16] | 陈亚平. 耐盐碱植物内生真菌的分离鉴定及促进作物耐盐菌株的筛选[D]. 杭州: 浙江大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10335-1014417629.htm |
| [17] | 蒙程, 陆妮, 柴琦. 不同pH下接种AM真菌和根瘤菌对紫花苜蓿生长的影响[J]. 草业科学, 2017, 34(2): 352–360. |
| [18] | 阮迪申, 曾加会, 等. 重金属胁迫下内生菌对宿主植物的解毒机制[J]. 微生物学通报, 2016, 43(12): 2700–2706. |
| [19] | 倪佳俊, 周婷, 等. 飞蓬草内生真菌的分离及抑菌活性研究[J]. 杭州师范大学学报(自然科学版), 2017, 16(1): 57–63. |
| [20] | 张维瑞, 郭秀春, 李钦, 等. 杜仲叶和果实中内生真菌的分离及抑菌活性[J]. 中草药, 2016, 47(16): 2921–2926. DOI:10.7501/j.issn.0253-2670.2016.16.025 |