2. 北京新源国能科技集团股份有限公司,北京 100016
2. Beijing E & E Technologies Co., Ltd., Beijing 100016
我国现有耕地有近1/5受到不同程度的重金属和有机物污染,污染土壤将导致农作物减产,甚至有可能引起农产品中污染物超标,进而危害人体健康和整个生态系统。随着经济发展与城市化的加速,工矿企业导致的场地污染也十分严重。由于产业结构与城市布局的变化与调整,有些化工、冶金等污染企业纷纷搬迁,加上一些企业的倒闭,污染场地不断产生。没有处理的污染场地成为潜在隐患,必须妥善管理并加以修复,使其环境风险最小化并得到可持续利用。
土壤重金属污染源以矿山开采和电镀厂的废水排放为主。物理化学修复和生物修复各有优缺点,生物修复成本较低、效果较好、操作较简单。土壤生物修复包括植物修复和微生物修复[1],目前微生物修复研究以微生物吸附和氧化还原重金属及微生物矿化固结重金属离子为主,后者通过微生物分泌有机质将离子态重金属转变为固态矿物[2]。土壤重金属污染持续时间长,可引起生物放大效应,在食物链中累积[3]。微生物修复经济高效,环境友好。目前对金属-微生物互作过程和机理研究逐渐深入,开发了多种重金属解毒/修复的新方案。
多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)是一类具有致癌、致畸、致突变性质的持久性有机污染物,中国土壤PAHs污染严重,微生物修复因其低成本、高效、污染少等优点受到关注。细菌主要产生双加氧酶来催化PAHs的加氧反应[4],真菌通过分泌木质素降解酶系或单加氧酶来氧化PAHs[5]。两种途径均首先降低PAHs的稳定性,使其容易被进一步降解。微生物修复技术正逐步应用于PAHs污染土壤的实地修复,已取得一定成效。
杀虫剂和除草剂在现代农业管理系统中发挥着重要作用,常规用于防治害虫和杂草以及相关的植物病害,减少或消除损失,保障提供高质量农产品。然而,持续广泛的使用农药对公众健康和环境造成潜在的威胁[6]。例如,杀虫剂进入环境后,经历代谢转化/降解,吸附/解吸附,挥发,植物摄取,进入表层水和转运至地下水等多条路径[7]。代谢转化或降解是其中的关键过程,包括非生物降解(如氧化、水解和光解)和生物降解。由此,有机污染物转化成降解产物,或完全矿化进入碳循环[8-9]。微生物降解通常是最重要的过程[10],有机污染物的分子结构决定其物理化学性质和其生物降解属性。例如,某些杀虫剂不溶于水,且紧密吸附于土壤颗粒。故这类化合物的生物利用度较低,难以生物降解,其残余物可在土壤中长期存留,对生态系统影响较大[11]。
有机污染物对土壤生物学的有害效应,包括土壤微生物群落的定性和定量的改变,酶活性改变,土壤氮平衡的变化(抑制固氮菌和硝化菌,干扰氨化过程),破坏菌根共生和豆科根瘤形成等。这些间接和直接的效应继而影响植物生长和土壤肥力[12]。
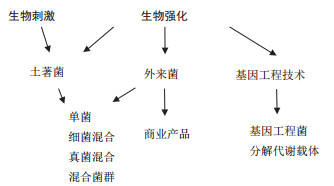
有机污染物带来的环境健康风险使人们要限制其应用,设计新型的环境友好的农药,开发有效的污染治理方案,包括更多生物技术的使用。微生物修复技术是利用微生物(土著菌、外来菌和基因工程菌)对污染物的代谢作用而转化、降解污染物,主要用于土壤中有机污染物的降解。通过改变各种环境条件如营养、氧化还原电位、共代谢基质,强化微生物降解作用以达到治理目的。微生物修复方法包括强化自然递减(Enhanced natural attenuation),生物刺激技术(Biostimulation)和生物强化技术(Bioaugmentation)等(图 1)。生物强化是指加入古菌、细菌或真菌培养物,加速降解污染物[6, 13]。起源于污染物所在场地的微生物通常有一定分解能力,但是当污染物过载时,外加菌能协助降解。生物强化技术有很多优点,如能在处理局地维持高浓度生物量,提高处理负荷;可选择性固定优势菌种,提高难降解有机物的降解效率;抗毒物能力强;对土质及pH变化有较好的稳定性。当然,筛选表征适于生物强化的菌株需要投入的人力物力都要考虑,适宜的菌株可能需要大量的驯化工作才能获得,而转基因菌株的安全性必须考虑,慎重使用。生物刺激是指修饰环境,刺激土著菌使其能进行生物修复[14-15]。可加入多种限速营养素和电子受体,如磷、氮、氧或碳。加入电子供体(有机底物)可刺激修复厌氧环境的卤代污染物,使土著菌以卤代污染物为电子受体。生物刺激有可能充分利用土著菌的修复潜力,但是受环境因素(如污染时间长短和污染物的成分)影响,修复效果变异大。过多加肥会降低微生物的降解能力。生物强化技术可加强生物刺激,两者常可联用,故总称为生物修复(Bioremediation)[13-14]。
本文综述近5年代表性实验研究结果,侧重介绍(1) 用适宜的细菌和真菌菌株,混菌(Consortia)或基因工程菌(GEMs)对污染土壤进行生物强化(图 2),联用生物刺激,降解多种类型污染物;(2) 影响微生物修复的生物和非生物因素;(3) 重金属、有机物复合污染,需要生物修复和非生物修复(如植物仿生修复)联用。微生物修复技术已成功应用于煤气厂址PAHs污染修复,石油烃污染土壤修复,农药污染土壤修复等领域。微生物修复的优点是费用低、易操作及没有二次污染等。

|
| 图 2 面向污染场地生物强化的降解/解毒菌筛选 |
As(Ⅲ)氧化菌可用于砷污染修复。从砷污染场地土壤和水样中分离两个ɤ-变形杆菌菌株[18],不动杆菌属JHS3和克雷白杆菌属JHW3,它们能自养氧化As(Ⅲ)-As(Ⅴ),氧是电子受体。两菌都有aioA基因,编码亚砷酸盐氧化酶,能进行化学无机自营养生长,并以As(Ⅲ)(10 mM)为电子供体。异养条件下两菌株细胞生长和As(Ⅲ)氧化速率明显改善。厌氧条件下,仅JHW3氧化As(Ⅲ),电子受体为硝酸盐或生物电化学系统的固态电极。有氧As(Ⅲ)氧化时JHW3的Vmax和Km高于JHS3。JHW3可用于地表面下的砷污染修复。
1.2 铅污染土壤目前Pb(Ⅱ)土壤污染日益严重,尤其农用地铅污染通过食物链严重威胁着人和动物的健康。多种微生物通过生物累积,沉淀或加速转化Pb(Ⅱ)至稳定矿物等机制,移除或固定土壤Pb(Ⅱ),显著影响Pb(Ⅱ)的移动性和生物利用度[19]。
从鞍山尾矿分离卷枝毛霉(Mucorcircinelloides)可与茄科龙葵(Solanum nigrum)联用于铅污染土壤的修复[20]。铅移除效率:联合修复>植物修复>真菌修复>对照。土壤接种卷枝毛霉加强Pb移除和龙葵生长。联合修复后土壤肥力增加,酶活性改善。
1.3 复合污染有机改良剂有助于减少严重污染的矿山土壤的重金属移动性,加强土壤微生物机能[21]。比较4种有机产品的效果,减少矿山土壤可移动重金属的能力:城市固体废弃物堆肥(MSWC)>橄榄加工固体废物(OPSW)>泥炭>风化褐煤,MSWC降低Zn和Cd水平分别达78和73%。这种改良有助恢复土壤微生物机能。5% MSWC处理矿山土,基础土壤呼吸,脱氢酶,脲酶和碱性磷酸酶活性分别增加187%、79%、42%和26%。MSWC是较佳改良剂,有助化学和微生物土壤修复。
密旋链霉菌(Streptomyces pactum)Act12和生物炭的不同组合可辅助植物修复治理重金属污染土壤[22]。Act12对矿山和工业污染土壤的物理化学性质都有影响。Act12活性提高了Zn和Pb生物利用度,Cd吸附于生物炭表面,使得生物利用度降低。Zn和Pb可经高粱植物提取修复,而富含铁的CZ土壤中Cd摄取减少是由于嗜铁体细菌产物的作用。高粱地上部检测不到Cd,但是根摄取增加。生物炭减少Cd摄取。Act12联用生物炭显著增加高粱干重和叶绿素量。Act12还能增加土壤β-葡萄糖苷酶,碱性磷酸酶和脲酶活性,Act12和生物炭减少重金属胁迫,从而减少抗氧化酶活(POD、PAL和PPO)和脂质过氧化。
植物-微生物联合修复体系具有生物固定与生物去除土壤重金属的两种功能,根际微生物可以菌根、内生菌等方式与根系形成联合体,通过增强植物抗性和优化根际环境,促进根系发展,增强植物吸收和向上转运重金属的能力[23]。植物-微生物联合修复充分发挥植物与微生物功能优势,提高污染土壤的修复效率。深入研究根际微生物、根系和介质载体三者之间复合功能,结合污染土壤类型与植物群落配置的特点筛选扩繁高效菌种和菌群。
2 土壤中石油,PAHs和其它芳香化合物的微生物修复 2.1 PAHs和其它芳香化合物用生物泥浆批量实验研究多环芳香化合物(PAC)污染土壤中PAH和极性PAC的变化特征[24]。监测修复5个月中土壤有机质和反应性,溶剂可提取有机质和PAC含量,有机质矿化。定量总细菌和真菌数,催化PAH环羟化的双加氧酶基因表达发现,PAHs和极性PACs的降解动力学不同,降解速率差异与土壤类型、PAH分布和生物利用度有关。低分子量化合物优先降解。降解选择性与异构体和结构相似物有关,可解释生物修复的效果。土壤细菌区系在PAC降解中处于支配地位。孵育实验中PAH降解细菌丰度增加,但其在细菌区系中的比例减少。修复中需要监测一些氧化PACs的累积。
植物根际构成一个复杂的小生境,含有多种可用于生物转化和污染物治理的微生物[25-26]。豆科植物田菁(Sesbaniacannabina),丛枝菌根真菌(AMF)摩西球囊霉(Glomus mosseae)和根瘤菌(剑菌属Ensifer)三方共生可用于土壤PAHs修复[27]。AMF和根瘤菌互利。AMF和/或根瘤菌显著增加植物生物质和植物内PAHs积累。植物+ AMF +根瘤菌联用能降解>97菲和85%-87%芘,单用植物修复则为81%-85%和72%-75%。AMF和/或根瘤菌处理土壤时产生大量水溶性酚类化合物,相应地,微生物活性和土壤酶活较高。三方共生中的两两互作刺激微生物发育和土壤酶活,加强了PAHs降解。
从2,4,6-三硝基甲苯(TNT)污染土壤分离杨氏柠檬酸杆菌(Citrobacter youngae)E4[28]。无外加氨基氮源时,E4降解TNT效果差,反之则剂量依赖地显著增加TNT转化效率。填加氨基氮源促进菌细胞生长,上调TNT硝基还原酶,包括NemA,NfsA和NfsB。这说明氮营养素刺激的E4转化TNT为一共代谢过程。用E4处理TNT污染土壤泥浆获得类似强化结果。E4和氮营养素的协同添加也许有助于TNT污染土壤修复。但是,TNT转化产物的96 h猛水蚤(Tigriopus japonicas)半数死亡浓度(LC50)高于TNT,故需要额外的解毒过程。
偶联化学氧化和微生物修复值得探索。化学氧化是否影响土著微生物区系,烷基苯污染土壤修复4周后发现,改良Fenton反应(MFR)和高锰酸盐减少微生物丰度和活性[29]。但某些烃类降解菌最终是增加的,表现为alkB基因丰度增加,已知的烃类降解菌成为优势菌群,如红球菌属(Rhodococcus),苍白杆菌属(Ochrobactrum)不动杆菌属(Acinetobacter)和贪铜菌属(Cupriavidus)。
2.2 PAH-重金属复合污染用改良的黏土调控微生物降解处理PAH/Cd复合污染[30-31]。棕榈酸(PA)接枝的基于Arquad® 2HT-75的有机膨润土吸附Cd量稍多于普通膨润土,羧基基团使其表面带更多负电荷,能耐受高浓度Cd。共存Cd(5和10 mg/L)时,与普通膨润土比较,Arquad® 2HT-75修饰的膨润土(AB)和PA接枝的有机膨润土(ABP)使浅黄分枝杆菌(Mycobacterium gilvum)VF1降解更多三环PAH菲(72%-78%和62%)。ABP通过吸附消除Cd对细菌的毒性作用,而且创造适于菌生存的微环境。ABP-细菌互作产生大分子,克服成分间的静电排斥,形成一个稳定的黏土-细菌簇。
废水灌溉土壤常同时污染PAHs和重金属(如Cd和Zn),微生物和植物联合修复效果较好。温室套种黑麦草和东南景天(Sedum alfredii),结合定期接种微杆菌属(Microbacterium)KL5和热带念珠菌(Candida tropicalis)C10,最大PAH去除96.4%,PAH矿化和金属植物提取(36.1% Cd和12.7% Zn)均为最大值[32]。两年修复后,各地块PAHs均减少至国标范围内(农用Ⅱ级,pH 6.5-7.5)。外加菌随时间逐渐消失,故每两月再接种可维持土壤中接种菌的高细胞密度和活性。引入KL5增加了土壤酶活性,促进植物生长,PAH去除和金属植物提取,C10增加土壤酶活性,促进高分子量PAHs去除。
重金属耐受的PAH降解菌在修复复合污染时十分重要,因其减轻有机物降解的重金属抑制。优化矿物盐培养液成分,避免使用金属结合成分(如磷酸盐),保证分离的PAH降解菌群生长,同时使Cd2+的生物利用度较高[33]。培养液的Cd超过60%。分离的菌群最小抑制浓度(MIC)最高为5 mg/L Cd,且能4 d内完全代谢200 mg/L菲。
2.3 石油污染土壤的生物强化和生物刺激微生物修复在石油污染治理中的重要作用广为人知,微生物-电化学处理系统是一较新的技术,能进行有效修复和能源回收。微生物燃料电池(MFCs)中的电极是电子受体,以柴油(V/V 1%)为唯一底物时功率密度达29.05 W/m3,电流密度72.38 A/m3,柴油移除速率提高4倍[34]。扫描电镜显示阳极碳纤维被生物膜和细菌胶体覆盖,它们为碳纤维构建连接体系,加强电子传递。厌氧生物降解中产生的微量代谢物起到乳化剂的作用,有助于油滴分散,在场地修复中起重要作用。
生物强化+生物刺激(BR,加营养素和混合菌群),以及自然递减(NA)对新发严重石油污染土壤的烃类降解和微生物区系有何影响,112 d短时程修复后,总石油烃(TPH,61 000 mg/kg土壤)减少4.5%(NA)和5.0%(BR)[35]。与自然递减相比,生物修复没能显著加强TPH生物降解。脂肪族部位降解最活跃,降解率30.3(NA)和28.7(BR)mg/kg/d。生物修复时土壤微生物活性和计数一般高于自然递减。MiSeq测序提示生物修复显著影响土壤微生物区系的多样性和结构。生物修复使得原小单孢菌属(Promicromonospora),假单胞菌属(Pseudomonas),Microcella,分枝杆菌属(Mycobacterium),Alkanibacter和Altererythrobacter成为优势菌属。用投菌法和生物刺激法对陕北子长石油污染土壤进行微生物修复研究[36]。测定不同处理方法对石油烃的去除效果,确定修复陕北石油污染土壤的最佳方案。石油污染土壤不同生物处理修复效果:生物刺激(加入N、P营养物质)>生物强化(投加降解菌)>其它。土壤中石油烃降解率与可降解石油烃的催化酶基因含量之间呈正相关,修复中土壤石油烃和烷烃降解菌数量显著多于PAH降解菌数量,投加外源降解菌SZ-1显著提高土壤细菌群落的多样性。深入理解生物修复石油污染土壤过程中的微生物生态效应变化有助制定适宜的修复策略。
污染土壤修复研究常使用细粒土而非低肥力砂壤,且很少研究再污染事件。选择曾经历植物修复并对残余总石油烃(TPH)有一定适应能力(土壤微生物已适应污染环境)的砂壤为研究对象,新引入废弃机油,比较有氧和厌氧处理效果[37]。90 d温室盆栽研究比较了有柳枝稷植被和无植被条件下修复含残余TPH的人为填充土的效果。尽管有植被时的细菌CFU高于无植被时几个数量级,有植被时最终TPH浓度较高。无植被盆中,不管是否施肥,TPH浓度均较低。已适应的土著微生物区系与植物(及同时引入的根际微生物)相比,能更有效地分解烃类。新引入非水相液体(废弃机油)的修复效果在饱和厌氧环境中最好,可能由于既有的微生物区系,污染物生物利用度较好,以及土壤条件适宜菌的生存。
3 土壤杀虫剂和除草剂的微生物修复 3.1 各类型杀虫剂用富集培养从长期使用拟除虫菊酯杀虫剂的棉田土壤筛选降解β-氯氰菊酯的菌株[38],用3周连续继代培养获得一个混合菌群,能以β-氯氰菊酯为唯一碳源。该菌群主要含假单胞菌(Pseudomonas),生丝微菌属(Hyphomicrobium),Dokdonella和Methyloversatilis。从中分离出4个菌株,GXZQ4,6,7和13,分属链霉菌属(Streptomyces),肠杆菌属(Enterobacter),链霉菌属和假单胞菌。混合菌群降解率(96 h,89.84%)高于单菌GXZQ4,6,7和13,以及它们的混合菌群。
甘蔗根际接种能降解杀虫剂六氯化苯的念珠菌(Candida)VITJzN04。盆栽实验中生物强化酵母的应用方式为浮游形式或蔗渣固定形式[39]。花园土中六氯化苯(100 mg/kg)移除半衰期为13.3 d(酵母),43.3 d(甘蔗),9.8 d(游离酵母-植物)和7.1 d(固定酵母-植物)。念珠菌还能促进植物生长,产生生长激素,促进土壤磷酸盐溶解和植物摄取。蔗渣固定酵母对土壤的生物刺激进一步提高了土壤的总酵母活性,促进六氯化苯移除。联用固定酵母-植物时的降解最好。
3.2 各类型除草剂污染土壤的生物强化由红球菌属(Rhodococcus)D310-1和肠杆菌属(Enterobacter)D310-5组成降解磺酰脲类除草剂氯嘧磺隆的混合菌群,优化后最大降解率87.42%[40]。土壤60 d修复的降解率达80.02%。Illumina MiSeq高通量测序提示土壤微生物多样性较高,覆盖33个菌门。变形杆菌、酸杆菌、厚壁菌和拟杆菌丰度较高。D310-1和D310-5组成的混合菌群促进修复,并改变了污染土壤细菌群落组成。
电动力方法定期极性反转策略(PRS)可与微生物联用于二苯醚类除草剂乙氧氟草醚(20 mg/kg)污染土壤的修复[41]。混合菌群来自炼油公司废水处理厂,经驯化能降解乙氧氟草醚。使用PRS时要控制土壤条件,包括温湿度,pH和电导等。联用PRS两周后各部分土壤的微生物活性均得以保持。在液态条件下微生物可降解100%乙氧氟草醚,但是单用菌群的土壤修复效率很低。联用低电压梯度和极性反转,移除效率达5%-15%,说明PRS促进基团转运,改善修复效率。
3.3 其它农药从污染的三七种植地分离出贪铜菌属YNS-85[42],其在液体培养中能共代谢200 mg/L杀真菌剂五氯硝基苯(PCNB),5 d后移除率73.8%。该菌能在酸性条件下(pH 4-6) 有效降解PCNB,并耐受重金属砷,铜和镉。该菌能以PCNB代谢中间体为唯一碳源。土壤实验显示该菌的生物强化加强了PCNB移除(37.8%),修复30 d后代谢产物五氯苯胺增加达89.3%。微生物修复改善了土壤酶活性和菌群功能多样性。YNS-85耐酸耐重金属扩大了其应用范围。
植物用杀真菌剂噻菌灵(TBZ)可用一个从污染土壤富集培养中分离的混合菌群快速降解[43]。TBZ作为菌的碳源。混合菌群由α-,β-和γ-变形杆菌组成。培养非依赖方法发现鞘脂单胞菌属(Sphingomonas)系统发育型B13是关键的降解菌。以结构相关化合物作为培养底物,提示苯并咪唑部分(噻唑或呋喃环)的环取代有利于咪唑部分的裂解。裂解后产生噻唑-4-甲脒,苯甲酰基部分被菌群利用。
复杂的土壤复合污染日益引起关注。大量污染物,包括PAHs、石油和相关产品、杀虫剂、氯酚及重金属常进入同一区域[44],对人类健康和生态系统造成巨大威胁。化学和物理技术或者低效或者成本过高,需要联用生物修复才更具实用性。堆肥法既增加土壤有机质和肥力,又修复污染[45],对污染场地微生物区系有积极影响,是最有效的修复手段之一。
4 结语为设计高效的生物强化和生物刺激修复方案,需要更多菌和污染土壤的信息进行创新开发研究。用污染物降解/转化菌清理污染土壤仍极具挑战性,因为至今对于土壤中的接种菌状况仍知之甚少。外加菌在污染土壤中的生存能力,其与土著菌的竞争能力,以及其降解/解毒活性是制约生物修复效率的关键因素。一般认为微生物适应多样环境的能力很强,但具体到每个生物强化菌株,其生存能力和活性差异很大,此常造成强化修复失败。一些新策略可能改善修复效率。植物仿生修复是一种可行的新型土壤修复技术[46-48]。对植物仿生修复装置进行系统优化,考察土壤类型、填料组成、管件高度、模拟叶片材质、活性炭比例等因素对植物仿生修复装置的影响,优化后的装置修复效率显著提高,其中管件的高度与修复装置蒸发速率呈负相关;活性炭的量与装置蒸发速率的相关不明显,模拟“叶片”的材料对蒸发速率大小的影响顺序为:玻璃纤维丝>玻璃纤维布>棉纱,蒸发速率分别为:100.13 g/d、64.75 g/d和61.61 g/d。考查植物仿生修复在野外条件下的实际应用效果,分别对农业污染土壤和工业污染土壤进行实地修复发现,两类污染土壤的重金属均有降低,其中农田污染土壤中Cd的降低率为37.5%-48.15%,工业污染土壤中Zn、Cr、Ni、Fe的降低率分别为27.03%、17.33%、31.60%和5.17%。与单纯植物修复比较,仿生修复与植物修复联用,显著降低红土Cd和Pb含量[49],且对植物富集Cd和Pb无消极影响,同时海泡石+硅藻土+高岭土+活性炭组填料中Pb和Cd含量高于其它填料组合。该技术可以与植物(及根际微生物)修复技术、微生物修复技术、物理-化学修复技术等联用,构建污染土壤的复合修复技术。植物仿生修复作为一种新型修复技术可以有效降低土壤重金属含量。在同一条件下,植物仿生修复与植物修复相比,效率较高,吸附重金属的量较大。该装置也有望用于清除有机物污染。仿生修复的材料筛选、可行性研究、系统优化和实际应用研究需要积累更多实证数据,为开发新型土壤重金属和有机物污染修复技术奠定基础。
另一新策略的例子是调节接种菌和土著菌的群体感应(QS),刺激生物膜形成。QS是一个与菌群密度相关的刺激和反应系统,使菌在高细胞密度时限制特定基因表达,使表型最优。可根据局部菌群密度用QS协调基因表达[50]。用自诱导物或抑制剂调控QS,可能显著影响生物强化和生物刺激的最终效应。迅猛发展的纳米技术可能为微生物修复提供新颖的解决方案。具有大表面积的纳米材料可显著增加其与污染物的亲和力,加速污染物降解/解毒[51]。但应注意纳米颗粒应不抑制微生物生长。
为获取接种菌转归信息,保障污染物降解高效进行,目前土壤生物技术领域注重引入一些分子工具和多相方法学。例如,可用4种分子方法研究假单胞菌(Pseudomonas monteilli)SB 3078引入污染的活性污泥后的生存和活性[52]。用qPCR和增强型绿色荧光蛋白标记监测菌细胞数,进行样品的可视化分析,用RT-qPCR和稳定同位素探针(SIP)估计降解酶基因和接种菌生长相关基因的表达,评价污染物对菌的影响。分子方法的最大优点是精确监测。灵活结合分子和传统方法监测污染物移除是评价引入菌株在原位修复条件下的表现的最好方式。另外,高通量扩增子测序[5]和宏基因组/宏转录组测序[53-54]极大地方便了污染场地微生物区系的详尽探查和动态监测,以及功能基因挖掘。未来改进生物强化和生物刺激策略还应更多考虑有机物-重金属复合污染等复杂情况。
| [1] | Sarwar N, Imran M, Shaheen MR, et al. Phytoremediation strategies for soils contaminated with heavy metals:Modifications and future perspectives[J]. Chemosphere, 2017, 171 : 710–721. DOI:10.1016/j.chemosphere.2016.12.116 |
| [2] | 钱春香, 王明明, 许燕波. 土壤重金属污染现状及微生物修复技术研究进展[J]. 东南大学学报:自然科学版, 2013, 43: 669–674. |
| [3] | Mishra GK. Microbes in heavy metal remediation:A review on current trends and patents[J]. Recent Pat Biotechnol, 2017 . DOI:10.2174/1872208311666170120121025 |
| [4] | 侯梅芳, 潘栋宇, 黄赛花, 等. 微生物修复土壤多环芳烃污染的研究进展[J]. 生态环境学报, 2014, 23: 1233–1238. DOI:10.3969/j.issn.1674-5906.2014.07.022 |
| [5] | Hao DC, Song SM, Mu J, et al. Unearthing microbial diversity of Taxus rhizosphere via MiSeq high-throughput amplicon sequencing and isolate characterization[J]. Sci Rep, 2016, 6 : 22006. DOI:10.1038/srep22006 |
| [6] | Cycoń M, Mrozik A, Piotrowska-Seget Z. Bioaugmentation as a strategy for the remediation of pesticide-polluted soil:A review[J]. Chemosphere, 2017, 172 : 52–71. DOI:10.1016/j.chemosphere.2016.12.129 |
| [7] | Chowdhury A, Pradhan S, Saha M, et al. Impact of pesticides on soil microbiological parameters and possible bioremediation strategies[J]. Ind J Microbiol, 2008, 48 : 114–127. DOI:10.1007/s12088-008-0011-8 |
| [8] | Karpouzas DG, Walker A. Factors influencing the ability of Pseudomonas putida epI to degrade ethoprophos in soil[J]. Soil Biol Biochem, 2000, 32 : 1753–1762. DOI:10.1016/S0038-0717(00)00093-6 |
| [9] | Singh BK, Walker A, Wright DJ. Bioremedial potential of fenamiphos and chlorpyrifos degrading isolates:influence of different environmental conditions[J]. Soil Biol Biochem, 2006, 38 : 2682–2693. DOI:10.1016/j.soilbio.2006.04.019 |
| [10] | Silva VP, Moreira-Santos M, Mateus C, et al. Evaluation of Arthrobacter aurescens strain TC1 as bioaugmentation bacterium in soils contaminated with the herbicidal substance terbuthylazine[J]. PLoS One, 2015, 10 : e0144978. DOI:10.1371/journal.pone.0144978 |
| [11] | Wang Q, Xie S, Hu R. Bioaugmentation with Arthrobacter sp. strain DAT1 for remediation of heavily atrazine-contaminated soil[J]. Int Biodeterior Biodegr, 2013, 77 : 63–67. DOI:10.1016/j.ibiod.2012.11.003 |
| [12] | Das R, Das SJ, Das AC. Effect of synthetic pyrethroid insecticides on N2-fixation and its mineralization in tea soil[J]. Eur J Soil Biol, 2016, 74 : 9–15. DOI:10.1016/j.ejsobi.2016.02.005 |
| [13] | Cornu JY, Huguenot D, Jézéquel K, et al. Bioremediation of copper-contaminated soils by bacteria[J]. World J Microbiol Biotechnol, 2017, 33 (2): 26. DOI:10.1007/s11274-016-2191-4 |
| [14] | Kuppusamy S, Thavamani P, Venkateswarlu K, et al. Remediation approaches for polycyclic aromatic hydrocarbons(PAHs)contaminated soils:Technological constraints, emerging trends and future directions[J]. Chemosphere, 2017, 168 : 944–968. DOI:10.1016/j.chemosphere.2016.10.115 |
| [15] | Alvarez A, Saez JM, Davila Costa JS, et al. Actinobacteria:Current research and perspectives for bioremediation of pesticides and heavy metals[J]. Chemosphere, 2017, 166 : 41–62. DOI:10.1016/j.chemosphere.2016.09.070 |
| [16] | Gao C, Jin X, Ren J, et al. Bioaugmentation of DDT-contaminatedsoil by dissemination of the catabolic plasmid pDOD[J]. J Environ Sci, 2015, 27 : 42–50. DOI:10.1016/j.jes.2014.05.045 |
| [17] | Zhang Q, Wang B, Cao Z, et al. Plasmid-mediated bioaugmentation for the degradation of chlorpyrifos in soil[J]. J. Hazard Mater, 2012, 221-222 : 178–184. DOI:10.1016/j.jhazmat.2012.04.024 |
| [18] | Nguyen VK, Tran HT, Park Y, et al. Microbial arsenite oxidation with oxygen, nitrate, or an electrode as the sole electron acceptor[J]. J Ind Microbiol Biotechnol, 2017, 44 (6): 857–868. DOI:10.1007/s10295-017-1910-7 |
| [19] | Pan X, Chen Z, Li L, et al. Microbial strategy for potential lead remediation:a review study[J]. World J Microbiol Biotechnol, 2017, 33 (2): 35. DOI:10.1007/s11274-017-2211-z |
| [20] | Sun L, Cao X, Li M, et al. Enhanced bioremediation of lead-contaminated soil by Solanum nigrum L. with Mucor circinelloides[J]. Environ Sci Pollut Res Int, 2017, 24 (10): 9681–9689. DOI:10.1007/s11356-017-8637-x |
| [21] | Abad-Valle P, Iglesias-Jiménez E, Álvarez-Ayuso E. A comparative study on the influence of different organic amendments on traceelement mobility and microbial functionality of a polluted mine soil[J]. J Environ Manage, 2017, 188 : 287–296. DOI:10.1016/j.jenvman.2016.12.017 |
| [22] | Ali A, Guo D, Mahar A, et al. Phytoextraction of toxic trace elements by Sorghum bicolor inoculated withStreptomycespactum(Act12) in contaminated soils[J]. Ecotoxicol Environ Saf, 2017, 139 : 202–209. DOI:10.1016/j.ecoenv.2017.01.036 |
| [23] | 李韵诗, 冯冲凌, 吴晓芙, 等. 重金属污染土壤植物修复中的微生物功能研究进展[J]. 生态学报, 2015, 35: 6881–6890. |
| [24] | Biache C, Ouali S, Cébron A, et al. Bioremediation of PAH-contamined soils:Consequences on formation and degradation of polar-polycyclic aromatic compounds and microbial community abundance[J]. J Hazard Mater, 2017, 329 : 1–10. DOI:10.1016/j.jhazmat.2017.01.026 |
| [25] | Hao DC, Ge GB, Yang L. Bacterial diversity of Taxus rhizosphere:culture-independent and culture-dependent approaches[J]. FEMS Microbiol Lett, 2008, 284 (2): 204–212. DOI:10.1111/fml.2008.284.issue-2 |
| [26] | 郝大程, 陈士林, 肖培根. 基于分子生物学和基因组学的植物根际微生物研究[J]. 微生物学通报, 2009, 36(6): 892–899. |
| [27] | Ren CG, Kong CC, Bian B, et al. Enhanced phytoremediation of soils contaminated with PAHs by arbuscularmycorrhiza and rhizobium[J]. Int J Phytoremediation, 2017, 19 (9): 789–797. DOI:10.1080/15226514.2017.1284755 |
| [28] | Liang SH, Hsu DW, Lin CY, et al. Enhancement of microbial 2, 4, 6-trinitrotoluene transformation with increased toxicity by exogenous nutrient amendment[J]. Ecotoxicol Environ Saf, 2017, 138 : 39–46. DOI:10.1016/j.ecoenv.2016.12.012 |
| [29] | Martínez-Pascual E, Grotenhuis T, Solanas AM, et al. Coupling chemical oxidation and biostimulation:Effects on the natural attenuation capacity and resilience of the native microbial community in alkylbenzene-polluted soil[J]. J Hazard Mater, 2015, 300 : 135–143. DOI:10.1016/j.jhazmat.2015.06.061 |
| [30] | Mandal A, Biswas B, Sarkar B, et al. Surface tailored organobentonite enhances bacterial proliferation and phenanthrene biodegradation under cadmium co-contamination[J]. Sci Total Environ, 2016, 550 : 611–618. DOI:10.1016/j.scitotenv.2016.01.164 |
| [31] | Biswas B, Sarkar B, Mandal A, et al. Heavy metal-immobilizing organoclay facilitates polycyclic aromatic hydrocarbon biodegradation in mixed-contaminated soil[J]. J Hazard Mater, 2015, 298 : 129–137. DOI:10.1016/j.jhazmat.2015.05.009 |
| [32] | Chen F, Tan M, Ma J, et al. Efficient remediation of PAH-metal co-contaminated soil using microbial-plant combination:A greenhouse study[J]. J Hazard Mater, 2016, 302 : 250–261. DOI:10.1016/j.jhazmat.2015.09.068 |
| [33] | Thavamani P, Megharaj M, Naidu R. Metal-tolerant PAH-degrading bacteria:development of suitable test medium and effect of cadmium and its availability on PAH biodegradation[J]. Environ Sci Pollut Res Int, 2015, 22 (12): 8957–8968. DOI:10.1007/s11356-013-1850-3 |
| [34] | Cheng Y, Wang L, Faustorilla V, et al. Integrated electrochemical treatment systems for facilitating the bioremediation of oil spill contaminated soil[J]. Chemosphere, 2017, 175 : 294–299. DOI:10.1016/j.chemosphere.2017.02.079 |
| [35] | Wu M, Ye X, Chen K, et al. Bacterial community shift and hydrocarbon transformation during bioremediation ofshort-term petroleum-contaminated soil[J]. Environ Pollut, 2017, 223 : 657–664. DOI:10.1016/j.envpol.2017.01.079 |
| [36] | 杨茜, 吴蔓莉, 聂麦茜, 等. 石油污染土壤的生物修复技术及微生物生态效应[J]. 环境科学, 2015, 36: 1856–1863. |
| [37] | McIntosh P, Schulthess CP, Kuzovkina YA, et al. Bio-and phytoremediation of total petroleum hydrocarbons(TPH)under various conditions[J]. Int J Phytoremediation, 2017, 19 (8): 755–764. DOI:10.1080/15226514.2017.1284753 |
| [38] | Qi Z, Wei Z. Microbial flora analysis for the degradation of beta-cypermethrin[J]. Environ Sci Pollut Res Int, 2017, 24 (7): 6554–6562. DOI:10.1007/s11356-017-8370-5 |
| [39] | Salam JA, Hatha MA, Das N. Microbial-enhanced lindane removal by sugarcane(Saccharum officinarum)in doped soil-applications in phytoremediation and bioaugmentation[J]. J Environ Manage, 2017, 193 : 394–399. DOI:10.1016/j.jenvman.2017.02.006 |
| [40] | Li C, Lv T, Liu W, et al. Efficient degradation of chlorimuron-ethyl by a bacterial consortium and shifts in the aboriginal microorganism community during the bioremediation of contaminated-soil[J]. Ecotoxicol Environ Saf, 2017, 139 : 423–430. DOI:10.1016/j.ecoenv.2017.02.005 |
| [41] | Barba S, Villaseñor J, Rodrigo MA, et al. Effect of the polarity reversal frequency in the electrokinetic-biological remediation of oxyfluorfen polluted soil[J]. Chemosphere, 2017, 177 : 120–127. DOI:10.1016/j.chemosphere.2017.03.002 |
| [42] | Teng Y, Wang X, Zhu Y, et al. Biodegradation of pentachloronitro-benzene by Cupriavidus sp. YNS-85 and its potential for remediation of contaminated soils[J]. Environ Sci Pollut Res Int, 2017, 24 (10): 9538–9547. DOI:10.1007/s11356-017-8640-2 |
| [43] | PerruchonC, Chatzinotas A, Omirou M, et al. Isolation of a bacterial consortium able to degrade the fungicide thiabendazole:the key role of a Sphingomonas phylotype[J]. Appl Microbiol Biotechnol, 2017, 101 (9): 3881–3893. DOI:10.1007/s00253-017-8128-5 |
| [44] | 高宪雯. 微生物—植物在石油—重金属复合污染土壤修复中的作用研究[D]. 济南: 山东师范大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10445-1013216929.htm |
| [45] | Chen M, Xu P, Zeng G, et al. Bioremediation of soils contaminated with polycyclic aromatic hydrocarbons, petroleum, pesticides, chlorophenols and heavy metals by composting:Applications, microbes and future research needs[J]. Biotechnol Adv, 2015, 33 (6 Pt 1): 745–755. |
| [46] | 周建强, 刘晓玲, 韩君, 等. 基于植物仿生的土壤重金属污染原位自持修复技术[J]. 环境化学, 2016, 35(7): 1398–1406. DOI:10.7524/j.issn.0254-6108.2016.07.2015112409 |
| [47] | 周建强, 韩君, 徐愿坚, 等. 基于植物仿生的污染土壤原位自持修复中重金属形态变化分析[J]. 环境工程技术学报, 2017, 7: 71–77. DOI:10.3969/j.issn.1674-991X.2017.01.011 |
| [48] | 周建强. 基于植物仿生的土壤重金属污染原位自持修复技术研究[D]. 重庆: 中国科学院重庆绿色智能技术研究院, 2016. http://d.g.wanfangdata.com.cn/Thesis_Y3106028.aspx |
| [49] | 郝大程, 周建强, 王闯, 韩君. 重金属污染土壤的植物仿生和植物修复比较研究[J]. 生物技术通报, 2017, 33(2): 66–71. |
| [50] | Ayaz E, Gothalwal R. Effect of environmental factors on bacterial quorum sensing[J]. Cell Mol Biol(Noisy-le-grand), 2014, 60 (5): 46–50. |
| [51] | Wei L, Wang S, Zuo Q, et al. Nano-hydroxyapatite alleviates the detrimental effects of heavy metals on plant growth and soil microbes in e-waste-contaminated soil[J]. Environ Sci Process Impacts, 2016, 18 (6): 760–767. DOI:10.1039/C6EM00121A |
| [52] | Dueholm MS, Marques IG, Karst SM, et al. Survival and activity of individual bioaugmentation strains[J]. Bioresour Technol, 2015, 186 : 192–199. DOI:10.1016/j.biortech.2015.02.111 |
| [53] | Abbasian F, Palanisami T, Megharaj M, et al. Microbial diversity and hydrocarbon degrading gene capacity of a crude oil field soil as determined by metagenomics analysis[J]. Biotechnol Prog, 2016, 32 (3): 638–648. DOI:10.1002/btpr.2249 |
| [54] | Garoutte A, Cardenas E, Tiedje J, et al. Methodologies for probing the metatranscriptome of grassland soil[J]. J Microbiol Methods, 2016, 131 : 122–129. DOI:10.1016/j.mimet.2016.10.018 |