2. 南京林业大学南方现代林业协同创新中心,南京 210037
2. Cooperative Innovation Center of Southern Modern Forestry, Nanjing Forestry University, Nanjing 210037
人工湿地是通过模拟自然湿地,经人为设计和建造,并可监督控制的一种污水生态处理工程,它是由基质、植物、微生物和水体组成的一种复合生态系统[1],其去污机理是利用基质、植物和微生物三者间物理、化学和生物三重协调作用,通过过滤、吸附、沉降、离子交换、植物吸收和微生物分解,实现对污水的高效净化[2, 3]。因具有投资少、效率高、处理效果稳定、运行费用低、抗负荷冲击能力强和维护方便等优点,现已被广泛应用于多类废水处理[4],相关的研究同时也在广泛地开展。
目前,人们对人工湿地的研究已从人工湿地的类型、基质的筛选、植物的选取和处理效果等方面逐步深入至微生物水平。微生物承担着水中污染物的降解任务,是系统中的主要分解者[5],因此,对人工湿地系统中微生物的探究有助于我们了解湿地植物与微生物在污染物去除过程中的协同作用,从而为优化生物系统组合和构建高效污水处理的人工湿地系统提供参考[6]。
鉴于微生物在人工湿地中的重要性,国内外学者已做了一定的研究。随着生物技术的不断发展,微生物研究方法也在不断更新,从对菌种进行纯培养的传统法到微生物生理指标法,再到PCR指纹图谱法及更为先进的高通量测序技术等,均可从不同的角度来研究湿地微生物群落结构特征[7-14]。近年来,有学者已对人工湿地微生物某些方面的研究进展进行了综述,如周巧红等[15]从人工湿地对病原微生物的去除、系统基质中微生物的种群和活性等方面的相关研究进行了综述。本文从人工湿地微生物的群落多样性与功能性研究出发,综合叙述目前人工湿地微生物的研究现状,并对该类研究进行展望,旨在为该领域的相关研究提供资料和借鉴。
1 人工湿地微生物多样性研究人工湿地微生物多样性是指人工湿地中所有的微生物种类及其所拥有基因的多样化程度,是影响人工湿地运行效果的重要因素。人们对微生物多样性的研究已从个体菌株水平过渡到群体水平生理特征,近年来逐渐进入分子水平[16-17]。
研究表明,在大多人工湿地的微生物群落中,细菌数量最多,放线菌数量次之,而真菌数量则最少。其中,细菌中具有脱氮功能的氨化细菌、亚硝化细菌、硝化细菌和反硝化细菌数量均处于较高水平[18],这正是人工湿地具有良好脱氮效果的主要原因,也是人工湿地脱氮微生物成为当前研究热点的主要原因。尽管以上各种具有脱氮功能的细菌数量均处于较高水平,但各自间数量及其随湿地运行时间延长所呈现的变化趋势差异极大。夏宏生等[19]研究发现,氨化细菌数量通常远远超过硝化细菌和反硝化细菌,且氨化细菌的数量随着人工湿地运行时间的延长而增加,硝化细菌数量则随之下降,而反硝化细菌数量受其影响较小,但它较其他细菌对温度更为敏感。
另有学者研究了其他环境条件对人工湿地脱氮菌群多样性的影响。Wang等[20]研究发现,人工湿地中具有硝化功能的菌群在基质的中上层以好氧性的氨氧化古菌(Ammonia-oxidizing archaea,AOA)和氨氧化细菌(Ammonia-oxidizing bacteria,AOB)为主,且AOA丰度通常高于AOB,而在基质的中下层则以厌氧氨氧化菌为主,这主要是由于人工湿地不同层次基质中氧环境差异造成的[21]。也有研究报道,对人工湿地采取适当的氧调控措施如曝气,会改善人工湿地微生物群落结构,提高微生物群落结构多样性[22]。不同植物也可影响人工湿地基质中的以上菌群的数量,杨俊娜等[23]通过对湿地基质中氨氧化古菌和氨氧化细菌的amoA基因和反硝化过程中N2O还原酶的nosZ基因拷贝数的研究发现,江南桤木被引种到芦苇人工湿地后,芦苇根际和非根际土壤中和反硝化细菌的数量显著降低,而氨氧化细菌的数量则没有明显变化,芦苇人工湿地的脱氮功能受到削弱。因此,不同植被组合可影响人工湿地微生物的多样性。
人工湿地中微生物的多样性还受到植物种类和植物组合方式的影响。雷旭等[24]采用PCR-DGGE技术和基因测序技术,分别对以美人蕉、梭鱼草和再力花为湿地植物的人工湿地根际微生物的多样性进行了研究,结果发现3种植物的根际微生物群落分属8个纲:α-变形菌纲(14.37%)、β-变形菌纲(38.13%)、γ-变形菌纲(6.87%)、ε-变形菌纲(16.87%)、δ-变形菌纲(6.87%)、放线菌纲(8.76%)、拟杆菌纲(4.38%)及硝化螺旋菌纲(3.75%),其中,β-变形菌纲为不同植物根际富集的主要细菌类群,同时发现3种植物根际的微生物数量各不相同,每种植物都存在一些种属相同但是数量不同的微生物,根际微生物多样性有随着温度的降低而减少的趋势。因为不同季节不同植物的生长状况和代谢活动不同,其输氧能力和分泌物也不同,这些均会引起根系周围微生物的种类和数量的变化[25-26]。另有研究显示,多种植物系统的人工湿地与单一植物的湿地相比,具有更丰富的微生物群落,因此表现出更高的污染物降解率[27]。
以上关于湿地微生物多样性的研究均从物种多样性开展的,近年来,也有部分学者从基因水平对湿地微生物的功能基因遗传多样性进行了研究。Walsh等[28]在研究潜流人工湿地处理垃圾渗滤液的过程中得出,微生物群落组成有37个OTUs。Ibekwe等[29]运用变性梯度凝胶电泳(Denatured gradient gel electrophoresis,DGGE)和细菌克隆文库的方法,在研究表面流人工湿地中根系微生物和表层水中微生物时,得出了其微生物群落分别有31和36个不同的OTUs,进而得出,人工湿地中的植物覆盖状况可同时影响微生物的多样性和湿地的去污效果,而该人工湿地植物覆盖率为50%时,湿地微生物生长作为旺盛,群落多样性最为丰富,且污染去除率最高。Peralta等[30]采用高通量测序技术,研究了人工湿地土壤中微生物的群落结构发现,主要细菌属于酸杆菌门、放线菌门、拟杆菌门、厚壁菌门和变形菌门,约占细菌总数的80%,而且人工湿地土壤中微生物间的差异比自然湿地小。Ligi等[31]也用该方法在对人工湿地生态系统片段微生物序列进行测序时发现,γ-、δ-和β-变形菌是最丰富的类群,而且不同的水文条件对湿地细菌群落结构有一定的影响。
人工湿地系统中,微生物的种类丰富,结构复杂,各类微生物在人工湿地净化水质的过程中协同作用,这也正是人工湿地可以高效去污的主要原因之一。不同人工湿地中微生物种群和数量各不同,主要受到人工湿地废水来源和类型、种植植物、基质材料和运行管理方式等因素的影响。
2 人工湿地微生物功能性研究人工湿地的主要功能之一是去除污水中的氮素。氮素在人工湿地中的主要存在形式为有机氮、氨态氮和硝态氮。人工湿地对氮的去除主要依靠微生物的氨化、硝化和反硝化作用[32]。氨化细菌属于好氧性细菌,在污水净化过程中起到巨大作用;硝化作用在好氧和低氧条件下都能进行,由亚硝化菌与硝化菌共同完成从氨氮转化为亚硝态氮和硝态氮的硝化作用;反硝化是湿地中氮去除的最后关键步骤[33],该过程是在缺氧条件下由反硝化细菌作用使硝态氮还原成N2O或N2,从而使系统中氮得以去除。
杜刚和夏艳阳等[34-35]研究了潜流人工湿地微生物脱氮效率发现,微生物数量对NH4+-N和TN去除率影响明显,其中对TN去除率影响更为明显,微生物数量越多,对TN的去除效果越好。魏成等[36]对旱伞草、美人蕉和芦苇植物进行组合实验发现,3种植物组合系统和两种植物组合系统根际微生物群落去污功能较强,利用碳源的能力较强,而单一旱伞草植物系统根际微生物群落去污功能较弱,利用碳源能力较差。因此,通过不同植物组合而成的湿地系统,可强化根际微生物群落的去污功能,从而提高人工湿地污染物净化的效率和稳定性。龙丽珠等[37]认为,复合垂直流人工湿地中微生物群落的数量和活性均远远高于表面流和潜流人工湿地,其脱氮效果最好。这是由于系统中溶解氧随深度增加呈现递减趋势,上层的有氧环境利于硝化细菌的活动,而中下层的缺氧环境则利于反硝化细菌的活动,这两类细菌共同作用是去除氮素的有效途径。
目前,人们对人工湿地微生物的研究已从传统的间接功能性测定发展到分子水平甚至深入至基因序列等水平的测定。有研究表明,氮转化速率与编码氮转化关键酶的基因存在着明显的定量响应关系[38]。目前,人工湿地微生物主导的氨化、硝化和反硝化作用部分关键酶的编码基因已被探明(图 1)。
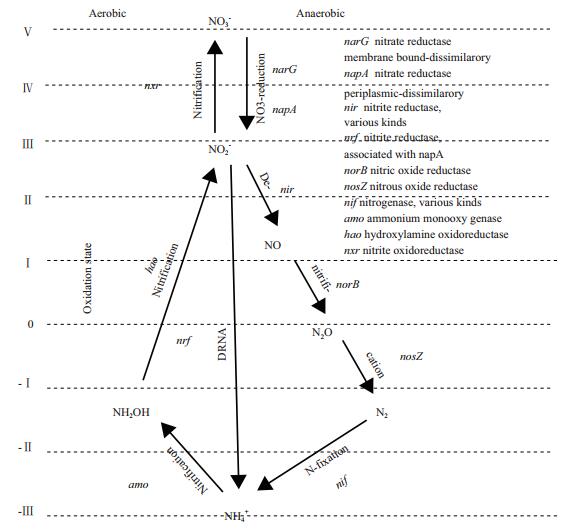
|
| 图 1 生物氮转化主要途径及参与该过程关键酶的编码基因 |
近年来,陆续有研究者发现这些功能基因分布在更为广泛的微生物类群中。例如,Treusch等[39]发现amoA基因不仅存在于细菌中,而且也存在于古细菌中,这表明主导人工湿地硝化作用的微生物可能既包括细菌,又包括古菌。Jones等[40]研究结果表明,具有反硝化功能的nosZ基因不仅存在于反硝化微生物中,而且存在于一些“非典型”的反硝化微生物中。而Wei等[41]的研究结果表明,nir基因不仅存在于变形菌门的α、β和γ变形菌纲中,也存在于放线菌门、拟杆菌门、绿弯菌门和硝化螺菌门等其他细菌类群中。同时,Wei等[42]报道在真菌的子囊菌门和接合菌门中的一些类群也具有nir基因。由此可见,在人工湿地中主导反硝化作用的微生物群落结构多样性、丰度以及功能性可能被严重的低估了。
李鹭珍等[43]在对潮汐流人工湿地的研究中,检测出ANO、(nap A+nar G)、amo A、nxrA、nirS、qnorB和nosZ八种氮转化功能基因,建立了不同水文条件下氮转化速率与氮转化功能基因之间的定量响应关系。闫邢君[44]等从分子水平探究在不同低温条件下和不同土层深度时的微生物群落和氮转化途径,建立了氮转化速率与氮转化菌群和功能基因amoA、qnorB、nosZ、napA、narG和nirS等之间的影响关系。结果均表明,人工湿地系统内氮转化速率与氮转化基因存在着明显的定量响应关系;人工湿地内部氮转化过程之间存在多种耦合机制,氮转化速率受制于多种氮转化菌群和功能基因的联合作用。
3 展望在人工湿地污水净化过程中,微生物发挥了举足轻重的作用。然而,目前人工湿地微生物的研究表明,多数研究方法较为传统,未来应运用更加全面先进的测序技术,从分子的水平上对湿地微生物的群落结构等特点进行深入研究。高通量测序技术作为新一代测序技术具有独特的自身优点,对人工湿地微生物多样性和功能性的研究具有很大的应用前景,它能够提供巨大的生物学信息,从而更为准确地解析人工湿地微生物群落结构和功能。因此,有效地利用高通量测序技术将会为人工湿地微生物群落结构和功能研究开辟出全新的途径。
人工湿地中微生物种群的多样性和功能性日益成为人们研究的热点,尤其是具有脱氮功能的菌群备受学者关注。但目前对脱氮微生物的研究过分拘于传统菌种,譬如对厌氧氨氧化菌的分布、丰富度和活性的研究是不足的,需要进一步深入研究其在氮循环过程中的作用。此外,随着具有amoA、nosZ和nirK/S等基因的新微生物菌群的发现,影响人工湿地脱氮效率的微生物可能远远超过现有种群。因此,需要深入对氮循环相关微生物多样性的研究。如何提高脱氮效率是未来人工湿地技术需要解决的重要问题之一。
人工湿地中微生物的功能性是整个湿地系统运行成败的关键,目前对湿地系统中不同微生物群落结构和功能方面所做的研究工作还相当少,且多数集中于传统技术的间接微生物功能性研究,缺少对氮转化菌群与其功能基因全面系统的定量研究。因此,有必要开发以功能基因研究为基础的其他分子技术来全面研究人工湿地中微生物群落功能特征,以前文提到的日益多样的氮素转化功能基因为研究对象,明确湿地微生物对湿地系统去污能力的影响,这将对人工湿地的设计、去污、运行和管理有十分重要的意义。
| [1] | 张清. 人工湿地的构建与应用[J]. 湿地科学, 2011, 9(4): 373–379. |
| [2] | 范志峰, 李平, 王丽卿, 等. 复合型人工湿地系统在农业面源污染水处理上的应用[J]. 上海海洋大学学报, 2010, 19(2): 259–264. |
| [3] | 周元清, 李秀珍, 李淑英, 等. 不同类型人工湿地微生物群落的研究进展[J]. 生态学杂志, 2011, 300(6): 1 251–1 257. |
| [4] | Liu D, Wu X, Chang J, et al. Constructed wetlands as biofuel production systems[J]. Nature Climate Change, 2012, 2 (3): 190–194. DOI:10.1038/nclimate1370 |
| [5] | Faulwetter JL, Gagnon V, Sundberg C, et al. Microbial processesinfluencing performance of treatment wetlands:A eview[J]. Ecological Engineering, 2009, 35 (6): 987–1004. DOI:10.1016/j.ecoleng.2008.12.030 |
| [6] | 胡智勇, 陆开宏, 梁晶晶. 根际微生物在污染水体植物修复中的作用[J]. 环境科学与技术, 2010, 33(5): 75–80. |
| [7] | 王兴春, 杨致荣, 王敏, 等. 高通量测序技术及其应用[J]. 中国生物工程杂志, 2012, 32(1): 109–114. |
| [8] | 王绍祥, 杨洲祥, 孙真, 等. 高通量测序技术在水环境微生物群落多样性中的应用[J]. 化学通报, 2014, 77(3): 196–203. |
| [9] | 王林, 李冰, 朱健. 高通量测序技术在人工湿地微生物多样性研究中的研究进展[J]. 中国农学通报, 2016, 32(5): 10–15. DOI:10.11924/j.issn.1000-6850.casb15090065 |
| [10] | 吴文卫, 刘昂, 谷照虎, 等. 采用PCR-DGGE技术研究处理农田退水组合人工湿地微生物群落特征[J]. 应用与环境生物学报, 2016, 22(6): 978–985. |
| [11] | 易乃康, 彭开铭, 陆丽君, 等. 人工湿地植物对脱氮微生物活性的影响机制研究进展[J]. 水处理技术, 2016(4): 12–16. |
| [12] | 朱砺之, 黄娟, 傅大放, 等. 人工湿地生态系统中的微生物作用及PCR-DGGE技术的应用[J]. 安全与环境工程, 2012, 19(2): 26–30. |
| [13] | 谢冰, 董亮. 芦苇人工湿地底泥微生物群落结构的PCR-SSCP技术研究[J]. 土壤与作物, 2007, 23(2): 205–211. |
| [14] | 米文秀, 谢冰, 徐亚同. PCR-SSCP技术用于脱臭微生物群落结构的研究[J]. 环境科学, 2008, 29(7): 1992–1997. |
| [15] | 周巧红, 王亚芬, 吴振斌. 人工湿地系统中微生物的研究进展[J]. 环境科学与技术, 2008, 31(7): 58–61. |
| [16] | 边玉, 阎百兴, 欧洋. 人工湿地微生物研究方法进展[J]. 湿地科学, 2014(2). |
| [17] | 刘国华, 叶正芳, 吴为中. 土壤微生物群落多样性解析法:从培养到非培养[J]. 生态学报, 2012, 3232(14): 4 421–4 433. |
| [18] | 付融冰, 杨海真, 顾国维. 人工湿地基质微生物状况与净化效果相关分析[J]. 环境科学研究, 2005, 18(6): 44–49. |
| [19] | 夏宏生, 蔡明, 向欣. 人工湿地净化作用与微生物相关性研究[J]. 广东水利水电, 2008(3): 4–8. |
| [20] | Wang L, Li T. Anaerobic oxidation in constructed wetlands with bio-contact oxidation as[J]. Engineering, 2011 (37): 1 225–1 230. |
| [21] | 赵艳, 李锋民, 王昊云, 等. 好氧/厌氧潜流湿地微生物多样性与净化能力的关系[J]. 环境科学学报, 2011, 31(11): 2423–2431. |
| [22] | 陶敏, 贺锋, 徐洪, 等. 氧调控下人工湿地微生物群落结构变化研究[J]. 农业环境科学学报, 2012, 31(6): 1195–1202. |
| [23] | 杨俊娜. 引种江南桤木对崇西湿地芦苇群落土壤中固氮菌及其生态过程的影响[D]. 上海: 上海大学, 2012. http://www.cnki.com.cn/Article/CJFDTotal-XBLX201602017.htm |
| [24] | 雷旭, 李冰, 李晓, 等. 复合垂直流人工湿地系统中不同植物根际微生物群落结构[J]. 生态学杂志, 2015, 34(5): 1373–1381. |
| [25] | 王青璐, 彭明春, 赵安娜, 等. 人工湿地中影响微生物空间分布因素的探讨[J]. 环境科学导刊, 2009, 28(2): 1–3. |
| [26] | Song K, Lee SH, Kang H. Denitrification rates and community structure of 0 bacteria in newly constructed wetland[J]. European Journal of Soil Biology, 2011, 4747 (1): 24–29. |
| [27] | 刘璐. 湿地系统氮循环微生物的分布与活性[D]. 长春: 长春工程学院, 2016. http://cdmd.cnki.com.cn/Article/CDMD-11437-1016052670.htm |
| [28] | Walsh KA, Hill TCJ, Moffett BF, et al. Molecular characterisation of bacteria in a wetland used to remove ammoniacal-N from landfill leachate[J]. Waste Management & Research, 2002, 20 (6): 529–535. |
| [29] | Ibekwe AM, Lyon SR, Leddy M, et al. Impact of plant density and microbial composition on water quality from a free water surfaceconstructed wetland[J]. Journal of Applied Microbiology, 2007, 102 (4): 921–936. |
| [30] | Peralta RM, Ahn C, Gillevet PM. Characterization of soil bacterial community structure and physicochemical properties in created and natural wetlands[J]. The Science of the Total Environment, 2013, 443 (3): 725. |
| [31] | Ligi T, Oopkaup K, Truu M, et al. Characterization of bacterial communities in soil and sediment of a created riverine wetland complex using high-throughput 16S rRNA amplicon sequencing[J]. Ecological Engineering, 2014, 72 : 56–66. DOI:10.1016/j.ecoleng.2013.09.007 |
| [32] | 刘超翔, 董春宏, 李峰民, 等. 潜流式人工湿地污水处理系统硝化能力研究[J]. 环境科学, 2003, 24(1): 80–83. |
| [33] | 方晶晶, 马传明, 刘存富. 反硝化细菌研究进展[J]. 环境科学与技术, 2010(s1): 206–210. |
| [34] | 杜刚, 黄磊, 高旭, 等. 人工湿地中微生物数量与污染物去除的关系[J]. 湿地科学, 2013, 11(1): 13–20. |
| [35] | 夏艳阳, 崔理华, 黄小龙. 污水碳源对复合垂直流-水平流人工湿地脱氮效果的影响[J]. 环境工程学报, 2017(1): 638–644. DOI:10.12030/j.cjee.201509223 |
| [36] | 魏成, 刘平. 人工湿地污水净化效率与根际微生物群落多样性的相关性研究[J]. 农业环境科学学报, 2008, 27(6): 2401–2406. |
| [37] | 龙丽珠, 阮晓红, 赵振华. 组合人工湿地工艺微生物群落结构及脱氮效果研究[J]. 环境污染与防治, 2008, 30(6): 75–77. |
| [38] | K?nneke M, Bernhard AE, Jr DL T, et al. Isolation of an autotrophic ammonia-oxidizing marine archaeon[J]. Nature, 2005, 437 (7058): 543–546. DOI:10.1038/nature03911 |
| [39] | Treusch AH, Leininger S, Kletzin A, et al. Novel genes for nitrite reductase and Amo-related proteins indicate a role of uncultivated mesophilic crenarchaeota in nitrogen cycling[J]. Environmental Microbiology, 2005, 7 (12): 1985. DOI:10.1111/j.1462-2920.2005.00906.x |
| [40] | Jones CM, Graf DR, Bru D, et al. The unaccounted yet abundant nitrous oxide-reducing microbial community:a potential nitrous oxide sink[J]. Isme Journal, 2013, 7 (2): 417–426. DOI:10.1038/ismej.2012.125 |
| [41] | Wei W, Isobe K, Nishizawa T, et al. Higher diversity and abundance of denitrifying microorganisms in environments than considered previously[J]. IsmeJournal, 2015, 9 (9): 299–304. |
| [42] | Wei W, Isobe K, Shiratori Y, et al. Development of PCR primers targeting fungal nirK, to study fungal denitrification in the environment[J]. Soil Biology & Biochemistry, 2015, 81 : 282–286. |
| [43] | 李鹭珍. 潮汐流人工湿地氮转化微生态过程的分子机制研究[D]. 长春: 东北师范大学, 2015. http://www.doc88.com/p-698155880610.html |
| [44] | 闫邢君. 潮汐流人工湿地低温条件下氮转化过程的研究[D]. 长春: 吉林建筑大学, 2014. http://industry.wanfangdata.com.cn/dl/Magazine?magazineId=tryhj&yearIssue=2009_2 |




