甲氧基丙烯酸酯类(Strobilurins)农药是以具有杀菌活性的天然β-甲氧基丙烯酸酯衍生物为先导化合物开发的一类新型农用杀菌剂,具有广谱、高效等特点[1]。这类农药的作用机理独特,能有效地预防与防治多种由真菌(卵菌纲、子囊菌纲、担子菌纲和半知菌纲等)引起的作物病害,并与目前国内市场上使用的杀菌剂没有交互抗性,对其他杀菌剂产生抗性的病原菌也有良好的防治效果[2]。甲氧基丙烯酸酯类农药在上市近20年间发展迅速,于2014年以37.43亿美元的销售额超过三唑类杀菌剂占据市场之首,成为继三唑类杀菌剂之后又一极具广阔发展前景的杀菌剂[3-5]。
然而,化学农药使用是一把双刃剑。在我国,化学农药超剂量、超范围的使用和施药技术的落后,导致生态环境和农产品中农药残留问题日益突出,直接或间接地损害人类健康。已有文献陆续报道该类农药并不像先前人们所认为的对非靶标生物安全和环境友好,不会造成污染或中毒。相反,甲氧基丙烯酸酯类农药的大量、频繁使用已给生态环境和人类健康带来潜在的巨大威胁[6-7]。如何消除环境及农产品中的甲氧基丙烯酸酯类农药污染已成为科研工作者亟待解决的科研命题。目前国内外研究的农药残留降解方法主要有物理、化学和生物降解3个方面[8]。相对于比较成熟的物理和化学降解方法,生物降解方法具有高效、安全、无残留、无二次污染等优点,是消除和降解农药残留的一种安全、有效的方法[9]。
本文将介绍甲氧基丙烯酸酯类农药的发展历程、生态毒理及其微生物降解的研究现状,旨在为研究和开发微生物降解制剂产品去除该类农药残留污染提供理论和技术支撑。
1 甲氧基丙烯酸酯类农药的发展历程1969年,捷克科学家Musilek等[10]在一种木腐担子菌——霉状小奥德蘑(Oudemansiella mucida)中发现有抗真菌活性的小奥德蘑素A(Oudemansin A),并制作成抗真菌软膏用于治疗人类的皮肤病。这是最早分离出来的β-甲氧基丙烯酸酯,后来称之为Strobilurin A。1977年,德国科学家Anke等[11]在另一种真菌——附胞球果菌(Strobilurus tenacellus)中发现了同类化合物嗜球果伞素A(Strobilurin A)。至此这类具有抗菌活性的天然化合物引起了许多科研工作者的注意,并分离鉴定出多种的天然β-甲氧基丙烯酸酯,如Strobilurin B[12],Strobilurin C[13]等。1996年,先正达、巴斯夫两家公司对这类化合物的结构进行优化改造,并先后成功研发出嘧菌酯和醚菌酯。随后一系列的以β-甲氧基丙烯酸酯衍生物为先导化合物的杀菌剂,即甲氧基丙烯酸酯类农药(部分品种结构如图 1)被研发并投入生产使用[14]。

|
| 图 1 部分甲氧基丙烯酸酯类农药品种的化学结构 |
甲氧基丙烯酸酯类农药的作用机制是真菌线粒体呼吸抑制剂。它们能特异地与作物病原真菌呼吸系统中的质子传递复合体Ⅲ的Qo位点键合,阻断了细胞色素b和c1之间的电子传递,干扰ATP产生,从而影响了病原真菌体内的能量循环,达到抑制真菌生长和杀菌的效果[15]。独特的作用机理使甲氧基丙烯酸酯类农药作为高效杀菌剂而被广泛应用于多种作物的真菌病害防治[16]。但是,随着其使用量与使用范围的不断增加,该类杀菌剂的残留问题和环境安全问题日益严重,引起世界各国对该类杀菌剂的生态毒理进行探讨研究的重视。
2.1 对水生生物的生态毒性大型溞(Daphnia magna)被广泛地用于检测水体中植物检疫产品(如杀菌剂)残留物的生态毒性,其灵敏度要比费氏弧菌(Vibrio fisheri)高[17]。Cui等[18]研究发现,甲氧基丙烯酸酯类农药中的醚菌酯、吡唑醚菌酯和肟菌酯分别在20 μg/L、0.15 μg/L和0.2 μg/L浓度下对大型溞具有毒性,而这组浓度分别接近于各自在环境中的残留浓度,即环境中的醚菌酯、吡唑醚菌酯和肟菌酯足以对大型溞产生毒害。
嘧菌酯及其代谢物R234886在土壤中经过长期的沥滤后,随着地下水直接流往并大量地累积在地表水中[19]。而嘧菌酯被认为对水生生物具有很高的毒性,浓度小于1 mg/L就足以导致50%的鱼类死亡(EC50,96 h)或对50%的藻类(EC50,72 h)和无脊椎动物(EC50,48 h)产生影响[20]。Olsvik等[21]分析得到嘧菌酯通过干扰线粒体的呼吸作用机制对大西洋鲑鱼的幼鱼生长和繁殖产生不良的影响。Gustafsson[22]研究了嘧菌酯对咸水水域中群落结构和功能的影响,结果显示,嘧菌酯在相当低的浓度下对桡足类动物具有毒性,并会直接影响浮游动植物的群落结构。Garanzini[23]等研究发现,嘧菌酯明显地抑制绿狐尾藻的抗氧化酶系统,并使其产生明显的脂质过氧化损伤和DNA损伤。
总之,甲氧基丙烯酸酯类农药对水生生物均具有很高的毒害作用,农药进入水体生态环境后,直接影响水生生物的群落结构和生活环境,因此在实际生产中需合理规范地使用此类农药。另外,对于嘧菌酯的主要代谢物R234886,目前还没有相关文献关注它是否对水生生物具有毒性,但由于它长期暴露并大量累积在水体中,R234886始终是脆弱的水体环境和饮水资源的一个潜在威胁,应加以重视。
2.2 对陆生生物的生态毒性农药对陆生生物生态风险评价用于评价农药使用后对非靶标陆生生物的影响,一般选择鸟类、蜜蜂、家蚕及哺乳动物等代表性陆生生物作为评价受体。张晶等[24]研究了吡唑醚菌酯对9·芙家蚕(Bombyxmori)的急性毒性评价,结果表明吡唑醚菌酯对家蚕96 h的LC50值为20.8 mg a.i./L,属于中毒级;郭耀全等[25]研究发现,95%吡唑醚菌酯20 000倍液对家蚕的残毒期为7 d,5 000倍液、10 000倍液均为14 d;另外,吕铭潇等[26]采用浸叶法测定了不同杀菌剂对家蚕的毒力,其中嘧菌酯对家蚕低毒,而醚菌酯对家蚕中毒。由以上结果可知,不同品种的甲氧基丙烯酸酯类农药对家蚕的毒力不同,其中吡唑醚菌酯、醚菌酯等对家蚕属于中毒级。根据报道,已经证实部分甲氧基丙烯酸酯类农药对蜂类产生毒性作用。金华超等[27]在实验中发现99.5%的肟菌酯明显激活了玉米螟赤眼蜂体内酚氧化酶的活性,表明肟菌酯对玉米螟赤眼蜂具有急性毒性;张宁等[28]通过药膜法和摄入法研究发现,虽然肟菌酯和醚菌酯对非靶标生物斑痣悬茧蜂没有明显的急性致死效应,但对其发育、寿命和行为等造成严重的威胁。也有实验证实,甲氧基丙烯酸酯类农药对人体存在潜在威胁。Cayir等[29]通过体外试验发现吡唑醚菌酯为人体外周血淋巴细胞有潜在的遗传毒性和细胞毒性;Regueiro等[30]也研究得到吡唑醚菌酯和醚菌酯对原代培养的皮元神经具有神经毒性;Pearson等[31]推测吡唑醚菌酯和和肟菌酯可能会与孤独症、脑部衰老、神经退化等有潜在的关联性。
不同品种的甲氧基丙烯酸酯类农药对非靶标陆生生物的毒性各不相同,但目前还缺乏足够的对鸟类、瓢虫等陆生环境生物的生态风险评价的研究报道。
2.3 对土壤生物群落的生态毒性近年来,研究工作者们越来越重视杀菌剂对土壤生物群落结构和功能的影响。蚯蚓是农田土壤生态群落中物质循环的重要载体,常用作为土壤污染毒理实验的标志生物[32-33]。邓勋飞等[34]研究发现嘧菌酯在使用后对土壤生态具有较高的长期风险(嘧菌酯土壤半衰期较长,为78 d),且其对蚯蚓的慢性无作用浓度较低(NOECW = 3 mg/kg)。Han等[35]发现嘧菌酯会引起蚯蚓的氧化应激反应,导致脂质的过氧化损伤和DNA损伤。另外,吡唑醚菌酯和氟嘧菌酯均会对蚯蚓产生一定的氧化胁迫效应,并对蚯蚓体腔细胞DNA造成明显的损伤[36]。
土壤微生物也是土壤生态系统的重要组分之一,能敏感地反映出土壤环境的细微变化,其常用的指标主要包括:微生物量、微生物生理生化过程、酶活性和微生物多样性[37]。Wassila等[38]通过总结前人的相关研究成果发现,杀菌剂使用后,几乎都对土壤酶活性产生抑制作用,并会减少土壤的微生物量及抑制微生物群落的活性。Bacmaga等[39]研究发现,嘧菌酯会抑制土壤的酶活性(如脲酶、磷酸酶、脱氢酶、过氧化氢酶等)。另外,土壤微生物量及微生物多样性还与嘧菌酯的使用剂量及使用时间显著相关,其中真菌群落的多样性随着嘧菌酯所施用剂量的增加而下降,且在最大剂量(22.50 mg/kg)条件下真菌的生理生化活性显著降低。
蚯蚓和土壤微生物在监测甲氧基丙烯酸酯类农药对土壤生物群落的影响中起到重要的作用。从实验数据中可见这类农药对蚯蚓有明显的药害作用,对土壤的微生物量和土壤酶活性均有负面作用,即这类农药在使用过程中会对土壤生物群落产生不利影响。
3 甲氧基丙烯酸酯类农药微生物降解研究现状 3.1 降解微生物的筛选、鉴定研究环境中残留的甲氧基丙烯酸酯类农药对生态环境安全和人类健康的问题越发突出,亟须寻找安全有效的方法降解该类杀菌剂的残留物,消除其潜在的威胁。
研究发现,甲氧基丙烯酸酯类农药在水中的水解速率受其本身化学结构和pH值的影响,其中醚菌酯的水解速率较快而嘧菌酯则水解缓慢。另外,该研究还指出嘧菌酯在水体和土壤中滞留期较长[20]。因此,需要寻找其他有效的途径降解残留在环境中的嘧菌酯。生物修复(Bioremediation)具有高效、安全、无残留、无二次污染等优点,是消除和解毒高浓度的农药残留的一种安全、有效的方法,是治理农药污染的新途径[9]。利用生物修复技术治理甲氧基丙烯酸酯类农药残留污染的基础是从不同环境样品中寻找其降解微生物,目前已经发现的可降解甲氧基丙烯酸酯类农药的微生物概括如下(表 1)。
最近,Bacmaga等[39]在研究嘧菌酯对土壤微生物和酶活性的影响时发现,4株芽孢杆菌属细菌(Bacillus cereus B9、Bacillus weihenstephanensis B10、Bacillus sp. B11和Bacillus megaterium B12) 和2株隐囊菌属真菌(Aphanoascus terreus G8和Aphanoascus fulvescens G9) 可耐受最高剂量为22.50 mg/kg的嘧菌酯,具有降解嘧菌酯环境残留的潜能。
到目前为止,已报道筛选得到的甲氧基丙烯酸酯类农药降解菌株的数量极少,相对于环境中丰富的微生物资源而言,菌株的筛选方面还有很大的空间,而且已有的文献一般只涉及到降解微生物的筛选,其降解途径、降解酶及其降解机理等方面的研究还没有相关报道。利用微生物降解治理甲氧基丙烯酸酯类农药残留污染及其在生产实践中的应用还有很大的距离。
3.2 代谢产物及降解途径研究甲氧基丙烯酸酯类农药微生物降解的作用方式和其他农药的微生物降解一样,主要是通过其分泌酶的代谢完成,本质都是酶促降解[44]。而降解途径的研究一般是通过各种色谱技术,如气相色谱-质谱联用法(GC-MS)、液相色谱-质谱联用法(LC-MS/MS)等,来测定其代谢产物并进行推测。
甲氧基丙烯酸酯类农药的化学结构复杂,导致其在代谢过程中因作用位点的不同而进行多种不同的代谢途径。图 2展示了这类农药的3种基本代谢途径:(1) 甲基酯键的水解是一个重要的代谢途径,水解产生的代谢物是一个没有生物活性的游离丙烯酸。(2) 芳香环的羟基化反应易引发其与谷胱甘肽的共轭,但若在同一芳香环上发生多次羟基化反应则易引起芳香环的裂解并矿化成CO2。(3) 丙烯酸基团的双键易发生不同的代谢机制,如双键发生环氧化反应最终产生苯甲酸衍生物;或通过加氢还原生成叔醇;此外,双键的光解反应通常会产生多种产物并可能引起该基团的完全降解[45]。在代谢产物中,由于甲氧基丙烯酸酯类农药在环境中的代谢途径繁杂,以致其产生多种不同的代谢产物,如嘧菌酯在环境产生的代谢产物有R234886、R230310、R401553、R402173、R405287等[7]。
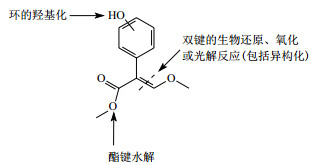
|
| 图 2 甲氧基丙烯酸酯类农药的基本代谢途径 |
但是,迄今为止,关于甲氧基丙烯酸酯类农药微生物代谢产物的研究报道极少,其具体代谢机制及各类代谢产物对环境是否具有潜在危害性目前还未明确,因此深入研究甲氧基丙烯酸酯类农药的微生物代谢产物及降解途径十分必要。
4 展望甲氧基丙烯酸酯类农药是目前应用广泛的一类杀菌剂。然而,越来越多的研究成果表明这类农药在使用过程中产生的农药残留对周围生态环境和人类健康存在着潜在威胁。如何降解该类农药残留已经成为世界各国的研究热点。
目前微生物对农药的降解得到了广泛的认可,许多农药的微生物降解已有深入的研究,如有机磷[46-48]、氨基甲酸酯[49-50]、拟除虫菊酯[51-56]等农药,已经确定了微生物降解在处理土壤和水环境中农药残留的重要地位。纵观国内外,利用微生物降解环境中甲氧基丙烯酸酯类农药的相关研究才刚刚起步,相关研究报道不多。现已有的科研成果主要集中于降解微生物的筛选鉴定,而且往往只针对单一的品种,后续的工作,如代谢产物及降解途径的分析、降解酶及其基因的研究、构建农药基因工程菌及其生物修复等,还有待进一步深入研究。因此,利用微生物降解甲氧基丙烯酸酯类农药的研究工作还有很大发展空间。为了加大该类农药生物降解菌剂的开发与应用,今后应加强以下几个方面的研究:
一是建立甲氧基丙烯酸酯类农药降解菌种资源库。环境蕴含了丰富的微生物资源,广泛筛选农药的高效降解菌,丰富现有的降解菌资源库。
二是构建甲氧基丙烯酸酯类农药基因工程菌。利用现代分子生物学技术,克隆降解菌株的相关降解酶,将降解酶基因构建于质粒载体导入能够高效利用农药降解过程产生的中间化合物的菌株中,能够消除中间化合物积累对甲氧基丙烯酸酯类的降解抑制或将多种降解酶基因克隆到一种微生物中实现多种优良性状的整合,获得环境适应力强、降解谱广、降解效率高的甲氧基丙烯酸酯类农药基因工程菌;值得注意的是,这种将外源基因构建于质粒载体而获得的基因工程菌由于质粒的不稳定性其应用越来越受到限制。因此,利用基因重组方法构建遗传稳定的多功能农药降解基因工程菌是未来构建基因工程菌的一个方向。
三是开发及应用生物降解菌剂或酶制剂。继续深入研究降解菌株的相关降解酶性质和作用机理,阐明对应降解基因的表达调控机制;利用基因工程技术,采用密码子优化和分子伴侣共表达策略等实现降解酶的异源大量表达,获得高效甲氧基丙烯酸酯类农药生物降解菌剂或高产量酶制剂投入实际生产实践中,达到消除环境中农药残留的目的。
| [1] | 闫晓静, 金淑惠, 陈馥衡, 等. Strobilurin类杀菌剂作用靶标的研究进展[J]. 农药学学报, 2006(04): 299–305. DOI:10.3321/j.issn:1008-7303.2006.04.002 |
| [2] | 王丽, 石延霞, 李宝聚, 等. 甲氧基丙烯酸酯类杀菌剂研究进展[J]. 农药科学与管理, 2008, 30(9): 24–27. |
| [3] | 严明, 柏亚罗. 甲氧基丙烯酸酯类等四大类杀菌剂市场概况及前景展望[J]. 现代农药, 2016, 15(6): 1–8, 11. |
| [4] | 何秀玲, 张一宾. 甲氧基丙烯酸酯类和酰胺类杀菌剂品种市场和抗性发展情况[J]. 世界农药, 2013, 35(3): 14–19. |
| [5] | 赵平, 严秋旭, 李新, 等. 甲氧基丙烯酸酯类杀菌剂的开发及抗性发展现状[J]. 农药, 2011, 50(8): 547–551. |
| [6] | Rodrigues ET, Lopes I, Pardal MA. Occurrence, fate and effects of azoxystrobin in aquatic ecosystems:a review[J]. Environment International, 2013, 53 : 18–28. DOI:10.1016/j.envint.2012.12.005 |
| [7] | EF SA. Conclusions on the peer review of the pesticide risk assessment of the active substance azoxystrobin[J]. European Food Safety Authority Journal, 2010, 8 (4): 1542–1652. |
| [8] | 陈少华, 罗建军, 林庆胜, 等. 农药残留降解方法研究进展[J]. 安徽农业科学, 2009, 37(1): 343–345. |
| [9] | Harms H, Schlosser D, Wick LY. Untapped potential:exploiting fungi in bioremediation of hazardous chemicals[J]. Nature Reviews Microbiology, 2011, 9 (3): 177–192. DOI:10.1038/nrmicro2519 |
| [10] | Musilek V, Cerna J, Sasek V, et al. Antifungal antibiotic of the Basidiomycete Oudemansiella mucida[J]. Folia Microbiologica, 1969 (14): 377–387. |
| [11] | Anke T, Oberwinkler F, Steglich W, et al. The strobilurins-new antifungal antibiotics from the basidiomycete Strobilurus tenacellus[J]. Journal of Antibiotics, 1977, 30 (10): 806–810. DOI:10.7164/antibiotics.30.806 |
| [12] | Schramm G, Steglich W, Anke T, et al. Chemlnform abstract:antibiotics from basidiomycetes, Ⅲ. strobilurin A and B, antifungal metabolites from Strobilurus Tenacellus[J]. Cheminform, 1978, 43 (9): 1779–1784. |
| [13] | Anke T, Besl H, Mocek U, et al. Antibiotics from basidiomycetes. ⅩⅧ. Strobilurin C and oudemansin B, two new antifungal metabolites from Xerula species(Agaricales)[J]. Journal of Antibiotics, 1983, 36 (6): 661–666. DOI:10.7164/antibiotics.36.661 |
| [14] | Bartlett DW, Clough JM, Godwin JR, et al. The strobilurin fungicides[J]. Pest Manag Sci, 2002, 58 (7): 649–662. DOI:10.1002/(ISSN)1526-4998 |
| [15] | Isamu Y, Makoto F. Recent topics on action mechanisms of fungicides[J]. J Pestic Sci, 2005, 30 (2): 67–74. DOI:10.1584/jpestics.30.67 |
| [16] | Battaglin WA, Sandstrom MW, Kuivila KM, et al. Occurrence of azoxystrobin, propiconazole, and selected other fungicides in US streams, 2005-2006[J]. Water Air Soil Pollution, 2011, 218 (1): 307–322. |
| [17] | Esteve K, Poupot C, Dabert P, et al. A Saccharomyces cerevisiae-based bioassay for assessing pesticide toxicity[J]. J Ind microbiol Biotechnol, 2009, 36 (12): 1529–1534. DOI:10.1007/s10295-009-0649-1 |
| [18] | Cui F, Chai T, Liu X, et al. Toxicity of three strobilurins(kresoxim-methyl, pyraclostrobin, and trifloxystrobin)on Daphnia magna[J]. Environ Toxicol Chem, 2017, 36 (1): 182–189. DOI:10.1002/etc.3520 |
| [19] | Jorgensen LF, Kjaer J, Olsen P, et al. Leaching of azoxystrobin and its degradation product R234886 from Danish agricultural field sites[J]. Chemosphere, 2012, 88 (5): 554–562. DOI:10.1016/j.chemosphere.2012.03.027 |
| [20] | 许静, 孔德洋, 宋宁慧, 等. 甲氧丙烯酸酯类杀菌剂的环境降解特性研究[J]. 农业环境科学学报, 2013, 32(10): 2005–2011. DOI:10.11654/jaes.2013.10.015 |
| [21] | Olsvik PA, Kroglund F, Finstad B, et al. Effects of the fungicide azoxystrobin on Atlantic salmon(Salmo salar L.)smolt[J]. Ecotoxicol Environ Saf, 2010, 73 (8): 1852–1861. DOI:10.1016/j.ecoenv.2010.07.017 |
| [22] | Gustafsson K, Blidberg E, Elfgren IK, et al. Direct and indirect effects of the fungicide azoxystrobin in outdoor brackish water microcosms[J]. Ecotoxicology, 2010, 19 (2): 431–444. DOI:10.1007/s10646-009-0428-9 |
| [23] | Garanzini DS, Menone ML. Azoxystrobin causes oxidative stress and DNA damage in the aquatic macrophyte Myriophyllum quitense[J]. Bull Environ Contam Toxicol, 2015, 94 (2): 146–151. DOI:10.1007/s00128-014-1428-x |
| [24] | 张晶, 贾鹏龙, 陈秋初, 等. 14种农药对9·芙家蚕(Bombyxmori)的急性毒性评价[J]. 农药科学与管理, 2016(11): 44–51. DOI:10.3969/j.issn.1002-5480.2016.11.007 |
| [25] | 郭耀全, 张晶, 梁慧君, 等. 4种低毒非桑园农药对家蚕的残毒试验[J]. 广东蚕业, 2016, 50(2): 20–23. |
| [26] | 吕铭潇, 张骞. 7种杀菌剂对家蚕的急性毒性评价[J]. 生物灾害科学, 2014, 37(2): 140–143. |
| [27] | 金华超, 尹晓辉, 朱国念. 四种杀菌剂对玉米螟赤眼蜂酚氧化酶活性的影响[J]. 昆虫学报, 2013, 56(2): 136–144. |
| [28] | 张宁, 张传清, 朱国念, 等. 甲氧基丙烯酸酯类和三唑类杀菌剂对斑痣悬茧蜂的毒性[J]. 农药学学报, 2016, 18(3): 387–392. |
| [29] | Cayir A, Coskun M, Coskun M. Micronuclei, nucleoplasmic bridges, and nuclear buds induced in human lymphocytes by the fungicide signum and its active ingredients(boscalid and pyraclostrobin)[J]. Environ Toxicol, 2014, 29 (7): 723–732. DOI:10.1002/tox.v29.7 |
| [30] | Regueiro J, Olguin N, Simal-Gandara J, et al. Toxicity evaluation of new agricultural fungicides in primary cultured cortical neurons[J]. Environmental Research, 2015, 140 : 37–44. DOI:10.1016/j.envres.2015.03.013 |
| [31] | Pearson BL, Simon JM, Mccoy ES, et al. Identification of chemicals that mimic transcriptional changes associated with autism, brain aging and neurodegeneration[J]. Nat Communi, 2016, 7 : 11173. DOI:10.1038/ncomms11173 |
| [32] | 肖能文, 赵彩云, 王学霞, 等. 用于土壤污染生态毒理诊断的蚯蚓生物标志物研究[J]. 江西农业学报, 2012, 24(1): 137–143. |
| [33] | 何巧力, 颜增光, 汪群慧, 等. 利用蚯蚓回避试验方法评价萘污染土壤的生态风险[J]. 农业环境科学学报, 2007, 26(2): 538–543. |
| [34] | 邓勋飞, 詹宇, 王祥云, 等. 蔬菜地农药施用的土壤生态风险评估[J]. 农业环境科学学报, 2014, 33(10): 1920–1927. DOI:10.11654/jaes.2014.10.007 |
| [35] | Han Y, Zhu L, Wang J, et al. Integrated assessment of oxidative stress and DNA damage in earthworms(Eisenia fetida)exposed to azoxystrobin[J]. Ecotoxicology and Environmental Safety, 2014, 107 : 214–219. DOI:10.1016/j.ecoenv.2014.06.006 |
| [36] | 王作彬. 吡唑醚菌酯和氟嘧菌酯对蚯蚓的氧化胁迫及DNA损伤[D]. 泰安: 山东农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10434-1016115114.htm |
| [37] | Beelen PV, Doelman P. Significance and application of microbial toxicity tests in assessing ecotoxicological risks of contaminants in soil and sediment[J]. Chemosphere, 1997, 34 (3): 455–499. DOI:10.1016/S0045-6535(96)00388-8 |
| [38] | Wassila R, Karine L, Emile LA, et al. Effects of pesticides on soil enzymes:a review[J]. Environmental Chemistry Letters, 2014, 12 (2): 257–273. DOI:10.1007/s10311-014-0458-2 |
| [39] | Bacmaga M, Kucharski J, Wyszkowska J. Microbial and enzymatic activity of soil contaminated with azoxystrobin[J]. Environmental Monitoring and Assessment, 2015, 187 (10): 615–629. DOI:10.1007/s10661-015-4827-5 |
| [40] | Lopes FM, Batista KA, Batista GL, et al. Biodegradation of epoxyconazole and piraclostrobin fungicides by Klebsiella sp. from soil[J]. World J Microbiol Biotechnology, 2010, 26 (7): 1155–1161. DOI:10.1007/s11274-009-0283-0 |
| [41] | Clinton B, Warden A, Haboury S, et al. Bacterial degradation of strobilurin fungicides:a role for a promiscuous methyl esterase activity of the subtilisin proteases?[J]. Biocatalysis and Biotransformation, 2011, 29 (4): 119–129. DOI:10.3109/10242422.2011.578740 |
| [42] | Howell CC, Semple KT, Bending GD. Isolation and characterisation of azoxystrobin degrading bacteria from soil[J]. Chemosphere, 2014, 95 : 370–378. DOI:10.1016/j.chemosphere.2013.09.048 |
| [43] | Chen S, Deng Y, He F, et al. Isolation and characterization of a azoxystrobin-degrading bacterial strain Ochrobactrum anthropi SH14[C]. 中国植物病理学会青年学术研讨会论文选编. 北京: 中国农业出版社, 2015. |
| [44] | Chen S, Lin Q, Xiao Y, et al. Monooxygenase, a novel beta-cypermethrin degrading enzyme from Streptomyces sp[J]. PLoS One, 2013, 8 (9): e75450. DOI:10.1371/journal.pone.0075450 |
| [45] | Hamdy B. Review of strobilurin fungicide chemicals[J]. J Environ Sci Health B, 2007, 42 (4): 441–451. DOI:10.1080/03601230701316465 |
| [46] | Cycoń M, Wojcik M, Piotrowska-Seget Z. Biodegradation of the organophosphorus insecticide diazinon by Serratia sp. and Pseudomonas sp. and their use in bioremediation of contaminated soil[J]. Chemosphere, 2009, 76 (4): 494–501. DOI:10.1016/j.chemosphere.2009.03.023 |
| [47] | Chen S, Liu C, Peng C, et al. Biodegradation of chlorpyrifos and its hydrolysis product 3, 5, 6-trichloro-2-pyridinol by a new fungal strain Cladosporium cladosporioides Hu-01[J]. PLoS One, 2012, 7 (10): e47205. DOI:10.1371/journal.pone.0047205 |
| [48] | Zhang Q, Wang B, Cao Z, et al. Plasmid-mediated bioaugmentation for the degradation of chlorpyrifos in soil[J]. Journal of Hazardous Materials, 2012, 21-222 : 178–184. |
| [49] | Yang L, Chen S, Hu M, et al. Biodegradation of carbofuran by Pichia anomala strain HQ-C-01 and its application for bioremediation of contaminated soils[J]. Biology and Fertility of Soils, 2011, 47 (8): 917–923. DOI:10.1007/s00374-011-0602-0 |
| [50] | Plangklang P, Reungsang A. Bioaugmentation of carbofuran residues in soil using Burkholderia cepacia PCL3 adsorbed on agricultural residues[J]. International Biodeterioration & Biodegradation, 2009, 63 (4): 515–522. |
| [51] | Chen S, Hu M, Liu J, et al. Biodegradation of beta-cypermethrin and 3-phenoxybenzoic acid by a novel Ochrobactrum lupini DG-S-01[J]. J Hazard Mater, 2011, 187 (1-3): 433–440. DOI:10.1016/j.jhazmat.2011.01.049 |
| [52] | Chen S, Geng P, Xiao Y, et al. Bioremediation of β-cypermethrin and 3-phenoxybenzaldehyde contaminated soils using Streptomyces aureus HP-S-01[J]. Appl Microbiol Biotechnol, 2012, 94 (2): 505–515. DOI:10.1007/s00253-011-3640-5 |
| [53] | Chen S, Dong Y, Chang C, et al. Characterization of a novel cyfluthrin-degrading bacterial strain Brevibacterium aureum and its biochemical degradation pathway[J]. Bioresource Technology, 2013, 132 : 16–23. DOI:10.1016/j.biortech.2013.01.002 |
| [54] | Chen S, Chang C, Deng Y, et al. Fenpropathrin biodegradation pathway in Bacillus sp. DG-02 and its potential for bioremediation of pyrethroid-contaminated soils[J]. Journal of Agricultural and Food Chemistry, 2014, 62 (10): 2147–2157. DOI:10.1021/jf404908j |
| [55] | Xiao Y, Chen S, Gao Y, et al. Isolation of a novel beta-cypermethrin degrading strain Bacillus subtilis, BSF01 and its biodegradation pathway[J]. Appl Microbiol Biotechnol, 2015, 99 (6): 2849–2859. DOI:10.1007/s00253-014-6164-y |
| [56] | Chen S, Deng Y, Chang C, et al. Pathway and kinetics of cyhalothrin biodegradation by Bacillus thuringiensis strain ZS-19[J]. Scientific Reports, 2015, 5 : 8784. DOI:10.1038/srep08784 |





