含酚废水是纸品制造、塑料生产、皮革纺织、农药医药合成、焦化、炼油等行业产生的一类污染物,21世纪初期含酚废水即被列为我国水污染控制中“重点解决的有害废水之一”[1]。含酚废水中主要包含苯酚、氯酚、甲酚、间苯二酚及其他酚类物质,其中以苯酚污染尤为严重。酚类化合物是一类离子化、弱酸性的有机物,具有毒性大、难降解的特点。此外,酚类化合物还被认为是一类原生质毒物[2],可造成原生质内的蛋白质变性凝固。有研究表明,含酚废水可对人体、水生生物、作物植物等产生巨大危害[3-4]。2013年,我国全年工业废水中酚类化合物的排放总量为1 259.1 t[5],污染形式非常严峻。
目前我国采用的含酚废水处理方法主要包括物化法(吸附法、萃取法和液膜法)、化学法(沉淀法、氧气法、电解法和光催化法)和生化法(酶处理技术、生物接触氧化法和生物流化床)三大类[6]。为了提高含酚废水的处理效果,通常采用多种方法协同处理。在酚类化合物中以苯酚为例,苯酚的降解途径为:首先在苯酚羟化酶(Phenol hydxoxylase)的作用下苯酚转化成儿茶酚(Catechol),这是苯酚好氧降解过程中的限速步骤。随后的儿茶酚降解途径有两种:邻位(Ortho)降解和间位(meta)降解,分别由儿茶酚1,2-双加氧酶(Catechol 1,2-dioxygenase)和儿茶酚2,3-双加氧酶(Catechol 2,3-dioxygenase)催化[7]。因此,研究苯酚羟化酶和儿茶酚双加氧酶这两个关键酶的基因和活性,对于明确微生物的酚类化合物降解途径具有重要意义。
在含酚废水处理过程中,生化法因其具有高效低耗的优点而被广泛应用[8]。活性污泥工艺是生化法中最常用的技术手段,在活性污泥中,起主要作用的是能够降解污染物的细菌菌群。因此针对特定细菌的研究将有利于充分提高含酚废水的生化处理效果。本课题组前期对东营市垦利石化污水处理厂来源的活性污泥的研究发现,陶厄氏菌(Genus Thauera)作为活性污泥的优势菌群,在酚类化合物的降解过程中发挥着关键作用[9]。分子生物学及相关研究发现,陶厄氏菌属不仅能够降解酚类污染物[10],还具有脱氮除磷作用[11]和反硝化作用[12-13]。陶厄氏菌的芳香化合物的降解机制存在较多未解之谜。如以往普遍认为的儿茶酚双加氧酶仅会在有氧条件下催化苯环的开环,但研究证实,在陶厄氏菌T. aromatica K172中,儿茶酚1,2-双加氧酶在厌氧条件下才有活性[14]。因此,研究陶厄氏菌降解酚类物质的作用和机理,对于揭示含酚废水的生物处理、降低酚类化合物污染等具有重要意义。
1 材料与方法 1.1 材料 1.1.1 菌株来源本研究利用从山东省东营市垦利石化污水处理厂采集的活性污泥样品,通过“菌悬液接种-样品筛选-分离-纯化-再纯化-菌株保存-菌株16S rRNA基因测序”的步骤,筛选出一株具有降解酚类化合物功能的陶厄氏细菌K11。现保存于中国普通微生物菌种保藏管理中心(CGMCC=1.5731) 和韩国农业典型菌种保藏中心(KACC=19216)。
1.1.2 主要试剂实验所用酚类化合物除苯酚外均购自日本TCI试剂公司,苯酚、乙酸丁酯、氯仿以及无机盐培养基成分化学试剂均购自国药集团,酵母提取物、麦芽糖提取物购自OXOID公司。所用化学试剂均为分析纯。
1.1.3 培养基类型GYM培养基:葡萄糖,4g/L;酵母提取物,4 g/L;麦芽糖提取物10 g/L,调至pH 7.0。
基础无机盐培养基(MS):(NH4)2SO4 1.32 g/L,K2HPO4·3H2O 2.28 g/L,NaH2PO4·2H2O 0.47 g/L,MgSO4 0.12 g/L,ZnSO4·7H2O 0.46 mg/L,CaCl2 2.63 mg/L,FeSO4·7H2O 0.72 mg/L,MnSO4 0.12 mg/L,调至pH 7.0。
1.2 方法 1.2.1 陶厄氏细菌的系统分类学分析在无菌的条件下,将陶厄氏细菌K11接种到GYM培养基,在35℃恒温摇床上170 r/min培养48 h,采用细菌基因组DNA提取试剂盒提取该细菌的基因组,利用通用引物27F和1492R扩增其基因组,电泳检测后,送上海生工生物工程技术服务有限公司进行测序。
通过对陶厄氏菌K11和相似细菌基因序列的比对,利用MEGA 6.0软件,采用邻接法(Neighbour-joining),自展值1 000(bootstrap value=1 000) 构建分离菌株及其最相近种属标准菌株的16S rRNA基因系统发育树。
1.2.2 陶厄氏菌K11对多种酚类化合物降解作用的研究将K11接种到MS培养基,以类酚类化合物作为唯一碳源,初始酚浓度分别设定为500 mg/L和1 000 mg/L。在30℃,150 r/min条件下培养72 h,利用含有5 mg/L乙酸丁酯作为内标物的氯仿作为萃取剂,对发酵液进行萃取处理,萃取样品进行气相色谱(Agilent 7890A)分析,以确定酚类化合物的降解效果。
色谱条件:选用HP-5色谱柱分流进样,分流进样比为20:1;进样口温度320℃;FID检测器温度320ä;程序升温,初始温度为60℃,恒温1 min,20℃/min升温至320℃,恒温3 min;空气流量为400 mL/min,H2流量为40 mL/min。进样量为1 µL。
1.2.3 陶厄氏菌K11对苯酚降解关键基因的克隆苯酚的降解首先从苯酚的羟基化作用开始,生成邻苯二酚或间苯二酚,然后进行双加氧作用开环,再经过后期的酶促反应逐步代谢进入三羧酸循环[15],最终为苯酚降解菌的生长繁殖提供能量。为了验证苯酚在菌株K11体内的降解途径,根据Futamata[16]等设计的苯酚羟化酶基因引物,以及NCBI已发表的基因组序列,设计邻苯二酚双加氧酶基因的引物,如表 1所示。利用K11的基因组DNA,进行PCR扩增,将扩增片段进行测序,可获得该基因的碱基序列信息。
以500 mg/L苯酚作为唯一碳源,在30℃、150 r/min条件下培养24 h,培养液经10 000 r/min离心10 min(4℃),取沉淀,用0.1 mol/L的磷酸盐缓冲液(pH 7.5) 清洗两次后,重新悬浮。将悬浮液在冰浴条件下进行超声波破碎:循环99次,每次3 s,振荡3 s,功率120 W。破碎后液体6 000 r/min离心10 min(4℃),去除沉淀得到粗酶液。
1.2.4.1 苯酚羟化作用途径研究取2.7 mL缓冲液、0.2 mL 300 mg/L的苯酚溶液及0.2 mL的粗酶液于试管中摇匀,置于40℃恒温水浴中。在零时刻加入粗酶液,之后分别将试管在10-60 min内每隔10 min取出,并煮沸3 min,直至酶失活,反应终止。用含有5 mg/L乙酸丁酯作为内标物的氯仿作为萃取剂,萃取样品进行气相色谱分析。色谱条件同1.2.2。
1.2.4.2 邻苯二酚双加氧酶途径研究分别移取2.9 mL缓冲溶液、0.1 mL 0.01 mol/L的邻苯二酚溶液及0.1 mL的粗酶液于试管中摇匀,放入37℃的恒温水浴中。在零时刻加入粗酶液,之后分别将试管在1-18 min内每隔1 min取出,并煮沸3 min,直至酶失活,反应终止;然后,分别将其放入紫外分光光度计(日本岛津UV-2450) 中连续(200-500 nm)扫描其光谱吸收特征。
邻苯二酚存在两种分解方式,分别是:1,2-双加氧酶起作用底物后,产物为内酯,在波长为在260 nm处有吸收峰。2,3-双加氧酶起作用底物后,产物为2-HMSA(2-羟基黏康酸半醛),在波长为在375 nm处有吸收峰。
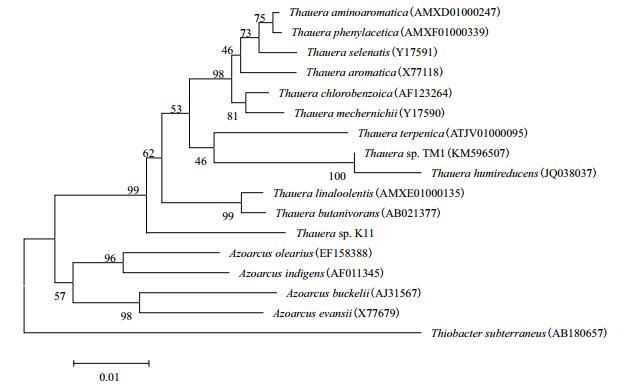
2 结果 2.1 陶厄氏细菌的系统分类学分析获得陶厄氏菌K11基因组的测序结果,用美国国立生物技术信息中心(NCBI)的BLAST程序对该菌的16S rRNA基因序列和GenBank已收录的序列进行核苷酸同源性比对发现,与之序列相似性最大的是已知标准菌株Thauera aromatica DSM6984T(X77118),相似度为97.49%。
利用MEGA6.0软件,构建出陶厄氏菌K11与其相近菌株的16S rRNA基因的系统发育树(图 1)发现K11独立成簇。
|
| 图 1 陶厄氏细11与其标准菌株的16S rRNA基因的系统发育树 |
经过气相色谱检测,菌株Thauera sp. K11对酚类化合物降解效果(表 2)。由表 2降解试验可知,以500 mg/L上述物质计,培养72 h后,Thauera sp. K11对苯酚、间甲苯酚、2,4-二甲基苯酚、3,4-二甲基苯酚的降解能力可达到100%;其次,对邻甲苯酚、2,5-二甲基苯酚、3-乙基苯酚的降解能力可达到80%以上;对对甲苯酚、2,6-二甲基苯酚的降解能力可达到70%以上;再次是对2,3-二甲基苯酚、3,5-二甲基苯酚的降解能力可达到57%以上。以1 000 mg/L上述物质计,Thauera sp. K11对大部分物质的降解率可以达到50%及以上。
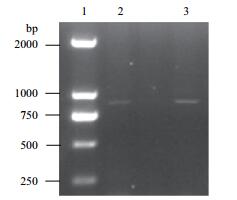
对K11基因组的DNA进行PCR扩增,扩增条带如图 2所示。将目的DNA片段进行测序,测序结果显示,K11的苯酚羟化酶基因片段长度为868 bp,与基因组数据库(NCBI)的比对结果显示,与之相似度最大的基因是Thauera sp. HMW106 phenol hydroxylase alpha subunit(pheN)gene,相似度为99%。邻苯二酚双加氧酶片段长度为927 bp,与基因组数据库的比对结果显示,除去基因组与之相似度最大的基因是Thauera sp. MZ1T catechol 2,3-dioxygenase。将相似性高的序列进行系统发育分析,得到系统发育树的结构(图 3),分析K11的苯酚羟化酶基因和邻苯二酚双加氧酶基因在系统发育树上的位置发现,其与Thauera属相关基因进化距离较近。因此,从基因水平上证实了该细菌是通过苯酚羟化酶和邻苯二酚双加氧酶的途径进行苯酚代谢的。
|
| 图 2 PCR扩增结果 1:D2000 Marker;2:苯酚羟化酶基因;3:邻苯二酚双加氧酶基因 |

|
| 图 3 菌株K11苯酚羟化酶基因(A)和邻苯二酚双加氧酶基因(B)系统进化树 |
气相色谱分析结果(图 4)显示,随着酶催化时间的延长,邻苯二酚在体系中能被检测到,同时苯酚的含量逐步降低。推测苯酚被催化形成邻苯二酚,但由于邻苯二酚双加氧酶的催化效率较高,邻苯二酚检测的含量较低。由实验结果可得出,Thauera sp. K11是通过产生苯酚羟化酶,催化生成邻苯二酚这一途径降解苯酚。

|
| 图 4 气相色谱测定苯酚和邻苯二酚的含量 |
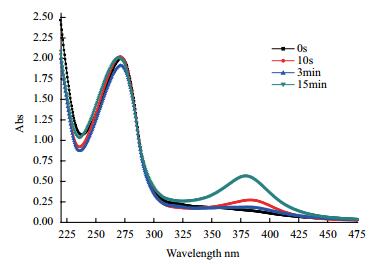
实验结果(图 5)显示,在375 nm处,在1 min时就有波峰出现。说明此酶分解邻苯二酚是从苯环两羟基的间位断开的,发现菌株Thauera sp. K11是通过邻苯二酚-2,3-双加氧酶催化酚进行降解。
|
| 图 5 紫外分光光度计扫描邻苯二酚降解后产物 Catechol:邻苯二酚;2-HMSA:2-羟基粘康酸半醛 |
目前陶厄氏细菌属(Thuaera)下分离出10余种细菌,具有酚类化合物降解作用的包括Thuaera aromatic K172[17]、Thuaera aromatic T1[18]、Thuaera aromatic AR-1[19]等,还包括具有硒酸[20]和甲苯[21]降解作用的Thauera selenatis和Thauera sp. DNT-1等。据王大威[22]报道,在渤海N油田注水中陶厄氏细菌属作为优势细菌属存在,可见陶厄氏细菌属分布之广泛。酚类化合物是一类原生质毒物,对细胞具有一定的毒害作用,因此这类化合物的微生物降解值得广泛的关注。利用微生物分离、纯化技术,在活性污泥样品中分离到菌株K11,获得该菌的16S rRNA基因序列,与其相似的标准菌株进行序列对比发现,K11的16S rRNA基因相似度较低,丰富了微生物物种多样性。
探究了该细菌对酚类化合物的降解作用和效果。通过气相色谱实验,当酚类化合物浓度为500 mg/L时,经过72 h培养可以完全降解苯酚、间甲苯酚、2,4-二甲基苯酚和3,4-二甲基苯酚,邻甲苯酚、2,5-二甲基苯酚、3-乙基苯酚的降解效果可达到80%以上;对甲苯酚和2,6-二甲基苯酚的降解效果超过70%。酚类化合物浓度为1 000 mg/L时,细菌K11通过72 h培养,大部分物质的降解率可以达到50%及以上。可以得出,陶厄氏菌K11是一株理想的含酚废水降解细菌。
为了研究该细菌对酚类化合物的降解机理,以苯酚作为降解底物,在基因水平和酶活性水平说明了Thauera sp. K11对苯酚存在以下降解途径的可能:首先通过表达苯酚羟化酶基因生成苯酚羟化酶,使苯酚增加一个羟基,变为邻苯二酚;然后表达邻苯二酚双加氧酶基因生成邻苯二酚双加氧酶,使邻苯二酚加氧开环,变成2-HMSA,随后进入三羧酸循环(TCA cycle)被K11同化利用(图 6)。

|
| 图 6 Thauera sp. K11对苯酚的降解途径 |
在垦利石化污水处理厂的活性污泥中分离获得一株较为新颖的陶厄氏菌Thauera sp. K11。通过气相色谱实验发现,该菌对11种酚类化合物具有降解作用,其中5种酚类化合物72 h的降解率 > 90%。通过基因克隆获得了K11的苯酚羟化酶和邻苯二酚双加氧酶基因。酶活实验表明,K11通过苯酚羟化酶催化苯酚转化为邻苯二酚,然后利用邻苯二酚-2,3-双加氧酶催化产生2-HMSA,通过苯酚→邻苯二酚→2-HMSA途径进行苯酚降解。因此,可以推断,Thauera sp. K11是一株能够降解多种酚类化合物的菌株。
| [1] | 乌锡康. 有机化工废水治理技术[M]. 北京: 化学工业出版社, 1999: 150-153. |
| [2] | 张帆, 刘媛, 贺盛福, 等. 处理含酚废水的研究进展[J]. 现代化工, 2015, 35(1): 67–72. |
| [3] | 王固宁. 苯酚高效降解复合菌群的构建及其固定化降解特性研究[D]. 长春: 东北师范大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10200-1013143767.htm |
| [4] | 吴勇民, 李甫, 黄咸雨, 等. 含酚废水处理新技术及其发展前景[J]. 环境科学与管理, 2007, 32(3): 150–153. |
| [5] | 乔鑫龙. 中空纤维膜萃取处理含酚废水的研究[D]. 杭州: 浙江大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10335-1016052757.htm |
| [6] | 范荣桂, 高海娟, 李贤, 等. 含酚废水综合治理新技术及其研究进展[J]. 水处理技术, 2013, 39(4): 5–8. |
| [7] | 孙海波. 多环芳烃降解菌的筛选鉴定, 降解特性及邻苯二酚-2, 3-双加氧酶的初步研究[D]. 济南: 山东大学, 2009. |
| [8] | Park MR, Kim DJ, Choi JW, et al. Influence of immobilization of bacterial cells and TiO2, on phenol degradation[J]. Water, Air, & Soil Pollution, 2013, 224 : 1473. |
| [9] | 张振冲. 不同的活性污泥及泡沫中微生物多样性和群落结构研究[D]. 青岛: 中国石油大学(华东), 2016. |
| [10] | Dibenedetto A, Noce RML, Aresta MNM. Structure—biodegrada-tion correlation of polyphenols for Thauera aromatica in anaerobic conditions[J]. Chemistry & Ecology, 2006, 22 (sup 1): S133–S143. |
| [11] | 杨华, 黄钧, 赵永贵, 等. 陶厄氏菌Thauera sp. strain TN9的鉴定及特性[J]. 应用与环境生物学报, 2013, 3(2): 318–323. |
| [12] | Scholten E, Lukow T, Auling G, et al. Thauera mechernichensis sp. nov. an aerobic denitrifier from a leachate treatment plant[J]. Int J Syst Bacteriol, 1999, 49 (3): 1045–1051. DOI:10.1099/00207713-49-3-1045 |
| [13] | Foss S, Harder J. Thauera linaloolentis sp. nov. and Thauera terpenica sp. nov. isolated on oxygen-containing monoterpenes(linalool, menthol, and eucalyptol)nitrate[J]. syst Appl Microbiol, 1998, 21 (3): 365–373. DOI:10.1016/S0723-2020(98)80046-5 |
| [14] | Ding B, Schmeling S, Fuchs G. Anaerobic metabolism of catechol by the denitrifying bacterium Thauera aromatica-a result of promiscuous enzymes and regulators?[J]. Journal of Bacteriology, 2008, 190 (5): 1620–1630. DOI:10.1128/JB.01221-07 |
| [15] | 唐莉丽. 高效苯酚降解细菌GXP04的苯酚羟化酶基因簇的克隆[D]. 南宁: 广西大学, 2005. http://d.wanfangdata.com.cn/Thesis/Y728207 |
| [16] | Futamata H, Harayama S, Watanabe K. Group-specific monitoring of phenol hydroxylase genes for a functional assessment of phenol-stimulated trichloroethylene bioremediation[J]. Applied & Environ Microbiol, 2001, 67 (10): 4671–4677. |
| [17] | Anders HJ, Kaetzke A. Taxonomic position of aromatic-degrading denitrifying Pseudomonad strains K 172 and KB740 and their description as new members of the genera Thauera, as Thauera aromatica sp. nov. and Azoarcus, as Azoarcus evansii sp. nov. respectively, members[J]. Int J Syst Bacteriol, 1995, 45 (2): 327–333. DOI:10.1099/00207713-45-2-327 |
| [18] | Coschigano PW. Transcriptional Analysis of the tutE tutFDGH Gene Cluster from Thauera aromatica strain T1[J]. Applied & Environ Microbiol, 2000, 66 (3): 1147–1151. |
| [19] | Gallus C, Schink B. Anaerobic degradation of alpha-resorcylate by Thauera aromatica strain AR-1 proceeds via oxidation and decarboxylation to hydroxyhydroquinone[J]. Archives of Microbiology, 1998, 169 (4): 333. DOI:10.1007/s002030050579 |
| [20] | Butler CS, Debieux CM, Dridge EJ, et al. Biomineralization of selenium by the selenate-respiring bacterium Thauera selenatis[J]. Biochem Soc Trans, 2012, 40 (6): 1239–1243. DOI:10.1042/BST20120087 |
| [21] | Shinoda Y, Sakai Y, Uenishi H, et al. Aerobic and anaerobic toluene degradation by a newly isolated denitrifying bacterium, Thauera sp. strain DNT-1[J]. Appl Environ Microbiol, 2004, 70 (3): 1385. DOI:10.1128/AEM.70.3.1385-1392.2004 |
| [22] | 王大威, 张健, 何春百, 等. 渤海N油田油藏内源微生物群落结构分析[J]. 生物技术通报, 2016, 32(9): 83–92. |





