2. 郑州大学水利与环境学院, 郑州 450001
2. School of Water Conservancy and Environmental Engineering, Zhengzhou University, Zhengzhou 450001
河流、湖泊水体中氨氮含量超标是我国水体污染的主要原因之一[1-2],因而受到人类的高度关注。多年来,世界各国在氨氮污染治理上投入大量精力,但是河流氨氮污染的现状仍旧存在。河流水体氨氮治理的方法分为物理法、化学法和生物法,物理法如底泥疏浚、环境调水,化学法如混凝沉淀、加氯处理等都有动力消耗大,需要投入大量人力、物力的特点,适于工程量大、氨氮污染更为严重的水体应急性治理[3-4];而生物法则主要依靠河流微生物的代谢活动实现对水中氨氮去除的目的,因其具有经济高效、无二次污染等优点受到广泛应用[5]。
传统生物脱氮理论中,氨氮经硝化途径被自养型亚硝化、硝化细菌逐步转化成亚硝态氮、硝态氮,再经反硝化途径被异养型的反硝化细菌转化成氮气从环境中去除[6]。20世纪80年代,Robertson等[7]筛选出Thiosphaera pantotropha,首次提出了异养硝化的概念。不同于自养硝化,异养硝化是微生物在利用有机底物的同时将氨氮转化为羟胺和亚硝酸盐,并还原成气体从环境中去除的过程,该过程是一个连续的过程,很少生成硝酸盐[8]。由于异养硝化菌具有生长速度快、溶解氧浓度要求低、氨氮去除率较高等诸多优点[9-11],异养硝化菌的筛选成为近年来污水脱氮的一个热点。
本研究以郑州市贾鲁河受污染的河水为接种样品,通过富集、分离、纯化和脱氮性能比选从中筛选出高效脱氮的土著异养硝化菌,以分子生物学技术对菌种的16S rDNA测序,结合菌种生理生化试验现象和对氨氮的转化性能鉴定菌种,旨为菌种用于河流氨氮污染的治理提供参考。
1 材料与方法 1.1 材料 1.1.1 实验样品土著脱氮微生物筛选所采用的样品为贾鲁河受污染的河水,为增加样品的生物多样性,提高成功筛选土著脱氮微生物的概率,选择沿程有支流汇入的点位以及典型污染区域的河水样品,共采集9个水样,编号#1-#9,采样点位分布,见图 1。
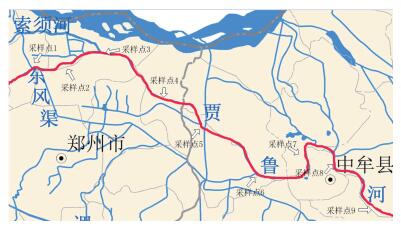
|
| 图 1 采样点位分布图 |
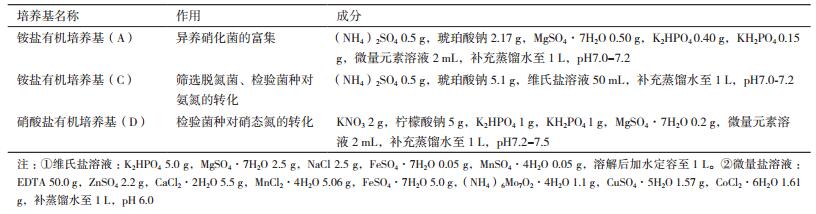
本研究采用的培养基种类、作用及具体成分如表 1所示。
以铵盐有机培养基(A)对采集的样品富集培养:以孔径为0.22 μm的滤膜对采集的水样抽滤,水体中的微生物被截留在滤膜上,将滤膜剪碎转移至装有100 mL液体富集培养基(A)的锥形瓶内,在30℃、150 r/min的条件下振荡培养,每24 h以萘氏试剂、格里斯试剂、二苯胺试剂检测培养基内铵盐、亚硝酸盐、硝酸盐的转化与生成情况,若铵盐大量减少,以1%接种量转接入新鲜富集培养基中继续富集,循环3-4个周期后,富集液具有将铵盐转化为亚硝酸盐和硝酸盐的能力,得到异养硝化菌的富集液。
1.2.2 脱氮微生物筛选方法从富集的样品中挑选铵盐转化能力较强富集液开展脱氮微生物的筛选研究:采用稀释涂布平板的方法将挑选的样品接种于固体铵盐有机培养基(C),恒温培养至菌落出现,挑取典型菌落划线分离,以纯化菌种,重复2-3次,斜面保存备用。将挑选的菌种分别接种于液体铵盐有机培养基(C)中,考察经纯化的菌种对铵盐的转化效果,选出效果较好的菌种。
1.2.3 菌种鉴定方法菌种鉴定包括16S rDNA测序方法和生理生化试验方法。
1.2.3.1 菌种的16S rDNA测序方法(1) 基因组DNA提取:用基因组快速抽提试剂盒(生工SK8 255) 提取基因组,提取方法参照配套说明书。(2) PCR扩增:采用细菌16S rDNA扩增通用引物27F-1 492R对提取的DNA扩增,扩增长度约1 500 bp,经94℃预变性4 min;94℃变性45 s,55℃复性45 s,72℃延伸1 min,共30个循环;最后72℃修复延伸10 min。(3) 凝胶电泳:扩增产物在1%琼脂糖电泳,150 V、100 mA 20 min电泳观察。(4) 纯化回收:PCR产物电泳条带切割所需DNA目的条带,以PCR引物直接测序,PCR产物的纯化和测序由生工生物工程(上海)股份有限公司完成。(5) 序列结果对比:将得到的序列输入NCBI(http://www.ncbi.nlm.nih.gov/),与数据库中已知菌种序列比对。
1.2.3.2 生理生化试验方法生理生化试验包括:氧化酶试验、接触酶试验、明胶液化试验、淀粉水解试验等,具体操作方法见《伯杰细菌鉴定手册》(第8版)。
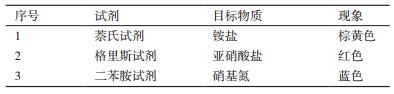
1.2.4 各形态氮含量检测方法 1.2.4.1 定性分析每个样品取3滴,分别滴加萘氏试剂、格里斯试剂及二苯胺试剂,以颜色显示氨氮、亚硝态氮及硝态氮的含量,如表 2所示。
用于初步检测氨氮、亚硝态氮、硝态氮的显色剂无法准确表示氮的浓度,因此需对样品进行定量分析。定量分析的方法如表 3所示。其中测定菌液氨氮、亚硝态氮、硝态氮时需对菌液进行离心处理,以消除菌体对吸光度测定的干扰,离心条件为3 000 r/min、15 min。
将采集的样品分别接种于铵盐液体有机培养基(A)作富集培养,经过大约4周的富集,成功得到异养硝化菌富集液,以萘氏试剂、格里斯试剂及二苯胺试剂检验最终的富集情况:#1、#2富集液对铵盐的转化能力较弱,而#3-#9对铵盐的转化能力较强,表明这些富集液能有效利用铵盐的微生物数量较多。其中#7-#9富集液遇二苯胺蓝色最深,表明该3个富集液样品中NO3--N含量最高,微生物硝化效果最好;#4富集液的NH3-N、NO2--N和NO3--N的浓度均不高,富集液中明显可以观察到大量菌体,表明该富集液中存在异养硝化菌或反硝化细菌。脱氮微生物的筛选重点选择铵盐转化性能较好的#4、#7、#8和#9富集样品。
2.1.2 菌种分离纯化结果采用梯度稀释涂布琼脂平板和平板划线分离的方法对富集的菌液进行分离和纯化,共得到菌落形态有差异的纯菌株63株,部分菌株在涂布和划线分离的平板上的形态(图 2)。
|
| 图 2 部分涂布和划线分离的平板 |
从选择培养基上筛选的63株菌依次编号,分别接种到液体选择培养基(C),在恒温摇床中培养3 d,检验菌种对氨氮的去除效果,结果如图 3所示。菌种对氨氮去除效果高低各异,C39的去除率最高为95.2%,其次为C38,去除率为91.2%;部分菌种对氨氮去除效果很低,如C20、C16、C13等,去除率在5%以下,结合菌种在液体培养基中的生长情况可以判断这几株菌在液体培养基中未正常生长,推测原因为菌株好氧,而液体培养基供氧效率不如固体培养基表面,因此氨氮去除率低。挑选对氨氮去除率高的菌种进行下步研究。
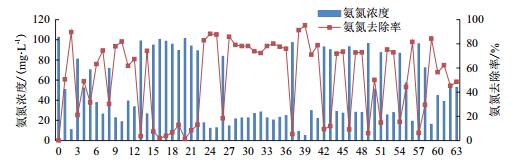
|
| 图 3 筛选的菌种对氨氮的去效果对比 图中0样品代表未接种的样品,用以空白对照,1-63按照菌种筛选先后顺序依次编号C1-C63 |
按照菌种对氨氮的去除效率高低排列,选择去除率75%以上的菌种共22株作16S rDNA测序鉴定。细菌DNA扩增引物采用通用引物27F-1 492R,扩增长度约1 500 bp,部分菌株的琼脂糖凝胶电泳图片,如图 4所示。

|
| 图 4 部分菌株的琼脂糖凝胶电泳图片 1:Mark;2-11:第一批测序的10个样品 |
经测序,将所得到的序列与NCBI数据库中的已知序列进行相似度对比发现,挑选的22株菌包括了假单胞杆菌属(Pseudomonas sp.)、噬氢菌属(Hydrogenophaga sp.)、短波单胞菌属(Brevundimonas sp.)等在内的11个不同的属,序列同源性最低为98.56%,最高为100%。假单胞杆菌属(Pseudomonas sp.)内部分菌种具有异养硝化的效果。因此,从测序的22株菌将假单胞杆菌挑选出来,共5株,分别为C2、C25、C36、C38和C56。查询《伯杰细菌鉴定手册》,参考假单胞杆菌属内模式菌种的生理生化特性,设计9组生理生化试验辅助鉴定菌种,结果如表 4所示。
根据生理生化试验进一步判断,5株菌分别为:硝化假单胞杆菌(Pseudomonas nitroredu-cens)、Pse-udomonas chengduensis、石油假单胞杆菌(Pseudo-monas oleovorans)、门多萨假单胞杆菌(Pseudomonas mendocina)、门多萨假单胞杆菌(Pseudomonas me-ndocina)。
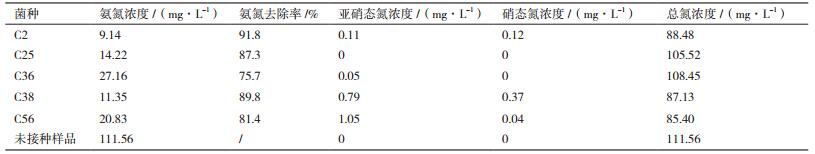
2.3 菌种脱氮性能研究 2.3.1 菌种的硝化性能将筛选的5株菌分别接种于铵盐液体有机培养基(C)中,于30℃、150 r/min条件下培养3 d,对液体培养基内氨氮、亚硝态氮、硝态氮、总氮含量进行测定,研究其硝化性能,结果如表 5所示。5株菌对氨氮都有较高的去除效果,其中C2对培养基内氨氮去除率达91.8%为最高。5株菌对硝态氮基本无积累,但菌株C38、C56对亚硝态氮有少量积累,在1 mg/L左右,其余3株菌对硝态氮、亚硝态氮基本无积累。菌株C2、C38、C56对总氮约有20%-25%的去除效果。综合这3株菌对培养基内氨氮的转化效果,可以判断培养基内氨氮一部分以铵盐形式被菌株同化吸收,用以合成自身菌体蛋白,维持生命活动,另一部分氨氮(约20%-25%)通过氮循环的方式从环境中去除,由于异养型微生物在生长过程中利用的碳源为有机碳源,生长速度较一般自养型微生物快,被同化吸收部分氨氮占比高。其余2株菌对总氮基本无去除效果,可以判断该2株菌对氨氮去除方式为菌株同化作用。
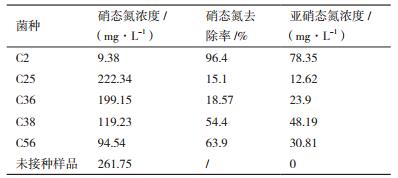
将菌种接种于硝酸盐液体有机培养基(D)中,于30℃、150 r/min条件下培养3 d,对液体培养基内硝态氮、总氮含量进行测定,以检验菌种反硝化性能,结果如表 6所示。菌株C25、C36对硝态氮的去除率较低,其余三株菌对硝态氮的去除效果较好,其中菌株C2(Pseudomonas nitroreducens)对硝态氮的去除率最高,达96.4%;5株菌对亚硝态氮都有积累,其中C2且对亚硝态氮积累量最高,达到78.35 mg/L,反硝化性能最强。
综合菌种对氨氮和硝态氮的转化情况,可以判断菌株C2(Pseudomonas nitroreducens)、C38(Pseu-domonas mendocina)、C56(Pseudomonas mendocina)为异养硝化菌,而其余2株菌是以微生物的同化方式去除氨氮的,非脱氮菌。
3 讨论由于具有生长速度快、溶解氧要求低、氨氮转化效率高等优势,近年来,越来越多的异养硝化菌被筛选和研究。姚秀清等[12]采用模拟废水和活性污泥在SBR反应器中富集培养异养硝化菌,投加的模拟废水氨氮浓度从100 mg/L逐步提升至1 396 mg/L,历经5个月,筛选出的两株异养硝化菌,对氨氮去除率分别为71.2%和85.8%;陈威等[13]利用亚硝化细菌分离培养基从浅层底泥中分离到一株具有硝化反硝化能力的异养硝化细菌,经8 d的培养,氨氮的去除率为49.2%。这些研究中异养硝化菌是从活性强、微生物种类多的环境中筛选得到的,这类细菌与长期栖息于河水中的土著菌相比,对河水环境的适应能力较差,因而难以在河水中发挥高效脱氮作用。
王珺等[14]从城市纳污河流中筛选出一株具有异养硝化功能的假单胞杆菌,该菌株7 d内对NO3--N和NO2--N的去除率分别达56.26%和53.99%;苏俊峰等[15]从水库底泥中富集分离出一株贫营养型异养硝化菌,优化培养条件后,对氨氮去除效果明显,氨氮浓度从9.02 mg/L、7.49 mg/L下降到1.83 mg/L、1.07 mg/L,最高去除率达91.42%;芮传芳等[11]从巢湖底泥中分离出一株具有氨氮转化活性的枯草芽孢杆菌,氨氮转化效率为39.4%。这些研究将菌种判定为异养硝化菌的依据仅是菌种能利用有机碳源、对氨氮去除效果高,然而水体中微生物种类相当复杂,有相当一部分微生物能将氨氮作为氮源用于自身生命活动,这给利用选择培养基筛选异养硝化菌的方法增添误导信号,在该类选择培养基上能生长的细菌并非都是异养硝化菌。本研究从受污染的贾鲁河水体中筛选异养硝化菌,所得菌种为贾鲁河土著菌种,在河流污染治理上比外来菌种能更快适应环境;在菌种的鉴定上,结合了分子生物学方法以及对菌种的生理生化特性研究初步挑选了5株可能为异养硝化菌的假单胞杆菌,通过该5株菌对氨氮和硝态氮的转化途径,从中筛选了3株异养硝化菌,在有效利用铵盐、硝酸盐的同时,还通过异养硝化途径对氨氮去除,该过程是一个连续过程,不生成NO3-,与Richardson等[16]对异养硝化途径的解释NH3-N→NH2OH→N2O→N2相符。
4 结论利用铵盐选择培养基从贾鲁河污染水体中筛选出能高效去除氨氮的5株假单胞杆菌,经菌种鉴定分别为硝化假单胞杆菌(Pseudomonas nitroreducens)、Pseudomonas chengduensis、石油假单胞杆菌(Pseudomonas oleovorans)、门多萨假单胞杆菌(Pseudomonas mendocina)、门多萨假单胞杆菌(Pseudomonas mendocina)。
分析菌株对氨氮和硝态氮的转化情况,发现菌株C2、C38、C56具有较强的硝化和反硝化性能,对氨氮的去除率最高达91.8%,且在对氨氮的转化过程中无NO3-生成,符合异养硝化菌对氨氮的转化途径,结合16S rDNA测序结果以及生理生化特性最终鉴定其为异养硝化菌。
| [1] | 于洋. 北运河水体中氨氮的氧化过程及微生物响应特征[D]. 北京: 首都师范大学, 2012. http://cdmd.cnki.com.cn/article/cdmd-10028-1012349594.htm |
| [2] | 刘金吉, 王波, 徐鑫. 塔山水库入库河流水质污染状况调查与评价研究[J]. 环境科学与管理, 2014, 11: 64–68. DOI:10.3969/j.issn.1673-1212.2014.01.014 |
| [3] | 杨玉珍, 王婷, 马文鹏, 等. 水环境中氨氮危害和分析方法及常用处理工艺[J]. 山西建筑, 2010, 36(20): 356–356. DOI:10.3969/j.issn.1009-6825.2010.20.223 |
| [4] | 胡学伟, 靳松望, 王亚冰, 等. 煤气化废水中有机物对磷酸铵镁结晶法去除氨氮的影响[J]. 环境化学, 2014, 33(11): 1957–1962. DOI:10.7524/j.issn.0254-6108.2014.11.010 |
| [5] | 关艳艳, 佘宗莲, 周艳丽, 等. 人工湿地处理污染河水的研究进展[J]. 水处理技术, 2010, 36(10): 10–15. |
| [6] | 郑世民. 自养微生物[M]. 北京: 科学出版社, 1983: 159-184. |
| [7] | Robertson LA, Kuenen JG. Combined heterotrophic nitrification and aerobic denitrification in Thiosphaera pantotropha and other bacteria[J]. Antonie van Leeuwenhoek, 1990 (57): 139–152. |
| [8] | Robertson LA, Kuenen JG. Thiosphaera pantotropha gen. nov. sp. nov., a facultatively anaerobic, facultatively autotrophic sulphur bacterium[J]. General Microbiol, 1983, 129 (9): 2847–2855. |
| [9] | 刘杰凤, 周天, 刘正辉. 一株新型异养硝化细菌的分离鉴定及硝化特性[J]. 环境科学与技术, 2014, 8(37): 99–103. |
| [10] | 余润兰, 苗雷. 异养硝化细菌Alcaligenessp. S3除氮特性及动力学[J]. 环境工程学报, 2012, 6(3): 869–872. |
| [11] | 芮传芳, 吴涓, 李玉成. 异养硝化细菌的筛选、鉴定及其氨氮转化特性的研究[J]. 生物学杂志, 2012, 29(1): 37–41. |
| [12] | 姚秀清, 韩明. SBR中异养硝化菌的分离与硝化特征[J]. 中国给水排水, 2010, 26(23): 83–85. |
| [13] | 陈威, 王振宇, 赵更峰, 等. 异养硝化微球菌的分离及性能评价[J]. 生态学杂志, 2010, 29(8): 1629–1633. |
| [14] | 王珺, 裴元生, 杨志峰, 等. 河流中异养硝化细菌的分离及其脱氮性能研究[C]. 中国环境科学学会年会论文集, 2010: 3547-3552. |
| [15] | 苏俊峰, 黄廷林, 刘燕, 等. 异养型同步硝化反硝化处理微污染水源水[J]. 环境科学与技术, 2010, 33(3): 141–161. |
| [16] | Richardson DJ, Wehrfritz JM, Keecht A. The diversity of redox proteins involved in bacterial heterotrophic nitrification and aerobic denitrification[J]. The Diversity of Bacterial Redox Proteins, 1998, 3 : 401–408. |