页岩气是一种清洁高效的能源,已经成为继石油、煤炭之后的一种重要能源[1-2]。美国“页岩气革命”的成功为我国带来了新启示,中国页岩气于2011年被批准为独立矿种,随后国家出台多种政策鼓励页岩气开发[3]。在此背景下,四川省丰富的页岩气资源成为了能源开发的新热点[4]。然而,页岩气的开发带来的不仅仅是能源,同时也会对环境造成一定的压力[5]。页岩气开采过程可能会造成土壤的污染,钻井废弃泥浆是油井开采过程中产生的污染物,包含矿物油、酚类化合物及重金属等复杂多项体系[6-7]。西南地区部分页岩气开发井场附近土壤和钻屑中石油类污染物和重金属(Ni)都超过环境的阈值[8-9],其中长宁-威远地区土壤中镍的含量超过《土壤环境质量标准》(GB15618-2008) 三级标准限值,达到210.19 mg/kg[8]。由此治理在页岩气开采过程中造成的石油类污染土壤的同时,对重金属超标的处理同样不可忽视。而且持久性有机污染物和重金属(Cd、Pb和Ni等)污染的现象比较突出[10]。其中石油类污染一直是环境的主要问题[11-12],石油和重金属在某些情况下可以共存,更难于修复[13-14],重金属和有机污染物造成的土壤污染已成为主要的全球环境和人体健康问题[15],而如何修复多组分污染物土壤已成为近年来研究的热点问题。利用微生物技术修复复合污染土壤起着重要作用,抗性微生物不仅可以以石油为唯一碳源对石油进行降解,还可以吸附和氧化还原重金属,将有毒害的金属元素转化为无毒或者低毒的金属离子,有利于重金属在土壤中沉淀固定[16]。生物法修复多组分污染物目前仍处于起步阶段,对于微生物修复技术在石油-重金属复合污染土壤的修复研究尚且较少[17-18],在页岩气开发井场复合污染土壤的修复研究更是空白,其作用机理及影响因素还需进一步研究。
本研究从四川省长宁-威远地区页岩气开发井场重度污染区的含油土壤中筛选出了一株对镍和石油具有复合抗性和降解的菌株,鉴定其菌属,测定了其一部分的生物学特性,并研究了它对镍和石油的去除效果,为后来以该菌株为生物修复剂,对石油-重金属混合污染土壤的微生物修复奠定实验基础。
1 材料与方法 1.1 材料 1.1.1 含油污泥含油污泥样品来源于四川省长宁-威远地区页岩气开发井场内部重度污染区,油泥的主要成分为有机物、无机盐、油类和重金属,含油量在100 000 mg/kg以上和重金属含量为210 mg/kg左右,采用对角线法,采取10份土壤混合均匀后的土样。
1.1.2 培养基 1.1.2.1 富集筛选培养基富集筛选培养基主要成分为葡萄糖10 g/L,酵母粉3 g/L,NaCl 5 g/L,MgSO4·7H2O 0.25 g/L,(NH4)2SO4 1 g/L,K2HPO4 10 g/L,KH2PO4 4 g/L,pH为7.2-7.4,1×105 Pa灭菌30 min。
1.1.2.2 原油重金属液体培养基原油重金属液体培养基主要成分为原油(原油取自辽河油田,组成为:饱和烃:35.32%,芳香烃:23.17%,胶质-沥青质:41.51%)10 g/L,酵母粉3 g /L,NaCl 5 g/L,MgSO4·7H2O 0.25 g/L,(NH4)2SO4 1 g/L,K2HPO410 g/L,KH2PO4 4 g/L,pH为7.2-7.4,加入一定浓度的重金属Ni2+溶液,使最终Ni2+浓度为300 mg/L,1×105 Pa灭菌30 min。
1.1.2.3 原油重金属固体培养基原油重金属固体培养基主要成分为在相应的原油重金属液体培养基中加入质量分数为2%的琼脂[17]。
1.1.2.4 基础扩大培养基基础扩大培养基的主要成分:牛肉膏5 g/L,蛋白胨10 g/L,NaCl 5 g/L,调节pH为7.2-7.4,1×105 Pa灭菌30 min[19]。
1.2 方法 1.2.1 镍抗性和石油降解菌的分离和筛选称取新鲜土样10 g,加入到90 mL的无菌水中,在室温下振荡30 min,制备成土悬液,然后用移液枪吸取1 mL所需浓度的菌悬液,注入到富集培养基内并置于30℃恒温培养箱中,培养1-2 d,用肉眼观察培养基内是否有菌生长。取富集样品1 mL,接种于原油重金属液体培养基中,在30℃、130 r/min的摇床上培养72 h,再取培养液1 mL进行传代驯化。每72 h接种传代一次,经过5次石油重金属液体培养基驯化后,蘸取驯化菌液于培养皿上涂布分离,30℃培养48-72 h,观察菌体的生长情况,挑选生长优良的菌落经过多次纯化后,将单菌落再次接种于石油重金属液体培养基中进行摇床培养,在30℃下,130 r/min的摇床上培养[20-22]。经过复筛后,淘汰去除石油和重金属能力较低的菌株,最终筛出抗镍(300 mg/L)和具有石油降解能力的菌株,共计7株(编号M1-M7),并从这7株菌株中筛选出一株对镍和石油烃去除能力较高的菌株接种于扩大培养基中,30℃下进行增殖培养为种子液,作为鉴定和生物学特性实验的供试菌株。
1.2.2 菌株菌落及细胞形态的观察在原油重金属固体培养基上观察菌落形态、边缘、颜色和透明度等[23]。并采用扫描电镜(SEM)对分离得到的菌株进行大小和形态的观察[24]。
1.2.3 生理生化实验甲基红实验、V-P实验、吲哚实验、接触酶实验、脂酶实验、酪蛋白水解实验、糖发酵实验、柠檬酸盐实验、明胶液化实验、硝酸盐还原实验、硫化氢产生实验和动力实验等方法见参考文献[19]。
1.2.4 供试菌株对石油的降解和对镍的去除及吸附实验将供试菌株接种在扩大培养基中培养为种子液。吸取0.5 mL加入到含Ni2+浓度为300 mg/L的50 mL的扩大培养基中,30℃恒温震荡(130 r/min)培养72 h[25-26]。8 000 r/min离心10 min,将上清液和菌体沉淀完全分开,取0.5 g上清液通过消解,采用原子吸收分光光度法测定镍的含量。将剩下的菌体沉淀取0.5 g,通过采用盐酸-硝酸-氢氟酸-高氯酸消解法预处理后,用原子吸收分光光度法测定镍的含量,计算镍的去除率和吸附率[27]。再吸取0.5 mL加入到50 mL原油液体培养基中,30℃恒温震荡(130 r/min)培养7 d,采用超声萃取-紫外分光光度法测定培养基中石油含量,计算降解率。计算去除率、吸附率和降解率公式如下:
 (1)
(1)
 (2)
(2)
 (3)
(3)
菌株在基础扩大培养基中,30℃条件下培养,取对数期的菌液于装有1mL无菌生理盐水的离心管中,洗涤一次,用生工生物工程(上海)股份有限公司细菌DNA提取试剂盒,提取基因组总的DNA。
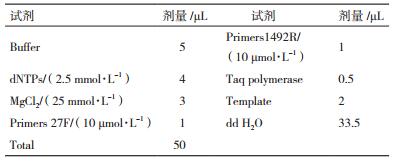
1.2.5.2 PCR反应引物设计来自文献[28]:27F:5'-AGAGTTTGATCMTGGCTCAG-3';1492R:5'-TACG-GYTACCTTGTTACGACTT-3';由生工生物工程(上海)股份有限公司合成(表 1)。
反应条件:94℃预变性4 min后进入循环,94℃变性30 s,52℃退火30 s,72℃延伸2 min,共35个循环,最后在72℃延伸10 min后降温至16℃。
PCR扩增的产物用浓度为1.2%琼脂糖凝胶电泳检验,PCR产物送生工生物工程(上海)股份有限公司测序,将测得的基因序列提交到NCBI数据库做BLAST比对,进行序列同源性分析。
1.2.6 培养条件对菌株生长的影响取种子液1 mL接种于50 mL的基础扩大培养基中(pH为7.2-7.4) 分别置于下列培养条件下震荡(130 r/min)培养24 h,取样测定OD600值。设置温度的梯度为15、20、25、27.5、30、35和37.5℃。调节培养液初始pH至5、6、7、8、9、10和11。用葡萄糖和硝酸钾作为碳源和氮源调节C﹕N[29]为2:1、5:1、7:1、10:1、12:1、15:1和17:1。设置NaCl浓度为1%、2%、3%、5%、7%、9%和11%。所有实验设置3个重复实验。
1.2.7 菌株生长特性研究 1.2.7.1 菌株的生长曲线取供试菌株接种于100 mL的基础扩大培养基中,30℃在0-72 h周期里,间隔2 h取样,测定OD600值。
1.2.7.2 污染物浓度对菌株生长的影响分别配制下列不同污染物浓度的基础扩大培养基中(pH为7.2-7.4),向每瓶接种1 mL种子液,30℃下培养0、2、3、4、5、7、10、18、30和48 h取样测定OD600值。Ni2+浓度分别为150、200、250、300和350 mg/L。原油浓度分别为2.5、5、7.5、10和12.5 g/L。原油和重金属混合浓度分别为2.5和0.15、2.5和0.2、2.5和0.25、2.5和0.3、2.5和0.35 g/L。
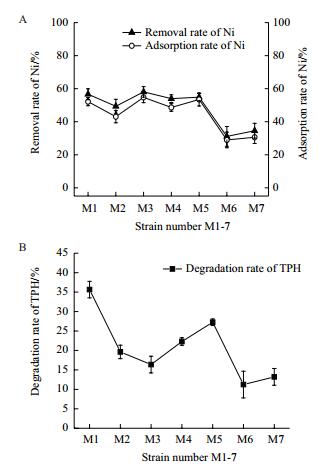
2 结果 2.1 供试菌株对石油降解和镍的去除及吸附实验由图 1-A可知,在初筛时筛选出的7株菌株中,M1和M3菌株对镍有较好的吸附和去除效果,当Ni2+的浓度为300 mg/L时,M1菌株对镍的去除率和吸附率分别达到了56.64%和52.16%,M3对镍的去除率和吸附率分别为58.07%和54.76%。由图 1-B可知,当总石油烃的浓度为10 g/L时,M1菌株对石油烃的去除率到达35.7%,而M3对石油烃的去除率只有16.4%。
|
| 图 1 镍抗性和石油降解菌株对镍的去除率及吸附率(A)及菌株对总石油烃的降解率(B) |
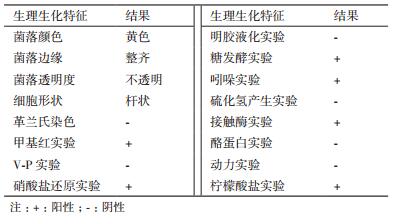
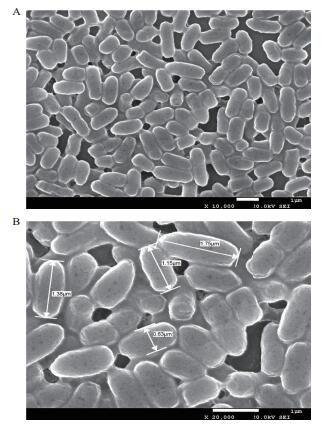
通过对菌株菌落的形态观察及生理生化实验结果(表 2)得出,该菌株的菌落形态为圆形且湿润、其颜色为淡黄色、边缘规整、顶部凸起且透明度较差;从图 2可以看出细胞呈杆状,表面略显粗糙,直径约0.6 μm,长约1.1-1.8 μm。此外,M.R实验、硝酸盐还原实验、糖发酵实验、吲哚实验、接触酶实验及柠檬酸盐实验结果均为阳性(记为“+”)。革兰氏染色、V-P实验、脂酶实验及酪蛋白水解实验、H2S产生实验、明胶液化实验和动力实验结果均为阴性(记为“-”)。从生理生化实验结果发现,上述菌株生理生化结果与柠檬酸杆菌属相一致,初步鉴定为柠檬酸杆菌属。
|
| 图 2 菌株细胞扫描电镜图片 |
为进一步确定菌株的种属关系,通过细菌基因组DNA提取试剂盒提取了M1基因组的DNA,并以27F:5'-AGAGTTTGATCMTGGCTCAG-3'和1492R:5'-TACGGYTACCTTGTTACGACTT-3'为PCR上下游引物,进行PCR扩增,扩增出约1 407 pb的条带并测序。序列结果与GenBank中的16S rDNA序列进行Blastn相似性分析发现,上述菌株与柠檬酸杆菌属(Citrobacter sp.)的16S rDNA序列的同源性均达到了98.7%以上,上述菌株的系统发育树如图 3所示,从进化距离分析发现与法氏柠檬酸杆菌的标准模式菌株接近,因此将它鉴定为法氏柠檬酸杆菌,命名为Citrobacter farmeri strain M1。
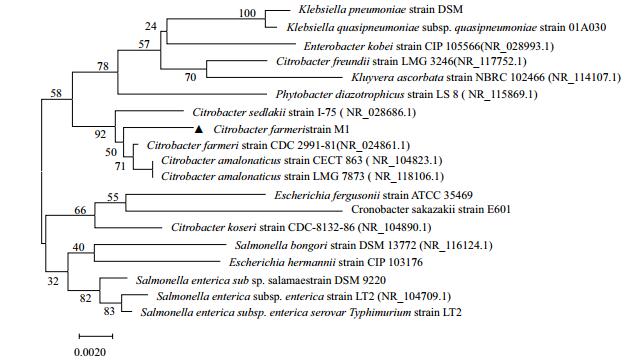
|
| 图 3 菌株M1的16S rDNA系统发育树 |
由图 4-A可以看出,该菌株最适宜的培养温度在27.5℃和32℃之间。在30℃之前,随着温度的升高菌株的生长速率升高,超过30℃菌株的生长速率降低;由图 4-B可以看出,该菌株的最适pH在9左右;如图 4-C所示,该菌株最适的C:N为10:1;由图 4-D可以看出,该菌株随着盐浓度的增大,菌株的生长速率受到抑制,当盐浓度超过5%生长受到抑制,当达到11%时基本不能正常生长。
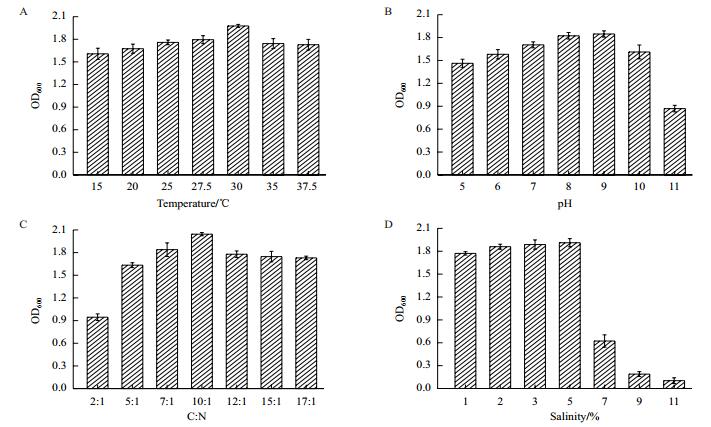
|
| 图 4 培养条件对菌株生长的影响 A:温度对菌株生长的影响;B:pH对菌株生长的影响;C:C:N对菌株生长的影响;D:盐浓度对菌株生长的影响 |
由图 5所示,该菌株在生长了2 h时的OD600值为0.08左右,在培养了2-16 h后,OD600迅速上升,达到了2.0左右,说明该菌株在接种0-2 h内处于延迟期;在2-16 h内处于对数生长期;在培养至16-50 h间,OD600值变化不大,说明这时进入了生长的稳定期;50 h之后,OD600值开始减小,说明此时该菌株的生长进入衰亡期。以上结果说明该菌株生长速度快,适用于石油和重金属复合污染土壤的修复。
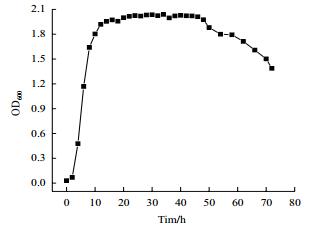
|
| 图 5 菌株生长曲线 |
由图 6可知,在菌株的生长前期0-4 h,Ni2+浓度对菌株生长的影响较小,但是4-10 h内Ni2+的存在对菌株的生长抑制较强,随着对数期的到来,菌株才恢复了正常生长。随着培养基内Ni2+浓度的升高,菌株的生长提前进入稳定期,当Ni2+浓度为300 mg/L时,菌株在培养10 h后直接进入稳定期缓慢生长,没有明显的对数期出现。而当Ni2+浓度为100 mg/L时,菌株在培养至7 h进入对数期,20 h后才开始进入稳定期,对数期持续了13 h左右。
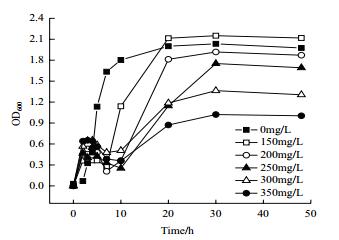
|
| 图 6 Ni2+浓度对菌株生长的影响 |
由图 7可知,从其在含原油培养基中的生长的OD600值和其生长曲线比较可以看出,该菌株的生长均随着培养基中原油质量浓度的升高而受到不同的抑制。在原油质量浓度为2.5 g/L时,供试菌株对数生长期缩短,提前4 h进入最高生长量期,但当原油的质量浓度进一步升高时,其生长能力相对的有所下降。
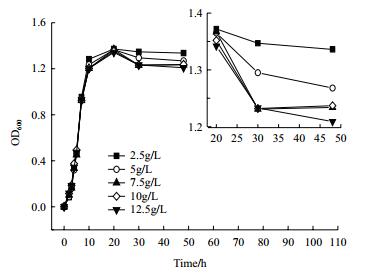
|
| 图 7 石油浓度分别对菌株生长的影响 |
由图 8可知,当液体培养基同时添加不同量的Ni2+和原油后,菌株生长受到抑制。在原油浓度2.5 g/L时,当Ni2+浓度超过0.25 g/L时,菌株生长受到明显抑制。
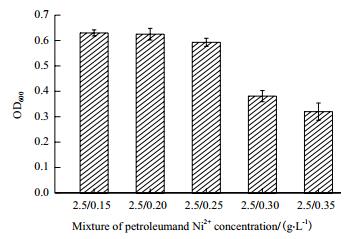
|
| 图 8 石油和Ni2+混合浓度(g/L)对菌株生长的影响 |
通过对菌株M1和M3对石油和镍去除和吸附实验,对石油主要通过降解作用从而达到对石油的去除。对镍的吸附和去除率观察得到相差不大,由此可见,细菌对重金属主要通过吸附和通过一系列的活动使重金属镍改变价态,使其生成磷酸盐沉淀而达到去除的作用[30]。利用微生物处理石油-重金属混合污染土壤的实际应用中,所用菌株对金属离子有较高的抗性和石油污染物有较好的降解效果,那么该菌株在污染土壤中往往具有较高的存活率,其处理污染土壤的效率也就越强[31-33]。综合比较选取M1作为接下来的实验菌株。
3.2 不同培养条件对菌株生长的影响温度是通过影响蛋白质、核酸等大分子的结构与功能进而影响微生物的生长、繁殖和新陈代谢。温度过高或过低,都会影响微生物的活性和代谢能力。不同微生物的生长繁殖要求的最适温度不同,根据微生物生长的最适温度范围,可分为高温菌、中温菌和低温菌。因此,每种菌株对环境温度的要求有一个最适宜的生长范围,本研究菌株最适宜的培养温度在27.5-32℃之间。pH通过以下3个方面对微生物的生长产生影响:一是使蛋白质和核酸等大分子物质所带电荷发生改变,从而影响其生命活性;二是引起细胞膜电荷变化,导致微生物吸收营养物质的能力改变;三是改变环境中营养物质的性质及有害物质的毒性。同时pH是反应菌株对环境的适应能力,不同的菌株对pH条件的要求各不相同,它们只能在一定的范围内生长,然而每个菌株的生长最适宜的pH常限制于一个较小的范围。该菌株在pH 7-9范围内生长良好,说明该菌株具有一定的耐碱性。微生物的生长繁殖需要适宜的营养,碳源、氮源、无机盐、微量元素、生长因子等都是微生物生长所必须,缺少其中一种,微生物便不能正常生长、繁殖。同时营养元素的比例也会对微生物的生长产生一定的影响,该菌株最适的C:N为10:1,在该营养元素比例下,可以为微生物创造一个良好的生长环境。高盐度对微生物的毒害作用主要是通过升高环境渗透压而破坏微生物的细胞膜和菌体内的酶,从而破坏微生物的生理活动。微生物生长繁殖受到盐度影响的作用主要有3种情况:脱水死亡、物质吸收过程受干扰阻断死亡和中毒死亡。不同微生物对渗透压的适应能力不同。该菌株属于耐盐度比较高的菌株,西南地区页岩气井场附近的土壤含盐量较低,均未超过1%[8],由此可见该菌株适用于页岩气井场附近石油和重金属复合污染区的修复。
3.3 Ni2+和石油浓度对菌株生长的特性的影响菌株的适应期相对有所延长,可能由于金属离子的存在对菌株生长产生了毒害作用。由于随着Ni2+浓度的升高,使得对数期缩短或者存在不明显,从而使细胞总量减少。但是从本实验来看,Ni2+浓度在200 mg/L以下时,菌株受到的抑制比较小,最大OD值达到了2.1左右,和生长曲线相比,反而能得出低浓度的金属离子的存在反而会促进菌株的生长[34];当Ni2+浓度达到300 mg/L时,才出现明显的抑制,说明该菌株对镍的抗性比较强。重金属等离子的抑菌作用主要是使菌体蛋白质变性,或者是与酶的-SH结合使酶失去活性。不同因素对微生物的影响不同,同一因素因其浓度不同,对微生物的影响也不同。
原油的质量浓度过高会对原油降解菌产生毒害作用,抑制菌体的正常生长繁殖,最终将会导致原油降解率下降,从而影响石油污染物的去除。另外,原油质量浓度过高,在培养基表面会形成一层油膜,油膜会阻止空气中的氧气向水体内部扩散,导致水中的溶解氧不足,从而抑制好氧微生物的生长[35],因此也会出现原油质量浓度的升高,微生物对生命力下降的现象。综上所述,该菌株对原油浓度有较高的耐受性。
由于筛选出来的该菌株将用于实际复合污染土壤的修复,该污染土壤中石油类污染物浓度较低,均未超过1%[8],因此固定原油的浓度,调节镍离子的浓度考察混合浓度对菌株生长的影响。本研究发现,复合污染物的对菌株的生长有较大程度的抑制,说明该菌株对复合污染物的抗性减弱。
4 结论从四川省长宁-威远页岩气开发井场重度污染土壤中,分离得到一株耐重金属镍的石油降解菌株,经过对菌株与菌落的观察和生理生化实验和16S rDNA分析,鉴定该菌株为法氏柠檬酸杆菌,命名为Citrobacter farmeri strain M1。该菌在重金属镍和石油污染的生物修复过程中起重要作用。(2) 柠檬酸杆菌M1的生长条件试验结果表明,该菌株具有较宽泛的pH生长范围,在pH7-9范围内生长良好;在盐浓度1%-5%范围内能较好地生长,并具有一定的耐碱性。当盐浓度超过5%该菌株生长受到抑制,属于耐盐度较高的菌株。柠檬酸杆菌M1生长的最佳条件为是温度为30℃,pH为9,C:N为10:1,盐最高耐受度为5%。(3) 在液体培养基中,柠檬酸杆菌M1对石油和重金属镍有较好的降解和去除作用,实验周期内该菌株对原油降解率可达到35.65%,对重金属Ni2+的去除率和吸附率分别达到56.64%和54.16%,同时对金属镍的抗性可达到300 mg/L。
| [1] | 吴孟余. 我国页岩气开发现状与展望[J]. 电力与能源, 2014, 35(4): 405–407. |
| [2] | 胡颖, 彭博. 美国页岩气开发现状及其能源发展趋势[J]. 广东化工, 2014, 41(23): 82–83. DOI:10.3969/j.issn.1007-1865.2014.23.038 |
| [3] | 杜群, 万丽丽. 美国页岩气能源开发的环境法律管制及对中国的启示[J]. 中国政法大学学报, 2015(6): 146–158. |
| [4] | 郭亦成. 四川省页岩气开发研究[D]. 成都: 四川省社会科学院, 2016. |
| [5] | 于慧龙. 论页岩气开发利用的革命性影响和作用[D]. 重庆: 重庆师范大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10637-1015959668.htm |
| [6] | 王景艺. 非传统能源开发对气藏区周边水系统的影响分析[D]. 北京: 华北电力大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-11412-1016270466.htm |
| [7] | 孟永涛. 页岩气水平井油基泥浆体系的研究及应用[D]. 荆州: 长江大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10489-1013361328.htm |
| [8] | 朱天菊, 解艺平, 吴波, 等. 页岩气开发井场污染土壤可生化性研究[J]. 广州化工, 2017(3): 60–62. |
| [9] | 卢邦俊. 页岩气钻屑中的重金属成分究[J]. 能源环境保护, 2015, 29(5): 33–34. |
| [10] | 骆永明. 污染土壤修复技术研究现状与趋势[J]. 化学进展, 2009, 21(203): 558–565. |
| [11] | Lu M. The use of goosegrass(Eleusine indica)to remediate soil contaminated with petroleum[J]. Water, Air, & Soil Pollution, 2010, 209 (1): 181–189. |
| [12] | Xu Y, Lu M. Bioremediation of crude oil-contaminated soil:comparison of different biostimulation and bioaugmentation treatments[J]. Journal of Hazardous Materials, 2010, 183 (1-3): 395–401. DOI:10.1016/j.jhazmat.2010.07.038 |
| [13] | Alisi C, Musella R, Tasso F, et al. Bioremediation of diesel oil in a co-contaminated soil by biougmentation with a microbial formula tailored with native strains selected for heavy metals resistance[J]. Science of the Total Environment, 2009, 407 (8): 3024–3022. DOI:10.1016/j.scitotenv.2009.01.011 |
| [14] | Atagana HI. Bioremediation of co-contamination of crude oil and heavy metals in soil by phytore-mediation using chromolaena odorata, (L)King & H. E. Robinson[J]. Water, Air, & Soil Pollution, 2011, 215 (1): 261–271. |
| [15] | PéREZ RM. Combined strategy for the precipitation of heavy metals and biodegradation of petroleum in industrial waste-waters[J]. Journal of Hazardous Materials, 2010, 182 (1-3): 896–902. DOI:10.1016/j.jhazmat.2010.07.003 |
| [16] | Yang W, Zhang T, Li S, et al. Metal removal from and microbial property improvement of a multiple heavy-metals contaminated soil by phytoextraction with a cadmium hyperaccumulator Sedum alfredii, H[J]. Journal of Soils and Sediments, 2014, 14 (8): 1385–1396. DOI:10.1007/s11368-014-0875-7 |
| [17] | 李亭亭. 石油-重金属复合污染盐渍土生物修复中MCB对重金属的钝化研究[D]. 济南: 山东师范大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10445-1014191515.htm |
| [18] | Reddy KR. Technical challenges to in-situ remediation of polluted Sites[J]. Geotechnical and Geological Engineering, 2010, 28 (3): 211–221. DOI:10.1007/s10706-008-9235-y |
| [19] | 杜连祥, 路福平. 微生物学实验技术[M]. 北京: 中国轻工业出版社, 2010. |
| [20] | 马前, 曹同成. 新型耐金属微生物的筛选研究[C]// 2013中国环境科学学会学术年会论文集. 中国环境科学学术年会, (第五卷), 2013. |
| [21] | 王慧萍. 耐锌细菌的筛选、抗锌特性及其对苯酚的降解研究[D]. 上海: 东华大学, 2011. http://d.wanfangdata.com.cn/Thesis/Y2136661 |
| [22] | 付瑾. 镉抗性菌DX-T3-01的筛选鉴定与吸附镉机理及其降解苯酚特性研究[D]. 上海: 东华大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10255-1011072025.htm |
| [23] | 金忠民, 郝宇, 刘丽杰, 等. 一株铅镉抗性菌株的分离鉴定及其生物学特性[J]. 环境工程学报, 2015(7): 3551–3557. DOI:10.12030/j.cjee.20150776 |
| [24] | 孙士顺. 重金属铜抗性细菌的筛选鉴定、吸附特性与机理研究[D]. 长春: 东北师范大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10200-1016118267.htm |
| [25] | 曹德菊, 王方, 胡海荣. 抗铅微生物的筛选及对水中铅的去除效果研究[J]. 环境与健康杂志, 2011, 28(1): 66–68. |
| [26] | 张汉波, 郑月, 曾凡, 等. 几株细菌的重金属抗性水平和吸附量[J]. 微生物学通报, 2005, 32(3): 24–29. |
| [27] | 悉旦立. 环境监测(修订版)[M]. 北京: 高等教育出版社, 1995. |
| [28] | Baker GC, Smith JJ, Cowan DA. Review and re-analysis of domain specific 16Sprimers[J]. Journal of Microbiological Methods, 2003, 55 (3): 541–555. DOI:10.1016/j.mimet.2003.08.009 |
| [29] | 林辰壹, 马娟, 杨婷婷, 等. 优化氮源种类及碳氮比对阿魏菇液体种生长的效应[J]. 新疆农业科学, 2012, 49(11): 2042–2047. DOI:10.6048/j.issn.1001-4330.2012.11.013 |
| [30] | 赵本良, 仇荣亮, 刘金芩, 等. 一株硫酸盐还原细菌的筛选及其功能研究[C]//第十次全国环境微生物学术研讨会论文摘要集. 2007. |
| [31] | Chen C, Lei W, Min L, et al. Characterization of Cu(Ⅱ)and Cd(Ⅱ)resistance mechanisms in Sphingobium sp. PHE-SPH and Ochrobactrum sp. PHEOCH and their potential application in the bioremediation of heavy-Metal phenanthrene co-contaminated sites[J]. Environmental Science and Pollution Research,, 2016, 23 (7): 6861. DOI:10.1007/s11356-015-5926-0 |
| [32] | Dave S, Damani M, Tipre D. Copper remediation by Eichhornia spp. and sulphate-reducing bacteria[J]. Journal of Hazardous Materials, 2010, 173 (13): 231–235. |
| [33] | Limcharoensuk T, Sooksawat N, Sumarnrote A, et al. Bioaccumulation and biosorption of Cd2+ and Zn2+ by bacteria isolated from a zinc mine in Thailand[J]. Ecotoxicol Environ Saf, 2015, 122 : 322–330. DOI:10.1016/j.ecoenv.2015.08.013 |
| [34] | 赵晓秀. 重金属铜复合污染土壤中石油的微生物降解[D]. 大连: 大连理工大学, 2008. http://cdmd.cnki.com.cn/article/cdmd-10141-2009041675.htm |
| [35] | 谢鲲鹏, 周集体, 曲媛媛, 等. 一株耐盐原油降解菌的分离鉴定及其降解特性研究[J]. 海洋环境科学, 2009, 28(6): 680–683. |