2. 宁夏农林科学院 宁夏回族自治区银川市 750002
2. Germplasm Resources Institute, Ningxia Academy of Agriculture and forestry Sciences, Yinchuan 750002
咪唑酮类除草剂从20世纪80年代开始被广泛应用于大豆田化学除草[1]。该类除草剂主要通过抑制植物乙酰乳酸合酶(ALS)合成,阻断植物必需氨基酸的合成从而使植物死亡[2],目前已经被证实该类除草剂残留时间较长,不仅对后茬作物造成严重危害,导致轮作困难,同时还给环境带来了严重的污染[3]。
咪唑乙烟酸(imazethapyr)是咪唑酮类除草剂的种类之一,它具有杀草谱广、选择性强、活性高等优点[4]。在20世纪90年代它曾是美国大豆田的第一大除草剂品种,目前主要在中国东北地区大豆田中使用[5],主要用来控制一年生及多年生阔叶杂草。该类除草剂有效期长,在土壤中的吸附系数较低,而且在水中的溶解度较大,不仅对下茬敏感作物产生要害,同时有可能对地下水造成一定程度的污染[6]。García-Garijo[7-8]发现咪唑乙烟酸可以快速积累在下茬作物中,如大豆和野豌豆中,在植物组织中抑制ALS的产生。鉴于咪唑乙烟酸的广泛使用和相关风险,快速有效去除农田土壤中咪唑乙烟酸残留物是至关重要的问题。
环境中除草剂的降解主要有生物降解和非生物降解两种方法[9],微生物是除草剂降解的主要因素,它可以利用除草剂为碳源或氮源供其自身生长和繁殖,从而达到降解除草剂的目的。微生物降解除草剂对环境无污染,安全性较高[10],所以分离筛选能高效降解咪唑乙烟酸的微生物是解决以上问题最为有效的途径。目前国内外有关咪唑乙烟酸生物降解的报道较少,Ding[11]分离到一株降解菌BH-1,在72 h内能降解咪唑乙烟酸(500 mg/L-1)超过90%,该菌鉴定为Alcaligenes sp.。Wang[12]发现菌株WWX-1 Arthrobacter crystallopoietes可以利用咪唑乙烟酸作为唯一碳源生长。Liu[13]在中国东北黑土地分离到一株高效降解菌Acinetobacter baumannii IB5,并对其降解特性以及代谢产物进行了研究。
本研究利用长期施用咪唑乙烟酸的大豆田土壤样品,采用富集驯化的方法分离得到1株可利用咪唑乙烟酸为唯一碳源生长同时可降解咪唑乙烟酸的菌株IM9603,并对其分类地位和降解特性进行了研究,同时优化其对咪唑乙烟酸的降解条件,以期为构建高效咪唑乙烟酸降解工程菌和降解酶制剂提供菌种资源。
1 材料与方法 1.1 材料 1.1.1 试剂咪唑乙烟酸标准品(纯度99%)购于美国Sigma-Aldrich公司,咪唑乙烟酸原药(96%)由农药检定所提供。甲醇和乙腈均为色谱级,实验中所用其他试剂均为分析纯。高效液相色谱检测所用样品均用0.45 μm的有机相针式过滤。
1.1.2 培养基富集培养基(TYC):5 g胰蛋白胨,5 g酵母粉,1 g K2HPO4,1 g葡萄糖,蒸馏水1 000 mL。无机盐培养基(MSM):1 g NH4NO3,1 g NaCl,0.5 g KH2PO4,1.5 g K2HPO4,0.1 g MgSO4 · 7H2O,蒸馏水1 000 mL。
LB培养基:5 g酵母膏,10 g蛋白胨,10 g NaCl,蒸馏水1 000 mL。
1.2 方法 1.2.1 富集,分离咪唑乙烟酸降解菌称取10 g长期施用咪唑乙烟酸的大豆田土壤样品并加入到含有100 mL富集培养基的250 mL三角瓶中,28℃、160 r/min培养24 h,取上清液10 mL置于含100 mg/L咪唑乙烟酸的100 mL液体无机盐培养基中,28℃、160 r/min黑暗培养,7 d后取10 mL转接至含200 mg/L咪唑乙烟酸的100 mL无机盐培养基中培养7 d。以此类推,连续富集培养至咪唑乙烟酸终浓度为800 mg/L。吸取100 μL富集液涂布于含800 mg/L咪唑乙烟酸的无机盐平板上,28℃培养,直到平板上长出肉眼可见的菌落,挑取菌落进一步分离纯化。共分离到12株形态差异的菌株。
将这12株菌株接种于液体LB培养基中,28℃生长24 h,离心收集菌体并用液体无机盐培养基清洗菌体,调节OD600使OD600值为1,吸取以上菌悬液1 mL于100 mL含50 mg/L咪唑乙烟酸的无机盐培养基中28℃、160 r/min黑暗培养,7 d后吸取培养液并用0.45 μm有机相针式过滤器过滤,用高效液相色谱(HPLC)测定菌株降解率。
1.2.2 降解菌的鉴定选取降解率最高的菌株IM9603进行下一步研究。通过形态学,生理生化鉴定[14]及16S rDNA鉴定该菌株。16S rDNA扩增引物为通用引物:27F(AGAGTTTGATCCTGGCTCAG)和1492R(TACGGTTACCTTGTTACGACTT)。将PCR产物送至上海生工生物公司测序,测得序列提交至NCBI,并在网站EzTaxon在线比对,采用MEGA 6.0构建系统发育树。
1.2.3 咪唑乙烟酸降解菌降解条件优化影响菌株降解的重要因素包括温度、pH和接菌量[15]。本实验所采用温度范围:20-40℃;pH:5.0-9.0;接菌量:1-3 mL(OD600= 1)。
采用Box-Behnken统计学试验设计方法对以上3个影响因素进行试验设计,试验设计见表 2,试验结果为菌株IM9603在含有50 mg/L咪唑乙烟酸无机盐培养基中生长第7天的降解率。
应用SAS统计学分析软件对表 2结果进行分析,同时绘制三维响应面图,从而获得最优降解条件的理论值。二项式如下所示:

Yi表示除草剂残余量;Xi,Xj表示可变量;b0表示恒变量;bi表示线性系数;bij表示相互系数;bii表示二项系数。
1.2.4 菌株的生长以及咪唑乙烟酸降解率的测定在最优条件(pH5.5,温度26.2℃,接菌量1 mL(OD600=1))下,将菌株IM9603接种于咪唑乙烟酸浓度为50 mg/L的液体无机盐培养基中培养,每隔12 h取样,并用分光光度计测定600 nm下的吸光值,绘制菌株IM9603的生长曲线。
在上述最优条件下每隔12 h取样,经0.45 μm有机相针式过滤器过滤,将滤液置于4℃冰箱保存,并用高效液相色谱测定其峰面积。
高效液相色谱测定条件:Agilent 1100 Series(具有可调波长紫外分光检测器),带色谱工作站;色谱柱:C18 DiamosilTM反相柱,250 mm×4.6 mm(i.d.),粒径5 μm(迪马公司)。流动相:乙腈:水(冰乙酸调pH3.0)=40:60检测波长:258 nm;流速:1.0 mL/min;进样体积:10 μL;柱温:30℃。
1.2.5 降解菌对咪唑乙烟酸的降解动力曲线向100 mL液体无机盐液体培养基中加入96%的咪唑乙烟酸,使其终浓度依次为50、100、200、300、400 mg/L,各接入1 mL菌悬液(OD600=1),于28℃、160 r/min、黑暗条件下培养。每个处理设置3个平行,每12 h之后取样并测其峰面积计算降解率。
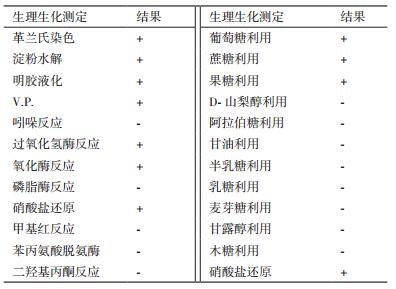
2 结果 2.1 降解菌的分离和生理生化特性从东北大豆田土壤样品中经过富集、筛选共分离到12株形态不同,具有降解咪唑乙烟酸能力的菌株,选取降解能力最强的菌株IM9603做进一步研究。菌株IM9603为革兰氏阳性菌,在MSM培养基上呈圆形,中间凸,表面光滑,淡黄色,表面潮湿,不透明。生理生化特性测定结果,见表 1。
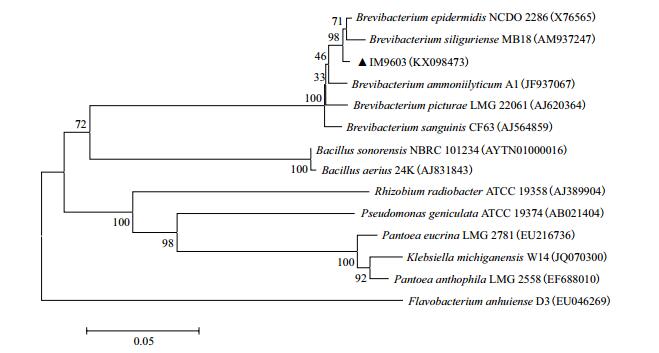
对菌株IM9603进行16S rDNA扩增并测序,序列在GenBank中的注册号为(KX098473),经过EzTaxon在线比对发现菌株IM9603的16S rDNA与表皮短杆菌的16S rDNA相似度最高,相似性达99.19%,构建系统发育树(图 1)。结合形态学特征、生理生化特性和系统发育树分析,初步鉴定该菌株为表皮短杆菌(Brevibacterium epidermidis)。
|
| 图 1 菌株IM9603(KX098473)16S rDNA系统发育树 |
应用SAS软件对表 2数据进行了回归分析,得到咪唑乙烟酸残留量(Y)对自变量温度(X1),pH值(X2)和接种量(X3)的二次多项式方程如下:
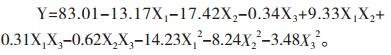
结果分析显示温度,pH值对菌株降解咪唑乙烟酸影响显著(P < 0.05),而菌体接种量和各因素之间的相互作用影响不显著(P > 0.05)。
在接种量为1 mL(OD600=1) 的条件下,应用Box-Behnken绘制温度、pH与咪唑乙烟酸残留量之间的响应面图(图 2)。在驻点处的温度为26.2℃,pH为5.5时,咪唑乙烟酸残留量最低。因此得出菌株IM9603降解咪唑乙烟酸的最优条件为:温度26.2℃,pH5.5,接种量为1 mL(OD600=1)。

|
| 图 2 接菌量为1 mL(OD600 =1),温度和pH值对菌株IM9603降解咪唑乙烟酸的响应面图 |
如图 3所示,在最优条件下第4天时菌株IM9603的生长和降解率均达到了最大值,咪唑乙烟酸的降解率在65%以上。4 d以后驻点开始衰退,降解能力随之下降。在第7天时IM9603的降解率达到了90%以上。

|
| 图 3 最优条件下菌株IM9603的生长曲线和咪唑乙烟酸的降解 ■:接菌时50 mL/L咪唑乙烟酸的降解;□:不接菌时50 mL/L咪唑乙烟酸的降解;▲:50 mL/L咪唑乙烟酸培养基中菌体生长;△:无咪唑乙烟酸培养基中菌株的生长 |
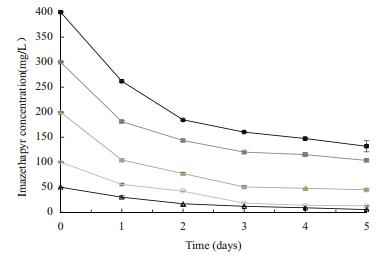
在最优条件下菌株IM9603的降解动力学曲线,如图 4所示,在第5天时咪唑乙烟酸初始浓度为50 mg/L和100 mg/L时,降解率分别达到了89.98%和87.05%,咪唑乙烟酸初始浓度为200 mg/L和300 mg/L时降解率分别达到77.49%和69.43%。然而,咪唑乙烟酸初始浓度为400 mg/L时,降解率只有64.56%。
|
| 图 4 最优条件下菌株IM9603对除草剂咪唑乙烟酸的降解动力曲线 △;50 mL/L咪唑乙烟酸的降解曲线;□:100 mL/L咪唑乙烟酸的降解曲线;▲:200 mL/L咪唑乙烟酸的降解曲线;■:300 mL/L咪唑乙烟酸的降解曲线;●:400 mL/L咪唑乙烟酸的降解曲线 |
本研究以咪唑乙烟酸为唯一碳源,从土壤样品中分离得到一株高效降解菌IM9603。经过形态学特征观察、生理生化实验、16S rDNA序列分析,将其鉴定为表皮短杆菌属。到目前为止,研究者已经分离到多种可以降解咪唑乙烟酸的微生物,包括细菌、真菌和放线菌等[16],其中对细菌及真菌的研究较为深入。在细菌降解除草剂的研究中,假单胞菌属、芽孢菌属、黄杆菌属和产碱菌属等研究较多,对咪唑乙烟酸的降解能力较强[17]。本研究分离得到的表皮短杆菌具有高效降解咪唑乙烟酸的能力,目前尚未见该菌属对咪唑乙烟酸降解的相关报道。
除草剂的生物降解是目前除草剂降解研究的热点,并且已经取得了相当大的研究进展,但是应用微生物进行实际的生物修复往往受到环境中很多因素的影响,如环境样品中的pH,水分及有机质的含量、温度等都影响着除草剂的降解[18]。研究表明,不同比例的腐殖酸可以加快咪唑乙烟酸的降解速率[19]。本研究针对性的选择了pH(5.0-9.0) 和温度(20-40)℃接菌量(1-3 mL)为影响因子通过Box-Behnken响应面法设计实验,优化菌株IM9603对咪唑乙烟酸在不同温度以及pH条件下的降解,探究其在不同条件下的降解能力,从而达到应用的潜力。结果表明在最优条件(pH5.5,温度26.2℃,接菌量1 mL(OD600=1))下,菌株IM9603降解能力最强。
降解动力学的研究为实际生产过程中除草剂的处理提供了理论依据,进而达到减少能耗同时缩短降解周期的目的[20]。本研究发现在不同浓度咪唑乙烟酸的降解动力曲线中,菌株IM9603均表现出降解能力,在咪唑乙烟酸含量为50 mg/L降解能力最强,降解率可达93%。在咪唑乙烟酸浓度为400 mg/L时降解能力最差,降解率仅为64%。因此,在菌株IM9603实际应用过程中可以通过稀释等方法调整咪唑乙烟酸的浓度,从而实现对咪唑乙烟酸的高效降解。
随着研究的进一步深入以及研究者对除草剂降解规律的掌握,除草剂的生物降解将会有很大的发展空间,在除草剂环境污染的治理过程中将发挥巨大的作用[21],如何实现高效、安全、低成本、无二次污染[22]降解是咪唑乙烟酸生物降解未来发展方向。有关该菌株对咪唑乙烟酸的代谢产物的测定,其在土壤中的生态学行为,以及其降解基因的克隆及调控和降解酶制剂等相关研究还待深入。
4 结论从大豆田土壤样品中分离到一株高效咪唑乙烟酸降解菌IM9603,经形态学、生理生化以及16S rDNA初步鉴定为表皮短杆菌Brevibacterium epidermidis。基于Box-Behnken试验设计,结合SAS软件进行了响应面分析,优化得到了菌株IM9603对除草剂咪唑乙烟酸降解的最优条件(温度26.2℃;pH为5.5) 在此最优条件下,菌株IM9603在7 d时对50 mg/L浓度的咪唑乙烟酸降解率达到了90%以上,同时,测定了菌株IM9603在最优条件下对咪唑乙烟酸降解的动力学曲线,结果表明在低浓度咪唑乙烟酸含量情况下降解率更高。
| [1] | Espy R, Pelton E, Opseth A, et al. Potodegradation of the herbicide imazethapyr in aqueous solution:effects of wavelength, pH, and natural organic matter(NOM)and analysis of photoproducts[J]. Journal of Agricultural and Food Chemistry, 2011, 59 : 7277–7285. DOI:10.1021/jf200573g |
| [2] | Kaloumenos N, Capote N, Aguado A, et al. Red rice(Oryza sativa)cross-resistance to imidazolinone herbicides used in resistant rice cultivars grown in northern Greece[J]. Pesticide Biochemistry and Physiology, 2013, 105 : 177–183. DOI:10.1016/j.pestbp.2013.01.008 |
| [3] | Goeiz J, Lavy T, Gbur E. Degradation and field persistence of imazethapyr[J]. Weed Science, 1990, 38 : 421–428. |
| [4] | Singh H, Reager ML, Verma JK, et al. Growth, yield performance and nutrient content as influenced by intercropping and weed control measures in moth bean[J]. Environment and Ecology, 2017, 35 : 193–196. |
| [5] | 刘亚光, 庞福德. 咪唑乙烟酸高效降解菌降解性能的研究[J]. 植物保护, 2009, 35(2): 63–66. |
| [6] | Perez-Iglesias JM, Soloneski S, Nikoloff N, et al. Toxic and genotoxic effects of the imazethapyr-based herbicide formulation Pivot H(R)on montevideo tree frog Hypsiboas pulchellus tadpoles(Anura, Hylidae)[J]. Ecotoxicology and Environmental Safety, 2015, 119 : 15–24. DOI:10.1016/j.ecoenv.2015.04.045 |
| [7] | García-Garijo A, Palma F, Iribarne C, et al. Alterations induced by imazamox on acetohydroxyacid synthase activity of common bean(Phaseolus vulgaris)depend on leaf position[J]. Pesticide Biochemistry and Physiology, 2012, 104 : 72–76. DOI:10.1016/j.pestbp.2012.07.004 |
| [8] | García-Garijo A, Palma F, Lluch C, et al. Physiological and bioche-mical responses of common vetch to the imazamox accumulation[J]. Plant Physiology and Biochemistry, 2013, 73 : 321–325. DOI:10.1016/j.plaphy.2013.10.013 |
| [9] | Maria S, Jens A, Sebastian R, et al. Microbial degradation of the benzonitrile herbicides dichlobenil, bromoxynil and ioxynil in soil and subsurface environments—Insights into degradation pathways, persistent metabolites and involved degrader organisms[J]. Environmental Pollution, 2008, 154 : 155–168. DOI:10.1016/j.envpol.2007.09.020 |
| [10] | Aiehele TM, Penner D, Penner D. Adsorption, desorption and degradation of imidazolinones in soil[J]. Weed Technology, 2005, 19 : 154–159. DOI:10.1614/WT-04-057R |
| [11] | Ding W, Cheng Z, Qu JJ, et al. Isolation and identification of imazethapyr degradable bacteria and its degradation characteristics[J]. Huan Jing Ke Xue, 2008, 29 : 1359–1362. |
| [12] | Wang X, Liu X, Wang H, et al. Utilization and degradation of imazaquin by a naturally occurring isolate of Arthrobacter crystallopoietes[J]. Chemosphere, 2007, 67 : 2156–2162. DOI:10.1016/j.chemosphere.2006.12.042 |
| [13] | Liu CG, Yang X, Lai Y, et al. Imazamox microbial degradation by common clinical bacteria:Acinetobacter baumannii IB5 isolated from black soil in China shows high potency[J]. Journal of Integrative Agriculture, 2016, 15 : 1798–1807. DOI:10.1016/S2095-3119(16)61344-8 |
| [14] | 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 267-273. |
| [15] | Zhang C, Wang SH, Yan YC. Isomerization and biodegradation of beta-cypermethrin by Pseudomonas aeruginosa CH7 with biosurfactant production[J]. Bioresource Technology, 2011, 102 : 7139–7146. DOI:10.1016/j.biortech.2011.03.086 |
| [16] | 陈玉洁, 束长龙, 刘新刚. 咪唑乙烟酸降解菌分离、鉴定及降解特性研究[J]. 农药学学报, 2011, 13(4): 387–389. |
| [17] | Diamond ML, de Wit CA, Molander S, et al. Exploring the planetary boundary for chemical pollution[J]. Environment International, 2015, 78 : 8–15. DOI:10.1016/j.envint.2015.02.001 |
| [18] | Gangadharan D, Sivaramakrishnan S, Nampoothiri KM, et al. Response surface methodology for the optimization of alpha amylase production by Bacillus amyloliquefaciens[J]. Bioresource Technology, 2008, 99 : 4597–4602. DOI:10.1016/j.biortech.2007.07.028 |
| [19] | Huang X, Pan J, Liang B, et al. Isolation, characterization of a strain capable of degrading imazethapyr and its use in degradation of the herbicide in soil[J]. Current Microbiology, 2009, 59 : 363–367. DOI:10.1007/s00284-009-9442-7 |
| [20] | 洪昌红, 黄本胜, 邱静, 等. 对硝基酚在超高交联吸附树脂NDA-701上的脱附行为研究[J]. 环境科学, 2011, 32: 1388–1393. |
| [21] | Villaverde J, Rubio-Bellido M, Merchan F, et al. Bioremediation of diuron contaminated soils by a novel degrading microbial consortium[J]. Journal of Environmental Management, 2017, 188 : 379–386. |
| [22] | 陈玉洁, 张浩, 张杰. 咪唑乙烟酸降解菌研究进展[J]. 公共植保与绿色防控, 2010, 3: 208–213. |