2. 南京工业大学生物与制药工程学院,南京 211816
2. College of Life Science and Pharmaceutical Engineering, Nanjing Tech University, Nanjing 211816
随着世界工业的迅速发展,地球上许多地区的土壤都不同程度受到重金属的污染。据统计,我国遭受不同程度重金属污染的耕地面积约占总耕地面积的1/5,每年因重金属污染的粮食,合计经济损失至少200亿元[1]。更为严重的是,土壤中的重金属可通过被污染的作物进入食物链、进入到人体体内,严重威胁人类的生命安全[2]。例如,高剂量的锌( > 400 mg/kg)会抑制机体的免疫功能,明显降低学习记忆能力[3]。因而重金属污染土壤的治理工作已成为国内外研究的重点。传统的土壤重金属修复技术,采用物理、化学或物理化学的方法将重金属从土壤中移除,如早期的淋洗法[4]、客土法[5]、电动力修复[6]、气相抽提[7]等。这类方法处理相对彻底,但处理费用较高,设备相对复杂,还会带来一定程度的二次污染。
生物修复是利用生物(主要是微生物、植物和动物)的新陈代谢作用吸收去除土壤中的重金属或使重金属形态转化,降低毒性、净化土壤[8-12]。重金属在土壤中的长期存在,使得某些微生物为了适应这种生存环境而形成了一些特殊的属性,使其在那些被重金属污染的土壤治理方面具有特别的作用。该方法主要利用微生物体内存在的酶去络合重金属及重金属化合物,将污染物降解或转化成相对毒性较小的形式[13]。这是一种运用生物技术治理污染土壤的新方法,且因效果好、易于操作、对环境没有额外的副作用,日益受到人们的重视。目前,微生物多被用于单独进行土壤生物改造或改良[14-15],或者和植物进行联合修复[16-18]。为了拓展重金属污染的治理技术,需要有效的抗重金属的微生物资源。本研究从受铅锌污染农田土壤中分离筛选到耐锌微生物,研究其对于水中锌的去除情况,并进一步利用改菌株与印度芥菜联合进行锌污染土壤修复盆栽实验,以期为微生物-植物联合修复重金属土壤实际应用提供参考依据。
1 材料与方法 1.1 材料 1.1.1 土壤分离抗锌重金属的土壤来自于江西省宜春市受铅锌污染农田。
1.1.2 培养基LB培养基:5g/L酵母膏,10 g/L蛋白胨,10 g/L氯化钠,调节pH至7.0。
1.2 方法 1.2.1 抗锌菌株的富集取1 g土壤加到10 mL的液体LB培养基中富集培养,培养条件37℃ 180 r/min,培养24 h;取1 mL富集培养液分别接种于含100 mg/L Zn2+离子的新鲜液体培养基,37℃、180 r/min培养;待液体培养基混浊后,从中取1 mL培养液接种于含100 mg/L Zn2+离子的液体培养基中,然后逐级提高Zn2+浓度(200 mg/L、300 mg/L和400 mg/L)。
1.2.2 抗锌菌株的筛选和复筛用接种环取最高耐受浓度培养液划线接种于含400 mg/L Zn2+的固体平板上,37℃培养24 h。根据平板菌落形态分别挑取单菌落再接种至400 mg/L Zn2+选择培养基进行验证,循环3次,以获得金属耐受能力较好的纯菌株。
1.2.2.1 温度对于菌株去除Zn2+的影响在Zn2+浓度为100 mg/L,接种量为1%(体积比)的水溶液、pH7,分别在20℃、30℃、37℃,40℃,180 r/min振荡吸附12 h,然后12 000 r/min离心2 min,取上清液测定Zn2+的浓度。
1.2.2.2 初始浓度对菌株去除Zn2+的影响接入摇瓶的菌为1%,pH7,Zn2+浓度分别为100 mg/L、200 mg/L、300 mg/L、400 mg/L和500 mg/L,37℃、180 r/min振荡吸附12 h,然后12 000 r/min离心2 min,取上清液测定Zn2+的浓度。
1.2.2.3 接种量对菌株去除Zn2+的影响在Zn2+浓度为300 mg/L、pH7,分别按1%、5%以及10%的接种量加入菌悬液,37℃、180 r/min振荡吸附10 h,然后12 000 r/min离心2 min,取上清液测定Zn2+的浓度。
1.2.3 菌株对印度芥菜生长及富集锌的影响向供试土壤中加入ZnCl2水溶液,搅拌均匀、风干,制备成800 mg/kg的锌污染土壤。取500 mL塑料花盆,每盆装土600 g,同时每盆加入0.4 g尿素以及0.6 g磷酸二氢钾作为肥料,并加入水一起进行搅拌,保持湿润,平衡7 d后,将印度芥菜种子播种于土壤中,生长12 h后,每盆保留3株苗,在印度芥菜生长25 d后,分别取活菌量为(1×109CFU/mL)的菌原液10 mL、40 mL和80 mL,加入无菌水稀释到100 mL,然后用注射器将其加入到植物根系土壤附近,植物在温室下生长,并定期浇水,60 d后收获。其中Ⅰ组为添加10 mL菌液,Ⅱ组为添加40 mL菌液,Ⅲ组为添加80 mL菌液,并以不加菌液的无菌水的作为对照组CK。
1.3 样品采集与分析生长60 d后,先测定印度芥菜地上部高度,然后收割植物地上部分和地下部分,并将地上部和地下部自来水冲洗净,再放入烘干箱105℃杀青30 min,80℃烘干至恒重,磨碎后放入自封袋中备用,土壤样品自然风干、研磨后过100目筛子备用。土壤中锌的有效态,按土壤BCR方法[19]进行分级提取,植物和土壤中锌含量用电感耦合等离子发射光谱仪(ICP-AES)测定。
采用TaKaRa细菌基因组提取试剂盒提取菌株的基因组DNA并进行纯化,纯化后的产物进行PCR扩增。扩增后的产物用0.8%的琼脂糖凝胶电泳对扩增的DNA进行纯度和浓度检测。PCR产物经过TaKaRa纯化试剂盒纯化后由南京金斯瑞有限公司完成测序和序列分析。测序所获序列信息通过Blast程序与GenBank的核酸数据库序列进行联配,用测出的16S rDNA基因序列进行BLAST比对,搜索相关性序列同所测序列用MEGA软件进行系统发育分析。
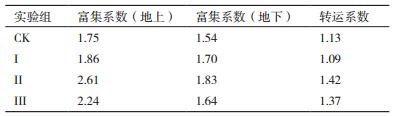
2 结果 2.1 菌株的筛选将耐受Zn2+浓度达到400 mg/L的菌液涂布培养,待长出菌落后,再将其接种至新的平板上培养观察,并用显微镜对菌落特征进行观察,结果如图 1所示。该菌在平板培养基上所形成的菌落形态为菌落边缘粗糙,不透明,黏稠,呈向外扩展状。该株菌经过革兰氏染色后的结果显微为蓝紫色,说明该菌属呈革兰氏阳性,形态为长杆状。
|
| 图 1 分离出的一株耐锌微生物的菌落特征 |
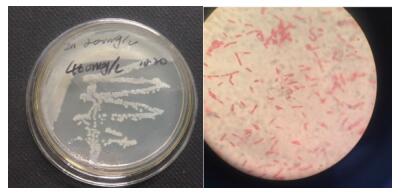
进一步对锌抗性菌株的基因组DNA进行PCR反应得到1 465 bp大小的扩增片段,扩增后的DNA片段经过纯化测序,并在GenBank中与相似性较高的菌株进行比对、构建系统发育树,结果(图 2)发现,锌抗性菌株与芽孢杆菌属的相似性最高。
|
| 图 2 抗锌菌株的系统发育树 |
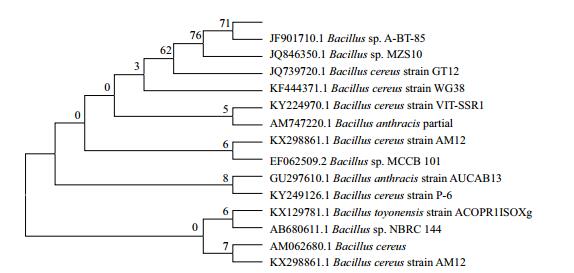
如图 3所示,在20℃的条件下,菌株生长缓慢,12 h后OD600值可达到0.33,而随着温度增加到30℃后,菌株生长速率加快,12 h后OD600值可达到0.41。当温度增加到37℃后,6 h后OD600值就达到了0.38,最终在12 h后OD600值可达到0.44,当温度增加到40℃时,其OD600相对于37℃增长变慢。
|
| 图 3 不同温度下菌株的OD600变化 |
图 4显示出不同温度对Zn2+去除的影响。由结果可看出,在20℃的条件下,第1小时Zn2+的去除率为15.6%,之后去除率不断的增加,在第6小时去除率达到了55.4%,随后去除率开始增加缓慢,在第12小时其去除率为67%。当温度增加到30℃时,在1 h的去除率就达到20.3%,6 h的去除率达到了70.2%,最终第12小时的去除率为78%,均高于20℃的去除率。当反应温度为37℃时,Zn2+的去除速率最快,在1 h的去除率就达到24.3%,最终第12小时的去除率为83.2%,反应温度为40℃时,其12 h的去除率只有77%。由结果可看出,温度为20℃时,由于反应温度较低,菌株增加缓慢,导致其去除效果一般。而随着反应温度的不断提升,菌株自我扩增速率增加,Zn2+的去除速率也不断增加,在反应温度为37℃时,去除率达到最高,进一步提升温度可能会影响到微生物生长,使得去除率下降。
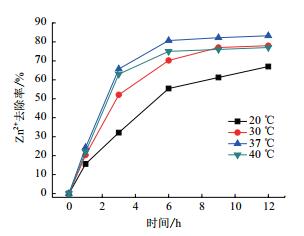
|
| 图 4 不同温度对于Zn2+去除的影响 |
锌的初始浓度可能会对菌样的生长产生促进或抑制作用,因此配置了一系列锌浓度分别为100 mg/L、200 mg/L、300 mg/L、400 mg/L和500 mg/L,研究浓度对菌株生长和锌去除的影响。如图 5所示,在Zn2+浓度为100 mg/L时,菌株生长缓慢,12 h后的OD600值可达到0.44。而随着Zn2+的浓度增加到200 mg/L时,菌株生长速率加快,12 h后的OD600值可达到1.09。随着Zn2+的浓度不断提高,对于菌株的生长速率影响不大,300 mg/L,400 mg/L,500 mg/L最终的OD600值分别达到了1.12、1.14和1.09。说明Zn2+浓度的增加,在一定程度上会对菌株的生长有促进作用。
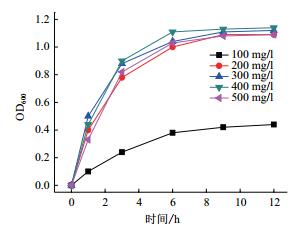
|
| 图 5 不同锌初始浓度菌株的OD600变化 |
图 6显示出锌初始浓度对于Zn2+去除的影响。在Zn2+浓度为100 mg/L的情况下,最终去除率为83.2%,随着初始浓度的进一步增加,在Zn2+浓度为200 mg/L时,最终去除率达到了90.1%。Zn2+浓度300 mg/L时去除率最高,达到91.7%。之后随着Zn2+浓度进一步增加,锌的去除率开始下降,在Zn2+浓度为400 mg/L和500 mg/L时,去除率分别为89.8%和86.3%,因此Zn2+最佳的初始浓度为300 mg/L。
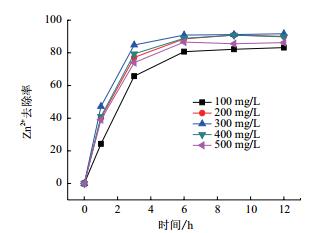
|
| 图 6 不同锌初始浓度对于Zn2+去除的影响 |
如图 7所示,随着接种量从1%增加到5%后,Zn2+的去除效率增快,在3 h达到了70.1%,最终12 h后的去除率为93%。再将接种量从5%增加到10%后,3 h后的去除率增加到75%,但最终12 h的去除率为94%,与接种量5%最终差不多。这可能是因为5%接种量,已经满足菌株自身扩增的需要,进一步加大接种量对于菌株增加已经不是很显著,因此,综合考虑选择最佳的接种量为5%。
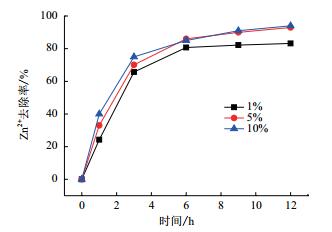
|
| 图 7 不同接种量对于Zn2+去除的影响 |
由图 8可看出,对照组的株高为12.7 cm,鲜重为20 g,接入菌液后的印度芥菜株高和鲜重均大于对照组的,其中添加40 mL菌液的Ⅲ组是生长最好的一组,其株高为28 cm,鲜重为25.6 g。
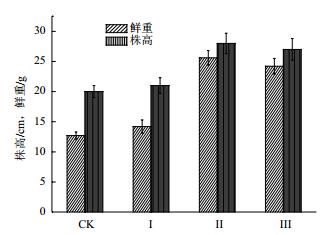
|
| 图 8 不同处理印度芥菜的生长情况 |
不同菌株添加量下对于印度芥菜富集锌的影响如图 9所示。由结果可看出,当添加10 mL的菌液后,Ⅰ组的地上部分和地下部分锌含量分别为1 210 mg/kg和1 102 mg/kg,相比对照组分别提高了6.2%和9.8%,增幅不大。而随着菌液提高到40 mL,Ⅱ组的地上部分和地下部分锌含量分别为1 779 mg/kg和1 247 mg/kg,相比对照组分别提高了56.1%和24.3%,说明添加菌株可有效提高印度芥菜对于土壤中锌的吸附能力,并且对于印度芥菜地上部分吸收锌的能力提升更显著。当菌液的添加量增加到80 mL,Ⅲ组的地上部分和地下部分锌含量分别为1 670 mg/kg和1 217 mg/kg,相比对照组分别提高了46.6%和21.3%,但其提高比例小于添加40 mL菌液的Ⅱ组,进一步增大菌株的添加量时反而会出现锌含量的下降的现象,对于印度芥菜的帮助不大。
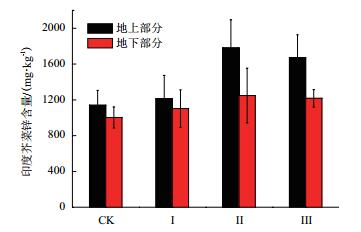
|
| 图 9 印度芥菜地上部分和地下部分锌含量 |
由表 1可知,收获时,Ⅰ、Ⅱ和Ⅲ组印度荠菜地上生物富集系数分别为1.86、2.61和2.24,与对照组相比提高了6.2%、49.1%和28%;Ⅰ、Ⅱ和Ⅲ组印度荠菜地下生物富集系数分别为1.70、1.83和1.64,与对照组相比提高了10.3%、18.8%和6.4%。
由图 10可看出,未添加菌株的对照组,其土壤中锌弱酸提取态占27.3%,当添加10 mL的菌液后,Ⅰ组的锌弱酸提取态为28.6%,较CK组增加了4.7%。随着菌液的进一步增加,Ⅱ组和Ⅲ组的锌弱酸提取态较CK组分别提高了26.3%和23.8%,残渣态较CK组降低了28.9%和25.7%,而还原态和可氧化态的锌变化不明显。
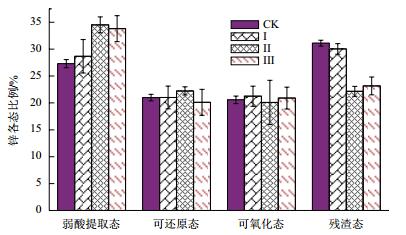
|
| 图 10 不同条件下土壤中锌的分级形态 |
本研究从受重金属污染土壤中筛选得到一株对锌有较高抗性的微生物,经鉴定该菌株为芽孢杆菌属。进一步考察温度、初始锌浓度以及接种量对菌株去除锌的影响,结果在最优条件下(Zn2+初始浓度300 mg/L,温度37℃,接种量5%)下,菌株去除Zn2+的效果最好。利用盆栽试验研究添加不同浓度菌株对印度荠菜富集土壤中锌的影响,结果发现,当添加10 mL菌液的Ⅰ组,其株高和鲜重分别比对照组提高了5%和11.8%。随着菌液的量增加到40 mL,相对应的印度芥菜株高和鲜重,相比对照组提高最大(40%和101.5%);将菌液量提高到80 mL时,印度芥菜的株高和鲜重没有再提高,这说明添加适宜浓度的菌株可有效提高印度芥菜的生长。
印度荠菜对锌有很好的吸收与耐受能力,是一种富集性植物[20],并且其锌富集系数地上部分高于地下部分,使得印度芥菜适用于土壤中锌的提取。印度荠菜生物富集系数(地上,地下)是用印度荠菜(地上,地下)部分对重金属的吸收量与土壤中重金属含量的比值[21]。转运系数是地上部重金属质量分数与地下部重金属质量分数之比,用来评价植物将重金属从地下部向地上部的运输和富集能力[22]。由表 1可看出,不同处理下印度荠菜的转运系数均 > 1,说明印度荠菜可以很好地将重金属锌转移到地上,并且添加菌液会提高印度荠菜的富集系数和转运系数,其中添加40 mL菌液的生物富集系数最高,其相对应的转移系数也最大,说明在此条件下印度荠菜对于土壤中重金属锌的吸收能力最强。而对于土壤中锌的价态中,弱酸提取态是指锌在土壤中容易迁移的价态,其容易被植物吸收而进入到植物体内。从图 10可看出,少量的添加菌液,对于土壤中弱酸提取态锌含量的提升较小,从而导致10 mL菌液的添加对印度芥菜吸收锌的帮助不大。而当菌液提高到40 mL时,其在印度芥菜根系附近可以更好的增长,并且会通过自身的或者是刺激根系附近微生物的代谢来直接或间接活化土壤中的锌,使得锌价态从残渣态向弱酸提取态转变,从而有利于印度芥菜对于土壤中锌的吸收,并在一定程度上促进了植物的生长。而将菌液提高到80 mL时,对自身或者是刺激根系附近微生物的代谢活动提高不大,反而可能会在一定程度上抑制其他根系微生物的生长。
4 结论从受农田污染土壤中筛选得到一株对Zn2+有较高抗性的菌株,经16S RNA鉴定其为芽孢杆菌属。考察了菌株不同条件下对Zn2+去除能力的影响。实验结果表明,Zn2+初始浓度为300 mg/L,温度为37℃,接种量为5%的情况下,菌株对Zn2+的去除效果最好,12 h的去除率可达到94%。盆栽实验结果表明,筛选得到的抗锌菌可提高印度荠菜对于锌的吸收,其在添加40 mL的菌液下,相对于对照组,锌弱酸提取态较可提高26.3%,从而使得印度荠菜地上和地下部分对于锌的吸收分别提高56.1%和24.3%。
| [1] | 高太忠, 李景印. 土壤重金属污染研究与治理现状[J]. 土壤与环境, 1999, 8(2): 137–140. |
| [2] | 刘春阳, 张宇峰, 滕洁. 土壤中重金属污染的研究进展[J]. 污染防治技术, 2006, 14(4): 42–45. |
| [3] | 丁虹, 彭仁绣, 孔锐, 等. 高锌摄入对正常小鼠生长发育、血液成分及免疫功能的影响[J]. 卫生研究, 1997, 26(5): 325–326. |
| [4] | Wasy SA, Barrington S, Tokunaga S. Organic acids for the insitu remediation of soils polluted by heavy metals:Soil flushing incolumns[J]. Water, Air, and Soil Pollution, 2001, 127 (3): 301–314. |
| [5] | 张秋芳. 土壤重金属污染治理方法概述[J]. 福建农业学报, 2000, 15(增刊): 200–203. |
| [6] | 张强, 刘彬, 刘巍, 等. 污染土壤的物化修复治理技术[J]. 化学通报, 2014, 4: 328–332. |
| [7] | 刘磊, 肖艳波. 土壤重金属污染治理与修复方法研究进展[J]. 长春工程学院学报:自然科学版, 2009, 10(1): 73–78. |
| [8] | 温志良, 毛友发, 陈桂珠. 重金属污染生物恢复技术研究[J]. 环境科学动态, 1999(3): 15–17. |
| [9] | Barton LL, David AS. Transport and remediation of subsurface contaminants[M]. Washington DC: American Chemical Society, 1992: 99-107. |
| [10] | Chen C, Wang JL. Influence of metal ionic characteristics on their biosorption capacity by Saccharomyces cerevisiae[J]. Applied Microbiology and Biotechnology, 2007, 74 (4): 911–917. DOI:10.1007/s00253-006-0739-1 |
| [11] | Herman A, Addadi L, Weiner S. Interaction of sea-urchin skeleton macromolecules with growing crystals—a study of intracrystalline proteins[J]. Nature, 1988, 331 (11): 546–548. |
| [12] | Fendler Janos H. Biomineralization inspired preparation of nanoparticles and nanoparticulate films[J]. Current Opinion in Solid State and Materials Science, 1997, 2 (3): 365–369. DOI:10.1016/S1359-0286(97)80129-5 |
| [13] | Chen C, Wang JL. Influence of metal ioniccharacteristics on their biosorption capacity by Saccharomyces cerevisiae[J]. Applied Microbiology and Biotechnology, 2007, 74 (4): 911–917. DOI:10.1007/s00253-006-0739-1 |
| [14] | 杨卓, 陈婧, 李术娜. 土壤中产酸菌的筛选及其对重金属生物有效性影响[J]. 环境科学与技术, 2014, 12: 78–84. |
| [15] | 赵光. 促进植物吸收土壤重金属的产酸菌的筛选鉴定及特性研究[J]. 安徽农业科学, 2010, 38: 9696–9698. DOI:10.3969/j.issn.0517-6611.2010.18.120 |
| [16] | Cunningham SD, Berti WR, Huang JW. Phytoremediation of contaminated soils[J]. Trends Biotechnol, 1995, 13 : 393–397. DOI:10.1016/S0167-7799(00)88987-8 |
| [17] | 杨榕, 李博文, 刘微. 胶质芽孢杆菌对印度芥菜富集土壤Cd及土壤pH的影响[J]. 环境科学学报, 2013, 33: 1648–1654. |
| [18] | 曹铁华, 牟忠生, 王淑萍, 等. 抗铅微生物的筛选及EDDS螯合诱导黑麦草修复铅污染土壤的效应初探[J]. 吉林农业科学, 2012, 37: 32–34. DOI:10.3969/j.issn.1003-8701.2012.01.010 |
| [19] | 张朝阳, 彭平安, 宋建中, 等. 改进BCR法分析国家土壤标准物质中重金属化学形态[J]. 生态环境学报, 2012(11): 1881–1884. DOI:10.3969/j.issn.1674-5906.2012.11.019 |
| [20] | 沈幸飞, 杨威, 俞寒升, 等. 镉胁迫对花叶芥菜生理抗性的影响[J]. 湖北农业科学, 2006, 45(2): 177–179. |
| [21] | Caccicatore DA, Mcneil MA. Principles of soil bioremediation[J]. Biocyde, 1995, 36 (10): 61–64. |
| [22] | Caplan J A. The worldwide bioremediation industry:prospects for proits[J]. Trends Biotechnol, 1993, 11 : 320–323. DOI:10.1016/0167-7799(93)90153-Z |