2. 国家环境保护创面生态修复工程技术中心 路域生态工程有限公司,北京 100082
2. State Environmental Protection Engineering Center for Ecological Restoration on Destroyed Surface/Luyu Ecological Engineering Company Ltd., Beijing 100082
土壤是自然生态环境的基础。近年来,矿山开垦、高速公路建设等工程对自然生态造成一定程度的破坏,形成大量的生荒地,表现为土壤腐熟度低、生物活性低、植被生长困难。随着国家对生态环境建设的重视,如何提高生荒地土壤生物活性,快速培肥土壤、恢复土壤生态环境成为农业科研工作者努力探索的课题。
在土壤生态修复领域,目前针对问题土壤的修复研究较多,比如对矿山土壤[1-2]、重金属污染土壤[3]、石油污染土壤[4]的研究报道很多。生荒地土壤的生态修复在近些年才受到重视,针对性较强的研究报道相对较少。肖波等[5]采用种植禾本科牧草对水库库滨荒滩进行了土壤生态修复试验,显著改善了土壤理化性质,取得了较好的配肥效果。黄华康等[6]采用引进客土的方法改善了滨海围垦荒地的理化性质和土壤肥力。采用微生物制剂改善生荒地土壤生态的报道尚未见到。
固氮菌是一类能够进行生物固氮的微生物,由于它们能够直接利用空气中的分子态氮素,因此生命力很强,能够在贫营养等恶劣环境中生存并且进行生命活动,在农业生产和生态环境修复中具有广泛的应用。乙烯是高等植物的内源激素,1-氨基环丙烷-1-羧酸(1-aminocyclopropane-1-carboxylate,ACC)是乙烯合成的前体,近年来发现,许多植物促生细菌(Plant growth promoting bacteria,PGPB)具有ACC脱氨酶活性,因此人们采用检测ACC脱氨酶的方法来筛选植物促生细菌[7]。
本研究针对生荒地土壤特点,以多年来收集的固氮微生物资源为基础,筛选出具有较高固氮酶活性和ACC脱氨酶活性的菌株4株,研制了多功能菌剂,应用于修建高速公路形成的生荒地,拟使试验地土壤酶活性提高,土壤生态环境得以改善。
1 材料与方法 1.1 材料 1.1.1 菌株实验菌株500余株,均为自生固氮和联合固氮菌,由本实验室保藏。菌株分离自生长期小麦、水稻、玉米、大豆、油菜、白菜、马铃薯等作物根际。圆褐固氮菌(Azotobacter chroococcum)ACCC11103为生产固氮菌剂常用菌株,由本实验室保藏,在本文中用作筛选高效固氮菌阳性对照菌株。实验所用试剂购自北京化学试剂公司和Sigma公司。
1.1.2 培养基(1) 牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨5 g,NaCl 5 g,蒸馏水1 000 mL,pH 7.0-7.2(固体培养基加入琼脂15-20 g);(2) 马丁培养基:葡萄糖10 g,蛋白胨5 g,KH2PO4 1 g,MgSO4·7H2O 0.5 g,氯霉素0.1 g,1%孟加拉红水溶液3.3 mL,蒸馏水1 000 mL,自然pH(固体培养基加入琼脂15-20 g);(3) 高氏一号培养基:可溶性淀粉20 g,KNO3 1 g,K2HPO4 0.5 g,MgSO4·7H2O 0.5 g,NaCl 0.5 g,FeSO4·7H2O 0.01 g,蒸馏水1 000 mL,pH 7.2-7.4(固体培养基加入琼脂15-20 g);(4) DF培养基:KH2PO4 4.0 g,Na2HPO4 6.0 g,MgSO4·7H2O 0.2 g,葡萄糖2.0 g,葡萄糖酸钠2.0 g,柠檬酸2.0 g,(NH4)2SO4 2.0 g,组分一、组分二溶液各0.1 mL,H2O 1 000 mL,pH 7.2(组分一:H3BO3 10 mg,MnSO4·H2O 11.19 mg,ZnSO4·7H2O 124.6 mg,CuSO4·5H2O 78.22 mg,MoO3 10 mg,溶于100 mL灭菌蒸馏水中;组分二:FeSO4·7H2O 100 mg溶于10 mL灭菌蒸馏水中);(5) ADF培养基:ACC溶于超纯水,过滤灭菌,加到不含(NH4)2SO4的灭菌DF培养基中,终浓度为3.0 mmol/L;(6) Fahraeus无氮植物营养液:Na2HPO4·12H2O 0.15 g,MgSO4·7H2O 0.12 g,柠檬酸铁0.005 g,CaCl2·2H2O 0.1 g,KH2PO4 0.1 g,Gibson微量元素液1 mL,H2O 1 000 mL,pH 6.5-7.0(Gibson微量元素液:H3BO3 2.86 g,ZnSO4·7H2O 0.22 g,CuSO4·5H2O 0.08 g,MnSO4·4H2O 2.03 g,Na2MoO4·2H2O 1.26 g,H2O 1 000 mL)。
1.2 方法 1.2.1 高固氮潜能菌株筛选以实验室保藏的500株固氮菌为出发菌株,采用乙炔还原法测定固氮菌的固氮酶活性[8],固氮酶活性高者初步选定为高效固氮菌株。固氮酶活性定义为:反应条件下,1 mg菌体蛋白1 h还原乙炔生成乙稀的nmol数。计算方法为:
固氮酶活性[nmol C2H4 /(mg蛋白·h)]= C2H4(nmol)/[菌体蛋白量(mg)×反应时间(h)]
式中:C2H4(nmol)= 1 000×C2H4体积(μL)×273×P/[22.4×(273 +t)×760]
其中:P为酶反应时气压(mm汞柱),t为酶反应时温度(℃)。测定结果为3次重复的平均值。
1.2.2 提高植物抗逆潜能的菌株筛选(1) 初步筛选ACC脱氨酶阳性菌株以实验室保藏的500株固氮菌为出发菌株,将实验菌株接入5 mL液体无氮培养基中,30℃、200 r/min振荡培养24 h;吸取上述培养液0.1 mL接种至5 mL DF培养基,振荡培养24 h;吸取上述培养液0.1 mL接种至5 mL ADF培养基,振荡培养24-48 h;将在ADF中生长的菌种重复转接、培养,并以ADF培养基作为阴性对照,能够以ACC为唯一氮源生长的菌株为ACC脱氨酶阳性菌株。(2) 菌株ACC脱氨酶活性测定采用比色分析法测定菌株ACC脱氨酶活性[9]。ACC脱氨酶定义为:反应条件下,1 mg菌体蛋白1 h催化ACC脱氨形成α-丁酮酸的μmol数,单位为:µmol α-丁酮酸/h·mg蛋白。测定结果为3次重复的平均值。
1.2.3 植物促生试验采用盆栽试验,种植普通白菜(Brassica campestris)[9]。试验在温室中进行,采用直径13 cm、高12 cm的塑料盆,每盆装土700 g。实验土壤为菜园土,基础营养检测[10]结果为全氮0.9 g/kg,有效磷10.6 mg/kg,速效钾111.5 mg/kg。实验设接种和不接种对照,出苗7 d后每盆定植普通白菜1株。分别培养收集实验菌株的菌体,用Fahraeus无氮植物营养液洗涤菌体,稀释到OD6001.5,菌数大约为15×108CFU/mL,定植2 d后每盆浇50 mL。不接种对照每盆浇无氮植物营养液50 mL。30 d后收获,测定植株鲜重。实验结果为3次重复的平均值。
1.2.4 菌株鉴定采用16S rRNA基因测序、比对法鉴定筛选到的高效菌株[11]。DNA测序由生工生物工程(上海)股份有限公司完成,序列拼接及相似性分析使用DNAStar软件完成,序列比对通过美国国家生物技术信息中心NCBI数据库和EzTaxon在线完成。
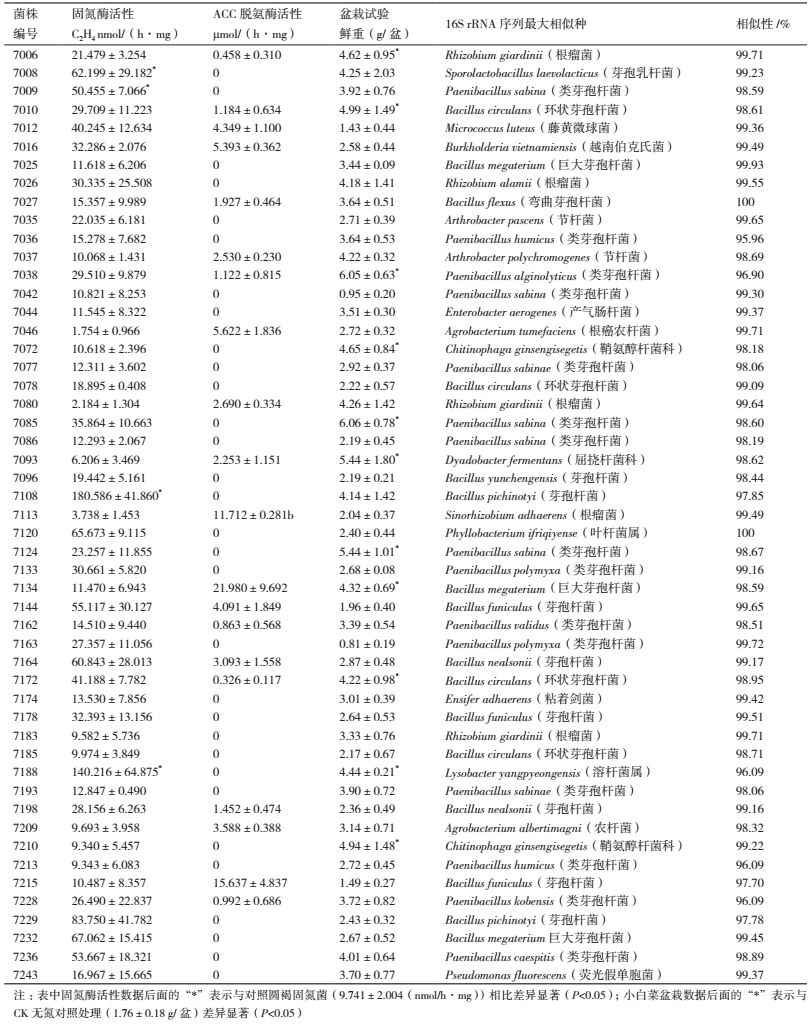
1.2.5 菌剂制作微生物制剂的功能中心就是所采用的功能菌株,即核心菌群。核心菌群菌株的选取首先要考虑菌株的安全性,包括人畜安全、植物安全及环境生态安全等,主要判定方法是首先确定菌株的分类地位,然后根据分类地位查阅文献资料初步判定其安全性,在此基础上进行生物安全试验。其次考虑菌株的功能,包括生物固氮潜能,培肥土壤能力,促进植物生长,提高植物抗逆性等。本实验选取了7012、7134、7144和7164作为制备土壤生态修复菌剂的核心菌株,它们功能特点和分类地位如表 1所示。
实验室条件下分别摇床培养筛选到的功能菌株7012、7134、7144和7164。1 L三角瓶装量250 mL,28℃、200 r/m振荡培养18 h-24 h至OD600达到1.5-1.8,活菌数达到15×108-30×108 CFU/mL。分别取4菌株的培养液各2 L,无菌操作混合,罐装,密封,即为多功能菌剂实验样品。取名为NFMF(固氮多功能)菌剂,室温保存,用于土壤培肥田间试验。
1.2.6 菌剂制作与田间试验田间试验位于京新高速公路G7兴和南互通口。新土层全部为贫瘠的生荒土,急需建植、培肥、恢复生态。试验地土壤基本性状为:有机质(%)0.435±0.2,全氮(%)0.027±0.006,碱解氮(mg/kg)0,全磷(%)0.089±0.006,有效磷(mg/kg)21.3±1.6。
2014年5月15日,进行了试验地建植和菌剂施用。坡面约30°,首先打桩挂网,然后采用机器喷播培土,培土机质为生荒土混入约1%的蘑菇渣,植物种子随土喷播。播种植物为木本、草本植物混播,包括榆树、柠条、紫穗槐、刺槐、胡枝子、苜蓿、冰草、披碱草、沙打旺及波斯菊等。NFMF菌剂(液体)含菌量为30×108 CFU/mL,在施工现场,将1 L该菌剂加入到盛有1 000 L自来水的水箱中,搅拌均匀,采用大功率喷播机将稀释后的菌剂随土壤、种子一起喷施于试验地坡面,用量为每600 m2试验地用1 L。试验处理设:(1) 阳坡空白对照(CK0,施用等量灭菌处理过的菌剂)(2) 阳坡施用菌剂(T1)(3) 阴坡施用菌剂(T2)3个处理,每个试验处理面积约2 000 m2。
施用NFMF菌剂3个月后,2014年8月7日进行了现场调查采样。采集了施用功能菌剂阳坡(T1)、施用功能菌剂阴坡(T2) 和未施功能菌剂(CK0) 土壤样品。采样方法为,在每个试验小区内采用五点法选点,剥去表层土壤,采集8 cm-15 cm深度的土壤,每个样点采集土壤约500 g,5个样点的样品混匀作为1个实验样品,带回实验室进行分析测定(3次重复)。
1.2.7 可培养土壤微生物数量测定取新鲜土样10 g加入到带玻璃珠的90 mL无菌水中,摇床振荡20 min,然后无菌操作制成101-106系列稀释梯度,取100 µL土壤悬液分别接种在牛肉膏蛋白胨培养基(细菌)、马丁培养基(真菌)和高氏一号培养基(放线菌)固体平板上,均匀涂布,3次重复,28℃培养2-5 d,观察计数。
1.2.8 土壤酶活性测定按照文献方法测定土壤活性[12]。酶活定义及标准工作曲线如下:(1) 土壤蔗糖酶活性测定(比色法)按照标准曲线y=(x+0.017 1)/16.08计算葡萄糖含量。土壤蔗糖酶活性定义为:37℃、pH5.5条件下5 g风干土壤24 h水解蔗糖生成葡萄糖的毫克(mg)数。(2) 土壤过氧化氢酶活性测定(容量法)按照高锰酸钾溶液的标定值计算出高锰酸钾溶液的消耗量。土壤过氧化氢酶活性定义为:2 g风干土壤30 min分解过氧化氢的数量折和氧化分解等量过氧化氢所需0.1 N高锰酸钾的毫升(mL)数。(3) 土壤脲酶活性测定(靛酚蓝比色法)按照标准曲线y=(x+0.000 6)/241.14计算出氨氮含量。土壤脲酶活性定义为:37℃、pH6.7条件下10 g风干土壤3 h分解尿素释放NH3-N的毫克(mg)数。(4) 土壤磷酸酶活性测定(磷酸苯二钠比色法)按照标准曲线y=(x-0.001 4)/200.88计算出酚含量。土壤磷酸酶活性定义为:37℃、pH9.6条件下10 g风干土壤24 h分解释放酚的毫克(mg)数。(5) 土壤纤维素酶活性测定(硝基水杨酸比色法)按照标准曲线y=(x+0.000 9)/5.357 1计算葡萄糖含量。土壤纤维素酶活性定义为:37℃、pH5.5条件下10 g风干土壤72 h分解释放葡萄糖的毫克(mg)数。(6) 土壤木聚糖酶活性测定(硝基水杨酸比色法)按照标准曲线y=(x+0.005 7)/4.160 5计算还原糖含量。土壤木聚糖酶活性定义为:37℃、pH5.5条件下5 g风干土壤120 h分解释放还原糖的毫克(mg)数。
2 结果 2.1 高效固氮菌筛选结果参考阳性对照菌株圆褐固氮菌ACCC11103的固氮酶活性9.741±2.004 nmol/(h·mg),经过大量的测定和筛选,从500余株实验菌株中筛选到固氮酶活性大于9 nmol/(h·mg)的菌株共计47株,其中4株菌株的固氮酶活性显著大于阳性对照菌株圆褐固氮菌ACCC11103(表 2)。
经过初筛和复筛,从500余株出发菌株中筛选到ACC脱氨酶阳性菌株20株,其ACC脱氨酶活性为0.326-21.980 µmol/(h·mg)(表 2)。
2.3 促进植物生长试验结果对筛选到的51株功能菌株进行了接种小白菜促生长实验。结果(表 2)显示,接种实验菌株后小白菜植株鲜重在(0.81±0.19) g/盆-(4.99±1.49) g/盆,不接种对照处理为(1.76±0.18) g/盆。与对照相比,47株接菌处理使小白菜鲜重增加,占实验菌株总数92%;11株接菌处理使小白菜鲜重显著增加,占实验菌株总数22%。
2.4 菌株鉴定结果结果(表 2)显示,筛选到的51株功能菌株的16S rRNA基因序列与已知模式种的最大相似性为95.96%-100%,其中46株与已知模式种的最大相似性大于97%。按照国际细菌分类委员会的建议,16S rRNA基因序列相似性达到97%为分类学定种的标准,说明已知模式种能够代表鉴定菌株的系统发育地位。筛选到的51株功能菌株系统发育地位上属于农杆菌、节杆菌、芽孢杆菌、伯克氏菌、鞘氨醇杆菌、屈挠杆菌、剑菌、肠杆菌、溶杆菌、微球菌、类芽孢杆菌、叶杆菌、假单胞菌、根瘤菌、中华根瘤菌及芽孢乳杆菌等16属31种。菌株7036、7038、7188、7213和7228的序列相似性低于标准约1%,分类地位归属可作参考。
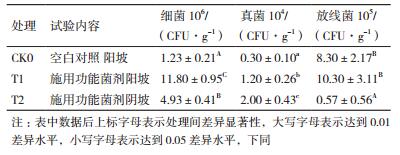
2.5 接种菌剂对试验地土壤微生物数量的影响结果(表 3)显示接种NFMF菌剂对土壤中3类微生物的数量产生了影响。统计分析表明,土壤中可培养细菌总数,施用功能菌剂的处理极显著高于未施用功能菌剂处理,同时阳坡处理极显著高于阴坡处理;土壤中可培养真菌总数,同样是施用功能菌剂的处理显著高于未施用功能菌剂处理,不同的是阴坡处理显著高于阳坡处理;土壤中可培养放线菌总数测定结果有所不同,施用功能菌剂阳坡处理与未施用功能菌剂处理无差异,但二者极显著高于施用功能菌剂阴坡处理。
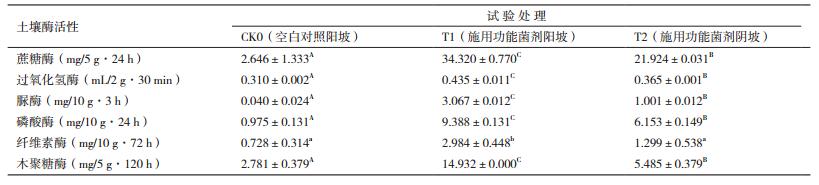
结果(表 4)显示,接种菌剂的2个处理(阳坡和阴坡)基本上全部极显著高于未施用菌剂的对照处理;只有纤维素酶表现出接种菌剂阳坡处理显著高于对照处理,阴坡处理与对照无统计学差异。另外,除纤维素酶之外的其他5种酶活性表现为菌剂阳坡处理极显著高于菌剂阴坡处理。
土壤生物活性的主要功能表现形式就是土壤酶活性,这也是土壤作为类生命体的一个重要特征。土壤酶活性的强弱与土壤供肥能力之间存在着密切关系,可以作为土壤肥力指标[13]。对农田土壤的研究表明,很多农业措施如施用有机肥[14]、秸秆还田[15]、施用绿肥[16]、轮作[17]、灌溉[18]等能够提高土壤酶活性,从而促进土壤中的物质能量转化,提高土壤供肥能力,甚至提高作物产量。
土壤微生物是土壤中物质能量转化的推动者,是土壤酶的主要来源,因此施用菌剂会影响土壤酶活性。文献报道,施用胶质芽胞杆菌菌剂可以提高黑麦草根际土壤脲酶、磷酸酶和过氧化氢酶活性[19],施用EM菌肥能够不同程度的提高黄瓜根际土壤脲酶、过氧化氢酶等土壤酶活性[20],施用木霉菌剂降低黄瓜根际土壤酸性磷酸酶活性,提高过氧化氢酶活性[21]。这些结果说明了菌剂对于提高土壤生物活性具有普遍意义,与本文的研究结果具有一致性。
生荒地土壤是不同于农田土壤的一类特殊土壤类型,基本组成为生土,土壤微生物数量少,生物活性很低。所以,针对这样的土壤类型进行生态修复时最有效的方法就是通过施用菌剂直接输入活性微生物。不同于前人的研究工作,本文以菌株的固氮酶活性和ACC脱氨酶活性为指标筛选功能菌株,这是因为固氮能力强的菌株通常在贫瘠土壤环境中生存能力较强,而ACC脱氨酶活性高的细菌通常能够提高植物抗逆性,这是因为1-氨基环丙烷-1-羧酸(1-aminocyclopropane-1-carboxylate,ACC)是乙烯合成的前体物质,某些细菌具有ACC脱氨酶活性,能够把ACC分解成氨和α-丁酮酸减少乙烯合成,从而提高植物抗逆能力[22],具有ACC脱氨酶活性的细菌在土壤生态修复中显示了较好的效果[23]。本文的研究结果也证明了固氮多功能菌剂对提高生荒地土壤生物活性的积极作用。
实验结果中还有一个有趣的现象,就是试验地的位置对实验结果有较大的影响。从表 3可以看到,施用功能菌剂后,阳坡土壤真菌数量低于阴坡,但土壤细菌和放线菌数量均极显著高于阴坡;这些土壤微生物数量的差异及其作用在表 4得到了充分体现,可以看到除纤维素酶之外,其他5种酶(蔗糖酶、过氧化氢酶、脲酶、磷酸酶和木聚糖酶)均表现为阳坡土壤极显著高于阴坡土壤。这个现象的本质是日照对菌剂作用有影响巨大,其机理可能是日照提高了地温,促进了土壤微生物生长;当然长日照也促进了植物生长,促进了根系分泌,进一步促进了土壤微生物的活性。
4 结论筛选到固氮酶活性大于9 nmol/(h·mg)的固氮菌47株、产生ACC脱氨酶的菌株20株。筛选到的51株功能菌属于农杆菌、节杆菌、芽孢杆菌、类芽孢杆菌等16属31种。采用高效菌株制备的功能菌剂应用于生荒地后土壤生物活性得以显著改善。固氮多功能菌剂对于提高生荒地土壤生物活性、修复生荒地土壤生态具有重要意义。
| [1] | Ghavri SV, Singh RP. Growth, biomass production and remediation of copper contamination by Jatropha curcas plant in industrial wasteland soil[J]. J Environ Biol, 2012, 33 : 207–214. |
| [2] | Rodrigues CR, Rodrigues BF. Use of Arbuscular mycorrhiza and organic amendments to enhance growth of Macaranga peltata (Roxb.)Müll. Arg. in Iron Ore Mine Wastelands[J]. Int J Phytoremediation, 2015, 17 : 485–492. DOI:10.1080/15226514.2014.922924 |
| [3] | Jelusic M, Lestan D. Remediation and reclamation of soils heavily contaminated with toxic metals as a substrate for greening with ornamental plants and grasses[J]. Chemosphere, 2015, 138 : 1001. DOI:10.1016/j.chemosphere.2014.12.047 |
| [4] | Lim MW, Lau EV, Poh PE. A comprehensive guide of remediation technologies for oil contaminated soil -Present works and future directions[J]. Mar Pollut Bull, 2016, 109 (1): 14–45. DOI:10.1016/j.marpolbul.2016.04.023 |
| [5] | 肖波, 武菊英, 王庆海, 等. 四种禾本科牧草对官厅水库库滨荒地的培肥效应研究[J]. 草业学报, 2010, 19(5): 113–121. DOI:10.11686/cyxb20100516 |
| [6] | 黄华康, 陈山虎, 翁定河. 滨海围垦地客土施肥方法对鲜食玉米的增产效应[J]. 福建农业学报, 2001, 16(2): 46–48. |
| [7] | Shaharoona B, Arshad M, Zahir ZA. Effect of plant growth promoting rhizobacteria containing ACC-deaminase on maize(Zea mays L.)growth under axenic conditions and on nodulation in mung bean(Vigna radiata L.)[J]. Letters Applied Microbiology, 2006, 42 : 155–159. DOI:10.1111/lam.2006.42.issue-2 |
| [8] | 孙建光, 罗琼, 高淼, 等. 小麦、水稻、玉米、白菜、芹菜内生固氮菌及其系统发育研究[J]. 中国农业科学, 2012, 45(7): 1303–1317. |
| [9] | 陈倩, 胡海燕, 高淼, 等. 一株具有ACC脱氨酶活性固氮菌的筛选与鉴定[J]. 植物营养与肥料学报, 2011, 17(6): 1515–1521. DOI:10.11674/zwyf.2011.1111 |
| [10] | 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 1999. |
| [11] | 孙建光, 张燕春, 徐晶, 等. 高效固氮芽孢杆菌选育及其生物学特性研究[J]. 中国农业科学, 2009, 42(6): 2043–2051. |
| [12] | 关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986. |
| [13] | 邱莉萍, 刘军, 王益权, 等. 土壤酶活性与土壤肥力的关系研究[J]. 植物营养与肥料学报, 2004, 10(3): 277–280. DOI:10.11674/zwyf.2004.0311 |
| [14] | 荣勤雷, 梁国庆, 周卫, 等. 不同有机肥对黄泥田土壤培肥效果及土壤酶活性的影响[J]. 植物营养与肥料学报, 2014, 20(5): 1168–1177. DOI:10.11674/zwyf.2014.0513 |
| [15] | 孟庆阳, 王永华, 靳海洋, 等. 耕作方式与秸秆还田对砂姜黑土土壤酶活性及冬小麦产量的影响[J]. 麦类作物学报, 2016, 36(3): 341–346. DOI:10.7606/j.issn.1009-1041.2016.03.12 |
| [16] | 叶协锋, 杨超, 李正, 等. 绿肥对植烟土壤酶活性及土壤肥力的影响[J]. 植物营养与肥料学报, 2013, 19(2): 445–454. DOI:10.11674/zwyf.2013.0222 |
| [17] | 王丽红, 郭晓冬, 谭雪莲, 等. 不同轮作方式对马铃薯土壤酶活性及微生物数量的影响[J]. 干旱地区农业研究, 2016, 34(5): 109–113. DOI:10.7606/j.issn.1000-7601.2016.05.17 |
| [18] | 张学琴, 马娟娟, 孙西欢, 等. 不同灌水方法对苹果树果实膨大期根系生长和土壤酶活性的影响研究[J]. 节水灌溉, 2016(3): 1–5. |
| [19] | 赵艳, 张晓波. 施用胶质芽胞杆菌菌剂对黑麦草根际土壤脲酶、磷酸酶及过氧化氢酶活性的影响[J]. 微生物学杂志, 2011, 31(6): 49–52. |
| [20] | 刘思宇. EM菌肥对黄瓜根际土壤酶活性的影响[J]. 中国瓜菜, 2016, 29(1): 11–13. |
| [21] | 李世贵, 吕天晓, 顾金刚, 等. 施用木霉菌诱导黄瓜抗病性及对土壤酶活性的影响[J]. 中国土壤与肥料, 2010(2): 75–78. |
| [22] | Saleem M, Arshad M, Hussain S, et al. Perspective of plant growth promoting rhizobacteria(PGPR)containing ACC deaminase in stress agriculture[J]. J Ind Microbiol Biotechnol, 2007, 34 : 635–648. DOI:10.1007/s10295-007-0240-6 |
| [23] | Arshad M, Saleem M, Hussain S. Perspectives of bacterial ACC deaminase in phytoremediation[J]. Trends Biotechnology, 2007, 25 (8): 356–362. DOI:10.1016/j.tibtech.2007.05.005 |