2. 山东农业大学, 泰安 271018
2. Shan Dong Agricultural University, Taian 271018
苹果连作障碍(Apple replant disease)是指随着苹果树种植年限的加长,导致新栽苹果幼树表现出生长衰弱、树冠小、根系发育不良、腐烂、甚至早期死亡的现象,严重影响苹果产量和品质,给生产带来了巨大的危害和损失[1]。造成连作障碍的原因有很多,包括土壤理化性质的恶化,根际微生物区系的改变等[2]。
研究发现,由苹果根系分泌的酚酸类自毒物质也是引起连作障碍的重要原因[3]。根皮苷(Phlorid-zin)的分子式为C21H24O10,是苹果所特有的酚酸类物质,它主要存在于苹果的根、茎、皮、嫩叶和果实中,有研究证实高浓度的根皮苷可以抑制苹果幼苗的生长,使植株光合速率和蒸腾速率降低[4]。此外,根皮苷作为叶绿体中一种光合磷酸化和磷酸化偶联电子传递的的特异性抑制剂,能够抑制苹果根系TCA循环柠檬酸合酶(CS)、苹果酸脱氢酶(MDH)等7种酶活性,是造成苹果连作障碍的重要的酚酸类自毒物质之一[5]。
利用微生物降解的方法是降低环境中根皮苷含量,缓解苹果连作障碍的有效途径。微生物降解具有经济、高效且无二次污染等特点逐渐受到人们的重视[6]。目前,研究人员虽然针对酚酸类化合物的生物降解展开了一系列的工作,如丁香酸、阿魏酸、对羟基苯甲酸等,但针对根皮苷的生物降解研究较少,特别是根皮苷的高效降解菌更为稀少[7]。因此,筛选根皮苷高效降解菌,具有重要的应用价值和意义。本研究从环渤海地区12个县市地区的苹果主产区取样,筛选分离根皮苷的高效降解菌,分析其降解特性,为根皮苷的生物降解、缓解苹果连作障碍提供资源和科学依据。
1 材料与方法 1.1 材料 1.1.1 土壤样品土壤样品采集自环渤海湾苹果主产区的苹果根际土,包括山东的昌邑、栖霞、蓬莱,辽宁绥中、瓦房店、锦州,河北的昌黎、抚宁、青县等12个地区。
1.1.2 培养基富集培养基(10 mmol/L):根皮苷4.8 g,磷酸二氢1 g,氯化钾0.2 g,硫酸镁0.2 g,蒸馏水1 L,pH7.0,于121℃灭菌20 min;分离培养基(2 mmol/L):根皮苷0.96 g,NH4H2PO4 1g,KCl 0.2 g,MgSO4 0.2 g,蒸馏水1 000 mL,pH7.0;若为固体培养基,则添加20 g琼脂,于121℃灭菌20 min;查氏琼脂(CA):NaNO3 3.0 g,K2HPO4 1.0 g,KCl 0.5 g,MgSO4 0.5 g,FeSO40.01 g,蔗糖30 g,琼脂15 g,蒸馏水定容至1 000 mL,于121℃灭菌20 min;查氏酵母膏琼脂(CYA):NaNO3 3.0 g,K2HPO4 1.0 g,KCl 0.5 g,MgSO4 0.5 g,FeSO40.01 g,酵母膏5 g,蔗糖30 g,琼脂15 g,蒸馏水定容至1 000 mL,于121℃灭菌20 min。
1.2 方法 1.2.1 根皮苷降解真菌的驯化、富集取苹果树根际土壤1 g,分别装入100 mL 10 mmol/L根皮苷液体培养基中,30℃,150 r/min培养5 d;再取1 mL培养液加入到另一新的100 mL 10 mmol/L根皮苷液体培养基中,30℃,150 r/min培养5 d,如此重复3次。
1.2.2 根皮苷降解真菌的分离纯化取富集培养液1 mL加入到99 mL无菌水中,充分混匀,按照梯度稀释法稀释至10-7;然后用无菌移液枪分别吸取0.1 mL上述稀释液于已经冷凝好的2 mmol/L根皮苷固体培养基平板中,用涂布棒涂抹均匀,每个稀释度3个平板,放在30℃的培养箱中培养5 d,观察菌的生长情况,分离并纯化固体平板上的真菌,4℃保存备用。
1.2.3 菌种鉴定形态学鉴定:将真菌菌株点种查氏琼脂(CA)和查氏酵母膏琼脂(CYA)培养基上,25℃培养7 d后用棉兰染色在低倍镜下观察菌丝体和孢子特征,依据菌落特征和个体形态特征进行初步鉴定。同时利用扫描电镜拍摄电镜照片。分子生物学鉴定:采用OMEGA真菌试剂盒提取菌体总DNA,所用引物参照NY/T 1736-2009 ITS1和ITS4序列,目的片段大小400-700 bp。扩增体系为50 µL:DNA模板4 µL,10×PCR buffer 5 µL,Mg2+ buffer 4 µL,dNTP(10 mmol/L each)4 µL,ITS1 2 µL,ITS2 2 µL,Taq酶2 µL,ddH2O 27 µL;PCR扩增程序为:94℃预变性3 min,94℃变性50 s,50℃退火1 min,72℃延伸1.5 min;共34个循环,72℃延伸10 min。将测序获得的序列在NCBI进行比对。
1.2.4 降解特性研究 1.2.4.1 孢子悬浮液的制备将真菌接种于PDA平板上,28℃培养3-5 d,待孢子成熟后用2 mmol/L的根皮苷液体培养基冲洗平板,用6-8层无菌纱布过滤除去菌丝体,用血小球计数板计数配制成密度约2.2×107CFU/mL的孢子悬浮液。
1.2.4.2 pH培养基对降解率影响按照2%的接种量将孢子悬浮液分别接入到50 mL、2 mmol/L的pH分别为4.5、5.0、5.5、6.0、6.5和7.0的根皮苷液体培养基中,30℃、160 r/min培养4 d,测定菌体生长量和根皮苷降解率,实验重复3次,每次3个平行。
1.2.4.3 培养温度对根皮苷降解率的影响按照2%的接种量将孢子悬浮液接入50 mL、2 mmol/L、pH5.0的根皮苷液体培养基中,分别置于温度为25、30、35、40和45℃的摇床中160 r/min培养4 d,测定菌体生长量和根皮苷的降解率,实验重复3次,每次3个平行。
1.2.4.4 根皮苷初始浓度对降解率的影响按照2%的接种量将孢子悬浮液分别接入50 mL、pH5.0的初始浓度分别为2、4、6、8和10 mmol/L的根皮苷液体培养基中,于30℃、160 r/min的摇床中培养4 d,测定菌体生长量和根皮苷降解率,实验重复3次,每次3个平行。
1.2.4.5 降解谱的研究将2 mmol/L的根皮苷液体培养基中的根皮苷分别换成2 mmol/L的绿原酸、间苯三酚、焦性没食子酸、对羟基苯甲酸、肉桂酸、丁香酸、阿魏酸、咖啡酸、苯甲酸九种不同的酚酸,按照2%的接种量将孢子悬浮液接入到50 mL的液体培养基中,放入到30℃、160 r/min的摇床中培养4 d,观察菌体的生长情况,实验重复3次,每次3个平行。
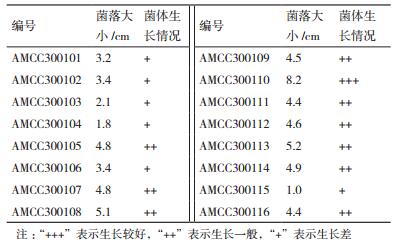
2 结果 2.1 菌种筛选以根皮苷为唯一碳源进行初筛,从12个县市区的苹果根际土壤样品中共获得44株能够利用根皮苷生长的真菌。根据菌落大小判定各真菌利用根皮苷的能力,其中编号为AMCC300110真菌利用根皮苷的能力最强,其菌落直径可达8.2 cm。
2.2 菌种鉴定AMCC300110在查氏培养基上菌落直径达40-45 mm,质地丝绒状,有放射状沟纹,中央部分稍凸起,初为白色,48-72 h后变成黄色;背面为淡黄色(图 1-A,1-B)。该菌在查氏酵母膏琼脂培养基上直径大约70-80 mm边缘白色,约3-5 mm,质地丝绒状,有放射状沟纹,中央部分稍凸起,菌落正面淡黄色反面为褐色(图 1-C,1-D)。

|
| 图 1 AMCC300110菌株形态特征 A,B:菌在查氏培养基上菌落正反面的情况;C,D:菌在查氏酵母膏培养基上菌落正反面的情况;E:菌棉兰染色后在光学显微镜下放大400倍的分生孢子头的形态;F:菌电镜拍摄1 500×的分生孢子头的形态 |
镜检发现,营养菌丝体由具横隔的分枝菌丝构成,由气生菌丝分化出的分生孢子梗直立,顶端膨大成球形,其上产生成串的分生孢子,分生孢子头的顶囊球形或“近球形”,小梗双层,呈放射状排列,顶端有链形孢子(图 1-E,1-F)。
扩增所得该菌的ITS序列,PCR产物长度约700 bp,在NCBI上进行比对分析,菌株AMCC300-110与土曲霉序列相似性为99%,结合其形态学特征,可将该菌初步鉴定为土曲霉(Aspergillus terreus)。
2.3 降解特性 2.3.1 pH培养基对降解率影响如图 2所示,菌株AMCC300110在pH4.5-7.0之间均能生长,其中在pH5.0处有最大生长量,对根皮苷的降解也达到最大值,可达到83.04%,随着pH的不断增大,其菌体生长量和根皮苷的降解率不断下降。

|
| 图 2 初始pH对菌体生长及根皮苷降解率的影响 |
该菌株在25-40℃时菌体量随温度升高而增多且降解率也随温度升高而升高,该菌在40℃时降解率最高,可达98.96%,随着温度的进一步升高,当到达45℃时,其菌体生物量显著降低,根皮苷的降解率仅为56.47%(图 3)。

|
| 图 3 培养温度对菌体生长及根皮苷降解率的影响 |
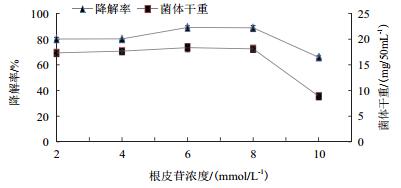
由图 4可以看出,不同根皮苷初始浓度下,根皮苷的降解率和菌体生长量有显著差异。随着根皮苷浓度的逐渐增加,该菌在根皮苷初始浓度为6 mmol/L时的降解率最高,达到89.15%,但当增加至10 mmol/L时,其降解率和菌体量明显降低,且菌体生长量和根皮苷降解率之间呈正相关趋势。
|
| 图 4 根皮苷初始浓度对于菌体生长及根皮苷降解率的影响 |
该菌可以利用以下10种酚酸为唯一碳源进行生长(表 2)。它在以对羟基苯甲酸和焦性没食子酸为唯一碳源的液体培养基中长势最好。而该菌在肉桂酸为唯一碳源的液体培养基中长势最弱。由于酚酸的降解率与菌体生长量之间呈正相关趋势,因此初步认为该菌对对羟基苯甲酸和焦性没食子酸的降解率最高而对肉桂酸的降解率最低。
中国苹果种植面积超过200万hm2,其中90%以上的树龄在20年以上,受土地资源限制,苹果产区老果园更新面临连作障碍,该问题已成为果园更新和苹果产业可持续发展的瓶颈[15]。连作条件下,苹果植株往往表现出生物量降低、干物质的积累量减少、产量降低、树势衰退等。引起连作障碍的原因错综复杂,由植物分泌产生的酚酸类自毒物质是其中的重要因素,根皮苷作为苹果所特有的酚酸类物质也是引起连作障碍的重要原因之一[16]。利用微生物降解法降解环境中的酚酸类物质越来越受到人们的青睐,其优点在于费用低、降解高效、不产生副作用、修复彻底等,是一类低耗高效和环境安全的修复技术,而筛选高效降解酚酸类物质的菌株称为该项技术的关键环节[17]。本研究通过对环渤海一带的果园土壤进行富集培养,筛选出44株能够以根皮苷为唯一碳源生长的真菌,其中,以AMCC300110菌株生长情况和利用根皮苷的能力最强,该菌在2 mmol/L的根皮苷筛选培养基上培养,其菌落直径可达8.2 cm,通过形态学和分子生物学方法初步鉴定该菌为土曲霉。研究特性结果表明,该菌分别在pH5.0、培养温度40℃、根皮苷初始浓度为6 mmol/L时有最大降解率,原因可能是在该培养条件下适合菌体的生长或是菌株产生的活性物质分别在此培养条件下活性最高,因此,研究探索该菌产生何种活性物质以及活性物质有何理化性质是下一步工作的重点。环境中酚酸类自毒物质往往以混合物形式存在,研究发现,该菌能够利用包括对羟基苯甲酸等在内的10种酚酸,表现出广谱降解酚酸的能力,具有一定的应用潜力。
4 结论以环渤海湾苹果主产区的苹果根际土为研究对象,以根皮苷唯一碳源进行富集培养和分离筛选真菌菌种,获得了一株能够高效降解根皮苷的土曲霉,编号为AMCC300110。同时,该菌还具有广谱降解酚酸的能力,为生物降解酚酸类物质,缓解苹果连作障碍提供了科学依据,积累了宝贵的资源。
| [1] | 孙海滨, 毛志泉, 朱树华. 环渤海湾地区连作苹果园土壤中酚酸类物质变化[J]. 生态学报, 2011, 31(1): 90–97. |
| [2] | 黄春生, 熊明. 连作障碍产生的原因及改善途径[J]. 上海蔬菜, 2010, 5: 62–64. DOI:10.3969/j.issn.1002-1469.2010.01.047 |
| [3] | 王闯, 徐公义, 葛长城, 等. 酚酸类物质和植物连作障碍的研究进展[J]. 北方园艺, 2009, 3: 134–137. |
| [4] | 张江红, 毛志泉, 王丽琴, 等. 根皮苷对平邑甜茶幼苗生理特性的影响[J]. 中国农业科学, 2007, 40(3): 492–498. |
| [5] | 张兆波, 毛志泉, 朱树华. 6种酚酸类物质对平邑甜茶幼苗根系线粒体及抗氧化酶活性的影响[J]. 中国农业科学, 2011, 44(15): 3177–3184. |
| [6] | 张一, 王凤忠, 张铭铄, 等. 苹果园土壤中一株根皮苷降解菌的筛选[J]. 山东农业科学, 2011, 12: 59–63. DOI:10.3969/j.issn.1001-4942.2011.01.017 |
| [7] | 王倩, 李晓林. 苯甲酸和肉桂酸对西瓜幼苗生长及枯萎病发生的作用[J]. 中国农业大学学报, 2003, 8(1): 83–86. |
| [8] | 崔晓敬. 苹果砧木抗自毒作用突变体筛选及其抗性生理机制研究[D]. 保定: 河北农业大学, 2010. http://cdmd.cnki.com.cn/article/cdmd-11920-2010139059.htm |
| [9] | Zhang Y, Gu M, Shi K, et al. Effects of aqueous root extracts and hydrophobic root exudates of cucumber(Cucumis sativus L.)on nuclei DNA content and expression of cell cycle-related genes in cucumber radicles[J]. Plant Soil, 2011, 327 : 455–463. |
| [10] | Seal AY, Pratley JE, Haig T, et al. Identification and quantitation of compounds in a series of allelopathic and non-allelopathic rice root exudates[J]. Journal of chemical Ecology, 2004, 30 : 1647–1662. DOI:10.1023/B:JOEC.0000042074.96036.14 |
| [11] | Manici LM, Ciavatta C, Kelderer M. Erschbaumer G. Replant problems in South Tyrol:role of fungal pathogens and microbial population in conventional and organic apple orchards[J]. Plant Soil, 2003, 256:315-324. https://link.springer.com/article/10.1023/A:1026103001592 |
| [12] | 魏景超. 真菌鉴定手册[M]. 上海: 上海科技出版社, 1997. |
| [13] | Cui XJ, Wang YA, Zhen WC. The effects of phlorizin stress on the protective enzyme and metabolic regulation substances in the root of M. micromalus[J]. Frontiers of Agriculture in China, 2010, 3 : 321–324. |
| [14] | Jennings AJ, Nelson CJ. Zone of autotoxic influence around established Alfalfa plants[J]. Agronomy Journal, 2002, 94 (5): 1104–1111. DOI:10.2134/agronj2002.1104 |
| [15] | 白茹. 苹果连作障碍中自毒物质的研究[D]. 杨凌: 西北农林科技大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10712-2010049510.htm |
| [16] | Cao L, Liu H, Zhang H, et al. Characterization of a newly isolated highly effective 3, 5, 6-trichloro-2-pyridinol degrading strain Cupriavidus pauculus P2[J]. Curr. Microbiol, 2012, 65 : 231–236. DOI:10.1007/s00284-012-0150-3 |
| [17] | 黄兴如, 张彩文, 张瑞杰, 等. 多环芳烃降解菌的筛选、鉴定及降解特性[J]. 微生物学通报, 2016, 43(5): 965–973. |