2. 北京市农林科学院北京农业生物技术研究中心, 北京 100097
2. Beijing Agro-Biotechnology Research Center, Beijing Academy of Agriculture and Forestry Sciences, Beijing 100097
我国是水资源严重短缺的国家,干旱、半干旱地区约占国土面积的一半以上,是世界上21个贫水和最缺水的国家之一[1]。干旱严重影响农作物的生长和产量,资料显示,因干旱损失的粮食占各种自然灾害造成粮食损失的60%以上[2]。目前我国北方部分地区,水资源开发利用已经超过资源环境的承受能力,成为工业化和城市化发展的瓶颈。其中,淡水资源70%用于农业生产,因此发展节水农业是应对水资源危机的必由之路[3-5]。微生物土壤修复技术与物理、化学技术相比,具有廉价、高效、不易产生二次污染等特点[6-7]。开发抗旱的微生物菌剂,通过施加菌剂改善土壤的理化性质及植物的抗逆性、促进植物生长,对于大面积干旱退化土壤的修复、提高水源涵养、治理水土流失、发展高效节水农业具有重要意义。
微生物分泌的聚谷氨酸(Poly-γ-glutamic acid,γ-PGA)具有良好的保水性,聚谷氨酸是一种高分子氨基酸聚合物,其分子链上具有大量游离羧基,水溶性好,保水性强,同时具有无毒害、可生物降解、生产成本低等优良特性,它在农业上已经表现出非常广阔的应用前景[8]。张新民等[9]研制的聚谷氨酸吸水材料的吸水率为化学常用的保水剂聚丙烯酸2.85倍,聚谷氨酸较强的保水性,可使水分在土壤中缓慢释放,提高土壤水分的有效性[10-11]。聚谷氨酸同时具有减渗作用,可改变土壤剖面含水率的分布情况,使水分集中在作物根部[12]。因此开发高效的分泌聚谷氨酸的微生物,具有重要的实用价值。
目前国内外对于聚谷氨酸在农业方面的研究多集中在其发酵条件优化、自身材料的改进和对植物生长及土壤理化性质的影响[13-15],但关于聚谷氨酸对土壤微生物的影响还鲜有报道。本研究旨在筛选聚谷氨酸产生菌,并利用其发酵液进行土壤保水性实验,通过盆栽试验研究细菌发酵液对植物抗旱性以及土壤微生物群落的作用,旨为聚谷氨酸应用于农业生产提供依据。
1 材料与方法 1.1 材料 1.1.1 实验材料及试剂纳豆及豆豉购自超市;葡萄糖、胰蛋白胨、酵母膏、谷氨酸钠、氯化钠、琼脂、氯化铵等均为国产分析纯;聚谷氨酸标准品购自sigma公司;DNA提取试剂盒购自天根公司;引物合成由生工生物工程有限公司合成;DNA测序由北京博迈德生物科技有限公司完成。
1.1.2 培养基产聚谷氨酸菌株的分离及保存采用LB固体培养基:酵母粉5 g/L,胰蛋白胨10 g/L,NaCl 10 g/L,琼脂20 g/L,pH 7.0,121℃灭菌20 min。以LB液体培养基作为种子培养基。发酵培养基:葡萄糖20 g/L,酵母粉1 g/L,谷氨酸钠18 g/L,(NH4)2SO41g/L,CaCl20.2 g/L,K2HPO40.5 g/L,MgSO40.1 g/L。
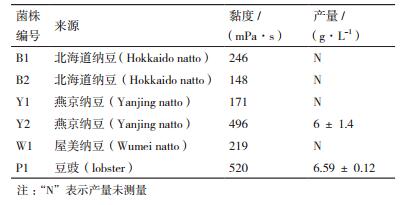
1.2 方法 1.2.1 产聚谷氨酸菌株的分离及发酵培养产聚谷氨酸菌株初筛:称取2 g纳豆或豆豉于10 mL无菌水中,振荡2 min,静置30 min,然后放水浴锅中,100℃维持5 min。冷却后吸取上清液1mL,采用平板培养法进行系列稀释涂布,37℃培养24 h,挑取生长迅速并且能够拉丝的单菌落,分离纯化后于LB试管斜面培养基4℃保存。复筛:将初筛得到的菌株接种到种子培养基中,37℃、150 r/min培养20 h,然后按2%的接种量接种到发酵培养基中,37℃、200 r/min培养48 h,发酵液用黏度计测量表观黏度,选择黏度较大的菌株作为复筛菌株。
1.2.2 聚谷氨酸产物的提取纯化及产物分析 1.2.2.1 提取纯化将以上筛选获得的黏度较大菌株的发酵液8 000 r/min离心15 min,去除菌体,取上清液用HCl调pH至3-4,加4倍的无水乙醇,低温静置过夜。去上清液得粗品,透析脱盐过夜。将透析后的样品进行冷冻干燥,得到纯化粗品。
1.2.2.2 产物分析(1)聚谷氨酸的水解:取0.05 g纯化样品,放入水解管中,加入10 mL、6 mol/L的HCl,通入氮气,维持5 min后封口,120℃水解12 h,冷却后过滤至小烧杯中备用。(2)紫外扫描光谱分析:将水解后的溶液稀释4倍,在190-600 nm的波长下进行紫外扫描,与聚谷氨酸标准品进行对比。(3)质谱-同位素内标法分析:利用高效液相色谱-四级杆离子阱串联质谱仪HPLC-MS/MS Q-TRAP分析水解液中氨基酸的组成及含量。
1.2.3 产聚谷氨酸菌株鉴定(1)生理生化鉴定:菌体形态、生理生化与Biolog GENIII鉴定板鉴定。(2)菌株16S rRNA鉴定:采用细菌DNA提取试剂盒(MoBio)进行菌体DNA提取。扩增应用细菌通用引物27F:5'-AGAGTTTGATCCTGGCTCAG-3',1492R:5'-TACGGCTACCTTGTTACGACTT-3'[16]。测序由北京博迈德公司完成。
1.2.4 聚谷氨酸产生菌对土壤保水性分析将土壤去除杂质,烘干充分研碎后备用。取6 mL聚谷氨酸发酵液稀释液,以蒸馏水作为对照,将水或聚谷氨酸发酵液充分拌于16 g烘干土壤中,然后均匀分散在直径为9 cm的表面皿中。将表面皿放置恒温40℃的培养箱中,定时取出称重,计算失水量:
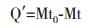
式中:Q'为保水剂的失水量(g),Mt0为最初表面皿的总重量(g),Mt为t时刻表面皿的总重量(g)。
1.2.5 玉米盆栽实验设计试验于2017年3月至4月在北京市农林科学院玻璃温室内进行。用塑料盆(120×100 mm)装400 g混合土(大田土:营养土:蛭石=1V:1V:1V),土壤田间持水量为15.22%,室温为20.8-35.4℃,湿度7.9%-12.3%,采用自然光照。供试玉米品种为郑58,挑取饱满玉米种子在28℃暗箱里进行催芽育苗,3-4 d后选取生长和健壮程度一致的玉米苗移栽。玉米在三叶一心期进行控水,实验共设3个处理(聚谷氨酸发酵液P1,聚谷氨酸发酵液Y2,自来水),每个处理设置5盆重复,每盆种3株。每周测一次生态指标,包括玉米的苗长、最大叶片叶面长和宽。盆栽实验结束后,分别将植株的茎叶和根放在80℃烘箱中烘干24 h,记录植株地上部分和地下部分干重。
1.2.6 土壤理化性质和微生物群落代谢特征测定方法土壤含水率采用烘干法,pH和电导率分别使用pH计和电导率仪。采用BiologECO微平板测定微生物代谢特征,该板包括31种碳源和空白对照,各3个重复。取新鲜土样制成微生物加样液,每孔加入150 μL置于28℃恒温培养箱培养10 d,每隔24 h用Biolog细菌自动读数仪读数。选取144 h的Biolog平均光密度吸收值进行后续数据的处理。
1.2.7 微生物群落代谢特征多样性计算经检测得到的每个吸光度值数据都是微生物对碳源利用的量值体现,这些量的差异主要由平均色度值(Average well color development,AWCD)、Shannon-Wiener多样性指数(H')、Mclntosh多样性指数(U)、Simpson优势度指数(D)以及Pielou均匀度指数(Jsw)来表征。其计算公式分别如下:

式中,n为培养基碳源种类数(本研究n = 31),Ci为第i(i = 1,2,3…,31)个非对照孔的吸光度值,R为对照孔的吸光度值,Pi为第i个非对照孔的吸光度值与所有非对照孔吸光度值总和的比值。采用EXCEL2013进行数据的基础处理,采用R语言进行数据差异显著性分析。
2 结果 2.1 聚谷氨酸产生菌的分离及鉴定 2.1.1 聚谷氨酸产生菌的分离采用平板培养法,从3种不同的纳豆样品和1种豆豉中分离、纯化,初筛得到6株生长迅速并且能够拉丝的菌株。经过摇瓶发酵复筛得到表观黏度较大的菌株2株(表 1)。其中Y2和P1产聚谷氨酸稳定,产量可达6 g/L和6.59 g/L。
将水解后的溶液稀释4倍,在190-600 nm的波长下进行紫外扫描,与聚谷氨酸标准品进行对比(图 1)。样品水解液与聚谷氨酸标准品在264 nm处均出现吸收峰,因此可以确定为发酵产物由谷氨酸聚合而成。此外在218 nm处出现吸收峰,据资料显示聚谷氨酸的吸收峰为216 nm,由紫外扫描的光谱图鉴定菌株P1与Y2的产物为聚谷氨酸。利用质谱-同位素内标法检测水解液中50种常见氨基酸的组成及含量(图 2)。P1和Y2水解液中谷氨酸含量分别占92.63%和95.48%,因此可以确定菌株发酵液的主要产物为谷氨酸聚合而成的高分子聚合物聚谷氨酸。
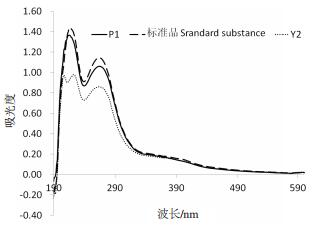
|
| 图 1 菌株发酵产物水解液的紫外扫描峰图 |
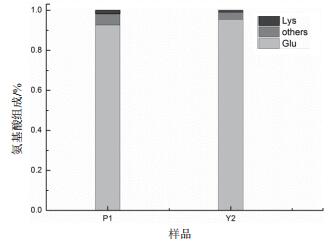
|
| 图 2 菌株发酵产物水解液的氨基酸组成 |
筛选出的菌株菌落表面光滑。生长到一定程度后就变成奶白色菌落,伞形,菌落表面有褶皱,菌落较大,挑取菌落,会出现拉丝。取少量种子液进行革兰氏鉴定,为革兰氏阳性菌。经芽孢染色,可观察到杆状细胞,有芽孢。
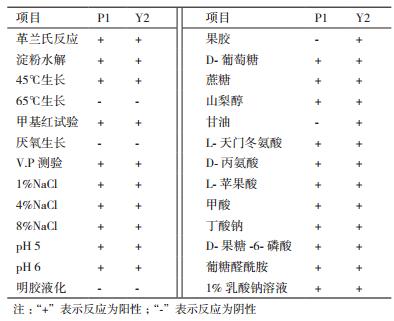
2.1.3.2 生理生化特征对P1和Y2菌株进行了部分生理生化鉴定,并使用Biolog GENIII鉴定板进行菌株碳代谢情况的测定,得到P1和Y2菌株可以水解淀粉,葡萄糖产酸,好氧,甲基红阳性,利用葡萄糖,蔗糖,山梨醇,丙氨酸,天冬氨酸,苹果酸和甲酸(表 2)。
从菌株基因组内扩增出1 500 bp的单一条带,经测序确定16S rRNA基因序列。序列与NCBI数据库中的16S rRNA序列进行BLAST比对分析。比对结果表明,NCBI数据库中与菌株Y2与P1相似度较高的菌株均属于枯草芽孢杆菌,利用MEGA软件,将Y2与P1菌株16S rRNA序列与GenBank数据中已知菌株的序列进行比对,结果(图 3)显示Y2和P1与Bacillus subtilis subsp. subtilis str.168(NC000964)、Bacillus subtilis subsp. subtilis strain PCD3(KY910140)、Bacillus subtilis strain TLO3(CP021169)和Bacillus subtilis strain SFA6(HM486416)聚集在一起,因此在分子水平上确定Y2和P1菌株为枯草芽孢杆菌。

|
| 图 3 Y2和P1菌株的16S rRNA的系统发育树 |
为检测菌株聚谷氨酸发酵液对土壤的保水性,将聚谷氨酸发酵液加到干土中,40℃恒温蒸发30 h,加聚谷氨酸发酵液的样品土壤失水率始终低于加蒸馏水的样品,蒸发3 h各处理组失水率基本一致,分别为8.06%、7.57%和7.5%,这可能是由于泥土表面的水分相对比较均匀的蒸发;到第6 h发酵液处理组的失水率明显低于对照组,P1聚谷氨酸发酵液、Y2聚谷氨酸发酵液与蒸馏水的失水率分别为16.93%、17.47%和20.61%(图 4)。说明聚谷氨酸发酵液可以减缓土壤中水分的蒸发,对土壤有一定保水效果;到第20 h处理组与对照组差异减小,各处理组失水量基本不变。

|
| 图 4 聚谷氨酸发酵液对土壤的保水作用 |
为试验聚谷氨酸发酵液在玉米幼苗生长过程的作用,两周施用一次聚谷氨酸发酵液的2倍稀释液,共施加两次。控制土壤含水量为田间最大持水量的30%-40%,相当中度干旱胁迫,移栽30 d后,测定植株生长状况。结果表明,与对照组相比,聚谷氨酸发酵液Y2处理可提高玉米幼苗的株高及生物量,但提高幅度小于聚谷氨酸发酵液P1。P1处理使玉米幼苗株高与最大叶面积显著增加;地上与地下生物量分别提高40.70%与19.59%,差异达到显著水平(P < 0.05)(表 3)。由此可见,聚谷氨酸发酵液P1可增强玉米幼苗的抗旱性,同时对其生长具有良好的促进作用。
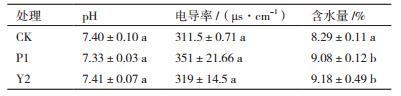
为进一步研究菌株的聚谷氨酸发酵液施加到土壤中是否对土壤理化性质造成影响,本研究分析了施加聚谷氨酸土壤中各项理化指标的变化。在盆栽实验结束后,测量各处理土壤的含水率、pH和电导率。结果(表 4)表明,聚谷氨酸发酵液处理对土壤pH和电导率基本无影响。处理组与对照组的pH在7.3-7.4左右,为中性。P1处理组的电导率略高于对照组和Y2处理组,但差异不显著。两株聚谷氨酸发酵液P1和Y2处理的土壤含水率分别为9.08%和9.18%均高于对照组土壤,差异达到显著水平(P < 0.05)。由此可知,聚谷氨酸发酵液的施加减缓土壤中水分的蒸发,缓解干旱胁迫对玉米幼苗的危害。
采用Biolog ECO微平板技术检测了土壤微生物的代谢多样性,平均颜色变化率(Average well color development,AWCD)表征微生物群落碳源利用率,反映了土壤微生物活性、微生物群落生理功能多样性。连续10 d每隔24 h测AWCD,从图 5中可以看出,AWCD随培养时间的延长而提高,不同处理都表现出在开始的24 h变化不大,而在第24-72 h内快速升高,随后持续缓慢地升高直到实验结束。不同处理AWCD的变化情况基本一致,表明聚谷氨酸发酵液的施加对碳代谢微生物的影响较小。为了进一步分析施加聚谷氨酸发酵液对土壤微生物丰度及均度的影响,计算了Shannon指数、Simpson指数、Pielou指数与Mclntosh指数,它们分别反映土壤微生物物种的丰富度、优势度以及群落物种的均匀度。Shannon指数的结果(表 5)表明,施加菌株P1的聚谷氨酸发酵液,玉米根际土壤微生物群落多样性呈增加趋势,施加菌株Y2的聚谷氨酸发酵液处理多样性降低,然而施加发酵液处理与对照组相比并没有显著性差异。Pielou和McIntosh指数的结果显示,P1处理的微生物均匀度最高;与处理组相比,加Y2聚谷氨酸发酵液略降低土壤微生物的均匀度。Simpson指数较多反映群落中常见的物种[17],本研究中与对照水处理相比,P1与Y2处理没有显著差异(P > 0.05),可见施加菌株的聚谷氨酸发酵液对土壤中常见微生物的多样性和均度没有显著影响。

|
| 图 5 微生物AWCD值随培养时间的变化曲线 |
本研究从豆豉和纳豆中分离得到两株聚谷氨酸产生菌,经生理生化、Biolog GEN III鉴定板以及16s rRNA鉴定两株菌均为枯草芽孢杆菌。应用菌株的聚谷氨酸发酵液对土壤保水性能分析及玉米盆栽实验,研究发现这两株聚谷氨酸产生菌的发酵液均可减缓土壤中水分的蒸发,土壤含水率均高于对照组土壤。聚谷氨酸发酵液可能在土壤表面形成保护膜,使水分可以较长时间的保持在土壤中、缓慢释放,以提高土壤水分的有效性。一些研究者认为聚谷氨酸粉末拌土不但增加了土壤的持水性,还能改变土壤剖面水分的分布形态,使水分蓄积在作物根部土层区[9]。这与聚谷氨酸的分子结构相关,其上含有大量的亲水性羧基和肽键,易交联、吸水饱和形成水凝胶,从而增加土壤颗粒的持水容量及释放速率。已有研究也表明聚谷氨酸可以使土壤颗粒膨胀,引起土壤结构、孔隙改变,增强土壤通透性[18],同时具有一定的缓冲作用,能有效平衡土壤酸碱性[19]。盆栽实验表明在中度干旱胁迫下,聚谷氨酸发酵液的施加可显著提高玉米幼苗的株高和生物量,施加聚谷氨酸发酵液P1对玉米幼苗有明显的促生效果。朱安婷等[20]研究也证明聚谷氨酸施加可以提高水稻幼苗的叶片活力,增加渗透调节物质的积累,缓解干旱对水稻幼苗的伤害。然而菌株Y2的聚谷氨酸发酵液相对于对照组增长不显著(P>0.05),这可能是与两株菌的发酵产物的分子量和浓度不同有关。郝荣华等[21]的研究表明,不同分子量的聚谷氨酸能够不同程度地增加幼苗的株高、根长以及鲜重等指标。由此可见,菌株的聚谷氨酸发酵液可增加植被在轻中度干旱土壤中的抗胁迫能力,提高植被的生物量。
3.2 聚谷氨酸发酵液对土壤微生物区系的影响土壤微生物对维持土壤功能至关重要,丰富的土壤微生物多样性有利于提高生态系统的稳定性、生产力以及可持续性[22-23]。有研究表明接种促生菌或添加有机肥都会调控细菌群落结构和多样性[24]。本文应用BiologECO微平板技术进行土壤微生物的代谢多样性分析,与对照组相比,施加菌株Y2的聚谷氨酸发酵液,对土壤中常见菌种的多样性及均度影响不大,菌株P1发酵液的施加具有提高玉米根际土壤微生物群落丰富度以及均度的趋势,这可能助于玉米幼苗的生长以及抗旱性。Ling等[25]发现一种新型的有机生物肥料可以提高土壤细菌群落的多样,其他有机聚合物如腐殖酸物等亦可改变土壤微生物群落多样性[26-28]。也有研究表明聚谷氨酸不但具有保水保肥性能,还可以为微生物提供碳源和氮源,提高土壤有益微生物活性[29],此外,土壤微生物群体生物量和多样性与植物生物量之间存在正相关性[30]。Xu等[31]利用聚谷氨酸作为肥料增效剂,调查了不同施加方式下,聚谷氨酸和尿素对土壤微生物多样性和氮循环的影响,研究结果表明聚谷氨酸包裹尿素的施加方式,不但可以提高油菜的产量,还可增加土壤可培养微生物的数量,提高土壤生态系统的稳定性。本研究中的两株菌的聚谷氨酸发酵液直接施加到土壤,未显著改变土壤中常见的微生物群落多样性及均度,其对于土壤中总的微生物组成是否有作用以及哪些菌群发生改变仍需后续微生物群落高通量测序实验进一步研究。
4 结论从纳豆和豆豉中分离出两株聚谷氨酸产生菌,经鉴定均为枯草芽孢杆菌,且其发酵液均可提高土壤的持水性。在中度干旱胁迫条件下,菌株P1聚谷氨酸发酵液可显著提高玉米幼苗抗旱性、幼苗株高、叶面积以及生物量。菌株聚谷氨酸发酵液具有良好的保水性,且不显著影响土壤微生物群落的多样性及均度,是安全的土壤生态保水剂。
| [1] | 柴方营. 中国水资源产权配置与管理研究[D]. 哈尔滨: 东北农业大学, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10224-2006178643.htm |
| [2] | 齐述华. 干旱监测遥感模型和中国干旱时空分析[D]. 北京: 中国科学院研究生院, 2004. http://cdmd.cnki.com.cn/Article/CDMD-80070-2004097759.htm |
| [3] | 李希, 贺纪正, 郑袁明, 等. 新型保水剂应用于土壤-小白菜系统的环境安全评价[J]. 环境科学, 2014, 35(2): 780–785. |
| [4] | 王传海, 何都良, 郑有飞, 等. 保水剂新材料γ-聚谷氨酸的吸水性能和生物学效应的初步研究[J]. 中国农业气象, 2004, 25(2): 20–23. |
| [5] | 张利平, 夏军, 胡志芳. 中国水资源状况与水资源安全问题分析[J]. 长江流域资源与环境, 2009, 18(2): 116–120. |
| [6] | 钱春香, 王明明, 许燕波. 土壤重金属污染现状及微生物修复技术研究进展[J]. 东南大学学报:自然科学版, 2013, 43(3): 669–674. |
| [7] | 周际海, 黄荣霞, 樊后保, 等. 污染土壤修复技术研究进展[J]. 水土保持研究, 2016, 23(3): 366–372. |
| [8] | 王传海, 何都良, 郑有飞, 等. 保水剂新材料γ-聚谷氨酸的吸水性能和生物学效应的初步研究[J]. 中国农业气象, 2004, 25(2): 20–23. |
| [9] | 张新民, 姚克敏, 徐虹. 新型高效吸水材料(γ-PGA)的农业应用研究初报[J]. 南京气象学院学报, 2004, 27(2): 224–229. |
| [10] | 张文, 张树清, 王学江. γ-聚谷氨酸的微生物合成及其在农业生产中的应用[J]. 中国农学通报, 2014, 27(6): 40–45. DOI:10.11924/j.issn.1000-6850.2013-1419 |
| [11] | 张超. 环境友好型土壤保水剂聚γ-谷氨酸高吸水性树脂的制备[D]. 曲阜: 曲阜师范大学, 2009. http://www.docin.com/p-911477103.html |
| [12] | 史文娟, 梁嘉平, 陶汪海, 等. 添加γ-聚谷氨酸减少土壤水分深层渗漏提高持水能力[J]. 农业工程学报, 2015, 31(23): 94–100. DOI:10.11975/j.issn.1002-6819.2015.23.013 |
| [13] | 白文波, 王春艳, 李茂松, 等. 不同灌溉条件下保水剂对新疆棉花生长及产量的影响[J]. 农业工程学报, 2010, 26(10): 69–76. DOI:10.3969/j.issn.1002-6819.2010.10.011 |
| [14] | 陈晓蓉, 刘辉, 陈薇, 等. 几种矿物复合保水剂的保水性能及养分增效研究[J]. 土壤学报, 2012, 49(01): 194–197. |
| [15] | Busscher WJ, Bjorneberg DL, Sojka RE. Field application of PAM as an amendment in deep-tilled US southeastern coastal plain soils[J]. Soil and Tillage Research, 2009, 104 (2): 215–220. DOI:10.1016/j.still.2009.02.009 |
| [16] | 刘玮琦, 茆振川, 杨宇红, 等. 应用16S rRNA基因文库技术分析土壤细菌群落的多样性[J]. 微生物学报, 2008, 48(10): 1344–1350. DOI:10.3321/j.issn:0001-6209.2008.10.012 |
| [17] | 徐华勤, 肖润林, 邹冬生, 等. 长期施肥对茶园土壤微生物群落功能多样性的影响[J]. 生态学报, 2007, 27(8): 3355–3361. |
| [18] | Tarui Y, Iida H, Ono E, et al. Biosynthesis of poly-γ-glutamic acid in plants:Transient expression of poly-γ-glutamate synthetase complex in tobacco leaves[J]. Journal of Bioscience and Bioengineering, 2005, 100 (4): 443–448. DOI:10.1263/jbb.100.443 |
| [19] | Doran JW, Zeiss MR. Soil health and sustainability:managing the biotic component of soil quality[J]. Applied Soil Ecology, 2000, 15 (1): 3–11. DOI:10.1016/S0929-1393(00)00067-6 |
| [20] | 朱安婷, 蒋友武, 谢国生, 等. 外源聚γ-谷氨酸对水稻幼苗耐旱性和渗透调节的影响[J]. 核农学报, 2010, 24(6): 1269–1273. DOI:10.11869/hnxb.2010.06.1269 |
| [21] | 郝荣华, 张晓元, 刘飞, 等. 不同分子量γ-聚谷氨酸对绿豆萌发及幼苗的影响[J]. 江苏农业科学, 2016, 44(6): 169–171. |
| [22] | Ibekwe AM, Kennedy AC, Frohne PS, et al. Microbial diversity along a transect of agronomic zones[J]. FEMS Microbiology Ecology, 2002, 39 (3): 183–191. DOI:10.1111/fem.2002.39.issue-3 |
| [23] | Set?l? H, McLean MA. Decomposition rate of organic substrates in relation to the species diversity of soil saprophytic fungi[J]. Oecologia, 2004, 139 (1): 98–107. DOI:10.1007/s00442-003-1478-y |
| [24] | Nie S, Xu H, Li S, et al. Relationships between abundance of microbial functional genes and the status and fluxes of carbon and nitrogen in rice rhizosphere and bulk soils[J]. Pedosphere, 2014, 24 (5): 645–651. DOI:10.1016/S1002-0160(14)60050-3 |
| [25] | Ling N, Deng K, Song Y, et al. Variation of rhizosphere bacterial community in watermelon continuous mono-cropping soil by long-term application of a novel bioorganic fertilizer[J]. Microbiological Research, 2014, 169 (7): 570–578. |
| [26] | Zhang Q, Shamsi IH, Xu D, et al. Chemical fertilizer and organic manure inputs in soil exhibit a vice versa pattern of microbial community structure[J]. Applied Soil Ecology, 2012, 57 : 1–8. DOI:10.1016/j.apsoil.2012.02.012 |
| [27] | Geisseler D, Horwath WR, Joergensen RG, et al. Pathways of nitro-gen utilization by soil microorganisms-a review[J]. Soil Biology & Biochemistry, 2010, 42 (12): 2058–2067. |
| [28] | Puglisi E, Fragoulis G, Ricciuti P, et al. Effects of a humic acid and its size-fractions on the bacterial community of soil rhizosphere under maize(Zea mays L.)[J]. Chemosphere, 2009, 77 (6): 829–837. DOI:10.1016/j.chemosphere.2009.07.077 |
| [29] | 褚群. γ-聚谷氨酸和解磷菌M20对番茄和西瓜穴盘苗基质养分供应和根际细菌群落结构的影响[D]. 北京: 中国农业科学院, 2016. http://cdmd.cnki.com.cn/Article/CDMD-82101-1016251522.htm |
| [30] | Wang J, Li X, Zhang J, et al. Effect of root exudates on beneficial microorganisms-evidence from a continuous soybean monoculture[J]. Plant Ecology, 2012, 213 (12): 1883–1892. DOI:10.1007/s11258-012-0088-3 |
| [31] | Xu Z, Lei P, Feng X, et al. Effect of poly(γ-glutamic acid)on microbial community and nitrogen pools of soil[J]. Acta Agriculturae Scandinavica, Section B-Soil & Plant Science, 2013, 63 (8): 657–668. |