2. 山东省土壤肥料总站, 济南 250100
2. Soil and Fertilizer Station of Shandong Province, Jinan 250100
花生作为世界主要的油料作物,是人类重要的油脂来源。河南是我国的粮油生产大省,其花生的种植和栽培具有悠久历史,提高河南花生产区的产量及品质对河南乃至全国都具有重要的意义。
作为河南省主要土壤类型之一,砂质潮土具有养分含量低、保肥性差等特点。在该土壤上种植的作物后期容易出现脱肥早衰现象,但因其通气性良好、通透性强,适合微生物生存。同时由于我国农业现代化的进程不断加快和深入,过量农药和化肥的施用不但增加了生产成本同时也极大程度上破坏了生态环境,到2020年我国化肥施用量要基本实现零增长,因此“减肥增效”是当前我国农业面临的重要挑战[1]。应用微生物制剂来替代部分化肥与农药也逐渐成为当前的研究热点。
根际促生菌(Plant growth promoting rhizobacte-ria,PGPR)是指生长在植物根际土壤中的具有促进植物生长、提高植物抗性功能的一类有益细菌[2-4]。大量研究表明,PGPR在水稻[5]、小麦[6]、玉米[7]、棉花[8]、大豆[9]及烟草[10]中的应用均取得了良好的效果。但是在花生上面的应用较少且功能相对单一,如姜瑛等[11]从灰潮土中的花生根际中筛选出具有固氮解磷功能的花生促生菌;李引等[12]从红壤中的花生根际中筛选出7株具有合成生长素的花生促生菌;闫小梅等[13]从潮土中筛选出一株具有解磷作用花生促生菌。花生根际促生菌在华北地区砂质潮土上的应用则更少,本实验室在前期,由张东艳等[14]从华北地区砂质潮土中筛选出一株具有产IAA功能的根际促生菌,本研究则后续从砂质潮土花生根际土中筛选一株具有固氮、解磷解钾以及合成生长素等多种促生功能的根际促生菌,并通过花生盆栽试验来验证其促生效应,旨为河南花生种植区产量和品质的提升奠定技术基础和提供理论依据。
1 材料与方法 1.1 材料 1.1.1 土样采集与保存根际土壤采集:农业部华北小麦玉米轮作营养与施肥科学观测试验站(河南,许昌)中选出一株长势较好的花生植株,取其根际10 cm范围内的土壤,用手轻轻抖落根系上的土壤,装入无菌袋中,带回实验室,备用。
盆栽土样采自农业部华北小麦玉米轮作营养与施肥科学观测试验站(河南许昌市)。取表层土壤(0-20 cm)土样,剔除枯枝落叶及根系后,过2 mm筛保存备用,土壤基本性状如表 1所示。
LB培养基:蛋白胨10 g,酵母提取物5 g,氯化钠10 g,蒸馏水1 000 mL,pH 7.0-7.2。121℃灭菌30 min;PKO液体培养基(无机磷细菌培养基):氯化钠0.3 g,葡萄糖10 g,氯化钾0.3 g,磷酸三钙5 g,硫酸铵0.5 g,七水合硫酸镁0.3 g,硫酸锰0.03 g,七水合硫酸亚铁0.03 g,蒸馏水1 000 mL,调节pH 7.0-7.2,121℃灭菌30 min;Ashby无氮培养基:甘露醇10.0 g,磷酸氢二钾0.2 g,七水硫酸镁0.2 g,氯化钾0.2 g,二水硫酸铵0.2 g,碳酸钙5.0 g,pH 7.2;液态解钾细菌培养基:蔗糖10.0 g,酵母膏0.5 g,硫酸铵1.0 g,磷酸氢二钾2.0 g,七水硫酸镁0.5 g,碳酸钙1.0 g,钾长石粉1.0 g,蒸馏水1 L,121℃灭菌20 min。
1.2 方法 1.2.1 供试土壤理化性质与植株的测定方法供试土壤理化性质和盆栽植株各指标的测定方法参考鲍士旦[15]的《土壤农化分析》。
1.2.2 菌株的筛选菌株的分离纯化:从农业部华北小麦玉米轮作营养与施肥科学观测试验站中选出一株长势较好的花生植株,取其根际10 cm范围内的土壤,用手轻轻抖落根系上的土壤,装入无菌袋中,带回实验室。在实验室内,取10 g土壤样品将其加入到装有100 mL无菌水的250 mL锥形瓶中,震荡20 min,静置10 min形成浓度为0.1 g/mL的菌悬液。按照稀释平板法将悬浮液稀释至10-6,30℃培养24 h,之后分离纯化出不同的根际菌株,保存在4℃冰箱中备用[16]。
1.2.3 溶磷能力的测定将筛选得到的菌株进行溶磷能力的定量测定,将纯化后的解磷菌接种于盛有50 mL的PKO液体培养基的三角瓶中,置于恒温摇床上振荡,温度为30℃、转速为180 r/min、培养时间为3 d,培养结束后将10 mL培养液转移至10 mL离心管中,温度4℃、转速10 000 r/min条件下离心15 min,离心后上收集上清液,用钼蓝比色法测定上清液中有效磷的含量。
1.2.4 解钾能力的测定在无菌操作台中,将分离的菌株分别接种于盛有50 mL液态解钾细菌培养基的150 mL三角瓶,放置于摇床中,设置摇床温度为30℃,转速180 r/min。培养3 d,用10 mL的离心管将培养液10 000 r/min离心,10 min后,取出离心管,转移出上清液,用火焰分光光度计测定钾的含量。
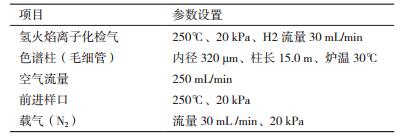
1.2.5 固氮能力测定向无氮液体培养基中分别接入已纯化的菌株,恒温培养24 h后,离心收集菌细胞,并向菌细胞中加入45 mL无菌水和5 mL无氮液体培养基,形成50 mL的菌悬浮液(浓度约为107个/mL)作为待接种菌液,并采用乙炔还原法测定固氮酶活性。乙炔还原活性(ARA)采用美国HP公司生产的HP6890型气相色谱仪测定其具体设置项目参数,如表 2所示。
乙炔还原活性(ARA),其计算公式为(单位:nmolC2H4/h·mL):

将分离纯化后的细菌接种于含有L-色氨酸(80 mg/L)的LB液体培养基,每一菌株3个重复,摇床培养(30℃,180 r/min)1 d后,取50 μL菌悬液滴于白色陶瓷板上,同时加入等体积的Salkowski比色液(50 mL 35% HClO4+ 1 mL 0.5 mol/LFeCl3),并以加入50 μL未接菌的LB液体培养基与等体积比色液的混合溶液为对照。将白色陶瓷板于室温避光放置30 min后观察,颜色变粉红者为阳性,表示能够分泌IAA,颜色越深表示分泌的强度越大,不变色为阴性,表示不能分泌IAA。
1.2.6.2 IAA含量的定量分析对初筛获得的能分泌IAA的细菌进行定量测定,培养条件同上。首先用分光光度法测定菌悬液的OD600值,然后将菌悬液以10 000 r/min离心10 min取上清液加入等体积Salkowski比色液,避光静置30 min,测定其OD530值。对照标准曲线计算单位体积发酵液中IAA的含量。标准曲线的绘制采用分析纯的IAA梯度稀释制备。
1.2.6.3 IAA标准曲线配置精确称取32.8 mg的IAA于100 mL容量瓶中,用甲醇定容(该溶液含IAA 328 µg/mL)。再用甲醇依次稀释1倍,连续进行4次,配成5份浓度依次相差1倍的标准溶液,比色时也是等量的标准溶液加等量的比色液。
1.2.7 植物促生菌的生理生化及16S rDNA分子学鉴定 1.2.7.1 菌落的形态观察将筛选的菌株接种到LB平板上,30℃培养24 h,观察菌落的大小、形状、颜色、光泽度、粘稠度、隆起形状、透明度、边缘特征及有无芽胞等。
1.2.7.2 菌株生理生化指标的测定生理生化鉴定试验的方法参照《常见细菌系统鉴定手册》和《伯杰细菌鉴定手册》[19, 20],对该菌株进行革兰氏染色、好氧性、过氧化氢酶、甲基红、乙酞甲基甲醇、淀粉水解、硝酸盐还原、柠檬酸盐利用以及明胶液化试验。
1.2.7.3 菌株的分子生物学鉴定采用SDS-CTAB法提取总基因组DNA[21],采用16S rDNA通用引物27f(5'-AGAGTTTGATCCTGGCTCAG-3')和1 492 r(5'-GGTTACCTTGTTACGACTT-3')进行16S rDNA的PCR扩增[22]。PCR反应条件:94℃预变性30 s;94℃变性30 s,36℃退火30 s,72℃延伸60 s,35个循环。将PCR产物进行1.5%的琼脂糖凝胶电泳。PCR产物经琼脂糖凝胶电泳后回收纯化测序(北京美亿美生物技术有限公司),根据获得的16S rDNA序列在GenBank中Blast搜索同源序列,通过MEGA 5.0软件,通过MEGA 5.0软件,用邻接法(Neighbour-Joining)建立系统进化树。
1.2.8 促生盆栽试验设计花生盆栽试验于2015年6月在河南农业大学科教园区内(郑州)进行,每盆装土700 g,调节含水量至田间持水量的60%[23]。试验用花生品种为“豫花八号”,20%双氧水消毒20 min后,无菌水冲洗多次,催芽2 d。选取生长状况一致的种子每盆种植两颗,待长势稳定后定植为每盆一棵。
接菌处理:将HS9接种于LB液体培养基,培养温度30℃,180 r/min摇床培养至对数期,然后将菌悬液10 000 r/min离心10 min,再用无菌水重悬并反复离心3次,此时接种量为108 CFU/g(等量菌株121℃,30 min高温高压灭菌即得灭活菌株)。将重悬后的菌株沿小麦根周围均匀的浇入土壤中。对照处理:对照处理土壤不施菌液以等体积灭活菌悬液代替。每个处理设置设6个重复。试验过程中不再施入其他肥料。
自然条件下生长30 d后进行采样(植株样和土壤)并对花生根系指标进行分析(Winrhizo2003,Canada),并测定土壤矿质氮、速效磷、速效钾含量,以及植株鲜重、干重、株高、SPAD值及全氮、全磷、全钾[17],土壤IAA含量用HPLC法测定[24]。
1.2.9 数据统计与分析本试验中所得采用SPSS 23.0进行相关分析统计,用Duncan(新复极差)法以及LSD法进行数据的方差分析(P < 0.05);运用Office 2016以及origin 2017进行相关图表的制作。
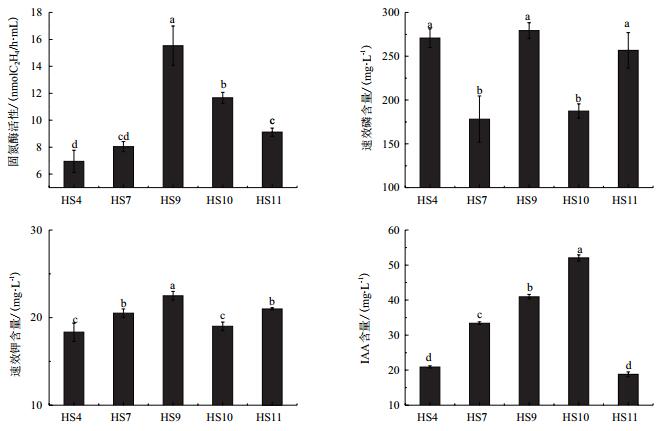
2 结果 2.1 菌株的固氮酶活性、磷钾溶解及IAA合成能力以及优势菌株的筛选从花生根际土壤中筛选出5株花生根际促生菌HS4、HS7、HS9、HS10和HS11。在经过液态摇瓶培养后,测定5株菌株的固氮酶活性、解磷解钾以及合成IAA的能力。由图 1可知,菌株HS9的固氮酶活性、溶钾能力均显著高于其他菌株,分别为15.53 nmol C2H4/h·mL和22.5 mg/L。这表明在5种菌株中,HS9具有较强的固氮、溶钾能力;解磷能力方面,菌株HS4、HS9和HS11三个菌株的解磷能力较好,但三者之间的差异不显著,其中HS9的无机磷含量最高为279.23 mg/L。由图 1可看出,5株菌均为产IAA菌,其产IAA能力大小顺序依次为HS10 > HS9 > HS7 > HS4 > HS11,其中HS10菌株的IAA合成量最大,为50.03 mg/L,且与其他菌株呈显著性差异。而HS9菌株的IAA合成量为40.96 mg/L,均与其他菌株呈显著性差异。因此我们选取菌株HS9为高效的固氮、解磷溶钾、以及合成IA的多功能促生菌,并进行盆栽试验验证其促生效果。
|
| 图 1 各菌株对固氮酶活性、解磷解钾、IAA合成量的影响 |
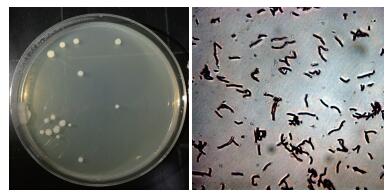
经平板划线、革兰氏染色,观察菌株培养特征及形态特征分析后发现根际促生菌HS9菌落形态呈同心圆状,不透明,表面粗糙,不湿润,产芽胞,菌体形态呈弯曲杆状(图 2)。
|
| 图 2 菌株HS9的形态观察 |
对菌株HS9进行革兰氏染色、好氧性试验、接触酶试验、甲基红反应(M.R)以及V-P试验后得到其生理生化指标。由表 3可知,菌株HS9为革兰氏阳性的兼性厌氧性细菌。其淀粉水解、明胶液化、接触酶试验、硝酸盐还原、V-P试验项目均呈现阳性反应,甲基红(M.R)反应、柠檬酸盐利用则呈现阴性反应。
将16S rDNA的测序结果和GenBank中已登录的核苷酸序列进行同源性比对,发现菌株HS9与Bacillus flexus IFO15715(AB021185)同源性达到99%,运用MEGA5.0软件N-J方法构建HS9的16S rDNA系统发育树(图 3)。结合生理生化特征结果,菌株HS9鉴定为弯曲芽胞杆菌(Bacillus flexus),将其序列上传至NCBI,获得登录号为KP743122。
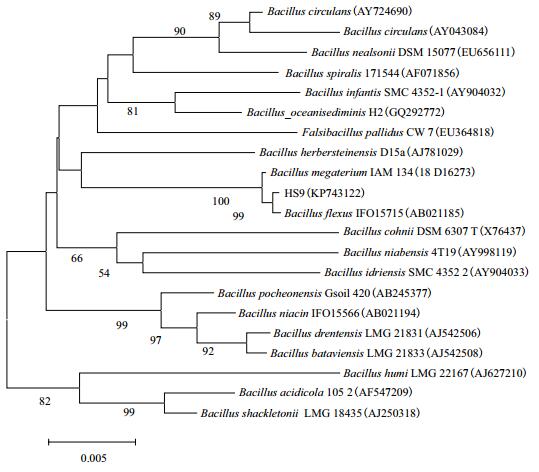
|
| 图 3 基于HS9和相关菌株的16S rDNA序列采用邻接法建立的系统发育树 (标尺代表每1 000个核苷中有5个核苷替代) |
在对HS9菌株功能进行摇瓶试验分析后,进行花生盆栽试验对其促生作用进行验证。
2.4.1 HS9对盆栽土壤养分的影响菌株接种花生盆栽后对盆栽土壤中养分的影响由表 4所示,与对照相比,土壤中矿质态氮、速效磷、速效钾以及IAA含量均得到提高。矿质态氮含量增加了2.4%,接种HS9的盆栽土壤中的速效磷、钾的养分含量分别显著增高了17.72%、20.58%;土壤IAA含量增加了171.4%。HS9的固氮作用为作物提供氮素,在实际的农业生产中能够降低化肥的施用量,更加有利于花生品质的改善。
接种菌株HS9后花生根系指标如表 5所示。与对照处理相比,接种HS9菌株能极显著地提高花生根系的根长、根表面积、根体积以及根尖数,并分别增加了109.60%、84.30%、76.08%和386.24%。这表明,HS9能使花生根系变得更长,有更多的分支,进一步增加根系与土壤的接触面积,促进了花生地上部对土壤养分的吸收。
接种菌株HS9对花生地上部的影响,如表 6所示,与对照处理相比,菌株HS9极显著地提高了花生的鲜重、株高,分别提高了70.05%、28.35%。由于花生地下部生长得到促进,导致植株地上部的生物量增加以及养分积累量提高,植株地上部的SPAD值、氮、磷、钾含量分别增加了16.06%、23.11%、83.04%和23.95%。其中与CK处理相比HS9处理的植株全氮含量达到显著性差异,而SPAD值、全磷、全钾差异则达到极显著水平。SPAD值表示植株的叶绿素含量,其值越高则表明植株光合作用能力越强,促进植株地上部养分的积累,从而提高植株株高以及鲜重等农艺性状。
本研究从华北地区石灰性潮土中的一株花生根际土中筛选出一株多功能根际促生菌HS9,对其进行研究发现HS9具有溶磷、解钾、固氮、以及产IAA等多种功能。根际促生菌(PGPR)的概念最早是由Kloepper等[25]提出的,是能够促进宿主植物生长的不可或缺的根际微生物。由于其强大的环境适应能力、快速的生长速率以及生物多样性并且通过自身代谢产物能过在土壤生态系统中稳定定殖[26]。根际促生菌的促生作用是通过多种方式以及多种途径来促进宿主植物生长以及改善土壤养分质量。Weller和Vessey等[27, 28]对根际促生菌进一步研究后指出,根际促生菌判定应当满足3个标准,即能够主动定殖或者侵染宿主植物、促进植物生长及生防功能。植物促生菌促进生长的机制分为直接与间接机制,直接影响机制通过释放出一些有利于植物生长的积极因子例如溶解养分,提高生物有效性、固氮以及分泌植物生长调节物质;亦或是通过病原体的竞争排斥作用以及清楚植物毒性产物来间接促进植物生长[26]。

|
| 图 4 接种菌株HS9对花生植株的影响 |
研究表明,PGPR能够通过直接和间接途径来促进植物生长以及提高粮食作物的产量。一些植物促生菌主要是通过固氮、溶磷解钾以及分泌植物激素,如IAA、细胞分裂素和一些易挥发的植物生长调解物质例如乙烯和2,3-丁二醇等物质[27-29]。本研究所筛选出的HS9具有固氮,解磷溶钾以及产IAA等功能。据研究报道,有些根际促生菌能够通过分泌螯合铁载体、抗生素、氰化氢等物质来最大程度的避免植株受到植物病原体以及根际有害细菌的干扰[30-34],从而来促进植物生长,但不论PGPR是通过哪种途径或机制来促进生长,必须能够定殖在根圈附近或者直接能够在根部稳定存在[35]。
华北黄泛地区土壤类型多为碱性的石灰性土壤,土壤养分贫瘠,特别是在砂质潮土中,由于土壤质地等因素,土壤黏粒空隙大导致其养分保持及矿化能力较低。芽胞杆菌作为土壤中的一个优势菌种,能够在环境条件比较恶劣的情况下稳定生长和定殖,通过产芽胞、耐高盐等方式稳定存活[36]。目前,对于芽胞杆菌的促生效果的研究较为常见,但大都集中在挖掘和探索其单一的促生作用方面上,对于根际促生菌的多功能促生作用的研究报告相对较少[37, 38]。张东艳等[14]在砂质潮土中筛选出一株产IAA功能的根际促生菌HS10(特基拉芽胞杆菌),对花生具有较好的促生作用,其产IAA能力达到了52.03 mg/mL,而本研究中的HS9也具有较强的产IAA能力为40.96 mg/L,略小于HS10。尹瑞龄[39]分离出具有解磷功能的巨大芽抱杆菌、节杆菌、黄杆菌、欧文氏菌及假单胞菌,它们的溶磷能力为25-30 mg/g。
SPAD值表示植株的叶绿素含量,其值越高则表明植株光合作用能力越强,促进植株地上部养分的积累,从而提高植株株高以及鲜重等农艺性状。Baset等[40]通过香蕉苗的水培试验发现,与不接种促生菌处理相比,根际促生菌通过增大叶面积和叶绿素含量来增加香蕉的生物量。Dobbelaere[41]通过对一些主要农作物接种固氮螺菌后发现,接菌处理作物的地下部和地上部干重均显著高于未接菌处理,作物能够更好地生长。
根系是植物吸收养分促进其生长的最主要来源,根系系统的发达与否直接影响到植物的生长状况。Saravanakumar等[42]通过对黄瓜促生菌研究后发现,接种荧光假单胞菌92 rk和P190r后,黄瓜的鲜重增加量为6.37%-49.66%和根长增加了5.92%-21.71%。Baset等[40]通过对香蕉施用根际促生菌后发现其根长增加了33%-44%,根体积增加了76%-168%。而本试验中筛选出的HS9能够使根长和根体积分别增加109.60%和76.08%。根际促生菌促进植物根系发育是由于在根际促生菌的作用下促进了小麦和玉米幼苗根尖细胞的分裂引起了跟皮层外部的变化进而促进作物根系更加发达,提高植物对养分的吸收能力。在本实验中,接种菌株HS9的花生根系变得更加发达,分支数更多、更长。其中根尖数的增加量最大,这可能是由于根尖细胞在整个根部中最为活跃,分裂速度最快。因此能够让根系更为发达,能够更加充分的与土壤中的养分进行交互,从而提高其养分的利用增加花生养分积累量,促进了花生的生长。
根际促生菌能够改变植物生理以及一些根际土壤的理化性质及养分状况。因此能够维持和改善土壤肥力以及促进养分吸收,主要是由于根际促生菌在固氮、产IAA、解磷溶钾表现出很强的能力[43-47],同时除了这些主要功能之外,有研究表明,多数根际促生菌在其生长过程中会分泌多种有机酸,例如羟基乙酸、乳酸、柠檬酸、草酸、琥珀酸和延胡索酸,这些有机酸的分泌能够降低培养介质的pH同时螯合某些微量金属元素增加其生物有效性[48]。本试验中HS9的接种有效地提高了土壤中NPK养分的提高从而促进花生的生长,而土壤微环境的改变还需要进一步的深入研究。
综合以上讨论和分析再结合本试验的研究结果,我们发现植物促生菌促进植物生长不仅仅是促进了植物某一方面的生长,而是整个地上部、地下部一个系统的影响。由于促生菌能够在土壤中稳定的定殖存在,提高了土壤中的养分活性以及某些具有生长调解功能的小分子物质的数量;植物在受到促生菌的影响之后,叶绿素含量提升,根系更加发达,从而提高养分的吸收效率以及利用率用,而土壤养分的提高又反过来影响了植物的根系分布,在土壤与植株互相影响相互促进之下促进了植株养分的积累以及生物量的提高。在我国实现肥料和农药施用量都不再增加,“减肥增效”的大背景下,以根际促生菌为基础的新型微生物肥料的研发具有巨大的发展潜力和市场前景。
4 结论本试验从华北地区花生根际砂质潮土中筛选出5株具有固氮、解磷解钾以及产IAA能力的根际促生菌HS4、HS7、HS9、HS10和HS11。通过功能指标对比筛选出一株优势菌种HS9,其固氮、解磷解钾以及产IAA能力分别为15.53 nmol C2H4/h·mL、279.23 mg/L、22.5 mg/L和40.96 mg/L。通过其菌落形态特征、生理生化指标以及16S rDNA基因序列分析,鉴定HS9为弯曲芽胞杆菌(Bacillus flexus)。摇瓶试验结果表明,菌株HS9具有固氮、解磷解钾及合成IAA的能力,这表明该菌株能够提高土壤中的速效氮、磷、钾含量,从而促进花生的生长发育。盆栽试验结果验证了菌株HS9能够提高盆栽土壤中的矿质态氮、速效磷、钾以及IAA含量并且能够促进花生根系生长,提高作物对养分的吸收利用,促进作物生长发育,提高花生地上部生物量以及养分含量。
| [1] | 中华人民共和国农业部. 农业部关于印发《到2020年化肥使用量零增长行动方案》的通知[EB/OL]. http://www.moa.gov.cn/zwllm/tzgg/tz/201503/t20150318_4444765.htm. |
| [2] | Bhattacharyya PN, Jha DK. Plant growth-promoting rhizobacteria(PGPR):emergence in agriculture[J]. World J Microbiol Biotechnol, 2012, 28 : 1327–1350. DOI:10.1007/s11274-011-0979-9 |
| [3] | Bashan Y, de-Bashan LE, Prabhu SR, Hernandez JP. Advances in plant growth-promoting bacterial inoculant technology:formulations and practical perspectives(1998-2013)[J]. Plant and Soil, 2013, 378 : 1–33. |
| [4] | Malik KA, Bilal R. Association of nitrogen-fixing, plant-growth-promoting rhizobacteria(PGPR)with kallar grass and rice[J]. Plant and Soil, 1997, 194 (1/2): 37–44. DOI:10.1023/A:1004295714181 |
| [5] | 陈佛保, 柏珺, 林庆祺, 等. 植物根际促生菌(PGPR)对缓解水稻受土壤锌胁迫的作用[J]. 农业环境科学学报, 2012, 31(1): 67–74. |
| [6] | 姚拓, 龙瑞军, 王刚, 等. 兰州地区盐碱地小麦根际联合固氮菌分离及部分特性研究[J]. 土壤学报, 2004, 41(3): 444–448. DOI:10.11766/trxb200305230318 |
| [7] | 丁延芹, 杜秉海. 玉米根际细菌中PGPR的筛选及初步鉴定[J]. 土壤肥料, 2001, 3: 41–43. |
| [8] | 王春霞. 棉花PGPR菌株的分离、筛选、鉴定、作用机制及其分子生态学研究[J]. 植物病理学报, 1998, 2: 95–96. |
| [9] | 吴皓琼, 牛彦波, 殷博, 等. PGPR植物促生肥在大豆上应用效果研究[J]. 生物技术, 2011, 3: 90–94. DOI:10.3969/j.issn.1004-311X.2011.02.059 |
| [10] | 王豹祥, 李富欣, 张朝辉, 等. 应用PGPR菌肥减少烤烟生产化肥的施用量[J]. 土壤学报, 2011, 48(4): 813–822. DOI:10.11766/trxb201011230485 |
| [11] | 姜瑛, 吴越, 王国文, 等. 一株固氮解磷菌的筛选鉴定及其对花生的促生作用研究[J]. 土壤, 2015, 47(4): 698–703. |
| [12] | 李引, 虞丽, 李辉信, 等. 一株花生根际促生菌的筛选鉴定及其特性研究[J]. 生态与农村环境学报, 2012, 28(4): 416–421. |
| [13] | 闫小梅, 虞丽, 叶成龙, 等. 一株灰潮土解磷菌的解磷特性及其对花生的促生作用[J]. 中国农学通报, 2015, 31(26): 150–155. DOI:10.11924/j.issn.1000-6850.casb15040148 |
| [14] | 张东艳, 刘晔, 吴越, 等. 花生根际产IAA菌的筛选鉴定及其效应研究[J]. 中国油料作物学报, 2016, 38(1): 104–110. |
| [15] | 鲍士旦. 土壤农化分析[M]. 第3版. 北京: 中国农业出版社, 2000. |
| [16] | 康贻军, 程洁, 梅丽娟, 等. 植物根际促生菌的筛选及鉴定[J]. 微生物学报, 2010, 07: 853–861. |
| [17] | Libbert E, Risch H. Interactions between plants and epiphytic bacteria regarding their auxin metabolism[J]. Physiol Plantarum, 1969, 22 : 51–58. DOI:10.1111/ppl.1969.22.issue-1 |
| [18] | Glickmann E, Dessaux Y. A Critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J]. Applied Microbiology, 1995, 61 (2): 793–796. |
| [19] | 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. |
| [20] | 布坎南RE, 吉本斯NE. 伯杰细菌鉴定手册[M]. 北京: 科学出版社, 1984. |
| [21] | 夏北成, ZhouJZ. 分子生物学方法在微生物生态学中的应用[J]. 中山大学学报:自然科学版, 1998, 37(2): 97–101. |
| [22] | Monis PT, Giglio S, Saint CP. Comparison of SYTO9 and SYBR Green I for real-time polymerase chain reaction and investigation of the effect of dye concentration on amplification and DNA melting curve analysis[J]. Analytical Biochemistry, 2005, 340 (1): 24–34. DOI:10.1016/j.ab.2005.01.046 |
| [23] | 毛小芳, 胡锋, 陈小云, 等. 不同土壤水分条件下华美新小杆线虫对枯草芽胞杆菌数量、活性及土壤氮素矿化的影响[J]. 应用生态学报, 2007, 18(2): 405–410. |
| [24] | 胡佩, 杨红, 刘德辉, 等. 高效液相色谱法测定蚓粪中的植物激素[J]. 分析试验室, 2001, 20(6): 8–10. |
| [25] | Kloepper J, Schroth MN. Plant growth-promoting rhizobacteria on radishes[C]//Proceedings of the 4th international conference on plant pathogenic bacteria, 1978:879-882. http://www.oalib.com/references/13237498 |
| [26] | Bashan Y, De-Bashan LE. Chapter Two-How the Plant Growth-Promoting Bacterium Azospirillum Promotes Plant Growth—A Critical Assessment[M]// Advances in Agronomy. Elsevier Science & Technology, 2010:77-136. http://www.sciencedirect.com/science/article/pii/S0065211310080028 |
| [27] | Weller DM, Raaijmakers JM, Gardener BB, et al. Microbial populations responsible for specific soil suppressiveness to plant pathogens[J]. Annual Review of Phytopathology, 2002, 40 (1): 309–348. DOI:10.1146/annurev.phyto.40.030402.110010 |
| [28] | Vessey JK. Plant growth promoting rhizobacteria as biofertilizers[J]. Plant and Soil, 2003, 255 (2): 571–586. DOI:10.1023/A:1026037216893 |
| [29] | Ryu CM, Farag MA, Hu CH, et al. Bacterial volatiles promote growth in Arabidopsis[J]. Proc Natl Acad Sci USA, 2003, 100 (8): 4927–4932. DOI:10.1073/pnas.0730845100 |
| [30] | Carson KC, Meyer JM, Dilworth MJ. Hydroxamate siderophores of root nodule bacteria[J]. Soil Biology & Biochemistry, 2000, 32 (1): 11–21. |
| [31] | El-Tarabily KA, Sivasithamparam K. Non-streptomycete actinomycetes as biocontrol agents of soil-borne fungal plant pathogens and as plant growth promoters[J]. Soil Biology & Biochemistry, 2006, 38 (7): 1505–1520. |
| [32] | Weller DM. Biological control of soilborne plant pathogens in the rhizosphere with bacteria[J]. Annual Review of Phytopathology, 2003, 26 (1): 379–407. |
| [33] | Schippers B. Biological control of pathogens with rhizobacteria[C]// Biological control of pests, pathogens and weeds:develop-ments and prospects:proceedings of a Royal Society discussion meeting held on 18 and 19 February 1987 / organized and edited by R. K. S. Wood and M. J. Way. 1988:291-293. |
| [34] | Stutz EW, Defago G, Kern H. Naturally occurring fluorescent pseudomonads involved in suppression of black root rot of tobacco[J]. Phytopathology, 1986, 76 (2): 181–185. DOI:10.1094/Phyto-76-181 |
| [35] | Glick BR. The enhancement of plant growth by free-living bacteria[J]. Canadian Journal of Microbiology, 1995, 41 (2): 109–117. DOI:10.1139/m95-015 |
| [36] | 陈中义, 张杰, 黄大昉. 植物病害生防芽胞杆菌抗菌机制与遗传改良研究[J]. 植物病理学报, 2003, 33(2): 97–103. |
| [37] | 谢越盛, 许泉, 王大成, 等. 植物根际促生枯草芽胞杆菌JC01筛选[J]. 微生物学通报, 2016, 43(10): 2187–2196. |
| [38] | 孙广正, 姚拓, 赵桂琴, 等. 植物根际促生菌对两种真菌病害病原的抑制作用及其鉴定[J]. 草业学报, 2016, 25(8): 154–163. DOI:10.11686/cyxb2015353 |
| [39] | 尹瑞龄. 我国旱地土壤的溶磷微生物[J]. 土壤, 1988, 20(5): 243–246. |
| [40] | Baset Mia MA, Shamsuddin ZH, Wahab Z, et al. Effect of plant growth promoting rhizobacterial(PGPR)inoculation on growth and nitrogen incorporation of tissue-cultured Musa plantlets under nitrogen-free hydroponics condition[J]. Australian Journal of Crop Science, 2010, 4 (2): 85–90. |
| [41] | Dobbelaere S, Croonenborghs A, Thys A, et al. Responses of agronomically important crops to inoculation with Azospirillum[J]. Functional Plant Biology, 2001, 28 (28): 871–879. |
| [42] | Saravanakumar D, Samiyappan R. ACC deaminase from Pseudom-onas fluorescens mediated saline resistance in groundnut(Arachis hypogea)plants[J]. Journal of Applied Microbiology, 2007, 102 (5): 1283–1292. DOI:10.1111/jam.2007.102.issue-5 |
| [43] | Antoun H, Beauchamp CJ, Goussard N, et al. Potential of Rhizobium and Bradyrhizobium species as plant growth promoting rhizobacteria on non-legumes:Effect on radishes(Raphanus sativus L.)[J]. Plant and Soil, 1998, 204(1):57-67. https://ar.scribd.com/document/212037999/Guerra-Capitulo-de-Citrus-pdf |
| [44] | Riggs PJ, Chelius MK, Iniguez AL, et al. Enhanced maize productivity by inoculation with diazotrophic bacteria[J]. Functional Plant Biology, 2001, 28 (9): 829–836. DOI:10.1071/PP01045 |
| [45] | Kloepper JW, Gutiérrezestrada A, Mcinroy JA. Photoperiod regulates elicitation of growth promotion but not induced resistance by plant growth-promoting rhizobacteria[J]. Canadian Journal of Microbiology, 2007, 53 (2): 159–167. DOI:10.1139/w06-114 |
| [46] | Han J, Sun LX, Cai Z, et al. Characterization of a novel plant growth-promoting bacteria strain Delftia tsuruhatensis HR4 both as a diazotroph and a potential biocontrol agent against various plant pathogens[J]. Systematic & Applied Microbiology, 2005, 28 (1): 66. |
| [47] | Spaepen S, Vanderleyden J, Remans R. Indole-3-acetic acid in microbial and microorganism-plant signaling[J]. FEMS MicroBiol Rev, 2007, 31 (4): 425–448. DOI:10.1111/j.1574-6976.2007.00072.x |
| [48] | Feng K, Lu HM, Sheng HJ, et al. Effect of organic ligands on biological availability of inorganic phosphorus in soils[J]. Pedosphere, 2004, 14 (1): 85–92. |