合成生物学是21世纪新兴的一门学科,结合了传统的代谢工程和系统生物学概念,旨在建立人工生物系统,将基因连接成网络,使微生物底盘细胞完成设计人员设想的各种任务,具体过程包括底盘细胞的构建、合成元件的挖掘、合成途径的设计以及细胞合成工厂的创建[1]。微生物具有生长代谢速率高、培养条件封闭易控制、多种营养缺陷型选择标记便于基因编辑操作、可通过生化反应器放大规模等诸多特点,选择其作为底盘细胞具有独特的优势。目前通常采用质谱、LC-MS、GC-MS及核磁共振技术,通过将合成产物与天然产物进行比较的方法,检测合成产物的质量。采用合成生物学技术生产目的产物具有稳定、高效、经济、环境友好等一系列优点,因此,该技术既被用来模拟已有生物元件及合成途径生产天然产物,也被用于生产制造各种化学品和燃料,甚至还被用于设计、合成新型非天然药物。
近年来,国家对生物制造业给予了大力支持,我国合成生物学的发展如火如荼。以中国科学院天津工业生物技术研究所马延和为首席的“人工合成细胞工厂”“973项目”,围绕着大肠杆菌及光合蓝细菌进行了大量研究,通过光合模块和CO2固定实现了从CO2到酮、醇及酸等化学品的生物合成[2]。北京化工大学袁其朋团队以大肠杆菌作为底盘细胞,经莽草酸途径合成了3-苯基丙酸、3- (4-) 羟基丙酸以及4-羟基香豆素等多种芳香族化合物[3]。以清华大学陈国强为首席的“973项目”则以嗜盐单胞菌为对象,实现了聚羟基脂肪酸 (polyhydroxyalkanoates,PHA) 等高分子材料、化学品和燃料的生物制造[4, 5]。以中国科学院微生物研究所张立新为首席的“合成微生物体系的适配性研究”“973项目”,则以大肠杆菌和链霉菌作为底盘细胞,生产微生物药物阿维菌素、聚酮类药物及核苷肽类药物等[6]。上海交通大学许平团队则开展了大量关于天然食品添加剂的生物合成学研究,采用自养光合菌如假单胞菌合成多元醇类生物香料、利用蓝藻生产乳酸、通过聚球藻生产苯丙烷类等高值化合物,实现了多种天然生物香料和药用谷氨酰胺的产业化生产[7, 8]。中国科学院院士邓子新提倡挖掘基因组“Dark holes”,带领团队以深海、极地等极端环境微生物以及动植物共生生物为研究对象,克隆鉴定多种抗生素基因簇,开展关于非天然抗生素药物的合成生物学研究,获得了大量新型抗生素衍生物,显著推动了我国微生物药物生物合成领域的发展[9]。随着合成生物学的不断发展和完善,该学科将为能源、材料、医药、食品、日化等行业提供更多的产品支撑。
1 萜类化合物的合成生物学研究 1.1 萜类化合物的种类及其应用萜类化合物是自然界广泛存在的一大类异戊二烯衍生物 (isoprenoids) ,主要从植物、微生物及海洋生物中分离得到。萜类通式是 (C5H8) n (n是异戊二烯的单元数) 。根据n的数目,萜类化合物可分为半萜 (C5) 、单萜 (C10) 、倍半萜 (C15) 、二萜 (C20) 、二倍半萜 (C25) 、三萜 (C30) 、四萜 (C40) 和多萜 (n> C40) [10]。目前发现的萜类超过5万多种,常见的有单萜薄荷醇 (menthol) 、倍半萜青蒿素 (artemisin-in) 、二萜紫杉醇 (taxol) 、三萜人参皂苷 (ginsenosi-de) 、四萜类胡萝卜素化合物 (carotenoids) 等。
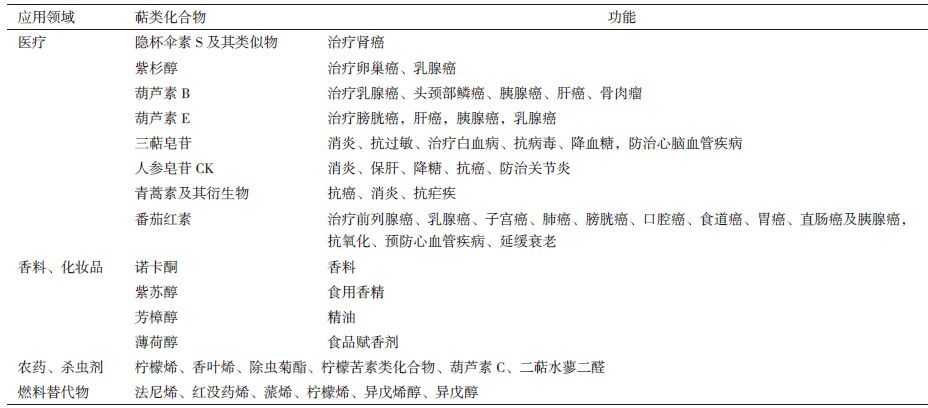
萜类有着重要的生物学功能和应用价值,见表 1。现代医学研究发现,很多萜类都具有广泛的抗癌功效[11]。来源于真菌属月光菌的倍半萜隐杯伞素S (illudin S) 及其类似物伊洛福芬 (irufloven) 能够有效抑制转移性肾癌中的DNA合成[12]。红豆杉属植物中的三环二萜化合物紫杉醇对卵巢癌和乳腺癌有明显的疗效[13]。葫芦科来源的三萜化合物葫芦素 (cucurbitacin) 能够抑制癌细胞的生长,可与其他抗癌药物一起用于癌症治疗。其中,葫芦素E具有抑制癌细胞增殖的功能,该结果已在膀胱癌、肝癌、胰腺癌、乳腺癌及白血病中得到证实[14, 15]。葫芦素B除了被证实具有抑菌和消炎活性,还能够抑制人类恶性肿瘤细胞的生长,包括乳癌细胞、头颈部鳞癌、胰腺癌、肝癌、骨肉瘤和骨髓性白血病[16-18]。截至目前,已有多种葫芦科植物来源的葫芦素及葫芦素衍生物被分离出来[19]。
萜类还具有消炎、降糖等广泛的药理作用。研究发现,三萜皂苷类能够消炎、抗过敏、治疗白血病、抗病毒、降血糖以及防治心脑血管疾病等[20]。2013年,人参皂苷化合物K (compound K,CK) 被我国药监局批准为防治关节炎的临床用药 (CDEL20130379) 。Yan等[21]发现CK是三萜皂苷在哺乳动物血液和器官中发挥消炎、保肝、降糖及抗癌等功效的主要组分。来源于菊科植物 (俗称青蒿) 的倍半萜内酯衍生物青蒿素不仅能够抗癌、消炎,还被发现是一种非常强大的抗疟疾药物,且不与其他抗疟药产生交叉耐药性[22]。四萜化合物番茄红素 (lycopene) 是类胡萝卜素的一种,存在于番茄、西瓜、葡萄柚等的果实中,是一种很强的食用抗氧化剂,能够有效抑制脂质的氧化,清除羟自由基。流行病学及临床医学实验发现,食用番茄红素不仅能够防治前列腺癌、乳腺癌、子宫癌、肺癌、膀胱癌、口腔癌、食道癌、胃癌、直肠癌及胰腺癌,还具有预防心脑血管疾病、延缓衰老等功效[23, 24]。
此外,很多植物源萜类化合物是芳香性挥发性物质,因此被广泛应用于香料、香水、调味剂及化妆品等行业[25]。诺卡酮 (nootkatone) 、紫苏醇 (sclareol) 、薄荷醇 (menthol) 及芳樟醇 (linalool) 等芳香萜类是植物性精油的重要组成成分,也是果实芳香和植物花香等的气味来源,因此是芳香食品和精油类化妆品中常用的香料[26]。
很多萜类是植物与昆虫协同进化过程中所产生的次生代谢产物,能够吸引传粉动物辅助植物授粉,抑或对昆虫有拒食作用,帮助植物抵御虫害和病原微生物,因此常被用于农药中[27]。一些单萜如柠檬烯 (limonene) 和香叶烯 (myrcene) 均有很好的杀虫性,一些单萜烯类的衍生物如除虫菊酯 (pyrethrin) 则是非常高效的植物性杀虫剂[28]。一些三萜如柠檬苦素类化合物 (limonoids) 也是很强的昆虫防御剂,被用作农作物的防虫害剂。其他三萜类化合物,如葫芦素C、二萜水蓼二醛 (polygodial) 均参与了植物的抗虫功能[29, 30]。
萜类结构的多样性还使得其成为汽油、柴油等燃料的高级替代物。事实上,倍半萜法尼烯 (farnes-ene) 和红没药烯 (bisabolene) ,单萜蒎烯 (pinene) 和柠檬烯,半萜异戊烯醇 (isopentenol) 和异戊醇 (isopentanol) 均是公认的燃料及燃料的前体物[31]。
1.2 萜类化合物的合成 1.2.1 萜类的生物合成途径植物源萜类化合物是植物中结构变化种类最多的一类天然产物,其在生物体中的合成可以由异戊二烯首尾相接,也可以通过异戊二烯成环形成[32]。异戊二烯首先需要通过活化转化成异戊烯焦磷酸 (isopentenyl pyrophosphate,IPP) 和二甲基丙烯基二磷酸 (dimethylallylpyrophosphate,DMAPP) 。生物体内IPP和DMAPP的合成存在两种途径:由3个乙酰辅酶A (Acetyl-CoA) 形成的甲羟戊酸 (mevalonate acid-dependent,MEV) 途径以及由丙酮酸 (pyruvate) 或3-磷酸甘油醛 (glyceraldehyde 3-phosphate,G-3-P) 缩合形成的甲基赤藓醇 (2C-methyl-D-erythritol-4-phosphate,MEP/deoxyxylulose 5-phosphate,DXP) 途径,不同途径的选择取决于生物的种类以及合成产物的亚细胞空间位置[33]。植物采用MEV和MEP/DXP两种途径来合成IPP和DMAPP (图 1) 。其中,MEV途径主要用于植物细胞质中的倍半萜、三萜及多萜的合成,MEP/DXP途径主要用于植物质体中的单萜、二萜和四萜的合成[34, 35]。除了植物以外的其他真核生物均采用MEV合成IPP,并在IPP异构酶的作用下生成DMAPP。原核生物则主要通过MEP/DXP途径将G-3-P转变成IPP和DMAPP[36]。
IPP和DMAPP是所有萜类的共同前体,一分子DMAPP和不同分子数的IPP在异戊烯转移酶 (prenyltransferase) 的作用下会进一步生成不同的萜类前体[37]。这些前体在各种萜类合酶 (terpene synthases,TPS) 的作用下会被合成种类各异的萜类骨架,因此,萜类合酶是不同萜类合成过程中的关键因子[38]。不同萜类的合成途径如图 1所示,具体如下: (1) 单萜:一分子IPP和一分子DMAPP能够生成牻牛儿基焦磷酸 (greanyl diphosphate,GPP) 或橙花基焦磷酸 (neryl diphosphate,NPP) ,GPP是无环单萜前体,NPP是单环单萜前体,它们在单萜合酶的催化下合成不同的单萜,如GPP在香叶醇合成酶的催化下能够产生无环单萜香叶醇 (geraniol) ;NPP在柠檬烯合酶 (limonene synthase,LS) 的催化下则会合成单环单萜骨架柠檬烯 (limonene) ,并进一步经过氧化还原作用等反应合成单萜薄荷醇。 (2) 倍半萜:两分子IPP和一分子DMAPP生成倍半萜前体法呢基焦磷酸 (fanesyl diphosphate,FPP) ,其在倍半萜合酶如紫穗槐-4,11-二烯合酶 (amorpha-4,11-diene synthase,ADS) 的催化下生成青蒿素的前体紫穗槐二烯 (amorphadiene) 。 (3) 二萜:三分子IPP和一分子DMAPP产生二萜的前体牻牛儿牻牛儿基焦磷酸 (greanylgeranyl diphosphate,GGPP) ,其在二萜合酶如紫杉烯合酶 (taxadiene synthase,TXS) 的催化下能够合成紫杉醇的前体紫杉-4 (5) ,11 (12) -二烯 (taxadiene) ; (4) 三萜:倍半萜前体FPP在鲨烯合酶 (squalene synthase,SQS) 的催化下合成鲨烯 (squalene) ,鲨烯经鲨烯环氧酶 (squalene epoxidase,SQE) 催化加氧转变成2,3-氧化鲨烯 (2,3-oxidosqualene) ,并在不同的鲨烯环化酶 (oxidosqulene cyclase,OSCs) 的作用下环化形成三萜骨架,如β-香树素 (β-amyrin) 、羽扇豆醇 (Lupeol) 、葫芦二烯醇 (Cucurbitadienol) 等。因此,不同种类三萜的合成取决于鲨烯环化酶的种类。萜类骨架在细胞色素P450单加氧酶 (cytochrome P450,CYP450) 、CYP450辅酶 (CYP reductase,CPR) 、脱氢酶 (dehydrogenases) 、糖基转移酶 (glycosyltransferase,GT) 和酰基转移酶 (acyltransferase,ACT) 的作用下会进一步进行氧化、糖基化和酰基化等化学修饰,最终获得不同的萜类化合物,如膜甾醇、油菜素内酯、人参皂苷等[11]。

|
| 图 1 植物源萜类的生物合成途径 植物主要采用两种途径来合成IPP和DMAPP:由3个乙酰辅酶A形成的甲羟戊酸 (mevalonate acid-dependent,MEV) 途径,以及由丙酮酸 (pyruvate) 或3-磷酸甘油醛 (glyceraldehyde 3-phosphate,G-3-P) 形成的甲基赤藓醇 (2C-methyl-D-erythritol-4-phosphate,MEP/ deoxyxylulose 5-phosphate,DXP) 途径。其中,MEV途径主要用于植物细胞质中的倍半萜、三萜以及多萜的合成,MEP/DXP途径主要用于植物质体中的单萜、二萜和四萜的合成 |
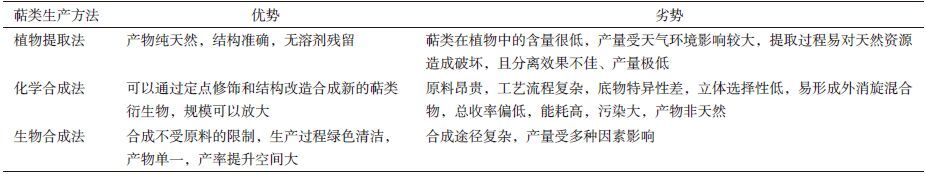
近年来,萜类化合物的合成研究成为了生物学领域的热点之一。大规模生产高价值的萜类化合物是科研工作者和企业的共同目标。目前萜类的生产方法主要有3种:植物提取法、化学合成法和生物合成法 (表 2) 。2015年诺贝尔生理学或医学奖得主、中国中医科学院首席科学家屠呦呦[39]及其同事通过不断改进提取方法,最终于1972年从青蒿中提取到了微量的新型抗疟药——青蒿素。但是,萜类在植物中的含量通常很低,且植物提取法还存在野生资源稀缺、分离效果不佳、产量极低的问题。中国科学院院士涂永强课题组[40]则通过建立仿生合成路线,对具有生物活性萜类抗癌药物的合成进行了大量系统性的化学合成研究。化学合成法虽解决了植物提取法中的诸多问题,但仍存在原料昂贵、工艺流程复杂、立体选择性低、能耗高、污染大、总收率偏低等问题。相比之下,生物合成法不受原料的限制、生产过程绿色清洁、产物单一、产率提升空间大,具有很大的优势。
生物合成法又分为两种,一种是通过代谢工程手段直接在植物中促进萜类的合成;另一种是通过合成生物学在微生物等底盘细胞中合成目标产物。第一种方法是直接向植物中引入强启动子驱动的萜类合酶,从而实现萜类的生产[41]。如通过过表达芳樟醇合酶可以大量生产单萜芳樟醇,构建的转基因植株包括矮牵牛、番茄、康乃馨、马铃薯及拟南芥[42-45]。这种代谢工程操作不仅用于高效生产萜类化合物,还可以用于改变作物的一些性状,如提高观赏植物和水果等的香味和口感,改善植物的授粉效率,增强植物的抗病和抗虫能力等。此外,还能帮助理解植物萜类化合物的合成途径和调控方式,揭示已有途径的旁支通路和反馈途径等。但是,由于植物生长缓慢,且体内代谢过程错综复杂,这种萜类合成方法面临着目标产物产量有限、后期分离困难、生产周期长等问题。为了实现萜类的高产,研究人员越来越多的开始尝试合成生物学手段[46]。
选取不同的底盘细胞对于萜类的生物合成有关键性的影响。例如,大肠杆菌中萜类前体IPP和DMAPP主要用于tRNA的异戊烯化和FPP的合成,进而用于醌类和细胞壁的合成,因此该底盘细胞主要用于酮、醇、酸等化学品而非萜类的生物合成[47]。代谢工程和合成生物学领域的先驱人物,如加州大学洛杉矶分校的James Liao教授和伯克利分校的Jay Keasling教授,他们的实验室也曾通过大肠杆菌进行萜类化合物的生物合成,但均需重构IPP和DMAPP的合成途径。如Farmer等[48]在大肠杆菌中重构MEV途径,提高了番茄红素的生物合成产量:向培养基中外源添加丙酮酸,并在重构番茄红素合成途径的大肠杆菌中过表达磷酸烯醇式丙酮酸合酶 (phosphoenolpyruvate synthase,PPS) ,使得丙酮酸转化成磷酸烯醇式丙酮酸,促进碳代谢流由丙酮酸向G-3-P逆流,进而得到大量类异戊二烯的前体,最终每克细胞干重中得到了25 mg番茄红素,比单纯重构番茄红素合成途径的大肠杆菌的发酵产量提高了5倍。Kim等[49]在重构番茄红素合成途径的大肠杆菌中,使用CRISPRi技术重新平衡MEV途径的代谢流,通过设计不同的sgRNA并比较其基因敲除效率,将MVA途径中的基因表达平均降低了81.6%,最终使得番茄红素的产量提高了9倍。Martin[25]则通过在大肠杆菌中建立酵母MEV途径促进FPP的合成,同时过表达紫穗槐二烯合酶,并向培养基中外源添加甘油 (0.8% V/V) ,最终使得青蒿素前体紫穗槐二烯的积累高达112.2 mg/L。
由于细菌缺少翻译后修饰而难以表达细胞色素P450,且很多萜类化合物具有抗菌活性,因此多采用酿酒酵母等真核生物进行萜类的生物合成[50, 51]。利用酵母细胞工厂的好处是酵母能够直接合成较多的DMAPP和IPP,从而为萜类合成提供大量前体物。选用酵母作为底盘细胞还可以通过酵母基因组的必需基因分析,保留最小基因组,从而在萜类的生物合成过程中减少其内源消耗。所有基因工程操作都可以通过染色体融合完成,保证了酵母工程菌株的遗传稳定性。通过酵母全基因组的筛选还能够获得一些高活性的内源启动子与终止子,如清华大学戴俊彪课题组[52]通过筛选酿酒酵母全基因组,获得了一些酵母来源的启动子和终止子。此外,他们还在酿酒酵母中构建了生物合成的功能模块,能够快速实现多基因代谢通路中的蛋白的异源表达,并完成多个转录单元的一步组装。选择酵母细胞的另一个优势是可以通过对酵母细胞进行耐高温、耐酸、耐盐等抗逆改造,如清华大学林章凛教授[53]主持的“973项目”研究了适合微生物的合成生物学抗逆元器件,获得了具有重要产业价值的微生物抗酸器件和工业菌株,为实现萜类目的产物的高密度发酵和产业转化奠定了研究基础。
1.3.1.2 萜类合成途径的挖掘合成途径的挖掘是合成生物学快速发展的保障。目前已经从拟南芥、水稻、苜蓿、百脉根等不同的植物中分离得到了几十个编码鲨烯环化酶的基因[54]。大量的基因组学数据表明,细胞色素P450家族在植物萜类化合物的合成过程中扮演着关键的角色[55]。随着全基因组测序、第二代DNA测序技术以及宏基因组学技术的发展,越来越多的天然产物的代谢途径被挖掘出来。研究发现,植物萜类化合物的合成往往伴随着基因表达簇结构的发现。通过萜类化合物基因表达簇的鉴定,研究人员发现了不同萜类合成通路中的鲨烯环化酶、共表达的CYP450 以及辅酶CPR。如中国农业科学院蔬菜花卉研究所黄三文团队[56]通过破解黄瓜的基因组数据,发现黄瓜苦味基因 (Bitter,Bi) 基因编码的蛋白为鲨烯环化酶。为了破解黄瓜苦味合成、调控及驯化的分子机制,他们进一步挖掘黄瓜组学数据,并结合代谢组学、遗传学以及分子生物学技术,最终鉴定出9个与黄瓜中葫芦素C合成相关的基因 (Csa6G088690、Csa6G088160、Csa6G088170、Csa6G088710、Csa3G698490、Csa3G903540、Csa3G903550、Csa1G044890、Csa6G088700) [19]。这一系列研究为三萜葫芦素的生物合成奠定了重要的数据基础。
萜类的生物合成是一个多因素调节的动态过程。通过异源基因的密码子优化、启动子终止子的选取和搭配组合、代谢途径基因簇的共表达、合成途径的标准化组装、关键调控基因的精细调控、细胞合成工厂的创建、发酵条件摸索及发酵工艺优化等方面的深入研究,能够显著提高萜类合成关键酶的异源高效表达以及萜类的合成能力。
1.3.2 萜类化合物的合成生物学研究进展 1.3.2.1 单萜酿酒酵母能够利用体内的 MEV途径合成IPP和DMAPP,进而缩合成GPP,为单萜的生物合成提供前体物质。因此,在酿酒酵母中外源表达单萜合酶有望实现单萜的合成。以芳樟醇为例,Herrero等[57]通过在酿酒酵母T73-4中表达来源于仙女扇的S-芳樟醇合酶 (linalool synthases,LIS) 的基因,从而引入了芳樟醇合成代谢通路,构建出了能够有效分泌芳樟醇的重组菌株,最终达到18 μg/L的积累水平。类似地,Zhang等[58]在酿酒酵母中表达了来源于软枣猕猴桃 (Actinidiaarguta) 的芳樟醇合酶的基因,实现了芳樟醇的产量为59.85 μg/L。Rico等[59]在表达芳樟醇合酶的基础上进一步调节了该菌株中的类异戊二烯生物合成途径,通过过表达羟甲基戊二酸单酰辅酶A还原酶 (3-hydroxy-3-methylglutaryl coenzyme A reductase,HMG-CoA还原酶) 的催化结构域 (truncated HMG-CoA reductase,tHMGR) ,解除了MEV途径中羟甲戊酸合成的内源限速步骤,最终使得芳樟醇产量进一步提高到132.66 μg/L。考虑到异戊二烯二磷酸异构酶 (IDI1) 参与的异构化反应能够实现IPP和DMAPP之间的可逆转化,是实现GPP合成的重要步骤,江南大学陈坚课题组[60]在过表达HMG1的催化结构域的基础上,同时过表达了IDI1,以期提高酿酒酵母中MEV合成途径的代谢通量,强化GPP合成供给,结果发现芳樟醇产量仍然只有127.71 μg/L。为了提高单萜在酿酒酵母中的合成,陈坚课题组[61, 62]进行了大量的深入研究,结果发现柠檬烯处理酿酒酵母细胞会诱发活性氧胁迫,引起菌体凋亡。Parveen等[63]则通过转录组学分析发现,单萜α单蒎烯 (α-terpinene) 胁迫会造成酿酒酵母的细胞膜功能损伤。因此,宿主对单萜的低耐受程度可能是限制单萜产量提高的瓶颈。对于酿酒酵母耐受单萜的机理研究将为构建高单萜耐受性的酵母菌株提供更多的理论依据。
1.3.2.2 倍半萜青蒿素是具有内过氧桥结构的倍半萜内酯类化合物,是目前研究最多关注度最高的一种倍半萜。以有效剂量的青蒿素为基础、辅以传统抗疟药物的联合疗法 (artemisinin-based combination therapy,ACT) 被世界卫生组织批准为治疗疟疾的最有效的办法。由于人工合成青蒿素的难度很大,且价格昂贵,青蒿素的生产曾主要依赖从中国传统中草药青蒿中提取,但这种方法产量极低,导致青蒿素类药物紧缺,价格波动幅度大,ACT疗法昂贵,因此亟需寻找更稳定的青蒿素生产方法。Keasling团队[64]对于青蒿素生物合成的研究工作是合成生物学领域取得的一项突破性进展。截止目前,他们已经在酿酒酵母中实现了青蒿素前体青蒿酸的合成与产业化,为化学合成青蒿素以及活性抗疟药物青蒿琥酯 (artesunate) 提供了大量前体。在该项工作中,他们首先在酵母中过表达了来自青蒿的紫穗槐-4,11-二烯合酶,实现了FPP向青蒿素前体紫穗槐二烯的合成,但合成量很低,这是因为酵母细胞中的大部分IPP和DMAPP前体会进入麦角固醇合成通路。随后,他们在该菌株中重构了MEV途径,使得与FPP合成相关的基因发生上调,而FPP流向其他通路如固醇的基因表达则发生下调,从而提高了FPP的合成产量,并通过染色体重组将MEV途径整合到酵母基因组上,保证了改造菌株的遗传稳定性,再辅助以固醇转录因子UPC2的表达,最终使得紫穗槐二烯的合成产量提高到153 mg/L,比之前的报道高出了500倍。后续的发酵实验甚至使得紫穗槐二烯的产量达到27 g/L。由于很多萜类代谢的中间产物如FPP对细胞均有毒性,研究者希望通过在大肠杆菌中构建压力传感器,调节细胞的代谢负荷,进而提高目的产物的表达。Keasling实验室的成员通过全基因组的转录芯片测序,鉴定出了一些能够响应有毒代谢产物的启动子。采用响应FPP积累的启动子驱动大肠杆菌中紫穗槐二烯合成途径的基因表达,结果使得紫穗槐二烯的产量达到1.6 g/L。因此,根据目的产物的合成途径,选取对某个中间产物敏感的启动子驱动目的产物的基因表达,可以有效提高目的产物的产出。这一方法将是提高目的产物的一种重要的通用工具[65]。为了实现紫穗槐二烯向青蒿酸的转变,他们从青蒿中分离得到了一种CYP450单加氧酶CYP71AV1,并协同表达CYP71AV1的辅酶CPR,实现了紫穗槐二烯的三步氧化,最终使得1 L发酵罐中青蒿酸产物的产量达到115 mg/L,生产效率比植物提取法提高了两个数量级。为了进一步提高青蒿酸的合成,Keasling团队在酵母中将MEV途径中的所有的酶全部进行了过表达,青蒿酸的产量达到约1.6 g/L,而紫穗槐二烯的产量更是比青蒿酸高10倍以上。于是,他们进一步对紫穗槐二烯生产菌株的发酵条件进行了优化,最终使得紫穗槐二烯的产量高达>40 g/L,为青蒿素的化学合成提供了大量前体[66]。在此基础上,他们团队在青蒿中鉴定出了两个新的植物脱氢酶 (artemisnic alcohol dehydrogenase,ADH1;artemisnic aldehyde dehydrogenase,ALDH1) 和一个细胞色素氧化酶 (cytochrome b5,CYB5) ,通过在酵母中进行表达,让紫穗槐二烯到青蒿酸的合成过程变得更具体高效,最终使得青蒿酸的发酵产量达到了25 g/L[67]。这项技术的知识产权已经免费释放。Keasling团队的这一系列工作极大地推动了青蒿琥酯等高效抗疟药物成分的生产,有效地降低了ACT治疗的价格,是合成生物学领域的经典案例,也对其他昂贵药物的合成生物学研究具有宝贵的借鉴意义[68]。
1.3.2.3 二萜很多萜类是传统中药的关键药用成分,如丹参酮类化合物 (tanshinones) 属于松香烷型去甲二萜化合物,是中药丹参的主要脂溶性活性成分,通常由其前体次丹参酮二烯 (Miltiradiene) 和铁锈醇合成得到。中国医学科学院中药研究所黄璐琦课题组[69, 70]通过功能基因组学技术从丹参中鉴定了两个次丹参酮二烯合酶:SmCPS (labdadienyl/copalyl diphosphate synthase) 和SmKSL (kaurene syn-thase-like) 。天津工业生物技术研究所张学礼课题组[71]将SmCPS和SmKSL整合到酵母基因组上,然后一方面过表达tHMGR抑制酵母中FPP向麦角固醇的合成;另一方面则过表达ERG20-BTS1-SaGGPS和一个固醇调节因子UPC2.1,使得次丹参酮二烯的合成达到了61.8 mg/L,分批发酵的方式能将次丹参酮二烯的合成进一步提高到488 mg/L。中国科学院大连物理研究所赵宗保课题组[72]。在采用合成生物学生产次丹参酮二烯的过程中,提出了一种新的模块途径工程 (modular pathway engineering,MOPE) 策略,通过将次丹参酮二烯合成途径的4个关键酶进行融合表达,包括催化FPP合成的ERG20 (farnesyl diphosphate synthase) 、将FPP转化成GGPP的BTS1 (GGPP synthase) 以及两个次丹参酮二烯合酶SmCPS和SmKSL的融合,使得次丹参酮二烯的合成代谢流更加高效,最终构建出了高产次丹参酮二烯的酵母工程菌株,产量高达365 mg/L。随后,他们利用第二代DNA测序技术鉴定了6个与丹参酮积累相关的CYP450基因,并通过基因表达和体外酶活筛选发现,CYP76AH1负责催化次丹参酮二烯转化生成铁锈醇。通过从中药丹参中克隆不同的CPR,进行CYP450和CPR等模块元件间的适配性分析,鉴定出SmCPR1 (Salvia miltiorrhizaCPR) 为更合适的CYP76AH1辅酶,最终使得摇瓶培养条件下酵母细胞合成铁锈醇的产量达到10.5 mg/L[73]。随着深度测序、代谢组学以及转录组学技术对丹参的基因组、转录组和代谢组数据的挖掘,越来越多的与丹参酮合成通路相关的基因被鉴定出来,这些数据为丹参酮的合成生物学研究奠定了扎实的理论基础[74-77]。丹参酮合成生物学的研究对于其他药用、食用萜类的异源合成将具有重要的参考价值[78]。
1.3.2.4 三萜三萜人参皂苷是人参中的主要有效成分,属于糖苷类化合物,包括齐墩果烷型无环三萜类皂苷和达玛烷型四环三萜类皂苷,后者又包含人参二醇型皂苷和人参三醇型皂苷。人参皂苷在人参和西洋参中的含量很低,大大限制了它的临床应用。因此,通过合成生物学技术生产人参皂苷已经成为研究热点。人参皂苷生物合成包含20余步酶促反应。目前,已经从人参属植物中克隆出20多种与人参皂苷合成相关的基因,并进行了相应的功能验证:鉴定出两种鲨烯环化酶——达玛烯二醇-II合酶 (darmmarenediol,DS) 和β-香树素合酶 (β-amyrin synthase,AS) ,它们分别参与了2,3-氧化鲨烯向达玛烷型和齐墩果烷型人参皂苷的合成过程[79, 80];发现一种细胞色素酶CYP716A47参与了达玛烯二醇-II向原人参二醇 (protopanaxadiol) 的转变[81]。中国科学院上海生命科学院周志华课题组[21]首次鉴定了一个来源于人参的UDP-糖基转移酶 (UGTPg1) ,通过在酵母中与CYP716A47及其辅酶ATR2-1同时过表达,实现了人参二醇型皂苷CK的从头合成。周志华课题组与赵宗保团队的萜类生物合成研究均属于以中国科学院上海生命科学院赵国屏为首席的“新功能人造生物器件的构建及集成”973项目,该项目在萜类的异源合成上已经取得了多项重要进展。此外,北京理工大学李春课题组在酿酒酵母中将来源于光果甘草的β-香树素合酶,以及 IDI1、ERG20、ERG9、ERG1等促进2,3-氧化鲨烯合成的酶的基因同时进行过表达,并将表达质粒同源重组到染色体中提高基因表达的稳定性,实现了齐墩果烷型人参皂苷前体β-香树素的合成。除此之外,该项研究还有两点重要发现,在表达质粒的启动子上构建固醇调控元件SRE (-TCGTATA-) 是一种有效的上调固醇类蛋白表达的转录调控方式;在补料分批培养中,以乙醇作为补料与以葡萄糖作为补料相比,可以显著提高β-香树素的合成产量,最终达到138.8 mg/L[82]。
2 展望萜类化合物的生物功能和药物活性使其在食品、日化、医疗等领域具有广泛的应用价值,因此,萜类化合物的高效合成具有广阔的市场前景。通过对萜类的生物合成途径的鉴定研究,设计开发出一套组合调控萜类合成途径的功能模块,并在底盘细胞中创建合成工厂,可以实现萜类的体外合成。因此,合成生物学的发展为实现微生物发酵生产食用、药用萜类提供了有力的支撑。
为提高萜类化合物的生物合成效率,实际操作过程中应考虑以下几个关键因素:萜类前体的含量、引入的萜类合酶的亚细胞定位、萜类合酶的活性、萜类合成通路的旁支通路,以及萜类化合物的生物毒性。此外,在“模块途径工程策略”快速组装代谢途径的基础上,还可以通过优化前体供给、细胞色素还原酶匹配、宿主选择、发酵优化等操作,构建高产酵母工程菌株,最终实现目标产物的高效生产。任何一项学科的迅猛发展都不是孤立封闭的,因此,为快速推进合成生物学技术的发展,未来应加强以下几个学科和技术的应用: (1) 结合转录组学、蛋白质组学、代谢组学等多种功能组学方法,对现有的生物系统和代谢网络进行更加全面的了解; (2) 通过结构生物学对合成途径的关键元件进行结构解析,了解具体催化机制; (3) 通过定向进化和理性设计等蛋白质工程对关键酶进行改造,包括提高关键酶的活性、增加酶的新功能等; (4) 从生物反应动力学角度出发,对合成途径的元件模块进行复合体组装以提高生物反应速率; (5) 采用计算生物学技术辅助分析整个代谢系统,通过调整代谢流、抑制旁支通路、解除反馈抑制等手段提高目的产物的生产; (6) 利用最新的先进技术如CRISPRi等对底盘细胞进行内源基因的有效敲除及最小基因组的快速构建; (7) 借鉴发酵工程多尺度 (基因、细胞、反应器) 调控策略,在后期发酵过程考虑细胞生长与产物合成之间的平衡,从而实现反应过程的优化放大; (8) 借助Amyris等大型合成生物学公司辅助搭建更为成熟、自动化的合成生物学平台,加速该领域的工业化应用和产品的开发[83]。综上所述,采用合成生物学策略合成萜类化合物,有望成为植物源萜类生产的有效技术手段。
| [1] | Nielsen J, Keasling JD. Synergies between synthetic biology and metabolic engineering. Nature Biotechnology, 2011, 29 : 693–695. DOI:10.1038/nbt.1937 |
| [2] | Zhou J, Zhang H, Zhang Y, et al. Designing and creating a modularized synthetic pathway in cyanobacterium Synechocystis enables production of acetone from carbon dioxide. Metabolic Engineering, 2012, 14 : 394–400. DOI:10.1016/j.ymben.2012.03.005 |
| [3] | Sun J, Lin Y, Shen X, et al. Aerobic biosynthesis of hydrocinnamic acids in Escherichia coli with a strictly oxygen-sensitive enoate reductase. Metabolic Engineering, 2016, 35 : 75–82. DOI:10.1016/j.ymben.2016.02.002 |
| [4] | Tan D, Wu Q, Chen J, et al. Engineering Halomonas TD01 for the low-cost production of polyhydroxyalkanoates. Metabolic Engineering, 2014, 26 : 34–47. DOI:10.1016/j.ymben.2014.09.001 |
| [5] | 陈国强, 王颖. 中国“合成生物学”973项目研究进展. 生物工程学报, 2015, 31(6): 995–1008. |
| [6] | Wu H, Chen M, Mao Y, et al. Dissecting and engineering of the TetR family regulator SACE_7301 for enhanced erythromycin production in Saccharopolyspora erythraea. Microbial Cell Factories, 2014, 13 : 158. DOI:10.1186/s12934-014-0158-4 |
| [7] | Li C, Tao F, Ni J, et al. Enhancing the light-driven production of D-lactate by engineering Cyanobacterium using a combinational strategy. Scientific Reports, 2015, 5 : 9777. DOI:10.1038/srep09777 |
| [8] | Ni J, Tao F, Wang Y, et al. A photoautotrophic platform for the sustainable production of valuable plant natural products from CO2. Green Chemistry, 2016, 18 (12): 3537–3548. DOI:10.1039/C6GC00317F |
| [9] | Tan G, Deng Z, Liu T. Recent advances in the elucidation of enzymatic function in natural product biosynthesis[J]. F1000Research, 2015, 4(F1000 Faculty Rev):1399 |
| [10] | Ashour M, Wink M, Gershenzon J. Biochemistry of terpenoids:Monoterpenes, sesquiterpenes and diterpenes[M]// Wink M. Biochemistry of Plant Secondary Metabolism. 2rd ed. Wiley-Blackwell, 2010:258-303. |
| [11] | Singh B, Sharma RA. Plant terpenes:defense responses, phylogenetic analysis, regulation and clinical applications. Biotechnology, 2015, 5 (2): 129–151. |
| [12] | Amato RJ, Perez C, Pagliaro L. Irofulven, a novel inhibitor of DNA synthesis, in metastatic renal cell cancer. Investigational New Drugs, 2002, 20 : 413–417. DOI:10.1023/A:1020649827173 |
| [13] | Jennewein S, Croteau R. Taxol:biosynthesis, molecular genetics, and biotechnological applications. Applied Microbiology and Biotechnology, 2001, 57 : 13–19. DOI:10.1007/s002530100757 |
| [14] | Zhang T, Li J, Dong Y, et al. Cucurbitacin E inhibits breast tumor metastasis by suppressing cell migration and invasion. Breast Cancer Research and Treatment, 2012, 135 : 445–58. DOI:10.1007/s10549-012-2175-5 |
| [15] | Sorensen PM, Iacob RE, Fritzsche M, et al. The natural product cucurbitacin E inhibits depolymerization of actin filaments. ACS Chemical Biology, 2012, 7 : 1502–1508. DOI:10.1021/cb300254s |
| [16] | Duangmano S, Dakeng S, Jiratchariyakul W, et al. Antiproliferative effects of cucurbitacin B in breast cancer cells:down-regulation of the c-Myc/hTERT/telomerase pathway and obstruction of the cell cycle. International Journal of Molecular Sciences, 2010, 11 : 5323–5338. DOI:10.3390/ijms11125323 |
| [17] | Kausar H, Munagala R, Bansal SS, et al. Cucurbitacin B potently suppresses non-small-cell lung cancer growth:identification of intracellular thiols as critical targets. Cancer Letters, 2013, 332 : 35–45. DOI:10.1016/j.canlet.2013.01.008 |
| [18] | Guo J, Zhao W, Hao W, et al. Cucurbitacin B induces DNA damage, G2/M phase arrest, and apoptosis mediated by reactive oxygen species(ROS)in leukemia K562 cells. Anti-cancer Agents in Medicinal Chemistry, 2014, 14 : 1146–1153. DOI:10.2174/1871520614666140601220915 |
| [19] | Shang Y, Ma Y, Zhou Y, et al. Biosynthesis, regulation, and domestication of bitterness in cucumber. Science, 2014, 346 : 1084–1088. DOI:10.1126/science.1259215 |
| [20] | Ukiya M, Akihisa T, Yasukawa K, et al. Anti-inflammatory and anti-tumor-promoting effects of cucurbitane glycosides from the roots of Bryoniadioica. Journal of Natural Products, 2002, 65 : 179–183. DOI:10.1021/np010423u |
| [21] | Yan X, Fan Y, Wei W, et al. Production of bioactive ginsenoside compound K in metabolically engineered yeast. Cell Research, 2014, 24 : 770–773. DOI:10.1038/cr.2014.28 |
| [22] | Wright CW. Traditional antimalarials and the development of novel antimalarial drugs. Journal of Ethnopharmacology, 2005, 100 : 67–71. DOI:10.1016/j.jep.2005.05.012 |
| [23] | Ford NA, Erdman JW Jr. Are lycopene metabolites metabolically active?. Acta Biochimica Polonica, 2012, 59 (1): 1–4. |
| [24] | Rao LG, Mackinnon ES, Josse RG, et al. Lycopene consumption decreases oxidative stress and bone resorption markers in postmenopausal women. Osteoporosis International, 2007, 18 (18): 109–115. |
| [25] | Martin VJ, Pitera DJ, Withers ST, et al. Engineering a mevalonate pathway in Escherichia coli for production of terpenoids. Nature Biotechnology, 2003, 21 : 796–802. DOI:10.1038/nbt833 |
| [26] | Aharoni A, Jongsma MA, Bouwmeester HJ. Volatile science?Metabolic engineering of terpenoids in plants. Trends in Plant Science, 2005, 10 : 594–602. DOI:10.1016/j.tplants.2005.10.005 |
| [27] | Pichersky E, Gershenzon J. The formation and function of plant volatiles:perfumes for pollinator attraction and defense. Current Opinion in Plant Biology, 2002, 5 : 237–243. DOI:10.1016/S1369-5266(02)00251-0 |
| [28] | 文福姬, 俞庆善. 植物性天然香料的研究进展. 现代化工, 2005, 25(4): 25–28. |
| [29] | Balkema-Boomstra AG, Zijlstra S, Verstappen FW, et al. Role of cucurbitacin C in resistance to spider mite(Tetranychusurticae)in cucumber(Cucumissativus L. )[J]. Journal of Chemical Ecology, 2003, 29:225-235. |
| [30] | Powell G, Hardie J, Pickett JA, et al. Laboratory evaluation of antifeedant compounds for inhibiting settling by cereal aphids. Entomologia Experimentalis Et Applicata, 1997, 84 (2): 189–193. DOI:10.1046/j.1570-7458.1997.00214.x |
| [31] | George KW, Alonso-Gutierrez J, Keasling JD, et al. Isoprenoid drugs, biofuels, and chemicals—Artemisinin, farnesene, and beyond[M]. . |
| [32] | Roberts SC. Production and engineering of terpenoids in plant cell culture. Nature Chemical Biology, 2007, 3 : 387–395. DOI:10.1038/nchembio.2007.8 |
| [33] | Lange BM, Ahkami A. Metabolic engineering of plant monoterpenes, sesquiterpenes and diterpenes--current status and future opportunities. Plant Biotechnology Journal, 2013, 11 : 169–196. DOI:10.1111/pbi.2013.11.issue-2 |
| [34] | Bouvier F, Rahier A, Camara B. Biogenesis, molecular regulation and function of plant isoprenoids. Progress in Lipid Research, 2005, 44 : 357–429. DOI:10.1016/j.plipres.2005.09.003 |
| [35] | Liao P, Hemmerlin A, Bach TJ, et al. The potential of the mevalonate pathway for enhanced isoprenoid production. Biotechnology Advances, 2016, 34 (5): 697–713. DOI:10.1016/j.biotechadv.2016.03.005 |
| [36] | Rohdich F, Hecht S, Gartner K, et al. Studies on the nonmevalonate terpene biosynthetic pathway:metabolic role of IspH(LytB)protein. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99 : 1158–1163. DOI:10.1073/pnas.032658999 |
| [37] | Liang PH, Ko TP, Wang AH. Structure, mechanism and function of prenyltransferases. European Journal of Biochemistry / FEBS, 2002, 269 : 3339–3354. DOI:10.1046/j.1432-1033.2002.03014.x |
| [38] | Keeling CI, Weisshaar S, Lin RP, et al. Functional plasticity of paralogous diterpene synthases involved in conifer defense. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105 : 1085–1090. DOI:10.1073/pnas.0709466105 |
| [39] | Wallaart TE, Pras N, Beekman AC, et al. Seasonal variation of artemisinin and its biosynthetic precursors in plants of Artemisia annua of different geographical origin:proof for the existence of chemotypes. Planta Medica, 2000, 66 : 57–62. DOI:10.1055/s-2000-11115 |
| [40] | Tian J, Zhao X, Tu Y, et al. A synthetic approach for constructing the 3/6/6/5-fused tetracyclic skeleton of tenuipesine A. Chemistry-An Asian Journal, 2014, 9 : 724–727. DOI:10.1002/asia.v9.3 |
| [41] | Aharoni A, Jongsma MA, Kim TY, et al. Metabolic engineering of terpenoid biosynthesis in plants. Phytochemistry Reviews, 2006, 5 (1): 49–58. DOI:10.1007/s11101-005-3747-3 |
| [42] | Lewinsohn E, Schalechet F, Wilkinson J, et al. Enhanced levels of the aroma and flavor compound s-linalool by metabolic engineering of the terpenoid pathway in tomato fruits. Plant Physiology, 2001, 127 : 1256–1265. DOI:10.1104/pp.010293 |
| [43] | Lucker J, Bouwmeester HJ, Schwab W, et al. Expression of Clarkia S-linalool synthase in transgenic petunia plants results in the accumulation of S-linalyl-beta-D-glucopyranoside. The Plant Journal, 2001, 27 : 315–324. DOI:10.1046/j.1365-313x.2001.01097.x |
| [44] | Lavy M, Zuker A, Lewinsohn E, et al. Linalool and linallol oxide production in transgenic carnation flowers expressing the Clarkia breweri linalool synthase gene. Molecular Breeding, 2002, 9 : 103–111. DOI:10.1023/A:1026755414773 |
| [45] | Aharoni A, Giri AP, Deuerlein S, et al. Terpenoid metabolism in wild-type and transgenic Arabidopsis plants. The Plant Cell, 2003, 15 : 2866–2884. DOI:10.1105/tpc.016253 |
| [46] | Bach TJ, Rohmer M. Isoprenoid synthesis in plants and microorganisms:New concepts and experimental approaches[M]. New York Heidelberg Dordrecht London: Springer International Publishing, 2013. |
| [47] | Jarboe LR, Zhang X, Wang X, et al. Metabolic engineering for production of biorenewable fuels and chemicals:contributions of synthetic biology. Journal of Biomedicine & Biotechnology, 2010 : 761042. |
| [48] | Farmer WR, Liao JC. Precursor balancing for metabolic engineering of lycopene production in Escherichia coli. Biotechnology Progress, 2001, 17 : 57–61. DOI:10.1021/bp000137t |
| [49] | Kim SK, Han GH, Seong W, et al. CRISPR interference-guided balancing of a biosynthetic mevalonate pathway increases terpenoid production. Metabolic Engineering, 2016, 38 : 228–240. DOI:10.1016/j.ymben.2016.08.006 |
| [50] | Wang D, Dai Z, Zhang X. Production of plant-derived natural products in yeast cells-A review. Acta Microbiologica Sinica, 2016, 56 (3): 516–529. |
| [51] | Dai Z, Liu Y, Guo J, et al. Yeast synthetic biology for high-value metabolites. FEMS Yeast Research, 2015, 15 : 1–11. DOI:10.1093/femsyr/fou003 |
| [52] | Guo Y, Dong J, Zhou T, et al. YeastFab:the design and construction of standard biological parts for metabolic engineering in Saccharomyces cerevisiae. Nucleic Acids Research, 2015, 43 : e88. DOI:10.1093/nar/gkv464 |
| [53] | Lin Z, Zhang Y, Wang J. Engineering of transcriptional regulators enhances microbial stress tolerance. Biotechnology Advances, 2013, 31 : 986–991. DOI:10.1016/j.biotechadv.2013.02.010 |
| [54] | Phillips DR, Rasbery JM, Bartel B, et al. Biosynthetic diversity in plant triterpene cyclization. Current Opinion in Plant Biology, 2006, 9 : 305–314. DOI:10.1016/j.pbi.2006.03.004 |
| [55] | Mizutani M. Impacts of diversification of cytochrome P450 on plant metabolism. Biological & Pharmaceutical Bulletin, 2012, 35 : 824–832. |
| [56] | Huang S, Li R, Zhang Z, et al. The genome of the cucumber, Cucumissativus L. [J]. Nature Genetics, 2009, 41:1275-1281. |
| [57] | Herrero O, Ramon D, Orejas M. Engineering the Saccharomyces cerevisiae isoprenoid pathway for de novo production of aromatic monoterpenes in wine. Metabolic Engineering, 2008, 10 : 78–86. DOI:10.1016/j.ymben.2007.11.001 |
| [58] | Zhang Y, Yuan Y, Zhang Q, et al. Characterisation of an(S)-lin-alool synthase from kiwifruit(Actinidiaarguta)that catalyses thefirst committed step in the production of floral lilac compounds[J]. Functional Plant Biology, 2010, 37(3):232-243. |
| [59] | Rico J, Pardo E, Orejas M. Enhanced production of a plant monoterpene by overexpression of the 3-hydroxy-3-methylglutaryl coenzyme A reductase catalytic domain in Saccharomyces cerevisiae. Applied and Environmental Microbiology, 2010, 76 : 6449–6454. DOI:10.1128/AEM.02987-09 |
| [60] | 孙明雪, 刘继栋, 堵国成. 调控酿酒酵母类异戊二烯合成途径强化芳樟醇合成. 生物工程学报, 2013, 29(6): 751–759. |
| [61] | Liu J, Zhu Y, Du G, et al. Response of Saccharomyces cerevisiae to D-limonene-induced oxidative stress. Applied Microbiology and Biotechnology, 2013, 97 : 6467–6475. DOI:10.1007/s00253-013-4931-9 |
| [62] | 刘继栋, 周景文, 陈坚. 酿酒酵母单萜耐受机理研究进展. 微生物学报, 2013, 53(6): 521–537. |
| [63] | Parveen M, Hasan MK, Takahashi J, et al. Response of Saccharomyces cerevisiae to a monoterpene:evaluation of antifungal potential by DNA microarray analysis. The Journal of Antimicrobial Chemotherapy, 2004, 54 : 46–55. DOI:10.1093/jac/dkh245 |
| [64] | Ro DK, Paradise EM, Ouellet M, et al. Production of the antimalarial drug precursor artemisinic acid in engineered yeast. Nature, 2006, 440 : 940–943. DOI:10.1038/nature04640 |
| [65] | Dahl RH, Zhang F, Alonso-Gutierrez J, et al. Engineering dynamic pathway regulation using stress-response promoters. Nature Biotechnology, 2013, 31 : 1039–1046. DOI:10.1038/nbt.2689 |
| [66] | Westfall PJ, Pitera DJ, Lenihan JR, et al. Production of amorphadiene in yeast, and its conversion to dihydroartemisinic acid, precursor to the antimalarial agent artemisinin. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109 : E111–E118. DOI:10.1073/pnas.1110740109 |
| [67] | Paddon CJ, Westfall PJ, Pitera DJ, et al. High-level semi-synthetic production of the potent antimalarial artemisinin. Nature, 2013, 496 : 528–532. DOI:10.1038/nature12051 |
| [68] | Paddon CJ, Keasling JD. Semi-synthetic artemisinin:a model for the use of synthetic biology in pharmaceutical development. Nature Reviews Microbiology, 2014, 12 : 355–367. DOI:10.1038/nrmicro3240 |
| [69] | 王学勇, 崔光红, 高伟. 药用植物功能基因克隆新方法——成分差异表型克隆法. 中国中药杂志, 2009, 34(1): 14. |
| [70] | Gao W, Hillwig ML, Huang L, et al. A functional genomics approach to tanshinone biosynthesis provides stereochemical insights. Organic Letters, 2009, 11 : 5170–5173. DOI:10.1021/ol902051v |
| [71] | Dai Z, Liu Y, Huang L, et al. Production of miltiradiene by metabolically engineered Saccharomyces cerevisiae. Biotechnology and Bioengineering, 2012, 109 : 2845–2853. DOI:10.1002/bit.v109.11 |
| [72] | Zhou YJ, Gao W, Rong Q, et al. Modular pathway engineering of diterpenoid synthases and the mevalonic acid pathway for miltiradiene production. Journal of the American Chemical Society, 2012, 134 : 3234–3241. DOI:10.1021/ja2114486 |
| [73] | Guo J, Zhou YJ, Hillwig ML, et al. CYP76AH1 catalyzes turnover of miltiradiene in tanshinones biosynthesis and enables heterologous production of ferruginol in yeasts. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110 : 12108–12113. DOI:10.1073/pnas.1218061110 |
| [74] | Yang L, Ding G, Lin H, et al. Transcriptome analysis of medicinal plant Salvia miltiorrhiza and identification of genes related to tanshinone biosynthesis. PLoS ONE, 2013, 8 : e80464. DOI:10.1371/journal.pone.0080464 |
| [75] | Xu X, Jiang Q, Ma X, et al. Deep sequencing identifies tissue-specific microRNAs and their target genes involving in the biosynthesis of tanshinones in Salvia miltiorrhiza. PLoS One, 2014, 9 (11): e111679. DOI:10.1371/journal.pone.0111679 |
| [76] | Gao W, Sun HX, Xiao HB, et al. Combining metabolomics and transcriptomics to characterize tanshinone biosynthesis in Salvia miltiorrhiz. BMC Genomics, 2014, 15 : 73. DOI:10.1186/1471-2164-15-73 |
| [77] | Ma XH, Ma Y, Tang JF, et al. The biosynthetic pathways of tanshinones and phenolic acids in Salvia miltiorrhiza. Molecules, 2015, 20 (9): 16235–16254. DOI:10.3390/molecules200916235 |
| [78] | 高伟, 胡添源, 郭娟, 等. 丹参酮合成生物学研究进展. 中国中药杂志, 2015, 40(13): 2486–2491. |
| [79] | Tansakul P, Shibuya M, Kushiro T, et al. Dammarenediol-II synthase, the first dedicated enzyme for ginsenoside biosynthesis, in Panax ginseng. FEBS Letters, 2006, 580 : 5143–5149. DOI:10.1016/j.febslet.2006.08.044 |
| [80] | Kushiro T, Shibuya M, Ebizuka Y. Beta-amyrin synthase--cloning of oxidosqualene cyclase that catalyzes the formation of the most popular triterpene among higher plants. European journal of biochemistry / FEBS, 1998, 256 : 238–244. DOI:10.1046/j.1432-1327.1998.2560238.x |
| [81] | Han JY, Kim HJ, Kwon YS, et al. The Cyt P450 enzyme CYP716A47 catalyzes the formation of protopanaxadiol from dammarenediol-II during ginsenoside biosynthesis in Panax ginseng. Plant & Cell Physiology, 2011, 52 : 2062–2073. |
| [82] | Zhang G, Cao Q, Liu J, et al. Refactoring β-amyrin synthesis in Saccharomyces cerevisiae. Aiche Journal, 2015, 61 (10): 3172–3179. DOI:10.1002/aic.v61.10 |
| [83] | Gardner TS. Synthetic biology:from hype to impact. Trends in Biotechnology, 2013, 31 (3): 123–125. DOI:10.1016/j.tibtech.2013.01.018 |