在过去的150年里,基于石化资源的过度开发及消费导致了三大能源的日益枯竭和污染的日益加重。以石化资源为基础的化工产业作为一种有效的方法生产化学品具有很多优势。但是,随着科技日新月异的发展,化工方法的不足也逐渐显示出来,包括: (1) 使用有毒或者环境不友好的催化剂; (2) 产生有毒的中间产物或副产物; (3) 需要高温高压的生产工艺; (4) 生产需要大量能源; (5) 生产手性化合物非常困难。这些问题使得人们把目光投向了生物合成及生物化工领域。生物合成主要以葡萄糖、甘油、木糖甚至纤维素等可再生资源为底物,通过改造微生物生产生物柴油、大宗化学品、精细化学品、药物及营养品等[1]。目前,合成生物学方法被广泛应用于生物合成领域。合成生物学是由基因组学、工程学、分子生物学、信息学等技术集成产生的工具与方法,从社会重大需求出发,合成具有生命功能的生物分子、细胞与系统,并使用系统生物学的全方位整合及分析研究策略,为生物学研究提供正向工程学方法。其目的是改造、设计、重建的生物部件、代谢途径、生物系统和发育分化过程,乃至具备生命活动能力的体系、生物部件、生物个体以及人造生态。2006年,以美国加州大学伯克利分校的Keasling教授[2]在Nature上发表首次使用酵母生产抗疟疾药青蒿素的前体-青蒿酸为标志,合成生物学进入了飞速发展的阶段。随着合成生物学的发展,历经7年的不断研究,2013年,青蒿酸的产量已由最初的115 mg/L提高到了25 g/L[3],显示了良好的工业应用前景。这说明合成生物学的发展日渐成熟,目前已经应用于生物化工的各个领域。本文以芳香族氨基酸及其衍生物为例,详细论述合成物学方法构建有效的底盘生物生产目标产物的策略,包括建立热力学可行的代谢途径、蛋白质工程、重写碳代谢流、利用不同的碳源、改造底物摄入机制等都是本文讨论的范围。
1 芳香族氨基酸的生物合成芳香族氨基酸包括L-苯丙氨酸、L-色氨酸及L-酪氨酸,在生物体内由莽草酸途径合成。其中色氨酸及苯丙氨酸是人体8种必需氨基酸,只能从膳食中进行补充。这3种氨基酸同时也是合成大量高附加值产物的前体。如图 1所示,芳香族氨基酸的合成首先通过磷酸烯醇式丙酮酸 (PEP) 和4-磷酸赤藓糖 (E4P) 缩合生产3-脱氧-D-阿糖基庚糖酮酸-7-磷酸 (DAHP) ,随后被催化生产分支酸。分支酸是生产3种芳香族氨基酸的重要分支[4, 5],因此,在生物合成的过程中,增强分支酸的碳代谢流以提高分支酸的产量是研究的第一个重点。首先,过表达PEP合成酶的基因ppsA和转酮醇酶的基因tktA以增强细胞内PEP和E4P的产量是最长用的方法。其次,通过改造DAHP合成酶和分支酸变位酶——预苯酸脱氢酶解除其所受的反馈抑制 (分别编码为aroGfbr和tyrAfbr) ,使得细胞内可以大量积累分支酸同时可以大量生产L-酪氨酸[6, 7]。另外,TyrR和TypR介导的抑制也影响了芳香族氨基酸的产量,通过敲除tyrR基因来除去转录的弱化情况,可以增强苯丙氨酸和酪氨酸的产量[6, 7]。另外的方法是,通过破坏一个全局调控的基因csrA可使苯丙氨酸的产量提高两倍[8]。近阶段的研究中,调控氨基酸的转运机制作为一种新的方法被用来提高芳香族氨基酸的产量。体内氨基酸的积累或者摄取都可以抑制宿主的生产力,而通过改造转运系统可以解除这个机制的抑制,从而提高氨基酸的产量[9]。利用这些策略,大肠杆菌和谷氨酸棒杆菌的L-酪氨酸、L-苯丙氨酸和L-色氨酸的产量分别达到了55 g/L[10]、46 g/L[11]和60 g/L[12, 13]。

|
| 图 1 芳香族氨基酸的生物合成途径 |
虽然芳香族氨基酸是重要的营养品,但是,芳香族氨基酸的衍生物则几乎全部为高附加值、具有生物学功能的化学品、药品及营养品。因此,在合成生物学蓬勃发展的今天,人们的研究重点则集中于芳香族氨基酸的衍生物的生物合成。
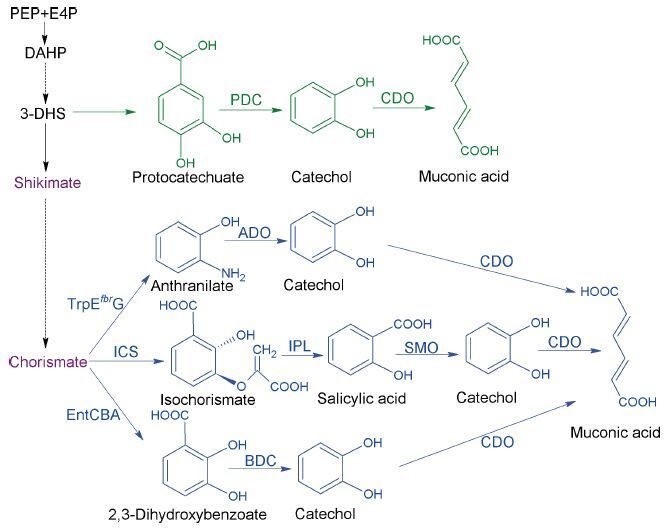
2 芳香族氨基酸衍生物的生物合成 2.1 有机酸类莽草酸途径生产芳香族氨基酸的重要中间代谢物是分支酸,而分支酸不仅可以生产芳香族氨基酸,同时也是一些重要的有机酸的前体物质。如黏糠酸和水杨酸就是以分支酸为前体生产的 (图 2) 。
水杨酸,又称为邻羟基苯甲酸或2-羟基苯甲酸,多存在于植物中,是一种调节生长发育的激素[14]。水杨酸是护肤品中的重要成分,被用于治疗痤疮、脂溢性皮炎、银屑病等[15]。其衍生物水杨酸甲酯具有缓解疼痛的作用,被广泛应用于医药行业[16]。水杨酸在微生物中的异源生物合成是通过调节莽草酸途径来增加分支酸及异分支酸的供应以达到高产的目的。Lin等[17]利用一个中拷贝的质粒调节了前体的碳代谢流,这个中拷贝的质粒上携带有ppsA、tktA和aroGfbr的基因,从而提高了莽草酸途径产生分支酸的量,生产了1.2 g/L的水杨酸。这篇研究同时发现,使用更高拷贝的质粒或者敲除其他的竞争性途径来增加生产分支酸的代谢流并没有生产更多的水杨酸,说明体内的碳代谢达到了平衡。最近的研究者们将研究的重点放在了莽草酸途径以外的代谢网络水平,从代谢全局的角度调整代谢流量。由于微生物自身的葡萄糖转运机制是消耗莽草酸途径重要的前体PEP的。因此,敲除了PTS系统和PEP向丙酮酸转化的关键基因,基于这个研究,水杨酸的最终产量达到11.5 g/L[18]。
水杨酸经过脱羧和氧化,就可以生产另外一种重要的有机酸——黏糠酸 (图 2) 。黏糠酸是一种六碳二羧酸,在化工领域是一种重要的平台化合物,可用于生产塑料、对苯二甲酸和己二酸。而己二酸则是尼龙-6,6和聚氨酯的重要单体。对苯二甲酸的全球经济价值达到7.1亿美元,而己二酸的年需求量也达到了330万t。1994年,Frost课题组首次报道了利用大肠杆菌从头异源合成黏糠酸[19]。如图 2所示,该研究将3个外源酶引入大肠杆菌,包括3-脱氢莽草酸脱水酶,原儿茶酸脱羧酶和儿茶酚1,2-双加氧酶,以3-二氢莽草酸 (DHQ) 为前体生产黏糠酸。同时过表达tktA、aroF和aroB基因以提高前体DHQ的产量。最终该工程菌在发酵罐中生产了38.6 g/L黏糠酸。最近有研究用同样的策略在酵母中生产黏糠酸,得到了141 mg/L的发酵产量[20]。Yan课题组[21]构建了三条不同的途径来生产黏糠酸,通过一系列的优化和全局调控,成功完成了生产黏糠酸的底盘细胞的构建。如图 2所示,这些途径均以分支酸为前体生产黏糠酸。第一条途径中,利用大肠杆菌自身的邻氨基苯甲酸合成酶将分支酸转化为邻氨基苯甲酸,接着用两个外源酶——邻氨基苯甲酸1,2-双加氧酶和儿茶酚1,2-双加氧酶生产最终产物。在抑制色氨酸的生物合成的同时引入谷氨酰胺循环体系,更加全面的调节宿主细胞,最终黏糠酸的产量达到389.96 mg/L。接下来,该课题组利用异分支酸合酶、异分支酸丙酮酸裂解酶、水杨酸1-单加氧酶和儿茶酚1,2-双加氧酶组成新的异源合成途径,在一个由苯丙氨酸生产菌改造的水杨酸生产菌中生产黏糠酸,通过增加上游途径到分支酸的产量,最终在该基因工程菌中生产了1.5 g/L黏糠酸[17]。最后一个途径是巧妙的将2,3-二羟基苯甲酸的生物合成及生物降解同时在大肠杆菌中表达,利用2,3-二羟基苯甲酸脱羧酶和儿茶酚1,2-双加氧酶降解大肠杆菌自身生产的2,3-二羟基苯甲酸来生产黏糠酸。通过过表达莽草酸途径的相关基因和entCBA (编码2,3-二羟基苯甲酸合成酶) 达到高产黏糠酸的目的,最终产量达到900 mg/L[22]。利用更为廉价的碳源来生产黏糠酸这种大宗化学品在工业上来说会降低成本的消耗,如使用甘油或纤维素水解液。最近的研究中,Zhang等[23]在PNAS上报道了通过共培养的方式将两种细胞在葡萄糖和木糖 (模拟纤维素水解液) 中共培养,通过克服微生物自身的生产缺陷提高碳源利用率来生产黏糠酸,得到了0.35 g/g木糖葡萄糖混合液的产率。Johnson等[24]利用木素水解物产生的芳香族化合物和葡萄糖共培养,在恶臭假单胞菌中生产黏糠酸,通过共表达原儿茶酸脱羧酶和其相关的两个蛋白来生产该蛋白所需要的辅因子,最终生产了15.6 g/L黏糠酸。黏糠酸可以作为生物传感器,通过控制相应的启动子的表达或抑制来完成对代谢网络的实时调控。同时也可以启动表达报告基因,通过报告基因的强度与黏糠酸的浓度关系,实时监测黏糠酸的产量。最近,Keasling课题组[25]成功将原核生物中的生物传感器改造了一个真核生物中的LysR转录调节元件,通过调节该元件对于黏糠酸的敏感性,不同浓度的黏糠酸可以控制蛋白不同的表达水平,从而控制荧光蛋白的荧光强度,通过荧光强度来定量黏糠酸的产量。
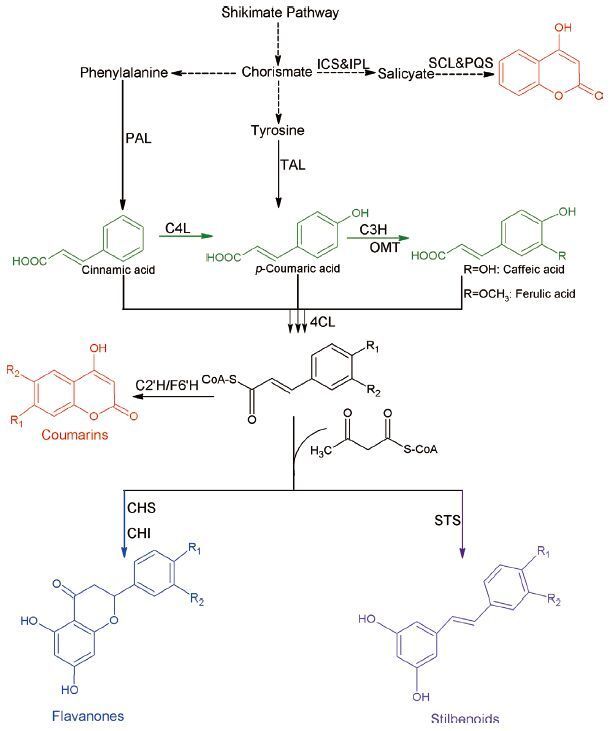
2.2 类苯基丙烷类 (Phenylpropanoid)类苯基丙烷类化合物是一种以苯丙氨酸为前体的植物次级代谢产物。如图 3所示,基于不同的分子结构,类苯基丙烷可以分为羟化肉桂酸类、香豆素类、黄酮类和茋类[26]。由于这些化合物具有抗氧化、抗炎、抗病毒和抗癌等能力,因此,这些化合物常被用于食品、医药、化妆品等领域[27, 28]。但是,这些化合物在植物中的含量很少,因此,利用分离提取的方法得到产品是非常低效的。随着代谢工程和合成生物学的发展,人们通常利用大肠杆菌和酵母等模式生物,以廉价的碳源或前体为底物,生产这些高附加值的产品。
|
| 图 3 人工构建的类苯基丙烷类生物合成途径 红色物质代表香豆素类;绿色化合物代表羟化肉桂酸类;蓝色代表黄酮类化合物;紫色代表茋类化合物 |
羟化肉桂酸通常是指羟基化的肉桂酸的衍生物或者带有简单取代基团的肉桂酸衍生物,包括对香豆酸、阿魏酸和咖啡酸等。其中,对香豆酸是一个关键的中间代谢物,可以合成大量的类苯基丙烷类产品。在植物代谢途径中,苯丙氨酸氨基裂解酶 (PAL) 催化苯丙氨酸脱掉氨基生成肉桂酸,再在肉桂酸4-羟化酶 (C4H) 的催化下完成对位的羟化反应,生成对香豆酸 (图 3) 。鉴于植物中的基因更容易在酵母这种真核细胞中完成异源合成,这条通路最早在酵母中被表达[29]。但是,细胞色素P450家族的C4H的催化效率低导致了整条通路的产量并不尽如人意。图 3显示,对香豆酸可以由酪氨酸直接脱氨基生成,Vannelli等[30]利用酪氨酸氨基裂解酶直接生产对香豆酸。同时,PAL也具有较宽的底物谱,可以催化酪氨酸的脱氨基反应。2012年,Kang等[31]利用一株大肠杆菌的酪氨酸生产菌,通过过表达来自酵母的酪氨酸氨基裂解酶 (Sam8) 生产了974 mg/L对香豆酸。最近的报道中,一株对香豆酸的高产酵母菌被进一步改造,通过敲除苯丙酮酸脱羧酶的基因ARO10和丙酮酸脱羧酶的基因PDC5来抑制副产物的生产,同时解除了DAHP合成酶的反馈抑制系统,增强莽草酸途径的碳代谢流,使对香豆酸的产量达1.93 g/L[7]。
咖啡酸也是一种重要的类苯基丙烷类化合物,具有抗肿瘤[32]和抗炎[33]的作用,同时也是一种良好的抗氧化剂[34],有研究报道称咖啡酸可以抑制黄曲霉素的产生[35]。在自然界中,咖啡酸的生产依赖于另外一种细胞色素P450家族的羟化酶——对香豆酸3-羟化酶 (C3H) [36]。鉴于细胞色素P450家族较低的催化效率和难以表达的特点,寻找C3H的同工酶成为异源合成咖啡酸的重要研究工作。Berner等[37]最早从酵母中分离得到了Sam5可以替代C3H催化对香豆酸生产咖啡酸。在大肠杆菌[38]、嗜热栖热菌 (Thermusthermophilus) [39]、鲍曼不动杆菌 (Acinetobacter baumannii) [40]及恶臭假单胞菌 (Pseudomonas putida) [41]中,存在一种参与4-羟基苯乙酸降解的羟化酶4-羟基苯乙酸3-羟化酶 (4HPA3H) ,可以高效的催化4-羟基苯乙酸的类似物对香豆酸的邻位羟基化,生成咖啡酸。有研究显示,带有铜绿假单胞菌4HPA3H基因的大肠杆菌,通过添加对香豆酸作为底物可以生产10.2 g/L的咖啡酸[42]。如图 3所示,在大肠杆菌中同时表达TAL和4HPA3H,即可实现咖啡酸的从头合成。利用大肠杆菌的苯丙氨酸生产菌株以甘油和葡萄糖为底物,提高酪氨酸的产量,进而生产咖啡酸,在摇瓶中的产量可以达到776 mg/L[43]。酵母中天然存在Sam8和Sam5,因此过表达这两个基因可以生产咖啡酸,但是,这条通路的产量略低于大肠杆菌中由TAL和4HPA3H组成的通路的产量[31]。
与此同时,由此中心途径延伸出来了很多生产其他芳香族有机酸的途径。Sun等[44]通过筛选10余种不同来源及可能的酶,成功获得可以催化肉桂酸生产羟化肉桂酸的酶,并将厌氧的羟化酶在好氧条件下成功表达,可以催化肉桂酸和香豆酸生产苯丙酸和对羟基苯丙酸,摇瓶产量分别达到366.77 mg/L和225.10 mg/L。在大肠杆菌中,利用混合碳源从头合成,建立了生产肉桂酸和对羟基肉桂酸的合成途径[45]。有研究报道,利用4HPA3H的底物谱较宽的特性,通过酪氨酸的合成的分支途径生产4-羟基苯丙酮酸,进而生产了7.1 g/L的丹参素A[46]。阿魏酸也可以通过中心途径产生咖啡酸进行生产,利用来自拟南芥的氧甲基转移酶催化咖啡酸生产阿魏酸[31]。另外,这个中心途径还可以被用来生产迷迭香酸[47]、绿原酸[48]、奎尼酸和莽草酸酯[5]等衍生物。
2.2.2 黄酮类黄酮类是非常著名的抗氧化抗衰老的一类化合物,分为以下几个小类:黄酮、黄烷酮、异黄酮、黄酮醇、黄烷醇等[4]。常见的有大豆异黄酮、柚皮素、圣草酚等[27]。迄今为止,关于黄酮类生物合成的研究主要集中于松属素和柚皮素。因为这两个简单的黄烷酮类是合成其他黄酮类物质的基本单位。如图 3所示,生物合成松属素和柚皮素的第一步是通过4-香豆酸辅酶A连接酶 (4CL) 将辅酶A与肉桂酸以及辅酶A与对香豆酸分别缩合为肉桂酰辅酶A和对香豆酰辅酶A。再通过查尔酮合酶 (CHS) 催化重复的克莱森缩合反应,将3分子的丙二酰辅酶A与肉桂酰辅酶A或者香豆酰辅酶A缩合形成黄烷酮查尔酮。接下来,这些查尔酮经过自发的反应或者在查尔酮异构酶 (CHI) 的催化下生成松属素和柚皮素。在酵母中,表达4CL、CHS和CHL可以通过相应的氨基酸生产0.2 mg/L柚皮素和16.3 g/L松属素[49],而在大肠杆菌中表达PAL/TAL、4CL、CHS和CHI,可以同时生产60 mg/L的柚皮素和58 mg/L的松属素[50]。Koopman等[51]在酵母中建立了一条从头合成柚皮素的代谢途径,该途径以葡萄糖为唯一碳源,通过平衡基因的表达,提高前体的供应和降低副产物途径的代谢工程手段,最终在发酵罐中生产了415 μmol/L的柚皮素。由黄烷酮类物质的生物合成过程 (图 3) 可知,通过增加体内丙二酰辅酶A的浓度,可以提高黄烷酮类物质的产量。一方面,过表达丙二酰辅酶A合酶 (MatB) 和一个可能的丙二酸盐转运蛋白 (MatC) 可以提高丙二酰辅酶A的浓度,从而显著的提高黄烷酮类的产量[52];另一方面过表达乙酰辅酶A羧化酶 (ACC) 和生物素连接酶可以促进乙酰辅酶A转化为丙二酰辅酶A,利用该策略,可以生产119 mg/L柚皮素、429 mg/L松属素和52 mg/L圣草酚[50, 53]。此外,更多的合成生物学方法被用于提高前体物丙二酰辅酶A的产量。利用反义RNAs 来抑制脂肪酸的合成来增加丙二酰辅酶A的胞内浓度,比直接敲除脂肪酸的合成途径更加有效地提高了细胞内丙二酰辅酶A的含量[54]。Yang等[55]利用一段合成的反义RNA工具动态调控了大肠杆菌中的丙二酰辅酶A的合成,使丙二酰辅酶A的含量提高了4.5倍,最终生产了91.31 mg/L柚皮素,产量比对照菌提高了1.53倍。通过调节启动子的强度来平衡模块间的表达水平,利用不同拷贝数的质粒平衡代谢途径中各个酶的表达,在大肠杆菌中以葡萄糖为碳源生产了100.64 mg/L柚皮素[56]。利用基因组水平的代谢模型以最小化进行基因干预的策略,重写碳流量,使其尽可能多的流向丙二酰辅酶A的生物合成,最终生产了474 mg/L柚皮素[56]。
2.2.3 香豆素类香豆素是来自于植物的一类天然产物,包括了双香豆素、4-羟基香豆素、7-羟基香豆素 (伞花内酯) 、6,7-二羟基香豆素 (七叶素) 等化合物[57, 58]。该类物质的重要共同结构是4-羟基香豆素。香豆素类药物的重要作用是抗凝血作用,主要通过与维生素K竞争性抑制,阻碍凝血因子在肝脏中合成,由此制成了著名的抗血栓药物华法林[59]。相对于羟化肉桂酸类化合物和黄酮类化合物,关于香豆素微生物合成的研究非常少,因为到目前为止,对于香豆素在植物中的代谢途径研究还不甚清晰。佐治亚大学的Yan Yanjun课题组在香豆素类物质的生物合成中做出了突出的贡献。2013年,该组在Nature Communications上发表文章,首次在大肠杆菌中实现了香豆素类的核心物质4-羟基香豆素的异源生物合成。利用来自大肠杆菌的4HPA3H参与的咖啡酸的生物合成途径,再表达3个酶:咖啡酸酯3-甲氧基转移酶、4CL和阿魏酸酯辅酶A 6’-羟化酶生产东莨菪亭。此外,另一个不是从类苯基丙烷类物质衍生出来的生物合成途径也在该研究中被建立,用来生产4-羟基香豆素。这个途径由分支酸作为前体,丙二酰辅酶A作为碳单位,利用异分支酸合成酶 (ICS) 、异分支酸丙酮酸裂解酶、水杨酰辅酶A连接酶和喹诺酮合成酶 (PqsD) 在大肠杆菌中成功的生产了约500 mg/L的4-羟基香豆素[57]。同时,该课题组还首次构建了伞形花内酯和东莨菪亭的微生物合成途径,这条途径不仅克服了香豆素合成中的未知步骤,还避免了使用细胞色素P450家族的羟化酶[60],他们还深入研究了大肠杆菌中4HPA3H的催化特性和底物兼容性。研究发现,该酶可以催化伞形花内酯高效转化为七叶亭,最终得到了2.7 g/L的七叶亭,同时,该酶还可以催化白藜芦醇转化为白皮杉醇[58],Furuya等[61]基于此工作,通过添加吐温80的方法,利用该酶进行全细胞催化,12 h生产了5.2 g/L 白皮杉醇,转化率达到83%。同时,该酶还可以将柚皮素转化为圣草酚,将阿福豆素转化为儿茶酸[58, 62]。
2.2.4 茋类茋类化合物是一类由对称苯代二乙烯和简单的取代集团形成的对称苯代二乙烯的类似物。其中最典型的化合物是白藜芦醇。白藜芦醇具有良好的抗氧化[63]、抗衰老[64]及预防癌症的功效[65]。如图 3所示,白藜芦醇的生物合成也是通过3分子的丙二酰辅酶A与对香豆酰辅酶A缩合后经过脱羧形成的。最初白藜芦醇是在酵母中通过表达4CL和对称二苯代乙烯合成酶 (STS) 实现首次异源生物合成的[66, 67]。经过优化,使用来自于拟南芥的4CL1和葡萄的STS,可以生产391 mg/L白藜芦醇[68]。近期有研究利用合成生物学的方法,改造不同的质粒,通过增加丙二酰辅酶A的浓度,来增加白藜芦醇的产量,该方法有效的将白藜芦醇的产量提高到了2.3 g/L[69]。
2.3 其他化合物除了上述的氨基酸及类苯基丙烷类化合物,芳香族氨基酸还有其它具有生物活性的简单衍生物,包括5-羟基色氨酸、天麻素等。
5-羟基色氨酸是色氨酸的衍生物,是一种治疗抑郁症、失眠、肥胖和慢性头痛的重要药物,常从非洲加纳的种子中提取获得[70]。而加纳只能在西部及中部非洲种植,极大的限制了5-羟基色氨酸的商品供应。Lin等[71]在大肠杆菌中筛选了苯丙氨酸4-羟化酶,通过蛋白质工程的方法改造该酶,使其可以利用四氢生物蝶呤特异性的将色氨酸转化为5-羟基色氨酸。同时,鉴于大肠杆菌不能产生四氢生物蝶呤且其价格昂贵,因此在大肠杆菌中引入了一个外源的四氢生物蝶呤循环系统。通过这些改造,全细胞转化法可以生产1.2 g/L 5-羟基色氨酸。Sun等[72]同时构建了另外一条途径实现了大肠杆菌中5-羟基色氨酸的从头生物合成,首先构建了高产5-羟基邻氨基苯甲酸的生物合成途径,该过程利用了水杨酸5-羟化酶催化邻氨基苯甲酸生成5-羟基苯甲酸,再利用大肠杆菌自身的TrpDCBA (色氨酸合成酶) 生成最终产物,首次实现了5-羟基色氨酸的从头合成。
芳香族氨基酸及其衍生物的糖苷类产品也是研究的重点,有些具有生物功能的芳香族化合物不易溶于水,因此生物相容性和利用度较差。而糖苷基团的引入可以有效的增加化合物的水溶性和稳定性,有些化合物在引入糖苷基团后可以增加其生物活性。天麻素就是这样一种物质,是由4-羟基苯乙醇在羟基基团上引入糖苷基团的化合物。天麻素具有抗氧化,抗炎等作用,在医学上可以作为镇静剂、安眠药、抗惊厥药和神经保护药[73-75]。2016年,Bai等[76]在大肠杆菌中构建了天麻素的从头合成途径,通过分支酸生产4-羟基苯甲酸,再经过两步催化生产4-羟基苯乙醇,最后在葡萄糖基转移酶的催化下生成天麻素。经过对代谢途径的优化和葡萄糖基转移酶的改造,最终生产了545 mg/L天麻素。同年,Ahmadi等[77]在大肠杆菌中实现了另外一种芳香族氨基酸衍生物——水杨酸的糖基化产品生产。葡萄糖基水杨酸是一种植物中的抗炎因子,通过莽草酸途径生产水杨酸,再过表达6-磷酸葡萄糖的生产途径,通过葡萄糖基转移酶催化,最终生成葡萄糖基水杨酸。利用两种不同的共培养系统,葡萄糖基水杨酸的最终产量为2.5 g/L。
3 结语随着石油资源的日益枯竭,以石油为基础的化工产业面临严重的挑战。在过去的几十年里,利用微生物以廉价可再生碳源为底物生产精细化学品和大宗化学品的研究日渐成熟。目前,建立一个高效的生物合成体系需要对底盘生物和外源途径进行全面的优化,必须解决如下问题: (1) 生产用的工程化微生物必须被系统的进行改造,具备高产量、高产率和可大规模生产; (2) 生产的原料必须便宜易得,生产过程耗能较少; (3) 产品体系中杂质少,产物容易分离。以合成生物学为基础发展出来的技术,如大规模基因编辑技术CRISPR-Cas9的发展及完善,反义RNA、DNA支架或蛋白支架等工具,都为合成生物学在生物化工领域的应用铺平了道路。而合成生物学的模块化、适配化的原则也使研究向着更加深入和普适化的方向进行。我们相信,随着合成生物学的发展,越来越多的工具和方法被应用,生物化工的研究也会更多元化,也将有更多的研究成果被应用。
| [1] | Jullessona D, Davida F, Pflegerb B, et al. Impact of synthetic biology and metabolic engineering on industrial production of fine chemicals. Biotechnology Advances, 2015, 33 : 1395–1402. DOI:10.1016/j.biotechadv.2015.02.011 |
| [2] | Ro DK, Paradise EM, Ouellet M, et al. Production of the antimalarial drug precursor artemisinic acid in engineered yeast. Nature, 2006, 440 : 940–943. DOI:10.1038/nature04640 |
| [3] | Paddon CJ, Westfall PJ, Pitera DJ, et al. High-level semi-synthetic production of the potent antimalarial artemisinin. Nature, 2013, 496 : 528–532. DOI:10.1038/nature12051 |
| [4] | Krivoruchko A, Nielsen J. Production of natural products through metabolic engineering of Saccharomyces cerevisiae. Current Opinion in Biotechnology, 2015, 35 : 7–15. DOI:10.1016/j.copbio.2014.12.004 |
| [5] | Sun X, Sh en, X, Jain R, et al. Synthesis of chemicals by metabolic engineering of microbes. Chemical Society Reviews, 2015, 44 : 3760–3785. DOI:10.1039/C5CS00159E |
| [6] | Lütke-Eversloh T, Stephanopoulos G. L-tyrosine production by deregulated strains of Escherichia coli. Applied Microbiology and Biotechnology, 2007, 75 : 103–110. DOI:10.1007/s00253-006-0792-9 |
| [7] | Rodriguez A, Kildegaard KR, Li M, et al. Establishment of a yeast platform strain for production of p-coumaric acid through metabolic engineering of aromatic amino acid biosynthesis. Metabolic Engineering, 2015, 31 : 181–188. DOI:10.1016/j.ymben.2015.08.003 |
| [8] | Tatarko M, Romeo T. Disruption of a global regulatory gene to enhance central carbon flux into phenylalanine biosynthesis in Escherichia coli. Current Microbiology, 2001, 43 : 26–32. DOI:10.1007/s002840010255 |
| [9] | Ikeda M. Towards bacterial strains overproducing L-tryptophan and other aromatics by metabolic engineering. Applied Microbiology and Biotechnology, 2006, 69 : 615–626. DOI:10.1007/s00253-005-0252-y |
| [10] | Patnaik R, Zolandz RR, Green DA, et al. L-Tyrosine production by recombinant Escherichia coli:Fermentation optimization and recovery. Biotechnology and Bioengineering, 2008, 99 : 741–752. DOI:10.1002/bit.v99:4 |
| [11] | KonstantinovKB, NishioN, SekiT, 等. Physiologically motivated strategies for control of the fed-batch cultivation of recombinant Escherichia coli for phenylalanine production. Journal of Fermentation and Bioengineering, 1991, 71: 350–355. |
| [12] | Ikeda M, Katsumata R. Transport of aromatic amino acids and its influence on overproduction of the amino acids in Corynebacterium glutamicum. Journal of Fermentation and Bioengineering, 1994, 78 : 420–425. DOI:10.1016/0922-338X(94)90040-X |
| [13] | Wehrmann A, Morakkabati S, Kr?mer R, et al. Functional analysis of sequences adjacent to dapE of Corynebacterium glutamicum reveals the presence of aroP, which encodes the aromatic amino acid transporter. Journal of Bacteriology, 1995, 177 : 5991–5993. DOI:10.1128/jb.177.20.5991-5993.1995 |
| [14] | Hayat S, Ali B, Ahmad A. Salicylic acid:biosynthesis, metabolism and physiological role in plants[M]. Salicylic acid: A plant hormone:Springer, 2007: 1-14. |
| [15] | Steele K, Shirodaria P, O’HARE M, et al. Monochloroacetic acid and 60% salicylic acid as a treatment for simple plantar warts:effectiveness and mode of action. British Journal of Dermatology, 1988, 118 : 537–544. DOI:10.1111/bjd.1988.118.issue-4 |
| [16] | Tounekti T, Hernández I, Munné-Bosch S. Salicylic acid biosynthesis and role in modulating terpenoid and flavonoid metabolism in plant responses to abiotic stress[M]. Salicylic acid: Springer, 2013: 141-162. |
| [17] | Lin Y, Sun X, Yuan Q, et al. Extending shikimate pathway for the production of muconic acid and its precursor salicylic acid in Escherichia coli. Metabolic Engineering, 2014, 23 : 62–69. DOI:10.1016/j.ymben.2014.02.009 |
| [18] | Noda S, Shirai T, Oyama S, et al. Metabolic design of a platform Escherichia coli strain producing various chorismate derivatives. Metabolic Engineering, 2016, 33 : 119–129. DOI:10.1016/j.ymben.2015.11.007 |
| [19] | Draths KM, Frost JW. Environmentally compatible synthesis of adipic acid from D-glucose. Journal of the American Chemical Society, 1994, 116 : 399–400. DOI:10.1021/ja00080a057 |
| [20] | Curran KA, Leavitt JM, Karim AS, et al. Metabolic engineering of muconic acid production in Saccharomyces cerevisiae. Metabolic Engineering, 2013, 15 : 55–66. DOI:10.1016/j.ymben.2012.10.003 |
| [21] | Sun X, Lin Y, Huang Q, et al. A novel muconic acid biosynthesis approach by shunting tryptophan biosynthesis via anthranilate. Applied and Environmental Microbiology, 2013, 79 : 4024–4030. DOI:10.1128/AEM.00859-13 |
| [22] | Sun X, Lin Y, Yuan Q, et al. Biological production of muconic acid via a prokaryotic 2, 3-dihydroxybenzoic acid decarboxylase. ChemSusChem, 2014, 7 : 2478–2481. DOI:10.1002/cssc.201402092 |
| [23] | Zhang H, Pereira B, Li Z, et al. Engineering Escherichia coli coculture systems for the production of biochemical products. Proceedings of the National Academy of Sciences, 2015, 112 : 8266–8271. DOI:10.1073/pnas.1506781112 |
| [24] | Johnson CW, Salvachúa D, Khanna P, et al. Enhancing muconic acid production from glucose and lignin-derived aromatic compounds via increased protocatechuate decarboxylase activity. Metabolic Engineering Communications, 2016, 3 : 111–119. DOI:10.1016/j.meteno.2016.04.002 |
| [25] | Skjoedt ML, Snoek T, Kildegaard KR, et al. Engineering prokaryotic transcriptional activators as metabolite biosensors in yeast. Nature Chemical Biology, 2016, 12 : 951–958. DOI:10.1038/nchembio.2177 |
| [26] | Vogt T. Phenylpropanoid biosynthesis. Molecular Plant, 2010, 3 : 2–20. DOI:10.1093/mp/ssp106 |
| [27] | Luo Y, Li B, Liu D, et al. Engineered biosynthesis of natural products in heterologous hosts. Chemical Society Reviews, 2015, 44 : 5265–5290. DOI:10.1039/C5CS00025D |
| [28] | Wang J, Guleria S, Koffas MAG, et al. Microbial production of value-added nutraceuticals. Current Opinion in Biotechnology, 2016, 37 : 97–104. DOI:10.1016/j.copbio.2015.11.003 |
| [29] | Ro DK, Douglas CJ. Reconstitution of the entry point of plant phenylpropanoid metabolism in yeast(Saccharomyces cerevisiae)IMPLICATIONS FOR CONTROL OF METABOLIC FLUX INTO THE PHENYLPROPANOID PATHWAY. Journal of Biological Chemistry, 2004, 279 : 2600–2607. DOI:10.1074/jbc.M309951200 |
| [30] | Vannelli T, Qi W, Sweigard J, et al. Production of p-hydroxycinna-mic acid from glucose in Saccharomyces cerevisiae and Escherichia coli by expression of heterologous genes from plants and fungi. Metabolic Engineering, 2007, 9 : 142–151. DOI:10.1016/j.ymben.2006.11.001 |
| [31] | Kang SY, Choi O, Lee JK, et al. Artificial biosynthesis of phenylpr-opanoic acids in a tyrosine overproducing Escherichia coli strain. Microbial Cell Factories, 2012, 11 : 1. DOI:10.1186/1475-2859-11-1 |
| [32] | Prasad NR, Karthikeyan A, Karthikeyan S, et al. Inhibitory effect of caffeic acid on cancer cell proliferation by oxidative mechanism in human HT-1080 fibrosarcoma cell line. Molecular and Cellular Biochemistry, 2011, 349 : 11–19. DOI:10.1007/s11010-010-0655-7 |
| [33] | Chao P, Hsu C, Yin M. Anti-inflammatory and anti-coagulatory activities of caffeic acid and ellagic acid in cardiac tissue of diabetic mice. Nutrition & Metabolism, 2009, 6 : 1. |
| [34] | Olthof MR, Hollman PCH, Katan MB. Chlorogenic acid and caffeic acid are absorbed in humans. The Journal of Nutrition, 2001, 131 : 66–71. |
| [35] | Kim JH, Campbell BC, Yu J, et al. Examination of fungal stress response genes using Saccharomyces cerevisiae as a model system:targeting genes affecting aflatoxin biosynthesis by Aspergillus flavus link. Applied Microbiology and Biotechnology, 2005, 67 : 807–815. DOI:10.1007/s00253-004-1821-1 |
| [36] | Kim YH, Kwon TW, Yang HJ, et al. Gene engineering, purification, crystallization and preliminary X-ray diffraction of cytochrome P450 p-coumarate-3-hydroxylase(C3H), the Arabidopsis membrane protein. Protein Expression and Purification, 2011, 79 : 149–155. DOI:10.1016/j.pep.2011.04.013 |
| [37] | Berner M, Krug D, Bihlmaier C, et al. Genes and enzymes involved in caffeic acid biosynthesis in the actinomycete Saccharothrix espanaensis. Journal of Bacteriology, 2006, 188 : 2666–2673. DOI:10.1128/JB.188.7.2666-2673.2006 |
| [38] | Louie TM, Xie XS, Xun L. Coordinated production and utilization of FADH2 by NAD(P)H-flavin oxidoreductase and 4-hydroxyphenylacetate 3-monooxygenase. Biochemistry, 2003, 42 : 7509–7517. DOI:10.1021/bi034092r |
| [39] | Soulimane T, O’Kane SR, Kolaj O. Isolation and purification of Thermus thermophilus HpaB by a crystallization approach. Acta Crystallographica Section F:Structural Biology and Crystallization Communications, 2010, 66 : 352–356. |
| [40] | Thotsaporn K, Sucharitakul J, Wongratana J, et al. Cloning and expression of p-hydroxyphenylacetate 3-hydroxylase from Acinetobacter baumannii:evidence of the divergence of enzymes in the class of two-protein component aromatic hydroxylases. Biochimica et Biophysica Acta(BBA)-Gene Structure and Expression, 2004, 1680 : 60–66. DOI:10.1016/j.bbaexp.2004.08.003 |
| [41] | Arias-Barrau E, Sandoval á, Naharro G, et al. A two-component hydroxylase involved in the assimilation of 3-hydroxyphenyl acetate in Pseudomonas putida. Journal of Biological Chemistry, 2005, 280 : 26435–26447. DOI:10.1074/jbc.M501988200 |
| [42] | Furuya T, Kino K. Catalytic activity of the two-component flavin-dependent monooxygenase from Pseudomonas aeruginosa toward cinnamic acid derivatives. Applied Microbiology and Biotechnology, 2014, 98 : 1145–1154. DOI:10.1007/s00253-013-4958-y |
| [43] | Huang Q, Lin Y, Yan Y. Caffeic acid production enhancement by engineering a phenylalanine over-producing Escherichia coli strain. Biotechnology and Bioengineering, 2013, 110 : 3188–3196. DOI:10.1002/bit.v110.12 |
| [44] | Sun J, Lin Y, Shen X, et al. Aerobic biosynthesis of hydrocinnamic acids in Escherichia coli with a strictly oxygen-sensitive enoate reductase. Metabolic Engineering, 2016, 35 : 75–82. DOI:10.1016/j.ymben.2016.02.002 |
| [45] | Vargas-Tah A, Martínez LM, Hernández-Chávez G, et al. Production of cinnamic and p-hydroxycinnamic acid from sugar mixtures with engineered Escherichia coli. Microbial Cell Factories, 2015, 14 : 1. DOI:10.1186/s12934-014-0183-3 |
| [46] | Yao Y, Wang C, Qiao J, et al. Metabolic engineering of Escherichia coli for production of salvianic acid A via an artificial biosynthetic pathway. Metabolic Engineering, 2013, 19 : 79–87. DOI:10.1016/j.ymben.2013.06.001 |
| [47] | Bloch SE, Schmidt-Dannert C. Construction of a chimeric biosynthetic pathway for the de novo biosynthesis of rosmarinic acid in Escherichia coli. ChemBioChem, 2014, 15 : 2393–2401. DOI:10.1002/cbic.201402275 |
| [48] | Kim BG, Jung WD, Mok H, et al. Production of hydroxycinnamoyl-shikimates and chlorogenic acid in Escherichia coli:production of hydroxycinnamic acid conjugates. Microbial Cell Factories, 2013, 12 : 1. DOI:10.1186/1475-2859-12-1 |
| [49] | Yan Y, Kohli A, Koffas MAG. Biosynthesis of natural flavanones in Saccharomyces cerevisiae. Applied and Environmental Microbiology, 2005, 71 : 5610–5613. DOI:10.1128/AEM.71.9.5610-5613.2005 |
| [50] | Miyahisa I, Kaneko M, Funa N, et al. Efficient production of(2S)-flavanones by Escherichia coli containing an artificial biosynthetic gene cluster. Applied Microbiology and Biotechnology, 2005, 68 : 498–504. DOI:10.1007/s00253-005-1916-3 |
| [51] | Koopman F, Beekwilder J, Crimi B, et al. De novo production of the flavonoid naringenin in engineered Saccharomyces cerevisiae. Microbial Cell Factories, 2012, 11 : 1. DOI:10.1186/1475-2859-11-1 |
| [52] | Leonard E, Yan Y, Fowler ZL, et al. Strain improvement of recombinant Escherichia coli for efficient production of plant flavonoids. Molecular Pharmaceutics, 2008, 5 : 257–265. DOI:10.1021/mp7001472 |
| [53] | Leonard E, Lim KH, Saw PN, et al. Engineering central metabolic pathways for high-level flavonoid production in Escherichia coli. Applied and Environmental Microbiology, 2007, 73 : 3877–3886. DOI:10.1128/AEM.00200-07 |
| [54] | Wu J, Yu O, Du G, et al. Fine-tuning of the fatty acid pathway by synthetic antisense RNA for enhanced(2S)-naringenin production from L-tyrosine in Escherichia coli. Applied and Environmental Microbiology, 2014, 80 : 7283–7292. DOI:10.1128/AEM.02411-14 |
| [55] | Yang Y, Lin Y, Li L, et al. Regulating malonyl-CoA metabolism via synthetic antisense RNAs for enhanced biosynthesis of natural products. Metabolic Engineering, 2015, 29 : 217–226. DOI:10.1016/j.ymben.2015.03.018 |
| [56] | Wu J, Zhou T, Du G, et al. Modular optimization of heterologous pathways for de novo synthesis of(2S)-naringenin in Escherichia coli[J]. PLoS One, 2014, 9:e101492. |
| [57] | Lin Y, Shen X, Yuan Q, et al. Microbial biosynthesis of the anticoagulant precursor 4-hydroxycoumarin. Nature Communications, 2013, 4 : 2603. |
| [58] | Lin Y, Yan Y. Biotechnological production of plant-specific hydroxylated phenylpropanoids. Biotechnology and Bioengineering, 2014, 111 : 1895–1899. DOI:10.1002/bit.25237 |
| [59] | Murray RDH, Méndez J, Brown SA. The natura, coumarins:Occurrence, Chemistry and Biochemistry[M]. 1982. |
| [60] | Lin Y, Sun X, Yuan Q, et al. Combinatorial biosynthesis of plant-specific coumarins in bacteria. Metabolic Engineering, 2013, 18 : 69–77. DOI:10.1016/j.ymben.2013.04.004 |
| [61] | Furuya T, Kino K. Regioselective synthesis of piceatannol from resveratrol:Catalysis by two-component flavin-dependent monooxygenase HpaBC in whole cells. Tetrahedron Letters, 2014, 55 : 2853–2855. DOI:10.1016/j.tetlet.2014.03.076 |
| [62] | Jones JA, Collins SM, Vernacchio VR, et al. Optimization of naringenin and p-coumaric acid hydroxylation using the native E. coli hydroxylase complex, HpaBC[J]. Biotechnology Progress, 2016, 32(1):21-25. |
| [63] | Carrizzo A, Forte M, Damato A, et al. Antioxidant effects of resveratrol in cardiovascular, cerebral and metabolic diseases. Food and Chemical Toxicology, 2013, 61 : 215–226. DOI:10.1016/j.fct.2013.07.021 |
| [64] | Hsu S, Huang S, Chen A, et al. Resveratrol increases anti-aging Klotho gene expression via the activating transcription factor 3/c-Jun complex-mediated signaling pathway. The International Journal of Biochemistry & Cell Biology, 2014, 53 : 361–371. |
| [65] | Lissa D, Senovilla L, Rello-Varona S, et al. Resveratrol and aspirin eliminate tetraploid cells for anticancer chemoprevention. Proceedings of the National Academy of Sciences, 2014, 111 : 3020–3025. DOI:10.1073/pnas.1318440111 |
| [66] | Beekwilder J, Wolswinkel R, Jonker H, et al. Production of resveratrol in recombinant microorganisms. Applied and Environmental Microbiology, 2006, 72 : 5670–5672. DOI:10.1128/AEM.00609-06 |
| [67] | Zhang Y, Li S, Li J, et al. Using unnatural protein fusions to engineer resveratrol biosynthesis in yeast and mammalian cells. Journal of the American Chemical Society, 2006, 128 : 13030–13031. DOI:10.1021/ja0622094 |
| [68] | Sydor T, Schaffer S, Boles E. Considerable increase in resveratrol production by recombinant industrial yeast strains with use of rich medium. Applied and Environmental Microbiology, 2010, 76 : 3361–3363. DOI:10.1128/AEM.02796-09 |
| [69] | Lim CG, Fowler ZL, Hueller T, et al. High-yield resveratrol production in engineered Escherichia coli. Applied and Environmental Microbiology, 2011, 77 : 3451–3460. DOI:10.1128/AEM.02186-10 |
| [70] | Byerley W, Judd LL, Reimherr FW, et al. 5-Hydroxytryptophan:a review of its antidepressant efficacy and adverse effects. Journal of Clinical Psychopharmacology, 1987, 7 : 127–137. |
| [71] | Lin Y, Sun X, Yuan Q, et al. Engineering bacterial phenylalanine 4-hydroxylase for microbial synthesis of human neurotransmitter precursor 5-hydroxytryptophan. ACS Synthetic Biology, 2014, 3 : 497–505. DOI:10.1021/sb5002505 |
| [72] | Sun X, Lin Y, Yuan Q, et al. Precursor-directed biosynthesis of 5-hydroxytryptophan using metabolically engineered E. coli[J]. ACS Synthetic Biology, 2014, 4:554-558. |
| [73] | Han Y, Je JH, Kim SH, et al. Gastrodia elata shows neuroprotective effects via activation of PI3K signaling against oxidative glutamate toxicity in HT22 cells. The American Journal of Chinese Medicine, 2014, 42 : 1007–1019. DOI:10.1142/S0192415X14500633 |
| [74] | Jung JW, Yoon BH, Oh HR, et al. Anxiolytic-like effects of Gastrodia elata and its phenolic constituents in mice. Biological and Pharmaceutical Bulletin, 2006, 29 : 261–265. DOI:10.1248/bpb.29.261 |
| [75] | Ahn EK, Jeon HJ, Lim EJ, et al. Anti-inflammatory and anti-angiogenic activities of Gastrodia elata Blume. Journal of Ethnopharmacology, 2007, 110 : 476–482. DOI:10.1016/j.jep.2006.10.006 |
| [76] | Bai Y, Yin H, Bi H, et al. De novo biosynthesis of Gastrodin in Escherichia coli. Metabolic Engineering, 2016, 35 : 138–147. DOI:10.1016/j.ymben.2016.01.002 |
| [77] | Ahmadi MK, Fang L, Moscatello N, et al. E. coli metabolic engineering for gram scale production of a plant-based anti-inflammatory agent[J]. Metabolic Engineering, 2016, 38:382-388. |