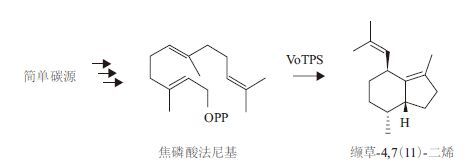
缬草-4,7(11) -二烯[valerian -4,7(11) - diene]是一种可挥发性的倍半萜烯类化合物,具有高度的镇静作用[1]。其主要存在于甘松属植物(Nardostachys chinensis)及缬草属植物(Valeriana officinalis)的根部中[2],这些植物的根部提取物常被古希腊、古罗马及古代亚洲国家用作镇静剂及抗焦虑药物[3]。缬草的根部提取物缬草油中主要含有单萜、倍半萜、环烯醚萜衍生物、生物碱如猕猴桃碱等,其中所含的缬草-4,7(11) -二烯的衍生物缬草烯酸也有镇静作用[4-7]。甘松属植物提取的甘松精油一直以来常被芳香疗法使用,可缓解日常压力带来的身体紊乱症状,如失眠、消化不良等[8]。在甘松精油中富含缬草-4,7(11) -二烯,其镇静作用已经在实验鼠身上得到证实[9]。常用的镇静剂主要是抗焦虑和精神抑制药,具有易产生药物依赖的副作用[10, 11]。缬草-4,7(11) -二烯作为植物提取成分,由于其在常温下的挥发性可使用吸入式给药的方式,很有希望发展成为更小副作用的治疗药剂,用来治疗注意力缺陷多动症(ADHD)等精神疾病。目前,缬草-4,7(11) -二烯主要通过化学方法来合成,如以缬草烯酸为原料,通过还原、溴化等步骤实现合成[12]。然而,这种化学合成的方法原料成本高,易造成环境污染。利用微生物合成萜类的方法将会有效避免化学合成中复杂条件的控制以及环境污染等问题[13]。从缬草属植物的根中鉴定缬草-4,7(11) -二烯合酶基因(VoTPS)功能,并在酵母中表达,在实现缬草-4,7(11) -二烯的合成之前已有报道[1]。大肠杆菌由于其遗传背景清晰,遗传操作技术简单,易于大规模化液体发酵生产,作为天然化合物的异源合成宿主越来越受到重视。之前已经有报道在大肠杆菌中成功实现萜类物质紫衫烯、香叶醇、木香烃内酯等化合物的合成[14-17]。缬草-4,7(11) -二烯在大肠杆菌中合成尚未见报道。本研究在大肠杆菌中增强焦磷酸法尼基合成的基础上,采用质粒pET28a过表达来源于缬草属植物(Valeriana officinalis)的缬草-4,7(11) -二烯合酶(VoTPS)基因,进行缬草-4,7(11) -二烯在大肠杆菌中异源合成研究,并进行液体发酵及萃取条件的初步探索,以期实现缬草-4,7(11) -二烯在大肠杆菌中的高效合成。本研究所构建合成途径如图 1所示。
|
| 图 1 缬草-4,7(11)-二烯合成途径 |
大肠杆菌DH5α及BL21(DE3) 由本实验室保存,DH5α用于质粒的扩增及基因克隆,BL21(DE3) 用于蛋白的过表达及合成缬草-4,7(11) -二烯。质粒pET28a购于Novagen公司,质粒pBbA5c-M-M[pBbA5c-MevT(CO)-MBIS(CO,ispA)]由Jay Keasling实验室构建并赠与。
1.1.2 试剂及培养基Phusion超保真DNA聚合酶购自New England Biolabs公司;限制性内切酶Hind Ⅲ、Nco Ⅰ购自Fermentas公司;T4连接酶购自TaKaRa Biotechnology公司;异丙基-β-D-硫代半乳糖苷(IPTG)购自北京索莱宝生物科技有限公司;正十二烷、正癸烷、正己烷购自天津科密欧化学试剂有限公司。
LB培养基:酵母粉5 g/L,胰蛋白胨10 g/L,NaCl 10 g/L,用于质粒的构建、扩增、种子液的准备。发酵培养基:酵母粉10 g/L,胰蛋白胨16 g/L,NaCl 5 g/L,甘油2%(W/V),用于蛋白质的过表达,及发酵生产缬草-4,7(11) -二烯。适量的抗生素:氯霉素25 μg/mL,卡那霉素50 μg/mL。
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE):浓缩胶(4 mL):H2O 2.7 mL,30%丙烯酰胺 0.67 mL,1 mol/L Tris-HCl(pH6.8) 0.5 mL,10% SDS 0.04 mL,10%过硫酸铵 0.04 mL,TEMED 0.004 mL;分离胶(10 mL):H2O 3.3 mL,30%丙烯酰胺 4 mL,1.5 mol/L Tris-HCl(pH8.8) 2.5 mL,10% SDS 0.1 mL,10%过硫酸铵 0.1 mL,TEMED 0.004 mL。
1.2 方法 1.2.1 基因扩增VoTPS(GenBank accession number:JQ437840) 来自缬草属植物(Valeriana officinalis),由上海捷瑞公司合成,为了在大肠杆菌中使用进行了密码子优化,用VoTPSsyn来表示。合成的VoTPSsyn基因片段被克隆到DEV载体,由捷瑞公司构建成载体DEV-VoTPS。用此载体作为PCR模板;PCR引物为VoTPS-NcoI5FP:5'-CCCccatggaatcttgtctgagcttttctagtc-3'(下划线为Nco I酶切位点),VoTPS-Hind Ⅲ 3RP:5'-CATGaagcttggtaccccgcggttaatacggaactg-3'(下划线为Hind Ⅲ酶切位点)。PCR参数:95℃ 2 min;95℃ 20 s,58℃ 20 s,72℃ 1.5 min,共30个循环;72℃ 10 min。凝胶电泳回收目的片段。
1.2.2 质粒及重组菌构建以限制性内切酶和Nco I和Hind Ⅲ对pET28a质粒和VoTPSsyn分别进行酶切;通过凝胶电泳回收载体及基因片段;以载体与基因片段摩尔数比为1∶3进行连接,转化大肠杆菌DH5α,获得质粒pET28a-VoTPS。将质粒pBbA5c-M-M转化至大肠杆菌BL21(DE3) ,获得重组菌BL21(DE3) /MM。将质粒pET28a-VoTPS与pBbA5c-M-M共转化至大肠杆菌BL21(DE3) ,获得重组菌BL21(DE3) /MMV。将pET28a和pET28a-VoTPS分别转入BL21中,获得重组菌BL21(DE3) /空与获得重组菌BL21(DE3) /V。
1.2.3 SDS-PAGE检测蛋白表达分别挑取BL21(DE3) /空与BL21(DE3) /V菌株单克隆于5 mL液体LB中,37℃培养12 h;按体积比1∶100 转接至50 mL液体发酵培养基,37℃培养至OD600为0.7-1.0,加入终浓度0.5 mmol/L的IPTG于30℃进行蛋白诱导6-8 h,收集发酵液2 mL,12 000 r/min离心10 min;加入200 μL的5×loading buffer,沸水浴10 min,12 000 r/min离心10 min,上样量5 μL。
1.2.4 重组菌发酵培养挑取BL21/MMV菌株单克隆于5 mL液体LB中,37℃培养12 h;按体积比为1∶100转接至50 mL液体发酵培养基中,37℃培养至OD600为0.7-1.0,加入终浓度0.5 mmol/L的IPTG于30℃进行蛋白诱导,再加入5 mL的正十二烷进行双相培养基发酵48-60 h。
1.2.5 缬草-4,7(11)-二烯GC-MS分析鉴定 收集发酵液4 000 r/min离心10 min,取正十二烷层进行检测。GC-MS检测系统是安捷伦气相色谱仪7890A;检测条件为:安捷伦色谱柱19091S-433,30 m×250 μm×0.25 μm;起始温度设定为40℃,保留时间2 min,以10℃/min的线性增长速率升温到250℃,保留时间5 min;进样口温度为250℃,进样量1 μL。检测有5 min的溶剂延迟。
1.2.6 发酵条件优化蛋白诱导温度优化:按1.2.4所述方法进行发酵培养,其中蛋白诱导温度分别设置20℃、30℃和37℃;IPTG浓度优化:按1.2.4中所述方法进行发酵培养,其中IPTG终浓度分别0.1、0.5和1 mmol/L;有机相的选择:按1.2.4中所述方法进行发酵培养,其中加入的5 mL有机相分别为正十二烷、正癸烷、正己烷。以优化后的条件进行培养,发酵结束后取有机相进行检测。
2 结果 2.1 载体pET28a-VoTPS的构建及验证扩增得到VoTPSsyn片段大小为1.7 kb(图 2-A)。重组载体pET28a-VoTPS用Hind Ⅲ和Nco I酶切验证,得到大小为1.7 kb和5.3 kb两条带(图 2-B),与理论大小一致,并送金唯智测序公司进行了DNA测序验证。质粒pET28a-VoTPS如图 2-C所示。

|
| 图 2 载体pET28a-VoTPS构建 A:M:DNA Marker;1:VoTPSsyn的PCR产物;B:2:载体pET28a-VoTPS Hind Ⅲ/Nco Ⅰ双酶切;C:载体pET28a-VoTPS |
BL21(DE3) /空与BL21(DE3) /V菌株按照1.2.3的方法发酵并诱导蛋白,制备样品,进行蛋白胶电泳,染色,脱色后的SDS-PAGE如图 3所示。

|
| 图 3 BL21(DE3)/空与BL21(DE3)/V的SDS-PAGE检测图 M:蛋白 Marker;1:BL21(DE3)/空总蛋白;2:BL21(DE3)/V总蛋白 |
质粒载体pBbA5c-M-M[pBbA5c-MevT(CO)-MBIS(CO,ispA)]内含有的8个基因,在大肠杆菌中过表达后,可增强乙酰辅酶A经甲羟戊酸途径转变成焦磷酸法尼基;第一部分使乙酰辅酶A转变成甲羟戊酸的3个基因为:大肠杆菌来源的乙酰乙酰辅酶A合酶基因(atoB),酵母来源的羟甲基戊二酸单酰辅酶A(HMG-CoA)合酶基因(HMGS)和氨基端被截短的羟甲基戊二酸单酰辅酶A还原酶基因(HMGR)。第二部分使甲羟戊酸转变为焦磷酸法尼基的5个基因为:来自酵母的甲羟戊酸激酶基因(MK)、磷酸甲羟戊酸激酶基因(PMK)、磷酸甲羟戊酸脱羧酶基因(PMD),来自大肠杆菌的异戊烯焦磷酸异构酶基因(idi)和焦磷酸法尼基合酶基因(ispA)。
将载体pET28a-VoTPS与pBbA5c-M-M共转化至BL21(DE3) 中,获得缬草-4,7(11) -二烯工程菌株BL21(DE3) /MMV。pBbA5c-M-M转化至BL21(DE3) 中,获得产焦磷酸法尼基工程菌株BL21(DE3) /MM,作为BL21(DE3) /MMV的对照。
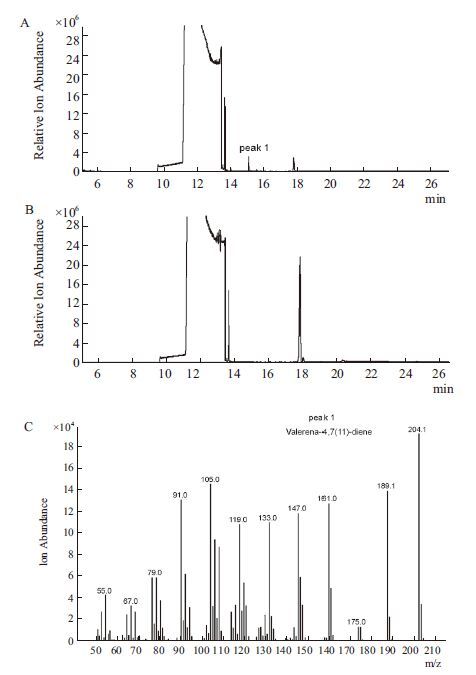
2.4 发酵液正十二烷层中缬草-4,7(11) -二烯GC-MS检测及鉴定对重组菌BL21(DE3) /MMV及BL21(DE3) /MM进行发酵培养,分别取60 h的发酵液正十二烷层进行GC-MS检测,图 4显示,在15.101 min处有新化合物的产生。缬草-4,7(11) -二烯分子量为204,GC-MS检测结果显示15.101 min主要碎片峰也为204,与已经报道的缬草-4,7(11) -二烯质谱图作对照,确定该峰对应的化合物为缬草-4,7(11) -二烯。
|
| 图 4 工程菌发酵液正十二烷层GC-MS A:BL21(DE3)/MMV发酵液GC图谱;B:对照BL21(DE3)/MM发酵液GC图谱;C:工程菌株BL21(DE3)/MMV产生的缬草-4,7(11)-二烯的GC-MS图谱 |
为进一步提高缬草-4,7(11) -二烯的产量,选择更合适的发酵条件,本研究对蛋白诱导温度、IPTG浓度和有机相的选取进行了单因素优化筛选。当蛋白诱导温度为20℃时,缬草-4,7(11) -二烯GC-MS响应信号的产物峰最面积最大为30℃的200多倍且前体FPP几乎转化完全,当诱导温度为37℃时,几乎没有检测到产物的生成(图 5-A);当IPTG浓度为0.1 mmol/L时,缬草-4,7(11) -二烯GC-MS响应信号的产物峰面积最大,并且随着IPTG浓度增大,产物量减少(图 5-B);当有机相为十二烷时,缬草-4,7(11) -二烯GC-MS响应信号的产物峰面积最大,且相较于正癸烷萃取出的副产物较少。在加入正己烷的一组中菌体细胞生长停滞进而死亡,正己烷几乎挥发完全,无法进行检测(图 5-C)。

|
| 图 5 缬草-4,7(11)-二烯发酵条件初步优化 A:20℃、30℃、37℃三种不同蛋白诱导温度的产物峰面积及30℃、37℃放大图;B:0.1、0.5、1 mmol/L三种不同IPTG浓度的产物峰面积;C:正己烷、正癸烷、正十二烷三种不同有机相的产物峰面积 |
本研究在大肠杆菌BL21(DE3) 中成功表达了缬草-4,7(11) -二烯合酶(VoTPS)基因及合成FPP的酵母源的8个基因,实现了在大肠杆菌中从头生物合成缬草-4,7(11) -二烯,并初步确定了合适发酵的条件。由于缬草-4,7(11) -二烯具有挥发性,使用水相及有机相的双相培养基进行发酵,可在有机相正十二烷层检测到缬草-4,7(11) -二烯生成。有机相十二烷对产物有吸附作用,可减少挥发,有利于产物的检测;与之对照的未加十二烷的单水相发酵液中使用高效液相色谱(HPLC)并未检测到缬草-4,7(11) -二烯生成,也说明了双相发酵的必要性。但目前对有机相中的缬草-4,7(11) -二烯后续的分离纯化条件及定量[19]还需进行摸索。
VoTPS基因来源于缬草属植物,本研究中仅对其DNA序列进行密码子的优化,为了使蛋白在大肠杆菌中更好地异源表达,进行了诱导剂IPTG浓度和蛋白诱导温度的优化,初步确定了更合适的蛋白诱导条件,即蛋白诱导温度为20℃、IPTG的浓度为0.1 mmol/L,未来工作中还可以通过提高蛋白的可溶性等方面来提高蛋白的表达及活性[20],从而进一步提高其产量。另外选择了不同的有机相作为萃取剂,萃取效果最好的为正十二烷,并且萃取出的副产物较少。当加入的有机相为正己烷时,菌体生长停滞进而死亡,推测可能正己烷对菌体细胞具有毒性,发酵结束后正己烷几乎挥发完全,所以正己烷不适合做双相发酵的有机相;后续还可以进行发酵培养基水相成分的优化[21],继续筛选不影响对菌体生长且更易吸附缬草-4,7(11) -二烯的有机相。
缬草-4,7(11) -二烯的衍生物缬草烯酸(val-erenic acid)也具有与缬草-4,7(11) -二烯相似的抗焦虑的药用价值[22],其作用靶点和作用方式研究的更为透彻[23, 24]。在缬草属植物(Valeriana officinalis)中,缬草烯酸的合成路径及相关的酶尚未鉴定清楚,但推测缬草烯酸是由缬草-4,7(11) -二烯经过氧化合成的[1]。本研究也曾尝试在重组菌BL21(DE3) /MMV的基础上表达来自菊苣属(Cichorium intybus)的吉玛烯A氧化酶(germacrene A oxidase)基因CiGAO和来自蒿属(Artemisia annua)的细胞色素P450还原酶基因AaCPR[25, 26],希望在缬草-4,7(11) -二烯的基础上继续合成缬草烯酸,但并未在发酵液中检测到缬草烯酸的生成。在后续的研究中从缬草属植物中发掘合成缬草烯酸的氧化酶也是一个重要的研究方向。
4 结论本研究在大肠杆菌中表达了酵母及缬草属植物来源的9个外源基因,构建了缬草-4,7(11) -二烯生物合成途径,使用气相色谱检测并鉴定了产物缬草-4,7(11) -二烯的生成。
| [1] | Bryan WP, Hue TT, Benjamin P, et al. Enzymatic synthesis of valerena-4, 7(11)-diene by a unique sesquiterpene synthase from the valerian plant(Valeriana officinalis). FEBS Journal, 2012, 279 : 3136–3146. DOI:10.1111/j.1742-4658.2012.08692.x |
| [2] | Takemoto H, Omameuda Y, Ito M, et al. Inhalation administration of Valerena-4, 7(11)-diene from Nardostachys chinensis roots ameliorates restraint stress-induced changes in murine behavior and stress-related factors. Biol Pharm Bull, 2014, 37 : 1050–1055. DOI:10.1248/bpb.b14-00136 |
| [3] | Houghton PJ. The scientific basis for the reputed activity of Valerian. Pharm Pharmacol, 1999, 51 : 505–512. DOI:10.1111/(ISSN)2042-7158 |
| [4] | Letchamo W, Ward W, Heard B, et al. Essential oil of Valeriana officinalis L. cultivars and their antimicrobial activity as influenced by harvesting time under commercial organic cultivation. AgricFood Chem, 2004, 52 : 3915–3919. DOI:10.1021/jf0353990 |
| [5] | Wang Y, Jin L, Yu S, et al. Chemical constituents of plants from the genus Valeriana. Mini Rev Org Chem, 2010, 7 : 161–172. DOI:10.2174/157019310791065537 |
| [6] | Bos R, Woerdenbag HJ, et al. Composition of the essential oils from underground parts of Valeriana officinalis L. and several closely related taxa. Flavour Fragr, 1997, 12 : 359–370. DOI:10.1002/(ISSN)1099-1026 |
| [7] | Khom S, Strommer B, Ramharter J, et al. Valerenic acid derivatives as novel subunit-selective GABAA receptor ligands- in vitro and in vivo characterization. Br J Pharmacol, 2010, 161 : 65–78. DOI:10.1111/j.1476-5381.2010.00865.x |
| [8] | Post RM. Transduction of psychosocial stress into the neurobiology of recurrent affective disorder. Am J Psychiatry, 1992, 149 : 999–1010. DOI:10.1176/ajp.149.8.999 |
| [9] | Takemoto H, Yagura T, Ito M. Evaluation of volatile components from spikenard:valerena-4, 7(11)-diene is a highly active sedative compound. Nat Med, 2009, 63 : 380–385. DOI:10.1007/s11418-009-0340-x |
| [10] | Lader M. Anxiolytic drugs:dependence, addiction and abuse. Eur Neuropsychopharmacol, 1994, 4 : 85–91. DOI:10.1016/0924-977X(94)90001-9 |
| [11] | Vukcevi? NP, Ercegovi? GV, Segrt Z, et al. Benzodiazepine poisoning in elderly. Vojnosanit Pregl, 2016, 73 : 234–238. DOI:10.2298/VSP141208025P |
| [12] | Kitayama T, Kawabata G, Ito M. Concise synthesis of valerena-4, 7(11)-diene, a highly active sedative, from valerenic acid. Biosci Biotechnol Biochem, 2010, 74 (9): 1963–1964. DOI:10.1271/bbb.100297 |
| [13] | Chotani G, Dodge T, Hsu A, et al. The commercial production of chemicals using pathway engineering. Biochim Biophys Acta, 2000, 1543 (2): 434–455. DOI:10.1016/S0167-4838(00)00234-X |
| [14] | Edgar S, Li FS, Qiao K, et al. Engineering of Taxadiene synthase for improved selectivity and yield of a key taxol biosynthetic intermediate. ACS Synth Biol, 2016 . DOI:10.1021/acssynbio.6b00206 |
| [15] | 田宁. 利用工程大肠杆菌生物法合成香叶醇的发酵工艺研究[D] . 青岛:中国海洋大学, 2015. |
| [16] | 岳雪, 聂少振, 王素珍, 等. 合成生物学在天然药物和微生物药物开发中的应用. 中国抗生素杂志, 2016, 41(8): 568–577. |
| [17] | Yin H, Zhuang YB, Li EE, et al. Heterologous biosynthesis of costunolide in Escherichia coli and yield improvement. Biotechnol Lett, 2015, 37 : 1249–1255. DOI:10.1007/s10529-015-1784-6 |
| [18] | Peralta-Yahya PP, Ouellet M, Chan R, et al. Identification and microbial production of a terpene-based advanced biofuel. Nat Commun, 2011, 2 : 483. DOI:10.1038/ncomms1494 |
| [19] | 陈妙芬, 冯静仪, 刘秋琼, 等. GC法测定香茅中香叶醇的含量. 中国药房, 2011(31): 2950–2951. |
| [20] | 马媛媛, 何健民, 康永杰. 外源性蛋白在大肠杆菌中可溶性表达的策略综述. 世界科技研究与发展, 2015, 37(5): 627–630. |
| [21] | 田宁, 咸漠, 胡仰栋, 等. 产香叶醇重组大肠杆菌发酵培养基的优化. 林产化学与工业, 2015, 35(4): 131–137. |
| [22] | Becker A, Felgentreff F, Schröder H, et al. The anxiolytic effects of a Valerian extract is based on Valerenic acid. BMC Complementary and Alternative Medicine, 2014, 14 (1): 1–5. DOI:10.1186/1472-6882-14-1 |
| [23] | Vidal-Cantú GC, Jiménez-Hernández M, Rocha-González HI, et al. Role of 5-HT5A and 5-HT1B/1D receptors in the antinociception produced by ergotamine and valerenic acid in the rat formalin test. Eur J Pharmacol, 2016, 781 : 109–116. DOI:10.1016/j.ejphar.2016.04.009 |
| [24] | Khom S, Hintersteiner J, Luger D, et al. Analysis of β-subunit-dependent GABAA receptor modulation and behavioral effects of Valerenic acid derivatives. Journal of Pharmacology & Experimental Therapeutics, 2016, 357 (3): 580–590. |
| [25] | Liu Q, Majdi M, Cankar K, et al. Reconstitution of the costunolide biosynthetic pathway in yeast and Nicotiana benthamiana. PLoS One, 2011, 6 (8): 764–778. |
| [26] | Ikezawa N, Göpfert JC, Nguyen DT, et al. Lettuce costunolide synthase(CYP71BL2)and its homolog(CYP71BL1)from sunflower catalyze distinct regio- and stereoselective hydroxylations in sesquiterpene lactone metabolism. Journal of Biological Chemistry, 2011, 286 (24): 21601–21611. DOI:10.1074/jbc.M110.216804 |




