胚胎发育晚期丰富蛋白(Late embryonic abund-ant,简称LEA)与种子抵抗脱水有关,它伴随种子的成熟过程产生,大量积累于种子成熟后期特定阶段,在种子萌发后很快消失[1]。研究发现,LEA蛋白在种子干旱中积累,以及在干旱、低温、高温或盐胁迫等逆境导致的缺水情况下,在植物组织或生殖组织也会大量积累[2, 3]。
脱水素是LEA中的第Ⅱ类蛋白,是LEA家族最具特色的一组[4],几乎在所有的种子植物、苔藓植物和石松属植物中都发现了脱水素的存在[5]。近年来,许多研究已经证实在非生物胁迫下,植物脱水素的表达与积累和植物抗逆性之间存在正相关的关系[3, 6]。
内含子是真核生物基因组中的独特成分,在基因演变过程中起着重要的作用。目前,内含子研究无论是在基因组学、分子进化和分子系统学领域,还是在转基因工程技术研究中都展现出愈来愈广阔的前景[7];同时,内含子对真核生物基因表达的调控越来越受到人们的重视[8]。然而,专门研究植物内含子结构及功能的文献很有限。Jiménez-Bremont等[9]对单子叶和双子叶植物脱水素基因内含子特性进行了系统比较,发现大多数SKn型脱水素含有一个内含子,该内含子在位置上是保守的,并且此内含子与编码S-motif的核苷酸序列有关。本实验室之前用差减杂交技术从强抗旱、寒沙漠豆科植物沙冬青中克隆获得AmCIP基因cDNA序列,生物信息学分析表明,该基因属于脱水素基因[10],转基因表明AmCIP能够提高大肠杆菌和烟草对低温胁迫的抗性[11]。而AmCIP基因DNA序列结构和功能进化特征缺少研究。
本文在前期研究工作的基础上,利用PCR克隆获得AmCIP基因的全长DNA序列,通过生物信息学分析该基因结构和内含子序列,以及5'非编码区序列、3'非编码区序列,旨在为进一步揭示沙冬青AmCIP基因对非生物胁迫的响应机制提供资料。
1 材料与方法 1.1 材料沙冬青种子采自内蒙古阿拉善荒漠地区。DNA Marker DL15000和离心柱型琼脂糖凝胶回收试剂盒购自北京天根公司,Taq DNA Polymerase和T4 DNA连接酶购自TaKaRa公司,Promega pGEM-T vector 购自Promega公司,引物由北京奥科鼎盛生物科技有限公司合成。
1.2 方法 1.2.1 沙冬青总DNA的提取培养沙冬青幼苗所用基质为珍珠岩,播种后,每3 d浇水1次,当沙冬青生长14 d后,以幼苗真叶为材料,以CTAB(2% CTAB、2% PVP、2 mol/L NaCl、25 mmol/L EDTA(pH=8.0)、100 mmol/L Tris-HCl(pH=8.0)、1 mol/L DTT)法提取基因组DNA。采用1%琼脂糖凝胶电泳检测DNA完整性,用NanoDrop 2000超微量分光光度计检测DNA浓度,基因组DNA置于-80℃冰箱保存备用。
1.2.2 沙冬青AmCIP编码区DNA序列克隆根据AmCIP基因的cDNA序列(GenBank登录号:AY590122.1)设计两条上游引物CDF:5'-ATAATCCTGTGCTTAAGATCAG-3'、CFE:5'-AGAATTCATGGCAGGTATCATCAACAAG-3';两条下游引物CDR:5'-ATGATTTACAACCAAAGTAGTGG-3'、CRH:5'-AAAGCTTCTAGTCACTGTCACTGCTGCTGCTG-3'。
以CDF和CDR为引物,以沙冬青基因组DNA为模板,扩增体系为20 µL:ddH2O 15.7 µL,10×PCR buffer(Mg2+ Plus)2.0 µL,10 mmol/L dNTP 0.4 µL,上下游引物各0.4 µL,模板DNA 1.0 µL,Taq DNA Polymerase 0.1 µL。PCR扩增参数为:94℃ 5 min;94℃ 30 s,52℃ 40 s,72℃ 2 min,30个循环;72℃ 15 min。以CFE和CRH为引物,以含有AmCIP基因的菌液为模板,扩增体系为20 µL:ddH2O 12.9 µL,10×PCR buffer 2.0 µL,dNTP 1.6 µL,MgCl2 1.6 µL,上下游引物各0.4 µL,菌液模板1.0 µL,Taq DNA Polymerase 0.1 µL。PCR扩增参数为:94℃ 5 min;94℃ 30 s,52℃ 40 s,72℃ 40 s,30个循环;72℃ 15 min。PCR产物经切胶回收后,经T4 DNA连接酶连接到pGEM-T载体上,转化大肠杆菌JM109感受态细胞进行蓝白斑筛选,并通过菌液PCR,将扩增条带正确的菌落保种并送北京华大基因进行测序鉴定,每个样品设3个重复。
1.2.3 序列分析利用Gene Structure Display Serv-er[12](http://gsds.cbi.pku.edu.cn/)分析外显子-内含子基因结构;使用PHYLIP3.69(http://evolution.genetics.washington.edu/phylip/getme.html)和MEGA 4.0[13]构建脱水素的系统进化树;利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)和PLACE(http://www.dna.affrc.go.jp/PLACE/signalup.html)分析AmCIP基因内含子和5'非编码区以及3'非编码区的顺式作用元件;利用Muscle软件[14]分析AmCIP蛋白质与其它脱水素的同源性;利用计算机语言Perl计算AmCIP基因各碱基的含量。
2 结果 2.1 DNA琼脂糖凝胶电泳检测利用CTAB法提取的沙冬青基因组DNA,经1%琼脂糖凝胶电泳分离,结果(图 1)显示,电泳条带单一,平直,清晰,点样孔干净。经NanoDrop 2000超微量分光光度计检测其A260/A280=1.87,浓度为995 ng/µL,说明所提取的DNA质量和浓度均符合实验的要求,可用于后续实验。
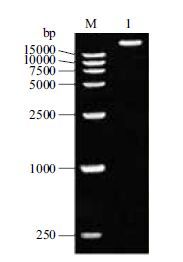
|
| 图 1 琼脂糖凝胶电泳检测沙冬青基因组DNA序列 M:DNA Marker DL15000;1:基因组DNA |
为了排除试剂的干扰,在进行PCR扩增时,做了阴性对照,即PCR反应体系里不加模板。以沙冬青基因组DNA为模板,利用引物CDF和CDR,进行PCR扩增,结果(图 2-A)显示,泳道1,在1 600 bp处有单一、清晰的电泳条带,泳道2是阴性对照,在1 600 bp处没有条带。以含有AmCIP基因的菌液为模板,以CFE和CRH为引物,PCR扩增结果如图 2-B所示,测序结果显示,扩增出来的沙冬青DNA序列全长1 548 bp(GenBank登录号:KU744005),而AmCIP cDNA序列长465 bp,编码154个氨基酸,与从AmCIP DNA序列编码区cDNA推导出的氨基酸序列同源性为100%,说明克隆得到的序列是沙冬青AmCIP基因的DNA序列。

|
| 图 2 AmCIP基因的DNA序列(A)和编码区cDNA(B)扩增结果 (A)M:DNA Marker DL2000;1:AmCIP基因DNA产物;2:阴性对照。(B)M:DNA Marker DL2000;1,2:AmCIP基因编码区cDNA产物;3-5:阴性对照 |
将沙冬青AmCIP基因的DNA序列与其cDNA序列利用Gene Structure Display Server进行比对分析得知,该基因含有2个外显子和1个内含子,外显子大小分别是85 bp和380 bp,内含子大小为78 bp,沙冬青AmCIP基因内含子5'剪切位点具有TG/GTGATT的序列,3'剪切位点具有CCATG/G的序列。
利用Gene Structure Display Server构建外显子-内含子基因结构图,结果(图 3)显示,在起始密码子ATG之前有67 bp的非编码区,即5' UTR(Untranslated Regions)区,3' UTR有938 bp。同时,利用计算机语言Perl计算,AmCIP基因序列中A+T碱基含量占64.7%,G+C碱基含量占35.3%。

|
| 图 3 AmCIP基因结构图 |
利用PlantCARE和PLACE在线软件,预测沙冬青AmCIP基因内含子和非编码区顺式作用元件,结果显示,该基因内含子具有参与厌氧诱导的类增强子元件(GC-motif,序列是CCCCCG)和光响应的部分元件(TCCC-motif,序列是TCTCCCT)。沙冬青AmCIP基因3'-UTR含有参与光响应的顺式作用元件(ACE,序列是ACTACGTTGG)、厌氧响应元件(ARE,序列是TGGTTT)、参与光响应的保守的DNA模块(Box 4,序列是ATTAAT)、光响应元件[Box Ⅰ(序列是TTTCAAA)、CATT-motif(序列是GCATTC)、GATA-motif(序列是GATAGGA)、TCT-motif(序列是TCTTAC)]、2个赤霉素响应元件(GARE-motif,序列分别是TCTGTTG和AAACAGA)、2个参与热胁迫响应的顺式作用元件(HSE,序列是AAAAAATTTC)、参与玉米蛋白新陈代谢调节的顺式调节元件(O2-site,序列是GATGATGTGG)、胚乳特异性响应元件(Skn-1_motif,序列是GTCAT)、2个胁迫防御响应元件(TC-rich repeats,序列是ATTTTCTTCA)、参与发芽特异性表达和光响应的元件(as-2-box,序列是GATAatGATG),以及14个CAAT-box(序列是CCAAT、CAAAT、CAAT、CAATT)和80个TATA-box(序列是TTTTA、TAAAGATT、TAATA、ATTA-TA、TATATAA、TATA、ATATAA、TATAAA、TT-TAAAAA、ATATAT、ATATAAT、TATAAAAT、TA-TAAAA、TATAA、TACAAAA、TAAAAATAA、TA-TAAATATAAA、TATAAATT、TATAAAT、TACAT-AAA、TATACA)。而沙冬青AmCIP基因5'-UTR只含有赤霉素响应元件(GARE-motif,序列是AAACA-GA),该序列可能在基因响应激素表达方面起作用。
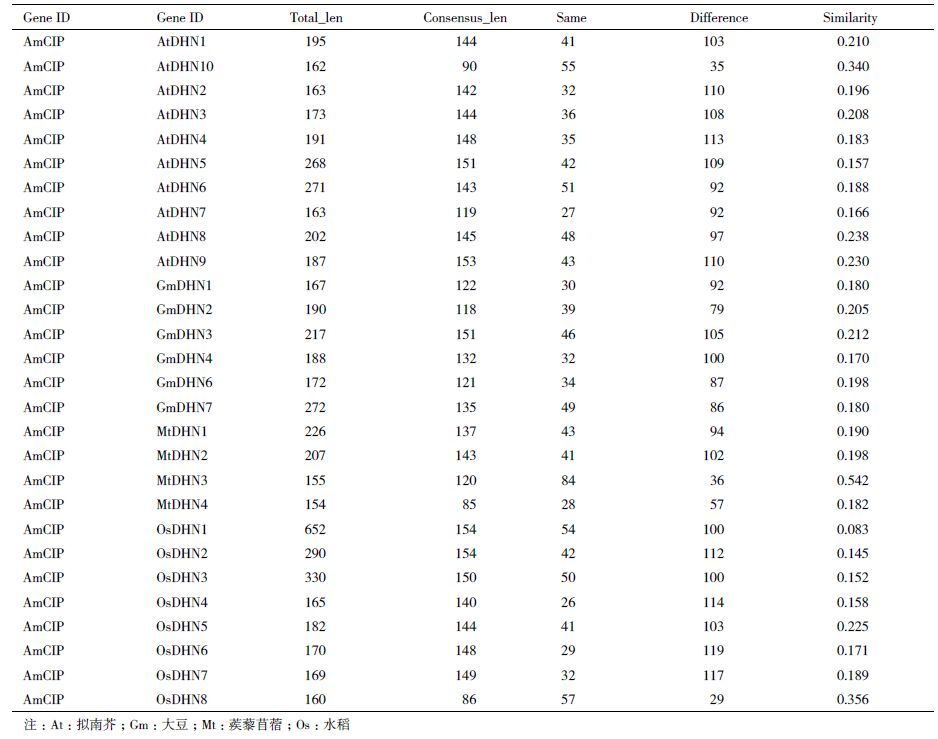
2.4 脱水素系统进化分析在Phytozome 数据库(http://www.phytozome.net/)下载拟南芥(10个)、大豆(6个)、蒺藜苜蓿(4个)和水稻(8个)脱水素基因相应的DNA、cDNA和蛋白质序列,利用PHYLIP软件构建脱水素的系统进化树,用MEGA 4.0编辑,Bootstrap值设为1 000,并利用Gene Structure Display Server分析基因外显子-内含子结构。结果(图 4)显示,脱水素系统进化树主要分为A、B、C三大分支:A分支中的脱水素基因结构主要有2个外显子和1个内含子组成,并且UTR区域的序列都比较短;B分支中的脱水素基因结构主要有2个外显子和1个内含子组成,并且3' UTR区域的序列都比较长,有6个脱水素基因只有1个外显子,没有内含子,分别是OsDHN8、AtDHN10、MtDHN3、MtDHN4、GmDHN7和AtDHN8,基因GmDHN2有3个外显子和2个内含子,但是没有UTR序列;C分支中的脱水素基因结构主要有2个外显子和1个内含子组成,并且UTR区域的序列都比较短,基因OsDHN1有11个外显子和10个内含子组成。

|
| 图 4 AmCIP蛋白质与拟南芥、大豆、蒺藜苜蓿和水稻的脱水素系统发育分析 At:拟南芥;Gm:大豆;Mt:蒺藜苜蓿;Os:水稻 |
AmCIP蛋白首先与蒺藜苜蓿(MtDHN3)聚类,其次与拟南芥(AtDHN10)聚类,再次与水稻(OsDHN8)聚类,最后与拟南芥(AtDHN3)聚类。虽然沙冬青AmCIP蛋白与蒺藜苜蓿(MtDHN3)亲缘关系最近,但是MtDHN3基因没有内含子序列,AmCIP基因的内含子大小为78 bp。
2.5 脱水素同源性分析AmCIP蛋白与拟南芥、大豆、蒺藜苜蓿和水稻脱水素的相似度,结果(表 1)显示,AmCIP蛋白与其它28个脱水素的相似度都比较低,其中与蒺藜苜蓿(MtDHN3)氨基酸序列的相似度最高,达到54.2%,其次,与水稻(OsDHN8)的相似度为35.6%,最后与拟南芥AtDHN10和AtDHN3氨基酸序列的相似度分别是34.0%和20.8%,表明进化距离较近的基因相似度高,而进化距离相对较远的基因之间,相似度比较低。
脱水素具有高度的水合能力,能够与膜脂结合,从而阻止细胞内水分过多流失,维持膜结构的水合保护体系,使生物膜和膜蛋白结构免受破坏[2, 3]。我们之前的研究表明,沙冬青AmCIP是脱水素基因,AmCIP蛋白属于稳定的亲水性蛋白[10]。在逆境下,脱水素具有稳定膜结构的作用,α-螺旋使脱水素能参与亲水和疏水的相互作用,也能使脱水素与部分变性蛋白质的疏水位点相结合,起到了类似于分子伴侣的作用,阻止蛋白质的进一步变性[2, 3],因此,沙冬青AmCIP蛋白质的特性有利于提高沙冬青的逆境耐受性。
脱水素的一个重要结构特征是它具有3类非常保守的区域:K、S和Y片段。K片段富含赖氨酸,通常位于C端,可具有1-11个重复,一般由15个氨基酸残基组成(EKKGIMDKIKEKLPG),K片段能形成双亲性的α-螺旋,这是脱水素的重要功能结构[2, 3]。许多脱水素还含有由丝氨酸残基组成的S片段,S片段的磷酸化可以使脱水素在信号肽的引导下进入细胞核[2, 3]。很多脱水素的N端还具有另一类保守区域:Y片段,它与植物和细菌分子伴侣的核酸结合位点有同源性[2, 3]。沙冬青AmCIP蛋白含有1个K片段,进一步说明沙冬青AmCIP基因是脱水素基因,在非生物胁迫下沙冬青AmCIP蛋白对抵抗多种逆境胁迫起到一定的保护作用[11]。
内含子不仅能参与结构基因转录后的再剪接,而且,有些内含子还能参与启动子启动活性和启动内含子含有的响应元件活性的调节[15]。内含子中存在一些类似增强子或其它的顺式作用元件,能增强基因表达效率[16],研究表明内含子的中部序列在基因表达调控中起着非常重要的作用[17]。小麦Group 1 LEA内含子能增强谷类植物细胞中β-葡萄糖醛酸酶基因的表达[18]。在沙冬青AmCIP基因内含子序列中含有参与厌氧诱导的类增强子元件(GC-motif)和光响应元件,这些元件可能对AmCIP基因转录表达起调控作用。Pre-RNA(precursor messenger RNA)主要由5'-UTR、外显子、内含子和3'-UTR组成,广义地说,5'-UTR和3'-UTR可以认为是内含子概念的延伸[19]。沙冬青AmCIP基因3'-UTR中存在许多个与光、胁迫和激素等响应的顺式作用元件,同时,5'-UTR含有赤霉素响应元件(GARE-motif),推测沙冬青AmCIP基因的3'-UTR和5'-UTR区域对该基因响应非生物胁迫,增强抗逆性起到非常重要的调控作用。
目前已报道的外显子-内含子连接处有AT-AC内含子[20]和GC-AG内含子[21]。沙冬青AmCIP DNA序列在外显子和内含子之间的交界处不符合第Ⅰ类内含子结构GT-AG,即5'剪辑位点具有AG/GTAAGT的保守序列,3'剪辑位点具有保守序列TGCAG/G[22],而是5'-GT......TG-3'。因此,我们推测它可能是一种新型的内含子。沙冬青AmCIP基因序列中A+T含量高达64.7%,A+T含量丰富有助于内含子的剪切效率和对剪切位点的识别[23]。
从不同物种脱水素系统进化树、外显子-内含子基因结构以及同源性分析得知,同一分支不同脱水素基因间的内含子序列长度存在很大差异,进化距离较近的基因相似度比较高,沙冬青AmCIP与蒺藜苜蓿(MtDHN3)氨基酸序列的相似度最高。
4 结论克隆得到沙冬青AmCIP基因的DNA序列,全长1 548 bp,由2个外显子和1个内含子组成。在该基因的ORF内存在一个78 bp的内含子序列,并且内含子序列中含有参与厌氧诱导的类增强子元件(GC-motif)和光响应元件,可能在启动或诱导AmCIP基因表达中起作用。该基因的3'-UTR和5'-UTR区域含有多个顺式作用元件,推测AmCIP基因的3'-UTR和5'-UTR区域对该基因响应非生物胁迫,增强抗逆性起到非常重要的作用。
| [1] | Park SC, Kim YH, Jeong JC, et al. Sweetpotato late embryogenesis abundant 14(IbLEA14)gene influences lignification and increases osmotic- and salt stress-tolerance of transgenic calli. Planta , 2011, 233 : 621–634. DOI:10.1007/s00425-010-1326-3 |
| [2] | 马杰, 刘翠芳, 李灵之, 等. 非生物胁迫下植物脱水素的研究进展. 生物学杂志 , 2012, 29 (1) : 71–74. |
| [3] | 夏惠, 林玲, 高帆, 等. 植物脱水素对多种逆境的响应. 干旱地区农业研究 , 2014, 32 (4) : 47–52. |
| [4] | Marina B, Yadira OC, Alejandro G, et al. The enigmatic LEA proteins and other hydrophilins. Plant Physiol , 2008, 148 (1) : 6–24. DOI:10.1104/pp.108.120725 |
| [5] | Laura S, Jan S, Valentina C, et al. A dehydrin gene in Physcomitrella patens is required for salt and osmotic stress tolerance. The Plant Journal , 2006, 45 : 237–249. DOI:10.1111/tpj.2006.45.issue-2 |
| [6] | Zhang YX, Wang Z, Xu J. Molecular mechanism of dehydrin in response to environmental stress in plant. Progress in Natural Science , 2007, 17 (3) : 237–246. DOI:10.1080/10020070612331343254 |
| [7] | 陈兵, 文建凡. 内含子在生物信息学研究和基因工程中的应用. 生命的化学 , 2010, 30 (1) : 59–63. |
| [8] | Emami S, Arumainayagam D, Korf L, et al. The effects of a stimulating intron on the expression of heterologous genes in Arabidopsis thaliana. Plant Biotechnology Journal , 2013, 11 (5) : 555. DOI:10.1111/pbi.2013.11.issue-5 |
| [9] | Juan FJB, Israel ML, Ana EOA, et al. LEA gene introns: is the intron of dehydrin genes a characteristic of the serine-segment?. Plant Mol Biol Rep , 2013, 31 : 128–140. DOI:10.1007/s11105-012-0483-x |
| [10] | Liu MQ, Shen X, Yin WL, et al. Functional analysis of cold-inducible cDNA clones in the legume Ammopiptanthus mongolicus. Cryoletters , 2005, 26 (4) : 213–222. |
| [11] | Shi J, Liu MQ, Chen YZ, et al. Heterologous expression of the dehydrin-like protein gene AmCIP from Ammopiptanthus mongolicus enhances viability of Escherichia coli and tobacco under cold stress. Plant Growth Regulation , 2015 . |
| [12] | Hu B, Jin JP, Guo AY, et al. GSDS 2. 0: an upgraded gene feature visualization server. Bioinformatics , 2015, 31 (8) : 1296–1297. DOI:10.1093/bioinformatics/btu817 |
| [13] | Tamura K, Dudley J, Nei M, et al. MEGA4: Molecular evolutionary genetics analysis(MEGA)software version 4. Molecular Biology & Evolution , 2007, 24 (8) : 1596–1599. |
| [14] | Edgar RC. MUSCLE: a multiple sequence alignment method with reduced time and space complexity. BMC Bioinformatics , 2004, 5 : 113. DOI:10.1186/1471-2105-5-113 |
| [15] | 李江涛, 杨世湖, 陈苗苗, 等. 内含子1、2对水稻pib基因启动子活性影响的转基因分析. 江苏农业科学 , 2012, 40 (3) : 15–19. |
| [16] | Chung BYW, Simons C, Firth AE, et al. Effect of 5′UTR introns on gene expression in Arabidopsis thaliana. BMC Genomics , 2006, 7 : 120. DOI:10.1186/1471-2164-7-120 |
| [17] | 张强, 李宏, 赵小庆, 等. 基因外显子连接序列与相应内含子序列的相互作用. 生物信息学 , 2013, 11 (3) : 172–180. |
| [18] | Nelsen NS, Marcotte WR Jr. A wheat group 1 Lea intron enhances β-glucuronidase gene expression in cereal cells. Journal Of Plant Physiology , 2000, 157 : 677–684. DOI:10.1016/S0176-1617(00)80011-5 |
| [19] | Lin SL, Miller JD, Ying SY. Intronic MicroRNA(miRNA). Journal of Biomedicine and Biotechnology , 2006 : 1–13. |
| [20] | 胡俊, 杨建红. 内含子的进化及其转录调控功能的统计分析. 计算生物学 , 2013, 3 : 21–23. |
| [21] | Thanaraj TA, Clark F. Human GC-AG alternative intron isoforms with weak donor sites show enhanced consensus at acceptor exon positions. Nucleic Acids Research , 2001, 29 (12) : 2581–2593. DOI:10.1093/nar/29.12.2581 |
| [22] | 曹军. 真核生物内含子研究进展. 生物过程 , 2011, 1 : 9–12. |
| [23] | Reddy ASN, Marquez Y, Kalyna M, et al. Complexity of the alternative splicing landscape in plants. The Plant Cell , 2013, 25 : 3657–3683. DOI:10.1105/tpc.113.117523 |