2. 南开大学生命科学学院分子微生物学与技术教育部重点实验室,天津 300071
2. Key Laboratory of Molecular Microbiology and Technology(Ministry of Education),College of Life Science,Nankai University,Tianjin 300071
微生物采油技术(microbial enhanced oil recov-ery,MEOR)发展至今已有90多年的历史,目前MEOR技术已经成功地应用于单井吞吐、调剖、降黏等方面,该技术能够经济有效地延长油田开采周期,提高近枯竭油藏的采收率[1]。在实施微生物采油技术之前通常需要对油藏内源微生物群落结构进行深入调查分析,以评价其实施微生物采油的潜力。但油藏作为“黑箱”体系,科研人员用传统培养方法所获得的微生物生态信息远不能反映油藏环境中的实际情况,无法有效获知微生物在地层中运移、群落丰度变化、菌种种群变化等参数,不能准确的对油藏内微生物提高原油采收率潜力进行评估。因此,影响微生物采油技术深入发展的主要难点是缺乏有效的采油微生物群落结构动态变化的检测评价方法[2-5]。
近年来基因组学和现代分子技术日臻成熟,逐渐渗透到有关生命科学的整个领域,也为微生物生态学提供了新的研究方法和机遇。自1985年Pace等[6]以核酸测序技术研究微生物的生态和进化问题以来,对微生物的多样性研究进入了一个新的阶段,并逐步发展形成了成型的微生物分子生态学(molecular ecological technology of microorganisms)方法和技术。变性梯度凝胶电泳(denature gradient gel electrophoresis,DGGE)是由Fischer和Lerman于1979年最先提出的用于检测DNA突变的一种电泳技术,是一种通过分离微生物基因组DNA 来研究环境样品中微生物群落的多样性及物种丰度的一种分子指纹技术[7-9],1993年,Muzyers等[10]首次将DGGE技术应用于分子微生物学研究领域,并证实了这种技术在揭示自然界微生物区系的遗传多样性和种群差异方面具有独特的优越性。近年来运用分子生物学技术对油藏微生物群落的研究已有不少报道[11-17],但如何通过分析内源微生物群落结构组成指导其菌种筛选和功能研究,仍是提高微生物采油技术有效性的关键。
本研究通过PCR-DGGE方法对渤海N油田油藏注水井和未注水井中的微生物群落结构及分布特征进行研究,分析油藏微生物功能,以期为评价目标油藏实施微生物驱油技术的可行性,定向调控油藏微生物群落以提高微生物驱油效率提供生态学依据。
1 材料与方法 1.1 材料 1.1.1 实验区块渤海N油田部分井开展注水作业,以产出液作为回注水进行循环操作,A平台原油黏度70 0-9 00 mPa.s(50 ℃ 黏度),采用注水开发;B平台原油黏度2 00 0-3 000 mPa.s(50 ℃ 黏度),采用天然能量开发。
1.1.2 水样的采集本实验主要对5口采油井的微生物群落结构进行分析,5口井分别为未注水采油井A1、A5、B10,注水采油井A18、B16,各井均为井口取样。用灭菌的塑料桶采集水样后,密封,4 ℃ 保存,在48 h内处理。
1.2 方法 1.2.1 水样DNA的提取将水样于4 ℃ 8 000 r/min离心15 min得菌体,采用玻璃珠研磨 - 酶法 - 化学法相结合的方法提取基因组,具体操作步骤是:离心所得菌体重悬于1 mL Lysis buffer(0.05 mol/L Tris,0.04 mol/L EDTA,0. 1 mol/L NaCl,pH8.0)中,加入0.3 g直径0.1 mm 玻璃珠,4 800 r/min涡旋1 min,冰浴1 min,反复3 次。加入溶菌酶(终浓度10 mg/mL),轻轻混匀,于37 ℃ 保温1 h,然后加入100 μL 20% SDS,混匀后65 ℃ 保温30 min 后,加入与上清液等量的酚 - 氯仿 - 异戊醇(25 ∶ 24 ∶ 1)溶液抽提蛋白,反复抽提直至中间没有明显的蛋白层为止,将上清液转移到新离心管中,加入0.6倍体积的异丙醇溶液,室温静置30 min,于4 ℃ ,10 000 r/min离心15 min,弃上清,加入1 mL 70% 乙醇洗涤,离心,沉淀风干后,溶于适量TE缓冲液(10 mmol/L Tris,1 mmol/L EDTA,pH8.0)中,用0.7%的琼脂糖凝胶电泳检测所提取的基因组。
1.2.2 水样微生物中细菌和古菌16S rDNA 高可变区的扩增油藏中细菌数量最大,种类也最多。这些微生物在长期的地层演化及水驱过程中,形成了各种细胞组分来适应油藏环境,其对原油降解、产生表面活性剂、有机酸、生物气、生物聚合物等功能对原油提高采收率具有重要作用。古菌是油藏中重要的微生物,具有耐受极端环境、产甲烷等特性,处于厌氧生物链最末端的产甲烷古菌代谢可以解除生物链的末端抑制,使一系列生化反应持续进行,促使发酵菌等微生物更好地生长繁殖,有利于提高采收率[18]。因此开展微生物采油技术前需对油藏中的细菌和古菌群落进行研究。细菌和古菌的16S rDNA高可变区片段分别使用引物1055f/1406r-GC 和引物46f/1017r、344f-GC/522r扩增,引物由北京三博远志生物公司合成,引物序列如表 2所示。具体的PCR步骤如下所述。
使用引物1055f/1406r-GC 进行扩增,反应体系为25 μL[2.5 μL 10×Buffer、1 μL dNTP Mixture(各10 mmol/L)、0. 3 μL 正向引物(20 μmol/L)、0.3 μL 反向引物(20 μmol/L)、10 ng DNA模板和0. 25 U Taq DNA 聚合酶],采用TouchDown PCR,反应条件为:94 ℃ 预变性5 min;94 ℃ 变性45 s,退火45 s,72 ℃ 延伸90 s(退火温度从60 ℃ 降至52 ℃ ,共20个循环);之后再进行15个循环(94 ℃ 变性1 min,55 ℃ 退火1 min,72 ℃ 延伸3 min);72 ℃ 后延伸10 min,4 ℃ 终止。
1.2.2.2 古菌16S rDNA V3高变区扩增采用巢式PCR扩增目的片段,分两步进行。第一步,扩增出古菌16S rDNA,使用古菌16S rDNA 通用引物46f和1017r,扩增反应体系为50 μL[5 μL 10×Buffer、2 μL dNTP Mixture(各10 mmol/L)、0. 5 μL 正向引物(20 μmol/L)、0. 5 μL 反向引物(20 μmol/L)、20 ng DNA 模板和0.5 U Taq DNA聚合酶],PCR 条件为:94 ℃ 预变性5 min;94 ℃ 变性45 s,50 ℃ 退火45 s,72 ℃ 延伸90 s,30个循环,72 ℃ 后延伸10 min,4 ℃ 终止。第二步:以第一步PCR 产物为模板,使用引物Arc344f-GC和Univ522r扩增16S rDNA V3 区片段,扩增反应体系同第一步,采用TouchDown PCR,反应条件为:94 ℃ 预变性5 min;94 ℃ 变性45 s,退火45 s,72 ℃ 延伸90 s(退火温度从65 ℃ 开始下降,每个循环降0.5 ℃ ,共20个循环);之后再进行15个循环(94 ℃ 变性1 min,55 ℃ 退火1 min,72 ℃ 延伸1 min);72 ℃ 后延伸10 min,4 ℃ 终止。PCR产物用2.0%琼脂糖凝胶电泳检测。
1.2.3 变性梯度凝胶电泳(DGGE)利用DcodeTM Universal Mutation Detection System(Bio-Rad)进行DGGE分析。细菌16S rDNA V6-V8高变区的DGGE条件为:6%聚丙烯酰胺凝胶,40% - 60% 的变性剂浓度范围(100%的变性剂为7 mol/L的尿素和40%的去离子甲酰胺的混合物),DNA 上样量为200 ng,缓冲液为1×TAE,60 ℃ 恒温,160 V恒压条件下电泳3.5 h;古菌16S rDNA V3高变区的DGGE条件为:10% 的聚丙烯酰胺凝胶,35% - 55%的变性剂梯度,60 ℃ 恒温、200 V恒压条件下电泳4.5 h。电泳结束后,用10 mg/mL EB染色15 min,脱色,通过Bio-Rad凝胶成像系统来成像,使用Quantity One软件对图像进行分析。
1.2.4 目的条带的回收及测序将目的片段所在的凝胶切下,使用聚丙烯酰胺凝胶回收试剂盒(日本Bioflux公司)回收,再次用对应的不带“GC”的16S rDNA高可变区引物扩增,然后按适当的比例连接到pMD19-T载体(日本TaKaRa公司)上,转入大肠杆菌DH5α感受态细胞,筛选插入片段正确的克隆,送至北京三博远志生物公司测序。
1.2.5 聚类分析所测的序列在GenBank中通过Blast进行比对,得到其最相似种属信息。将所测序列与其最相似序列用软件Clustal X1.81排序,生成的序列文件经格式转化后,使用MEGA 4.0软件中的Neighbor joining算法和Kimura two-parameter模型构建系统发育树,进行序列间同源性分析。
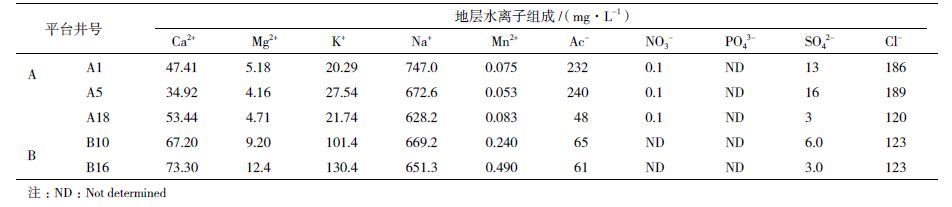
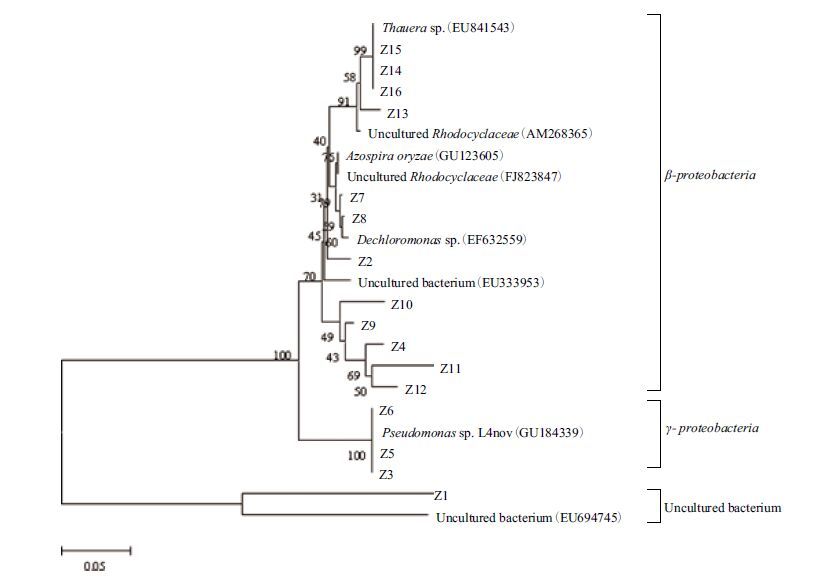
2 结果 2.1 细菌群落结构分析采出液水样中细菌DGGE电泳图谱(图 1)显示,图中每一条带代表一种微生物,各条带经回收、克隆、测序后,在GenBank数据库中比对,得到各条带的最相似种属信息,利用Clustal X1.81软件和MEGA 4.0软件构建系统进化树,如图 2所示。

|
| 图 1 细菌16S rDNA V6-V8高可变区DGGE图谱 1:A1;2:A5;3:A18;4:B10;5:B16 |
|
| 图 2 16S rDNA V6-V8高可变区序列DGGE所代表的细菌的系统发育进化树 |
通过DGGE检测得到16个条带,从图谱中可以看出,注水井与未注水井的细菌种类差异较大,注水井A18、B16的菌种数量明显多于未注水井的A1、A5、B10,其中A18、B16井有8、7个条带,而A1、A5、B10分别有4、3、4个条带,说明经过长期注水开发,注入水携带外源微生物,对地层中内源微生物菌群结构产生了一定的影响,油藏中的菌群结构发生了一定程度的变化,外源微生物与内源微生物形成了新的微生物群落,从而造成注水井微生物类型多于未注水井;同时尽管两口注水井处于不同的区块,但注入水中的外源微生物较为相近,外源微生物在与内源微生物的竞争中可能处于优势地位,因此油藏中形成的细菌群落种类差别较小,A18井8个条带有7条与B16井相同;未注水井由于没有水驱携带新的外源菌进入地层,造成其内源菌种结构单一,尽管处于不同区块,结果显示地层内本源微生物差别也较为相近,A1、A5、B10均有3个条带相同。
经序列分析后得知这些条带所代表的微生物主要是变形菌门细菌,包括 β-变形菌纲、 γ-变形菌纲以及少量的未培养细菌,其中优势种属为Azospira sp.、Pseudomonas sp.和Thauera sp.。由于所检测的几口井均为高温油藏,但是DGGE并未检测到嗜热菌或者耐热菌的存在,推测可能是由于脱离了油藏环境,一些微生物由于条件不适合而死亡裂解,从而检测不到其存在。同时由于DGGE检测的是油水样中含量在1%以上的优势种群,可能某些嗜热菌含量较少,尚未能检测到。
使用Quantity One软件对细菌DGGE图谱进行分析,根据每个样品中每条带的相对光密度计算其在该样品中的相对含量,做出每个样品多样性和相对含量图,如图 3所示。结果表明,油藏中的内源微生物细菌种类同中存异,但丰度差别较大;其中A平台的细菌以固氮螺菌(Azospira sp.)和假单胞菌(Pseudomonas sp.)为主,两种菌分别占35%、32%;B平台的细菌以陶厄氏菌(Thauera sp.)和未培养细菌为主,其中陶厄氏菌(Thauera sp.)占45%。

|
| 图 3 各样品主要内源细菌的多样性分析 |
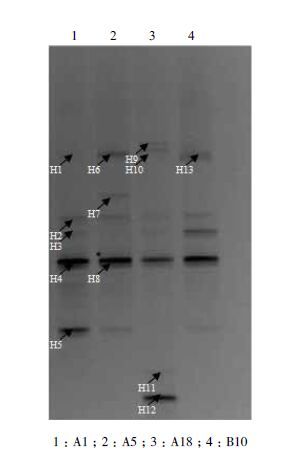
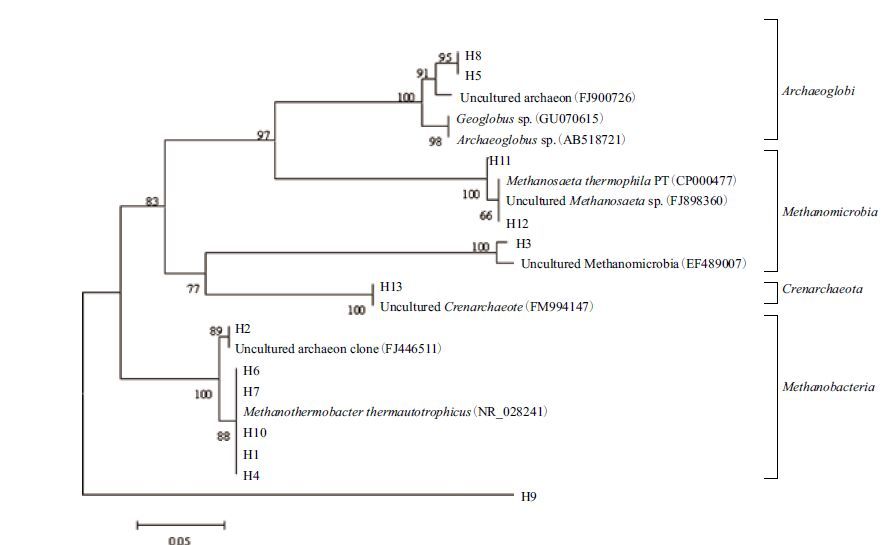
采出液水样中古菌DGGE电泳图谱(图 4)所示,图中每一条带代表一种微生物,各条带经回收、克隆、测序后,在GenBank数据库中比对,得到各条带的最相似种属信息,利用Clustal X1.81软件和MEGA 4.0软件构建系统进化树,如图 5所示。
|
| 图 4 古菌16S rDNA V3高可变区DGGE图谱 1:A1;2:A5;3:A18;4:B10 |
|
| 图 5 16S rDNA V3高可变区序列DGGE所代表的古菌的系统发育进化树 |
从DGGE 图谱(图 4)可以看出,相对于细菌来说,注水井和未注水井的古菌种类也有一定差别,注水井A18有7个条带,而其他3个未注水井A1、A5、B10都只有5个条带,说明注水开发对古菌群落也有一定影响,尽管注入水中本身不含有古菌,但注水井更接近开放环境,并且注入水中含有溶解氧等物质,检测出的古菌绝大多数都是产甲烷菌,这类古菌生长是严格厌氧的,少量溶解氧也会对它们的生长造成影响,因此注水井与未注水井在古菌群落结构上可能产生差异,但种类增多原因尚不清楚。根据系统发育信息(图 5)得知,与检测到的各序列最相似的古菌主要有甲烷鬃菌属(Methanosaeta)、甲烷微菌属(Methanomicrobium)、泉古菌门(Crenarchaeota)、古球菌属(Archaeoglobus)及未培养古菌(Uncultured archaea)。
产甲烷古菌的作用通常发生在生物降解的末端,它们在深层油藏的原油的厌氧烃降解过程中发挥着非常重要的作用。同时也可以看出,在检测出的古菌中,未培养的古菌占很大一部分,尤其是其中的一些还是优势菌属,这是由于古菌生长条件的特殊性,导致绝大多数的菌至今仍未能被培养出,所以对于这些菌的利用也非常有限,如果能在实验室条件下,寻找合适的培养条件来对古菌进行纯培养,对于微生物采油将会有非常重要的意义(表 3)。
使用Quantity One软件对古菌DGGE图谱进行分析,结果(图 6)显示,注水井和未注水井中主要内源古菌的种类差异较小,以热自养甲烷杆菌(Methanothermobacter thermautotrophicus),嗜热鬃毛甲烷菌(Methanosaeta thermophila)和未培养的甲烷微菌为主。
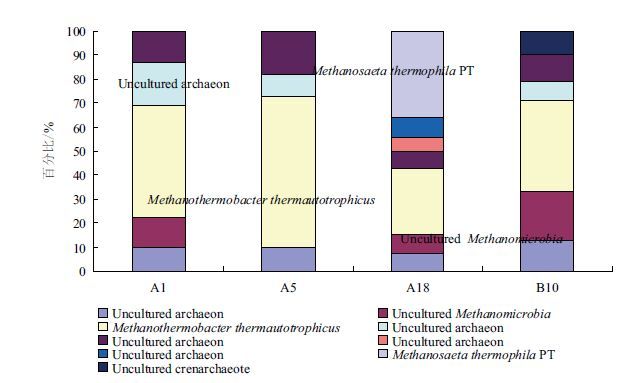
|
| 图 6 各样品主要内源古菌的多样性分析 |
本研究结果显示,N油田油藏细菌群落结构较单一,16S rDNA文库16个序列分别属于变形菌门 γ-变形菌纲的假单胞菌属(Pseudomonas sp.)、固氮螺菌(Azospira sp.)以及陶厄氏菌(Thauera sp.),而且与已知序列的相似性都很高,与已经报道过的菌种群落结构较为相似。赵玲侠等[25]对大庆聚驱后油藏内源微生物群落结构进行研究,显示细菌主要以好氧的假单胞菌属和不动杆菌属、陶厄氏菌属、油杆菌属及大量的未培养细菌。黄立信等[26]利用MPN和16S rDNA克隆文库分析方法研究了大庆水驱和聚驱后两类油藏微生物群落特征,确定了油藏中采油功能细菌主要是变形菌纲的陶厄氏菌属、油杆菌属、假单胞菌属、不动杆菌属等微生物。齐义彬等[27]采用OTU聚类分析对克拉玛依油田七中区克上组油藏微生物群落结构进行分析显示,各油藏中均含不动杆菌属、假单胞菌属、陶厄氏菌属等微生物。说明注水油田内部微生物群落结构较为相似。
同时,研究结果也显示注水井的细菌种类和丰度要明显高于未注水井,这是因为注水开发不仅会使油藏中形成温度梯度,从而提高内源微生物多样性,还会因注入水中携带的外源微生物(种类则较油藏微生物更为丰富)、营养物质甚至溶解氧等外来因素的长年积累,对油藏中原始的内源微生物群落及其代谢方式和速率产生影响,甚至形成新的内源微生物群落结构[28]。宋智勇等[28]曾对胜利油田水驱油藏微生物群落结构及分布规律进行研究,结果显示,研究中的各油藏均已注水10年以上,相对未注水的油藏,内源微生物群落已普遍较为丰富,同时根据不同注水时间比较,以油藏温度、矿化度和渗透率相对较为接近的3个油藏为例,孤岛Ng1+2、埕东东区馆上和孤岛中一区Ng3,分别已经注水18年、34年和37年,内源微生物种类分别为9、23和14个属,说明注水时间的延长有助于提高内源微生物的多样性。佘跃惠等[12]对大港孔店油田孔二北断块注水井和采油井的微生物群落结构进行分析发现,两个井中微生物群落结构差异显著,注水井样品中的微生物多样性比采油井样品大很多,认为是原始采油井未经处理前特殊的营养和高压,厌氧及高温条件,使得适应该环境的微生物种类必定比较单一,而注水井中注水提高石油采收率的同时,带入了很多外源微生物,导致了种群多样性的提高。这些研究说明,注水过程对油藏内源微生物群落的深远影响,因此,开展了注水及注水时间较长的油藏内源微生物群落多样性相对较高,有利于内源微生物驱油技术的开展。
假单胞菌属是油藏重要的一类内源微生物,许多假单胞菌属的微生物能够分泌表面活性剂降低界表面张力,改善油藏的润湿性,降低原油黏度,常见于国内地下油藏,在大港油田、华北油田、胜利油田、克拉玛依油田等某些区块的油藏微生物群落中为优势菌群[10, 16],常用来进行本源微生物采油开发。黄英等[29]采用假单胞菌(Pseudomonas sp.)LH-18 和短杆菌(Brevibacterium sp.)LH-21在辽河油田冷 43 块开展单井吞吐矿场试验,5口井中有3口井增油降水,1口井(间开井)可连续生产,效果最好的 6 9-1 62 井原油日产量最大增幅达150%。申坤等[30]采用假单胞菌、芽孢杆菌和节杆菌在长庆安塞油田王窑区块12 个高含水井组开展微生物“调剖+驱油”复合驱油试验,试验区块累计增油超过5 070 t,累计降水900 m3,平均有效期在10个月左右,取得的投入产出比达到 1 ∶ 5.9。Azospira 和Thauera均为红环菌科细菌,Thauera是兼性厌氧的革兰氏阴性杆菌,具反硝化能力,广泛存在于污水处理系统中,在以乙酸盐、丙酸盐和乙醇等进行硝化作用时可降解多环芳烃类物质[31, 32],说明该类细菌在微生物采油中具有较大的应用潜力,同时对油田采出液处理系统中脱氮、污泥膨胀、重金属吸附等具有重要意义[21],Azospira也有一定的降解功能,例如Azospira oryza可降解硒和硒酸盐,在环境污染处理中应用,也有一些有固氮作用[22],因此这几口井都具备实施微生物采油的潜力。
研究发现甲烷微菌属(Methanomicrobium)在目标油田的油藏古细菌中占有绝对优势地位。甲烷微菌属(Methanomicrobium)是1971年首次从污泥里分离出来的古细菌,该菌主要生长在高温厌氧的环境里,其最适生长温度为6 5-7 0 ℃ ,可利用H2/CO2以及N2、NH4等产生甲烷。Methanosaeta是油藏中常见的产甲烷古菌,可利用H2/CO2及乙酸产甲烷,当生长因子为H2时,甲醇和甲基胺都被还原成甲烷。本研究中发现的Crenarchaeote(泉古菌门)利用氨作为它们的能量来源,将氨和氧结合,然后放出能量。嗜热鬃毛甲烷菌(Methanosaeta thermophila)这类嗜热菌的大量生长可能源于油藏的地层温度对本源微生物的长期选择的结果。两个平台不同井组中古菌结果的稳定状态表明该区块的各井中的古菌已适应了所处的地质环境,但在检测出的古菌中,未培养的古菌占很大的一部分,尤其是其中的一些还是优势菌属,由于古菌生长条件的特殊性,导致绝大多数的菌至今仍未能被培养出,所以目前对于这些菌的利用也非常有限[26]。
PCR-DGGE技术作为一种微生物生态结构、丰度的检测手段,具有快速、灵敏的特点,结合现场实际条件,可以获得众多传统技术难以培养或鉴定的自然种群的DNA 信息,更精确地揭示油藏微生物的种类和遗传多样性。胜利油田采用PCR-DGGE和T-RFLP分子生态学技术对胜利油田单12块注入水和产出水中的微生物群落进行了研究,DGGE分析结果表明,单12区块油井产出水中检测到的条带数明显多于注入水中的条带数,一方面说明油藏内源微生物群落的丰富多样性,另一方面说明激活剂的注入激活了油藏内源微生物群落;T-RFLP分析结果表明,单12块油藏中主要存在脱硫弧菌、假单胞菌、不动杆菌和梭菌等细菌群落,这些均为采油有益菌类[33]。柯从玉等[34]采用PCR-DGGE技术对现场微生物驱油过程产出液的跟踪监测及室内物模实验对微生物在地层中的生长繁殖、运移及分布规律进行研究,显示该技术对今后微生物采油中培养基优化、配伍性研究、注入工艺研究、现场跟踪监测具有指导意义,对建立油藏微生物分子生态技术研究体系、微生物驱油的现场试验方案设计提供更加准确和充分的理论依据。
4 结论(1)目标油藏注水井与未注水井的细菌种类差别较大。原因在于注水油藏经过长期注水后,引入了外源细菌种群,与油藏内源的细菌种群发生竞争、共生等关系,进而形成新的稳定的油藏微生物群落。(2)古菌在注水井和未注水井中的分布均相对稳定。菌群主要以乙酸营养型产甲烷的甲烷鬃菌属(Methanosaeta)、中常见的H2/CO2营养型和甲基营养型的甲烷热杆菌属等为主。(3)目标油藏内微生物种群种类较少,但其中具有应用潜力的采油功能菌种的丰度较高,细菌包括具有降解原油能力的固氮螺菌属(Azospira sp.)、铜绿假单胞菌(Pseudomonas sp.)、陶厄氏菌属(Thauera sp.),古菌包括可利用H2/CO2等产生甲烷的热自养甲烷热杆菌(Methanothermobacter thermautotrophicus)、甲烷鬃毛菌属(Methanosaeta),说明目标油田具备开展微生物采油技术的应用前景。
| [1] | 雷光伦. 微生物采油技术的研究与应用. 石油学报 , 2001, 22 (2) : 56–61. |
| [2] | 汪卫东, 魏斌, 谭云贤, 等. 微生物采油需要进一步解决的问题. 石油勘探与开发 , 2004, 31 (6) : 88–91. |
| [3] | 李晓然, 栾建军, 柳陈坚. 微生物分子生态学研究方法及其存在的缺陷. 中国微生态学杂志 , 2013, 25 (2) : 228–232. |
| [4] | 包木太, 王兵, 陈庆国, 等. 不同压力条件下油藏内源细菌群落激活过程中变性梯度凝胶电泳分析. 微生物学报 , 2009, 49 (4) : 536–539. |
| [5] | 王大威, 张健, 马挺, 等. 外源和内源微生物在营养剂激活过程中丰度变化及对原油作用研究. 生物技术通报 , 2013 (11) : 164–169. |
| [6] | Pace NR, Stahl DA, Lane DJ, et al. The analysis of natural microbial populations by ribosomal RNA sequence. Advanced in Microbial Ecology , 1986, 9 : 1–55. DOI:10.1007/978-1-4757-0611-6 |
| [7] | 包木太, 肖生科, 孔祥平, 等. 16S rRNA基因技术在油藏微生物生态研究中的应用. 应用基础与工程科学学报 , 2007, 15 (3) : 369–371. |
| [8] | 王君, 马挺, 刘静, 等. 利用PCR-DGGE技术指导高温油藏中功能微生物的分离. 环境科学 , 2008, 29 (2) : 462–468. |
| [9] | Grabowski A, Nercessian O, Fayolle F, et al. Microbial diversity in production waters of a low temperature biodegraded oil reservoir. FEMS Microbiology Ecology , 2005, 54 (3) : 427–443. DOI:10.1016/j.femsec.2005.05.007 |
| [10] | Muyzer G, Waal EC, Uitterlinden AG. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction amplified genes encoding for 16S rRNA. Appl Environ Microbiol , 1993, 59 : 695–700. |
| [11] | Li H, Yang SZ, Mu BZ, et al. Molecular analysis of the bacterial community in a continental high temperature and water flooded petroleum reservoir. FEMS Microbiology Letters , 2006, 257 (1) : 92–98. DOI:10.1111/fml.2006.257.issue-1 |
| [12] | 佘跃惠, 张学礼, 张凡, 等. 大港孔店油田水驱油藏微生物群落的分子分析. 微生物学报 , 2005, 45 (3) : 329–334. |
| [13] | Orphan VJ, Taylor LT, Hafenbradl D, et al. Culture dependent and culture independent characterization of microbial assemblages associated with high temperature petroleum reservoirs. Appl Environ Microbiol , 2000, 66 (2) : 700–711. DOI:10.1128/AEM.66.2.700-711.2000 |
| [14] | 郭省学, 宋智勇, 郭辽原, 等. 微生物驱油物模试验及古菌群落结构分析. 石油天然气学报 , 2010, 23 (1) : 148–152. |
| [15] | 程海鹰, 肖生科, 马光东, 等. 营养注入后油藏微生物群落16S rRNA基因的T-RFLP对比分析. 石油勘探与开发 , 2006, 33 (3) : 356–359. |
| [16] | 程海鹰, 肖生科, 汪卫东, 等. 变性梯度凝胶电泳方法在内源微生物驱油研究中的应用. 石油学报 , 2005, 26 (6) : 82–85. |
| [17] | 王中华, 梁静儿, 杨建强, 等. 原油微生物群落构成及降解菌降解特性的研究. 生物技术通报 , 2013 (1) : 178–185. |
| [18] | 承磊, 仇天雷, 邓宇, 等. 油藏厌氧微生物研究进展. 应用与环境生物学报 , 2006, 12 (5) : 740–744. |
| [19] | Thomsen TR, Kong Y, Nielsen PH. Ecophysiology of abundant denitrifying bacteria in activated sludge. Fems Microbiology Ecology , 2007, 60 (3) : 370–382. DOI:10.1111/fem.2007.60.issue-3 |
| [20] | Bae HS, Rash BA, Rainey FA. Description of Azospira restricta sp., nov., a nitrogen-fixing bacterium isolated from groundwater. International Journal of Systematic and Evolutionary Microbiology , 2006, 57 (7) : 1521–1526. |
| [21] | Petrikov K, Delegan Y, Surin A, et al. Glycolipids of Pseudomonas and Rhodococcus oil-degrading bacteria used in bioremediation preparations:Formation and structure. Process Biochemistry , 2013, 48 (5-6) : 931–935. DOI:10.1016/j.procbio.2013.04.008 |
| [22] | Zeikus JG, Wolee RS. Methanobacterium themoautotrophicus sp. n., an anaerobic, autotrophic, extreme thermophile. Journal of Bacteriology , 1972, 109 (2) : 707–713. |
| [23] | Rotaru AE, Shrestha PM, Liu F, et al. A new model for electron flow during anaerobic digestion:direct interspecies electron transfer to Methanosaeta for the reduction of carbon dioxide to methane. Energy & Environmental Science , 2014, 7 (1) : 408–415. |
| [24] | Weidler GW, Dornmayr-Pfaffenhuemer M, Gerbl FW, et al. Communities of archaea and bacteria in a subsurface radioactive thermal spring in the Austrian Central Alps, and Evidence of Ammonia-Oxidizing Crenarchaeota. Appl Environ Microbiol , 2007, 73 (1) : 259–270. DOI:10.1128/AEM.01570-06 |
| [25] | 赵玲侠, 高配科, 曹美娜, 等. 大庆聚驱后油藏内源微生物群落结构解析与分布特征研究. 环境科学 , 2012, 33 (2) : 625–632. |
| [26] | 黄立信. 典型油藏微生物群落解析及驱油机理研究[D]. 北京:中国科学院大学, 2014. http://epub.cnki.net/kns/detail/detail.aspx?QueryID=12&CurRec=1&recid=&FileName=1015646144.nh&DbName=CDFDLAST2016&DbCode=CDFD&pr= |
| [27] | 齐义彬. 典型油藏微生物群落结构与代谢特征研究[D]. 北京:中国科学院大学, 2015. http://epub.cnki.net/kns/detail/detail.aspx?QueryID=20&CurRec=1&recid=&FileName=1015646156.nh&DbName=CDFDLAST2016&DbCode=CDFD&pr= |
| [28] | 宋智勇, 郝滨, 赵凤敏, 等. 胜利油田水驱油藏内源微生物群落结构及分布规律. 西安石油大学学报 , 2013, 28 (4) : 44–49. |
| [29] | 黄英, 梁凤来, 刁虎欣, 等. 特重原油油藏微生物采油试验. 油田化学 , 2002, 19 (2) : 178–181. |
| [30] | 申坤, 李斌, 黄战卫, 等. 复合本源微生物驱油技术在低渗透油藏的应用研究. 西安石油大学学报:自然科学版 , 2013, 28 (3) : 63–69. |
| [31] | Allen MS, Welch KT, Prebyl BS, et al. Analysis and glycosyl composition of the exopolysaccharide isolated from the floc-forming wastewater bacterium Thauera sp. MZ1T. Environ Microbiol , 2004, 6 (8) : 780–790. DOI:10.1111/emi.2004.6.issue-8 |
| [32] | Song B, Palleroni NJ, Kerkhof LJ. Characterization of halobenzoate degrading, denitrifying Azoarcus and Thauera isolates and description of Thauera chlorobenzoica sp. nov.. Intern J Syst Evol Microbiol , 2001, 51 (2) : 589–602. DOI:10.1099/00207713-51-2-589 |
| [33] | 苏俊杰, 高光军, 宋永亭, 等. 胜利油田单12区块内源微生物分子生态研究. 石油钻采工艺 , 2006, 28 (1) : 37–40. |
| [34] | 柯从玉, 吴刚, 游靖, 等. 采油微生物在微驱过程中的生长、运移及分布规律. 微生物学通报 , 2013, 40 (5) : 849–856. |