茅苍术(Atractylodes lancea)为菊科苍术属多年生草本植物,是我国重要的药用植物,其根茎具有燥湿健脾、祛风散寒、明目等功效。茅苍术主要分布于江苏、湖北和河南等省,江苏茅山一带是其产区。近年来由于掠夺性采挖和生态环境的人为破坏,造成其天然资源日趋枯竭;同时茅苍术的人工栽培也有一定难度,具体表现在栽培过程中易发病、地上部分枯萎和生长到一定时间就陆续坏死等现象,这些原因使茅苍术濒于灭绝,已被列为江苏省珍稀保护植物,4种濒危药用植物之一。随着国内外学者对茅苍术的研究日趋深入,关于其化学成分的研究表明茅苍术的主要活性成分是挥发油,其道地性则表现为挥发油中各种次级代谢成分呈现出特定比例关系[1]。茅苍术挥发油合成的研究主要停留在组培苗的培养与提取上,这种技术虽可实现大规模种植,然而远离了生境的茅苍术挥发油含量与野生道地药材相比表现出巨大差异。本课题组从茅苍术与内生菌互作的角度出发,得出内生菌可以促进挥发油积累并且提升其品质的结论[2, 3],成功获得了可以和茅苍术建立良好共生关系的多种内生菌,将它们制成诱导子可以有效刺激挥发油的积累[4-6]。
虽然目前掌握了一些茅苍术道地性成分的生物调控技术,但由于茅苍术遗传背景不清楚,生成挥发油的生理机制和合成途径基本处于空白状态。因此,研究茅苍术如何产生这些次级代谢物,以及如何对其合成进行有效调控等问题,仍是一个巨大的挑战。以我国科学家屠呦呦从菊科植物黄花蒿中提取出青蒿素用于治疗疟疾从而获得诺贝尔生理学或医学奖作为标志性事件,可以预见:从庞大的中药植物宝库,尤其是富含萜类代谢物的菊科植物中寻找活性药用成分将成为生物医药发展的主流研究方向之一。而对药用植物进行活性成分探索的前提必须是明了其代谢途径并在此基础上进行有效的代谢调控以提高产物积累。要解决这个问题,除了基因组、转录组等昂贵的技术手段之外,建立一个性价比高、便捷有用的技术平台显得十分迫切,我们期望借助该平台能够弥补上述高通量测序的不足,从生命功能的执行者蛋白的角度更直接的理解环境扰动对植物各种生化与信号途径的影响,及其涉及到的关键蛋白变化情况,从而确定有效的代谢调控策略。蛋白质组学分析无须完全依赖基因组信息,可直接从蛋白质入手,有望从蛋白序列同源性解析基因背景尚不清楚的非模式物种的特殊代谢机制[7]。
细胞膜作为外界与细胞间信息传递的大门,表面存在许多与信号转导相关的元件,同时还有一些蛋白作为介导下游信号转导的媒介存在于膜上。尽管如此,膜蛋白质组的研究却一直是个瓶颈,主要原因在于膜蛋白疏水性较强,表达丰度低[8]。目前植物细胞膜蛋白质组学研究多采取SDS-PAGE单向电泳分离结合液相层析偶联电喷雾串连质谱[9, 10]。而双向电泳(2DE)作为重要的蛋白质组学经典技术,由于其具有较高分辨率,且蛋白表达丰度可视化程度强,尽管其在分离疏水性较强的膜蛋白时稍有欠缺,但这点是可以通过筛选合适的去污剂增强蛋白溶解度来进行一定程度弥补解决的[11],因此进行膜蛋白质组的2DE技术仍将是今后的一个重要研究方向[12]。从目前进展看,2DE分离已经成功用于原核膜蛋白组[11, 13, 14],其方法能否直接应用于真核细胞膜蛋白组学尤其是高等植物还有待研究。另一方面,对高等植物细胞质膜蛋白双向电泳图谱虽然也有一些报道[15, 16],但多集中于禾本科植物,且植物组织器官的分化千差万别,样品制备困难,2DE条件并未进行系统优化,结果差异较大,尤其是适用于重要的药用植物的统一、高效的方法尚待建立。
本课题组虽然在前期研究中建立了茅苍术叶片胞内可溶性的2DE蛋白质组学体系,对于很多重要的生化代谢机制研究意义重大。鉴于人们提高茅苍术挥发油积累的重要手段是依赖于宿主对包括内生菌诱导子在内的各种刺激的防御反应,而这些反应势必需要对信号途径进行深层次的阐释[17],信号途径涉及到的蛋白则多数位于质膜上[12]。此外,挥发油次级代谢物的合成还涉及到一个特殊的在植物不同器官的运输过程,如萜类合成蛋白多位于叶片部位,而萜类挥发油则最终积累于根部的油室,这个过程是怎样发生的,所以研究不同组织部位的差异蛋白同样重要。希望通过本研究为这样一种富含挥发油类次级代谢物的菊科植物建立一套同时适用于根、茎、叶各组织器官质膜蛋白的2DE路径的蛋白质组学技术平台。从而为茅苍术主要药用成分的生物合成途径探索,乃至调控机理的研究提供一个可行的技术支撑,同时也将为其他未测序药用植物的研究开发提供重要的借鉴。
1 材料与方法 1.1 材料茅苍术外植体选择生长于江苏茅山地区的茅苍术野生植株。无性培养体系由本课题组构建[18],具体如下:收集叶芽,洗涤数遍后进行表面消毒处理;在超净台中将叶芽依次浸泡于75%乙醇及1%升汞溶液,无菌水冲洗;将沥干的叶芽转移至MS分化培养基中,添加0.3 mg/L萘乙酸(NAA),2.0 mg/L 6-苄氨基嘌呤(6-BA),30 g/L蔗糖和10%琼脂;当有新芽长出后,将其分离转移至新鲜培养基中继续分化培养,当积累足够新芽后,将其分离,转移至含有0.25 mg/L NAA,30 g/L蔗糖和10%琼脂的MS生根培养基中进行生根培养。组培苗放置于25/18 ℃ ,光照强度 3 400 lx,光照周期12 h的光照培养箱中培养。生根培养30 d的组培苗用于实验,无菌条件下分别取整株苗的根、茎、叶作为本研究的实验材料。
1.2 方法 1.2.1 粗膜蛋白的制备分别取茅苍术根、茎、叶,用蒸馏水洗涤后剪碎,液氮研磨成粉末;将粉末悬浮于Buffer A(0.025 mol/L HEPES,0.25 mol/L山梨醇,10%甘油,0.6% PVPP,0.005 mol/L抗坏血酸,0.005 mol/L EDTA,0.001 mol/L NaF,0.001 mol/L钼酸钠,0.002 mol/L咪唑,0.001 mol/L正钒酸钠,0.005 mol/L DTT,1×10-6 mol/L抗蛋白酶,1×10-6 mol/L抑肽酶,1×10-6 mol/L亮抑酶肽,0.001 mol/L PMSF,pH7.5)中,比例为2 ∶ 1(V/W),组织匀浆器匀浆15 min;用0.45 μm水系膜过滤后15 000×g离心10 min,去除组织碎片;取上清100 000×g超速离心2 h(Beckman,L8-60M Ultracentrifuge);弃上清,取沉淀悬浮于适量体积的Buffer B(0.005 mol/L磷酸二氢钾,0.25 mol/L山梨醇,0.003 mol/L KCl,1×10-4 mol/L DTT,1×10-6 mol/L抗蛋白酶,1×10-6 mol/L抑肽酶,1×10-6 mol/L亮抑酶肽,0.001 mol/L PMSF,pH7.8)中震荡混匀,所得溶液即为粗膜组分。
1.2.2 膜蛋白的纯化双水相系统效率的主要控制因素是两相系统中盐离子浓度和聚合物浓度,不同的浓度纯化质膜的效率有所不同,其中尤以聚合物的影响最大。本实验选择无机盐为0.008 mol/L KCl,聚合物葡聚糖T-500和聚乙二醇PEG 3350浓度为:5.6%、5.7%、5.8%、5.9%、6.0%、6.1%、6.2%、6.3%、6.4%和6.5%(W/W)。双水相体系萃取的操作见Larsson等[19]方法:将1.2.1所制粗膜组分与双水相体系混匀(1 ∶ 4,V/V),10 000×g离心分层取上相,重复3次;加10倍体积Buffer B,100 000×g超离2 h收集沉淀悬浮于适量不加山梨醇的Buffer B中;加5倍体积三氯乙酸(TCA)-丙酮(13% TCA,0.07% β-巯基乙醇),旋涡混匀后-20 ℃ 过夜,15 000×g离心15 min,弃上清,所得沉淀即为纯化的质膜蛋白。
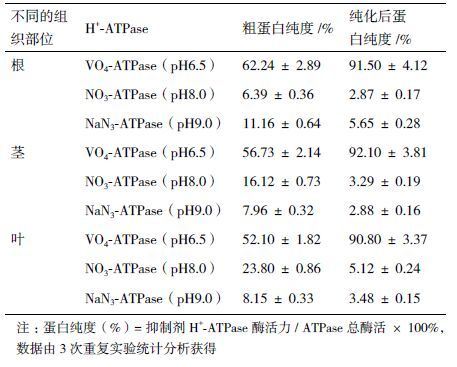
1.2.3 膜蛋白纯度的分析分别以pH6.5时对钒酸钠敏感的ATP酶(VO3-ATPase)作为质膜标志酶,pH8.0时对硝酸钾敏感的ATP酶(NO3-ATPase)作为液泡膜标志酶,pH9.0时对叠氮化钠敏感的ATP酶(NaN3-ATPase)作为线粒体膜标志酶,以膜标志酶H+-ATPase 活性抑制率衡量质膜纯度。H+-ATPase酶活测定参见宋齐鲁等[16]方法,适当修改,H+-ATPase活性测定在0.5 mL Tris-MES缓冲体系(0.05 mol/L Tris-MES、0.005 mol/L MgSO4、0.05 mol/L KCl、0.02%(W/V)聚氧乙基十六烷基醚、0.005 mol/L ATP-Na2)中进行:加2 μg膜蛋白,37 ℃ 水浴30 min后加200 μL 10% SDS 终止反应;2 min后加1 mL显色剂(2%浓硫酸(V/V),0.5%钼酸铵(W/V))和1 mL双蒸水,立即加10 μL 10%抗坏血酸(W/V),37 ℃ 水浴30 min后于最适波长处测吸光值。相同条件下,煮沸30 min后失活的膜蛋白作空白对照。活性抑制率测定是在上述反应体系中分别加VO3-ATPase、NO3-ATPase和NaN3-ATPase的抑制剂5×10-4 mmol/L Na3VO4、0.05 mmol/L KNO3、0.001 mol/L NaN3和非特异性磷酸酶抑制剂0.001 mol/L Na2MoO4,计算对不同抑制剂敏感的活性在总活性(不加抑制剂)中所占比例。质膜蛋白回收率=纯化质膜蛋白质量/100 mg粗膜蛋白;H+-ATPase相对活性=抑制剂H+-ATPase酶活力/ ATPase总酶活×100%。
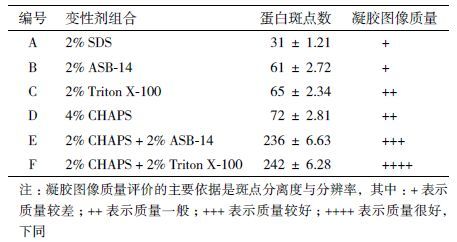
膜蛋白2-DE样品的制备配制6种下列含不同变性剂的蛋白裂解液:(1)7 mol/L尿素,2 mol/L硫脲,2% SDS;(2)7 mol/L尿素,2 mol/L硫脲,2% ASB-14;(3)7 mol/L尿素,2 mol/L硫脲,2% Triton X-100;(4)7 mol/L尿素,2 mol/L硫脲,4% CHAPS;(5)7 mol/L尿素,2 mol/L硫脲,2% CHA-PS + 2% ASB-14;(6)7 mol/L尿素,2 mol/L硫脲,2% CHAPS + 2% Triton X-100。各取适量膜蛋白分别溶于6种裂解液中,室温震荡1 h,超声30 min充分溶解;离心弃去未溶部分,然后用GE 2D-Quanti Kit蛋白定量试剂盒进行蛋白定量。将蛋白样品按每份200 μg的量分装,-80 ℃ 冰箱保存备用。
1.2.5 双向电泳及凝胶图谱分析将适量膜蛋白样品和水化液[7 mol/L尿素,2 mol/L硫脲,4% CHAPS,2.8 g/L DTT,0.5% IPG buffer(pI 3-1 0)]混合至450 μL;水化槽中水化12 h,等电聚焦使用固相pH梯度胶条(Bio-Rad)放在胶条槽中,在等电聚焦系统(GE Healthcare,Ettan IPGphor)中进行,设置等电聚焦程序,具体如表 1所示,温度20 ℃ ,最大电流50 μA/胶条;聚焦结束后,用超纯水冲去胶条上的矿物油,放入平衡液中(0.05 mol/L Tris-HCl pH6.8,6 mol/L尿素,30%甘油,2% SDS,0.002%溴酚兰,1% DTT / 2.5%碘乙酰胺)平衡15 min;平衡好的胶条放到预先配好的一定浓度/梯度的SDS-PAGE胶上,琼脂糖溶液封胶,然后在电泳单元(GE Healthcare,DALT Six)中进行第二相SDS-PAGE电泳。
染色方法采取一种与质谱兼容的银染方法[20]。2DE凝胶通过扫描仪(GE Healthcare,Image Scanner Ⅲ)获得图像,选择透射模式,调整扫描区域,600 dpi分辨率扫描图像并保存。图像采用Image Master 2D Platinum 7.0(GE Healthcare)软件分析,获得蛋白质的等电点、分子量、相对表达丰度及凝胶间蛋白斑点匹配的信息。其中分子量根据标准蛋白在凝胶上的条带位置,通过软件计算出各蛋白质斑点的分子量;等电点根据线性pH胶条的特点,通过软件在pI 3-1 0范围内进行等分,确定几个点的等电点后,通过软件的计算获得各个蛋白质点的等电点;表达丰度是通过蛋白质斑点在凝胶上的灰度计算出来的。
1.2.6 质膜蛋白质的鉴定与分析从最优的图谱中随机选取5个蛋白点,对其进行脱色、胰酶酶解、基质辅助激光解吸/电离飞行时间质谱仪(MALDI TOF MS/MS,Bruker,ultrafleXtreme)质谱鉴定、数据库比对[21]。将质谱得出的结果导出,在NCBI上得到氨基酸序列,利用跨膜区在线分析工具TMHMM Server v. 2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测蛋白是否为质膜蛋白。
2 结果 2.1 质膜蛋白提取方法的确定选择3种方法分别对茅苍术的茎、叶、根的膜蛋白进行抽提,其中方法A为本研究1.2所介绍的超速差速离心法,方法B为Mao等[11]原核生物常用提取膜蛋白的方法,方法C为商品化试剂盒的膜蛋白提取方法(Beyotime,Membrane and Cytosol Protein Extraction Kit)。为验证所提膜蛋白的抽提效果,进行了SDS-PAGE单向电泳,具体如图 1所示。由SDS-PAGE电泳结果可知一般的原核生物膜蛋白提取方法并不适用于植物膜蛋白,分析原因在于植物组织样品不同于原核生物,制备较为困难,且步骤繁琐,样品损失较多,很难富集到足量的膜蛋白。商业化试剂盒可能由于其独特性,在叶片部位的膜蛋白制取上效果尚可,但不适用于其他组织的膜蛋白制备。本研究提出的一种差速离心法效果最佳,可同时适用于茅苍术根、茎、叶3种组织部位的膜蛋白提取,结果表明,所提膜蛋白种类比较完整,条带之间没有明显的断层现象,蛋白量也适中,说明所制备膜蛋白样品可以用于后续的进一步纯化及蛋白质组学研究。
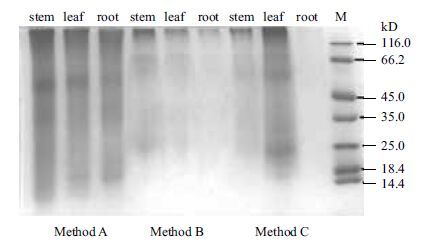
|
| 图 1 不同提取方法的茅苍术质膜蛋白SDS-PAGE效果 方法A:为本研究所采用的超速离心差速法;方法B:为原核生物常用提取膜蛋白的方法;方法C:为商品化试剂盒的膜蛋白提取方法 |
高纯度质膜的获得是确保后续蛋白质组学研究的关键。本研究采用了双水相体系法对2.1获得的粗膜组分进行纯化。为了测定质膜纯度,首先对H+-ATPase酶活反应体系在40 0-9 00 nm 波长范围内进行扫描,确定了反应体系在780 nm处达到了最大吸收值,以此作为测定茅苍术质膜蛋白纯度的最适波长。然后以蛋白回收率和质膜蛋白纯度为参考指标,对影响双水相体系分配效率的聚合物质量分数进行优化。最后对3种粗膜组分进行3次双水相纯化,即得纯化质膜蛋白。
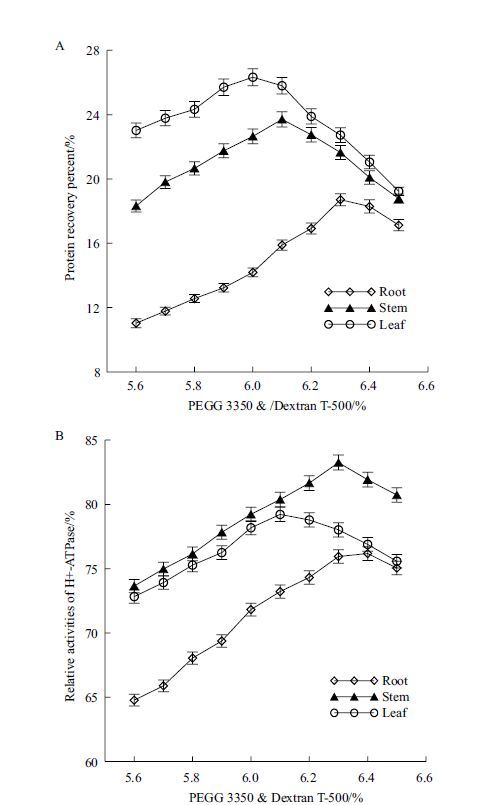
2.2.1 双水相体系中聚合物质量分数对质膜蛋白纯化的影响采用以下10个梯度质量分数:5.6%、5.7%、5.8%、5.9%、6.0%、6.1%、6.2%、6.3%、6.4%和6.5%的葡聚糖T-500和聚乙二醇PEG 3350双水相分配体系对茅苍术根、茎、叶3种组织质膜进行了纯化。结果表明,双水相体系中聚合物质量分数不同,细胞质膜在上相中的分配情况有明显差异:随聚合物浓度升高,上相中的3种组织质膜蛋白质产率基本呈现先升高后降低的变化趋势,根、茎、叶质膜蛋白回收率分别在6.3%、6.1%和6.0%时达到最大,为18.71%、23.71%和26.33%(图 2-A)。质膜H+-ATPase(VO3-ATPase)对钒酸盐敏感性的变化趋势如图 2-B所示,在葡聚糖T-500和聚乙二醇PEG 3350质量分数分别为6.4%、6.3%、6.1%时VO3-ATPase相对活性最高,为76.18%、83.25%和80.04%。综合考虑质膜蛋白回收率和纯度,质量分数分别为6.4%、6.3%、6.1%的葡聚糖T-500和聚乙二醇PEG 3350聚合物组成的双水相体系更适于茅苍术根、茎、叶质膜蛋白的纯化,可以用于下一步的研究。
|
| 图 2 PEG 3350/Dextran T-500(W/W)对双水相体系分离的茅苍术质膜蛋白回收率(A)和H+-ATPase相对活性(B)的影响 |
基于上述双水相体系的优化结果,KCl浓度设为0.008 mol/L,根、茎、叶双水相纯化体系的葡聚糖T-500和聚乙二醇PEG3350质量分数分别设为6.4%、6.3%和6.1%。由表 2可知:在叶片中,差速离心所得到的粗膜蛋白中液泡膜(NO3-ATPase)和线粒体膜(NaN3-ATPase)污染分别高达23.80%和8.15%,而质膜蛋白的纯度仅为52.10%左右,经双水相体系3次纯化后的质膜蛋白中液泡膜(NO3-ATPase)和线粒体膜(NaN3-ATPase)污染分别降低至5.12%和3.48%左右,而质膜蛋白的纯度高达90.80%。同理,在根部和茎部中的粗膜组分经过双水相纯化后,最终二者的膜蛋白纯度分别达到了92.10%和91.50%。纯度高达90%以上的质膜蛋白的获得为后续的双向电泳分离奠定了基础。
值得一提的是,搜集3次双水相体系的下相,合并后提取挥发油,通过气相色谱法分别在根、茎、叶的体系中检测到15.91 μg/mL、8.72 μg/mL和9.15 μg/mL。这充分说明双水相体系不仅可以有效除去除质膜外的其他膜组分,而且对于茅苍术质膜蛋白中含有的部分挥发油也有明显的去除效果。而挥发油的主要成分是萜类等有机物,这对于后续的双向电泳效果势必产生一定的干扰,因此,我们所建立的双水相体系完全适合于茅苍术质膜蛋白纯化后的基于双向电泳技术的蛋白质组学分析平台。
基于以上结果,以茅苍术叶片质膜蛋白为例,对纯化后的膜蛋白样品在裂解液组成、等点聚焦条件、凝胶浓度、蛋白上样量、凝胶染色方式等参数上进行了系统的优化,期望藉此建立一个茅苍术质膜蛋白的双向电泳蛋白质组学技术平台。
2.3.1 疏水性质膜蛋白的复溶蛋白质组技术对于高度疏水性膜蛋白的分离一直是一个很难达到的阶段。如何将膜蛋白尽可能的溶解并应用双向电泳进行分离目前仍然是一个技术瓶颈。为了尝试将茅苍术的膜蛋白运用双向电泳进行分离,我们首先选取了目前常用到的几种商品化变性剂,如SDS、ASB-14、CHAPS、TritonX-100来分别溶解所得到的茅苍术的叶片膜蛋白组分,通过2DE分离来比较它们溶解膜蛋白的能力,从而评价这几种变性剂组合对茅苍术膜蛋白的溶解能力,进而选取合适的变性剂用于后续的比较蛋白质组研究。
通过2DE分离膜蛋白发现,不同的变性剂对茅苍术叶片膜蛋白抽提具有不同的效果。从图 3的2DE结果可以看出,2% CHAPS + 2% TritonX-100的组合对质膜蛋白的抽提复溶效果最好,在2DE凝胶上能够最大程度的展示茅苍术质膜蛋白质组。根据2DE胶的比较分析,我们对6种不同变性剂组合在2DE胶上产生蛋白点的数量、横纹产生的程度及整个胶图的质量进行了详细的比较(表 3)。在pH 3-1 0的2DE胶上产生的总蛋白点数最多的是2% CHA-PS+2% TritonX-100组合(图 3-F,216个蛋白点);最差的结果是2% SDS(图 3-A),几乎很难形成清晰的斑点。除此之外,虽然使用2% CHAPS + 2% ASB-14组合也能在一定pI( 6-1 0)范围内产生较好的效果(图 3-E,209个蛋白点),但该组合在酸性端分离效果很差,产生了大量的水平横纹。CHAPS一般用于胞内可溶性蛋白的变性处理,但单独使用似乎不适合于质膜蛋白的复溶(图 3-D)。通过对比发现2% CHAPS + 2% TritonX-100的组合具有高通量的分离效果,胶图质量高、重复性好、横纹少的优点。因此,选取该变性剂组合用于后续的膜蛋白质组研究。

|
| 图 3 茅苍术质膜蛋白在不同的变性剂组合下的复溶2DE效果 A:2% SDS;B:2% ASB-14;C:2% Triton X-100;D:4% CHAPS;E:2% CHAPS + 2% ASB-14;F:2% CHAPS + 2% Triton X-100 |
为了摸索等电聚焦的合适条件,以茅苍术叶片质膜蛋白为例,分别对其上样量和等电聚焦条件进行了系统的优化。为了提高蛋白分离的分辨率,我们选取24 cm,pH 3-1 0的非线性胶条。在蛋白上样量上,实验设计了80 μg、100 μg和120 μg等三个水平以寻找最佳上样量。按照方法1.2.5的等电聚焦程序,保持除盐与升压程序一致,结合以上3个上样量水平,分别考察了聚焦总量为60 000 Vhs、70 000 Vhs和80 000 Vhs时的聚焦效果,优化的结果如表 4所示。
其中上样量为80 μg的凝胶图谱蛋白点最少,软件分析不足100个点;上样量为100 μg时得到了200个以上蛋白斑点,且斑点清晰;上样量增至120 μg时,虽然也能得到200个以上的蛋白点,但横向条纹明显,斑点与横纹连在一起,不易分辨。通过以上结果的比较分析可以发现,当上样量增加时检测出的蛋白点增多,但当上样量过多时会出现横纹过于明显,加剧与斑点连成一片的现象。综合考虑蛋白点数量、质量及聚焦实际效果,选择100 μg为最佳上样量、聚焦总量则为80 000 Vhs。接下来,我们在以上研究基础上利用梯度灌胶仪设置了一个12.5% - 15%的呈梯度的SDS-PAGE胶进行第二向电泳分离。
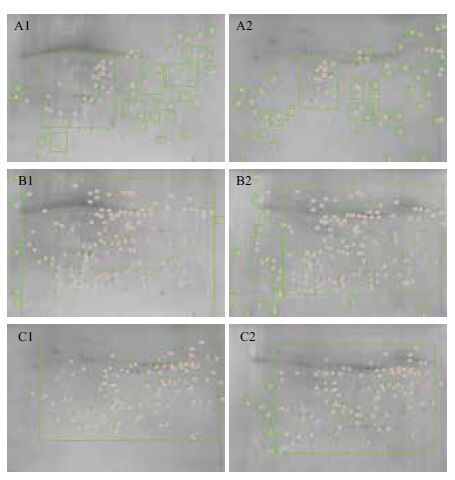
2.4 三种质膜蛋白在2DE图谱上的分布与差异分析根据以上优化的参数,以2% CHAPS和2% Triton X-100作为组合变性剂,在pI 3-1 0,24 cm非线性胶条上对100 μg质膜蛋白等电聚焦80 000 Vhs,以12.5% - 15% 梯度SDS-PAGE分离胶进行双向电泳,硝酸银染色后分别获得了茅苍术叶片、根部、茎部3个组织器官的质膜蛋白双向电泳凝胶图谱。通过Image Master 2D Platinum 7.0分析软件可知:根部质膜蛋白分离得到267个(图 4-A1和B1),茎部质膜蛋白则分离到297个(图 4-B2和C2),叶片质膜蛋白共分离得到248个(图 4-A2和C1)。从等电点和分子量对蛋白斑点进行分布考察,其中等电点 3-5 区域和 8-1 0区域内表达的蛋白最少,而在 5-6 区域内表达的蛋白最多(图 5-A),这表明:选择非线性胶条分离茅苍术质膜蛋白是合理的。分子量10 kD以下区域内表达的蛋白最少,而在5 0-9 0 kD区域内表达的蛋白最多,2 0-5 0 kD区域蛋白数量次之(图 5-B)。
|
| 图 4 茅苍术根、茎、叶质膜蛋白的2DE差异比较分析 茅苍术叶(A1)和根(A2)的差异比较;茅苍术叶(B1)和茎(B2)的差异比较;茅苍术根(C1)和茎(C2)的差异比较 |

|
| 图 5 茅苍术质膜蛋白在2DE图谱上的等电点(A)和分子量(B)分布情况 |
为了了解茅苍术中3种质膜蛋白质组与其组织特异性之间的关系,分别对叶片和根部、叶片和茎部、根部和茎部3对不同组织的质膜蛋白图谱进行两两比较的差异分析。结果表明,若以叶片的图谱为参考胶,叶片和根部的质膜蛋白质组中差异在2倍以上的蛋白斑点有73个,其中上调33个,下调40个(图 4-A1和A2);以叶片的图谱为参考胶,叶片和茎部的质膜蛋白质组中差异在2倍以上的蛋白斑点有147个,其中上调67个,下调80个(图 4-B1和B2);以根部的图谱为参考胶,根部和茎部的质膜蛋白质组中差异在2倍以上的蛋白斑点有104个,其中上调50个,下调54个(图 4-C1和C2)。不同组织之间成功的差异蛋白组表达分析将为后续对茅苍术挥发油的代谢与运输途径构建提供重要的参考数据。
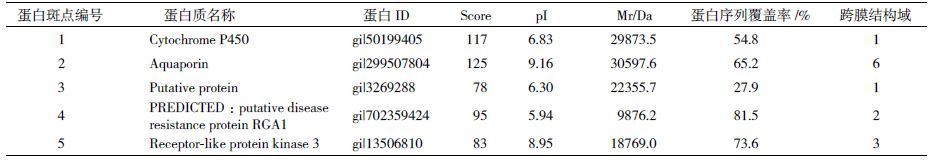
2.5 质膜蛋白的质谱鉴定与分析从茅苍术根、茎、叶3种组织中共同存在的蛋白斑点中随机选取具有代表性的5个做进一步的MALDI TOF MS/MS分析,这5个点在叶片质膜蛋白中的分布如图 6所示。质谱分析结果(表 5)显示,5个蛋白全部获得了成功鉴定,这些蛋白主要涉及到以下生化代谢途径和信号通路:植物体内的萜类合成途径,如细胞色素P450;胞内外之间运输相关的蛋白,如水通道蛋白;以及信号途经相关的受体类似蛋白激酶。最后,通过TMHMM 2.0在线分析软件对这几个蛋白进行跨膜结构域的分析表明,这5个蛋白全部都拥有数量不等的跨膜结构域(表 5),并且其中有3个蛋白的跨膜结构域在2个以上。这从蛋白定性的角度说明了本研究所采取的一整套技术流程适合于茅苍术质膜的蛋白质组学分析。

|
| 图 6 拟鉴定分析的5个蛋白斑点在茅苍术叶部质膜蛋白2DE图谱上的分布 |
质膜蛋白质组学分析是蛋白质组学研究中的难点,而高纯度质膜的获得又是质膜蛋白质组学研究的基础。双水相纯化法是最经典的质膜蛋白纯化方法,其原理是利用不同的膜组分在两相体系中的分配系数差异而达到的分离纯化质膜的目的,但不同植物以及相同植物不同组织质膜组分的特性都不相同[19],除叶绿素之外,菊科植物中富含的挥发油也是干扰H+-ATPase酶活的一类重要物质[22]。因此本研究采取了差速超速离心法结合聚合物PEG 3350/Dextran T-500体系。而在双水相系统效率的主要控制因素是两相系统中聚合物的质量分数,聚合物质量分数不同,不同内膜标志酶H+-ATPase对特异性抑制剂的敏感性存在明显的差异[23],本实验对双水相体系的聚合物葡聚糖T-500和聚乙二醇PEG 3350的质量分数进行了优化,建立了分别适合于茅苍术根、茎、叶的3种双水相分配体系。经3次纯化后不仅最大程度的除去了其他膜组分,还有效去除了其中残留的部分挥发油,使3种茅苍术质膜蛋白的纯度都提高到了90%以上,为双向电泳的顺利开展奠定了基础。
蛋白质样品制备的成功与否是决定双向电泳成败的关键。为了获得更多的蛋白质信息,要求尽量增大样品蛋白质的溶解度。而质膜蛋白具有很强的疏水性,它们在普通样品裂解液中的溶解性很低。本研究对几种有代表性的变性剂进行优化,得到了一个2% CHAPS和2% TritonX-100的最佳变性剂组合,显著提高了茅苍术质膜蛋白的溶解能力。一般而言,由于带有跨膜结构域的膜蛋白疏水性很强,特别是含有多个跨膜结构域的膜蛋白在等点聚焦中不易溶解到缓冲液。另外,即使暂时溶解,这类膜蛋白也不容易进入IPG胶条,而且在等电聚焦的过程中容易在其等电点产生沉淀。因此普通的双向电泳技术很少能分离到跨膜结构域个数超过两个的膜蛋白[24]。本研究在3种组织样品中各自检测到了200多个蛋白斑点,并且成功鉴定了其中的5个,并且检测到了与植物萜类合成密切相关的细胞色素P450[25]。值得提出的是在这些蛋白中发现有3个蛋白的跨膜结构域在2个以上,这是十分难得的。推测原因,除了双向电泳条件的系统优化外,我们选择的变性剂在疏水性膜蛋白的溶解过程中发挥了巨大的作用。最后,需要指出的是虽然SDS是公认溶解膜蛋白的最强变性剂,但是该变性剂与双向电泳不兼容,本研究的结果也证明了这点。近年来发展的鸟枪法蛋白质组技术(shotgun proteomics),利用强变性剂SDS在一维蛋白胶上分离、酶解蛋白并结合LC-MS/MS鉴定技术进行高疏水性膜蛋白的分离鉴定具有更高的效率[26]。我们在后续的工作中将尝试进行这方面的研究,以期获得更多种类的茅苍术膜蛋白。
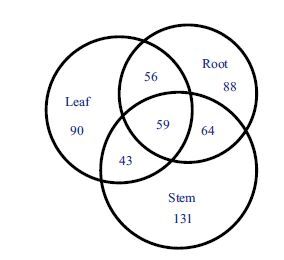
植物不同组织之间的差异蛋白质组表达分析将为其次级代谢产物的代谢与运输途径构建提供重要的理论依据[27]。为了了解茅苍术中3种质膜蛋白质组与其组织特异性之间的关系,从而阐释挥发油次级代谢产物在其体内不同器官的运输过程和代谢机理[28],选取了根、茎、叶这3种具有代表性的组织:其中根部是茅苍术挥发油积累较多的部位,有研究报道叶片中含有较多的萜类合酶[29],因此叶片可能是挥发油合成的部位,茎部则是起着承上启下肩负运输作用的组织部位。前文的2DE图谱数据已经表明3种组织的质膜蛋白种类差异较大,对这些数据再作进一步分析,结果(图 7)显示:3种组织中共同的蛋白有59个,其组织特异性非常明显。质谱结果表明所获得的5个蛋白全是具有跨膜结构域的质膜蛋白,这也从蛋白定性的角度间接验证了本研究建立的一套完整的膜蛋白质组学技术平台完全适合于茅苍术的进一步研究开发。另外,茅苍术由于基因组测序尚未完成,我们主要是通过其他绿色植物的数据库来完成蛋白鉴定的,在后期研究中将结合转录组的测序结果建立基于EST的蛋白质鉴定数据库,并利用生物信息学的分析进行验证[30],这种方法将为那些基因背景尚不清楚的非模式物种的代谢机制研究提供一个新的解决问题的思路。
|
| 图 7 基于2DE图谱分布的茅苍术三种组织中的质膜蛋白的异同 |
分别采用质量分数为6.4%、6.3%和6.1%的聚合物葡聚糖T-500和聚乙二醇PEG 3350(W/W)的双水相体系对超速差速离心法提取的茅苍术根、茎、叶粗膜组分进行处理获得了对应纯度高达92.10%、91.50%和90.80%的质膜蛋白;以2% CHAPS和2% Triton X-100作为组合变性剂裂解膜蛋白,等电聚焦总量为80 000 Vhs,浓度为12.5% - 15% 的梯度SDS-PAGE对100 μg质膜蛋白进行双向电泳,在根、茎、叶的凝胶图谱上各识别出了267、297和248个蛋白斑点;进一步比较分析了这3种组织质膜蛋白的异同之处,并成功鉴定了其中的5个共有蛋白质,这些蛋白都是膜蛋白,主要涉及到萜类合成、胞内外之间运输相关蛋白,以及信号途经相关的受体类似蛋白激酶。成功构建了一套完整的同时适用于茅苍术根、茎、叶各个组织的从高纯度质膜蛋白的制备到膜蛋白的质谱鉴定的蛋白质组学技术平台。
| [1] | 周洁, 郭兰萍, 黄璐琦, 等. 基于道地药材标准的炮制苍术挥发油变化规律研究. 中国药学杂志 , 2009, 44 (8) : 567–570. |
| [2] | 张波, 戴传超, 方芳, 等. 三种内生真菌对茅苍术组培苗的生长及主要挥发油成分的影响. 生态学杂志 , 2009, 28 (4) : 704–709. |
| [3] | Wang XM, Yang B, Ren CG, et al. Involvement of abscisic acid and salicylic acid in signal cascade regulating bacterial endophyte-induced volatile oil biosynthesis in plantlets of Atractylodes lancea. Physiologia Plantarum , 2015, 153 (1) : 30–42. DOI:10.1111/ppl.2015.153.issue-1 |
| [4] | Wang Y, Dai CC, Cao JL, et al. Comparison of the effects of fungal endophyte Gilmaniella sp. and its elicitor on Atractylodes lancea plantlets. World Journal of Microbiology and Biotechnology , 2012, 28 (2) : 575–584. DOI:10.1007/s11274-011-0850-z |
| [5] | Ren CG, Dai CC. Jasmonic acid is involved in the signaling pathway for fungal endophyte-induced volatile oil accumulation of Atractylodes lancea plantlets. BMC Plant Biology , 2012, 12 : e128. DOI:10.1186/1471-2229-12-128 |
| [6] | Redding-Johanson AM, Batth TS, Chan R, et al. Targeted proteomics for metabolic pathway optimization:application to terpene production. Metabolic Engineering , 2011, 13 (2) : 194–203. DOI:10.1016/j.ymben.2010.12.005 |
| [7] | Zhou JY, Yuan J, Li X, et al. Endophytic bacterium-triggered reactive oxygen species directly increase oxygenous sesquiterpenoid content and diversity in Atractylodes lancea. Applied and Environmental Microbiology , 2016, 82 (5) : 1577–1585. DOI:10.1128/AEM.03434-15 |
| [8] | Yohann B, Patrick M. Plasma membrane partitioning:from macro-domains to new views on plasmodesmata. Frontiers in Plant Science , 2014, 5 : e128. |
| [9] | Abdallah C, Valot B, Guillier C, et al. The membrane proteome of Medicago truncatula roots displays qualitative and quantitative changes in response to arbuscular mycorrhizal symbiosis. Journal of Proteomics , 2014, 108 : 354–368. DOI:10.1016/j.jprot.2014.05.028 |
| [10] | Smolders K, Lombaert N, Valkenborg D, et al. An effective plasma membrane proteomics approach for small tissue samples. Scientific Reports , 2015, 5 : e10917. DOI:10.1038/srep10917 |
| [11] | Mao SM, Luo YM, Bao GH, et al. Comparative analysis on the membrane proteome of Clostridium acetobutylicum wild type strain and its butanol-tolerant mutant. Molecular Biosystems , 2011, 7 : 1660–1677. DOI:10.1039/c0mb00330a |
| [12] | Yao Z, Petschnigg J, Ketteler R, et al. Application guide for omics approaches to cell signaling. Nature Chemical Biology , 2015, 11 (6) : 387–397. DOI:10.1038/nchembio.1809 |
| [13] | Gilmorea JM, Washburn MP. Advances in shotgun proteomics and the analysis of membrane proteomes. Journal of Proteomics , 2010, 73 (11) : 2078–2091. DOI:10.1016/j.jprot.2010.08.005 |
| [14] | Li FH, Liang JD, Wang WX, et al. Analysis of Streptomyces coelicolor membrane proteome using two-dimensional native/native and native/sodium dodecyl sulfate gel electrophoresis. Analytical Biochemistry , 2014, 465 : 148–155. DOI:10.1016/j.ab.2014.08.009 |
| [15] | Tang WQ, Deng ZP, Oses-Prieto JA, et al. Proteomics studies of brassinosteroid signal transduction using prefractionation and two-dimensional DIGE. Molecular & Cellular Proteomics , 2008, 7 (4) : 728–738. |
| [16] | 宋齐鲁, 王书平, 张改生, 等. 小麦旗叶高纯度质膜的提取及蛋白质组学双向电泳体系的建立. 中国生物化学与分子生物学报 , 2013, 29 (7) : 690–697. |
| [17] | 范海延, 崔娜, 邵美妮, 等. 植物应答逆境胁迫的蛋白质组学研究进展. 生物技术通报 , 2009 (10) : 15–19. |
| [18] | Wang Y, Dai CC, Zhao YW, et al. Fungal endophyte-induced volatile oil accumulation in Atractylodes lancea plantlets is mediated by nitric oxide, salicylic acid and hydrogen peroxide. Process Biochemistry , 2011, 46 (3) : 730–735. DOI:10.1016/j.procbio.2010.11.020 |
| [19] | Larsson C, Sommarin M, Widell S. Isolation of highly purified plant plasma membranes and separation of inside-out and right-side-out vesicles. Metho ds in Enzymology , 1994, 228 : 451–469. DOI:10.1016/0076-6879(94)28046-0 |
| [20] | Yan JX, Wait R, Berkelman T, et al. A modified silver staining protocol for visualization of proteins compatible with matrix-assisted laser desorption/ionization and electrospray ionization-mass spectrometry. Electrophoresis , 2000, 21 (17) : 3666–3672. DOI:10.1002/(ISSN)1522-2683 |
| [21] | Mao SM, Luo YM, Zhang TR, et al. Proteome reference map and comparative proteomic analysis between a wild type Clostridium acetobutylicum DSM 1731 and its mutant with enhanced butanol tolerance and butanol yield. Journal of Proteome Research , 2010, 9 (6) : 3046–3061. DOI:10.1021/pr9012078 |
| [22] | Hiraoka N. Intra-plant distribution of essential oil components and oil accumulation tissues in Atractylodes lancea. Natural Medicines , 1995, 49 (2) : 168–171. |
| [23] | 何磊, 聂燕芳, 高元媛, 等. 水稻叶片质膜的纯化及质膜蛋白质双向电泳分析. 华南农业大学学报 , 2012, 33 (1) : 11–17. |
| [24] | Tan S, Tan HT, Chung MC. Membrane proteins and membrane proteomics. Proteomics , 2008, 8 (19) : 3924–3932. DOI:10.1002/pmic.v8:19 |
| [25] | Weitzel C, Simonsen HT. Cytochrome P450-enzymes involved in the biosynthesis of mono- and sesquiterpenes. Phytochemistry Reviews , 2015, 14 (1) : 7–24. DOI:10.1007/s11101-013-9280-x |
| [26] | 王玮鹏, 苗芳芳, 武丹丹, 等. 蛋白质组学技术在细胞信号转导研究中的应用. 生物技术通报 , 2013 (11) : 46–50. |
| [27] | Lunn JE. Compartmentation in plant metabolism. Journal of Experimental Botany , 2007, 58 (1) : 35–47. |
| [28] | Mintz-Oron S, Meir S, Malitsky S, et al. Reconstruction of Arabidopsis metabolic network models accounting for subcellular compartmentalization and tissue-specificity. Proceedings of the National Academy of Sciences of the United States of America , 2012, 109 (1) : 339–344. DOI:10.1073/pnas.1100358109 |
| [29] | Nagegowda DA. Plant volatile terpenoid metabolism:Biosynthetic genes, transcriptional regulation and subcellular compartmentation. FEBS Letters , 2010, 584 (14) : 2965–2973. DOI:10.1016/j.febslet.2010.05.045 |
| [30] | 刘海军, 陈克平. 利用EST序列构建Mascot本地数据库. 生命的化学 , 2012, 32 (3) : 294–298. |